Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Элькар® - метаболическое средство пациентов с хронической ишемией мозга и патологией сердца / постинфекционной астенией, далее...
Лечение постинфекционной астении и постковидного синдрома
Влияние L-карнитина на эхокардиографические показатели у пациентов с острым коронарным синдромом
СтатьиГлезер М. Г. , Киселева А. Е., Прокофьева Е. Б., Асташкин Е. И.
ГБОУ ВПО «Первый МГМУ имени И. М. Сеченова» МЗ РФ, 119991, Москва, ул. Трубецкая, д. 8, стр. 2
Опубликивано в журнале:
"Сердечная Недостаточность" 2015;16 (4)
Резюме
Актуальность. Широкая распространенность СН часто обусловлена поражением миокарда при ОКС и постинфарктным ремоделированием сердца. В связи с этим важным является поиск путей уменьшения выраженности повреждения миокарда и постинфарктного ремоделирования. Цель. Оценить влияние внутривенного введения L-карнитина на структурно-функциональное состояние сердца у пациентов с ОКС. Материалы и методы. Изучено влияние внутривенного введения L-карнитина / плацебо на изменение параметров структурно-функционального состояния сердца у 58 пациентов с ОКС в госпитальном периоде. ЭхоКГ параметры изучены на 1–3-и сутки и на 12–15-е сутки от момента госпитализации. Результаты. Введение L-карнитина приводило к уменьшению конечно-систолического и конечно-диастолического объемов сердца (КСО И КДО), тем самым способствуя повышению сократительной функции миокарда ЛЖ, в то время как введение плацебо приводило к менее выраженному уменьшению КСО и значимому увеличению КДО. Наиболее выраженные изменения ФВ отмечены у пациентов с исходно сниженной ФВ и достоверно выраженные изменения при введении L-карнитина. При проведении тканевой допплерографии в группе пациентов, получавших L-карнитин, отмечено достоверное увеличение пиковой систолической скорости движения миокарда различных сегментов ЛЖ. Так, наблюдалось увеличение пиковой систолической скорости (Sm) базального и среднего сегмента межжелудочковой перегородки (МЖП) от 3,5±1,3 до 4,1±1,2 м / с (р<0,002) и от 2,7±1,2 до 3,2±1,2 м / с (р<0,004) соответственно. Увеличивалась Sm базального, среднего и верхушечных сегментов боковой стенки от 3,6±1,7 до 4,3±1,8 м / с (р<0,0008), от 2,5±1,3 до 2,9±1,2 м / с (р<0,01) и от 1,7±0,9 до 2,0±0,8 м / с (р<0,01) соответственно. Также увеличивалась Sm базальных и средних сегментов нижней стенки от 3,1±1,4 до 3,6±1,2 м / с (р<0,006) и от 2,6±1,1 до 2,7±0,4 м / с соответственно. В группе получавших стандартную терапию и плацебо достоверного увеличения Sm исследуемых сегментов миокарда ЛЖ не наблюдалось. Заключение. Внутривенное введение L-карнитина пациентам в ранние сроки ОКС позволяет уменьшить выраженность постинфарктного ремоделирования сердца и улучшить параметры сократительной функции миокарда в госпитальный период. Наиболее выраженный эффект может быть получен у пациентов с исходно сниженной ФВ.
Ключевые слова: ОКС, инфаркт миокарда, тканевая допплер-эхокардиография, L-карнитин, фракция выброса левого желудочка, локальная и глобальная сократимость, диастолическая функция
Сердечная недостаточность (СН) – это синдром, обусловленный нарушением насосной функции сердца, что приводит к изменению гемодинамики, нейрогормональных систем и не обеспечивает метаболических потребностей тканей. Частой причиной развития СН является ишемически / реперфузионное поражение миокарда. По данным исследования ЭПОХА, ИБС является основной причиной СН примерно у 2/3 пациентов, причем ИМ – у 30 % мужчин и 13 % женщин [1]. Развитие СН при остром ишемически / реперфузионном повреждении обусловлено объемом пораженного (погибшего) миокарда и в дальнейшем процессом ремоделирования миокарда [2, 3]. Основная роль в протекании процессов ремоделирования отводится активации САС, РААС и усилению оксидативного стресса [4].
В связи с этим современная тактика лечения пациентов с ОКС состоит: в скорейшем восстановлении миокардиального кровотока, в назначении препаратов, снижающих нейрогормональную активность и в попытках изменить энергетический обмен миокарда и снизить выраженность окислительного стресса. Многочисленные исследования свидетельствуют об успешном применении первых двух подходов и в снижении частоты летальных исходов, и в уменьшении степени ремоделирования миокарда и риска развития СН.
Применение же различных подходов, направленных на уменьшение окислительного стресса, в основном не привели к положительным результатам [5]. Тем не менее такие подходы продолжают разрабатываться. Например, в исследовании EMIP-FR в группе пациентов, которым не проводилась тромболитическая терапия, назначение триметазидина в остром периоде ИМ привело в отдаленном периоде к уменьшению степени ремоделирования миокарда и снижению смертности [6]. Поскольку одним из подходов к уменьшению повреждения клеток во время ишемии/реперфузии является сохранение энергетического метаболизма миокарда, с этой целью предлагают использовать экзогенное введение L-карнитина, содержание которого в период острого ишемически / реперфузионного повреждения снижено [7].
Целью настоящего исследования было оценить влияние внутривенного введения L-карнитина на структурно-функциональное состояние сердца у пациентов с ОКС.
Материалы и методы
Дизайн исследования
Проспективное, двойное слепое, рандомизированное, плацебо-контролируемое, в параллельных группах исследование.
Критерии включения пациентов
В исследование включали пациентов с ОКС (ИМ или нестабильная стенокардия), не подвергавшихся инвазивному коронарному вмешательству, старше 18 лет, подписавших согласие на проведение исследования. Диагноз ИМ устанавливали на основании наличия типичного болевого приступа продолжительностью более 20 мин, сопровождавшегося изменениями на ЭКГ в виде подъема или депрессии ST либо появлением новой блокады левой ножки пучка Гиса и повышением уровня тропонина. Диагноз нестабильной стенокардии устанавливали при учащении или усилении типичных стенокардических болей, наличии депрессий ST на ЭКГ и при отсутствии повышения уровня тропонина.
Критерии невключения пациентов
В исследование не включали пациентов с болями или изменениями на ЭКГ, возникшими в связи с повышением АД более 180 и 100 мм рт. ст., имеющих признаки кардиогенного шока, хронических заболеваний печени и почек с выраженными нарушениями их функции (повышение АСТ, АЛТ более чем в два раза от верхней границы нормы и снижение уровня скорости клубочковой фильтрации менее 30 мл / мин), хронических интоксикаций (алкоголизм, наркомания), принимающих другие препараты метаболического действия.
Рандомизация на группу плацебо и группу активного лечения проводилась случайным образом с помощью таблицы простых чисел.
Терапия
Все пациенты получали общепринятую при ОКС терапию, включавшую тромболизис по показаниям, двойную дезагрегантную терапию (ацетилсалициловая кислота + клопидогрел), антикоагулянтную терапию (гепарин или фондапаринукс), статины, β-АБ, иАПФ или сартаны, нитраты (по показаниям). Частота назначения различных групп препаратов не различалась в исследуемых группах.
Режим дозирования исследуемого препарата
Препарат L-карнитина (Элькар для внутривенного и внутримышечного введения, компания ПИК-ФАРМА, Россия) или плацебо назначались внутривенно капельно сразу после рандомизации пациента. Перед внутривенным введением содержимое ампулы растворяли в 100– 200 мл 0,9 % раствора хлорида натрия. Препарат вводили в течение первых 3 суток по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 по 15-е сутки (или до выписки, если она происходила раньше) по 2 г (по 4 ампулы) 1 раз в сутки.
Продолжительность наблюдения составляла не менее 15 дней или до выписки из стационара
Оценка действия препарата
Анализировали структурные и функциональные показатели сердца при проведении ЭхоКГ исследования (TOSHIBA Aplio MX с применением Q-анализа). Оценивали размеры камер сердца (конечно-систолический и конечно-диастолические объемы ЛЖ – КСО и КДО) и толщину стенок сердца, рассчитывали величину ФВ ЛЖ.
Диастолическая функция ЛЖ оценивалась по характеристикам трансмитрального кровотока в режиме импульсной допплерографии из верхушечной 4-х камерной позиции, а также по данным тканевой допплерографии. Оценивалась максимальная скорость кровотока раннего диастолического наполнения ЛЖ (Vmax пика Е), максимальная скорость кровотока, характеризующая наполнение ЛЖ в момент систолы предсердий (Vmax пика А), величина их отношения (Е / А), время замедления пика Е, а также время изоволюмического расслабления ЛЖ (IVRT) и время замедления раннего диастолического наполнения (DTE). Признаками нарушения диастолической функции считались увеличение значения IVRT более 100 мс, DTE более 200 мс.
Тканевую допплер-ЭхоКГ проводили в импульсном режиме. Исследование продольного движения межжелудочковой перегородки (МЖП) проводили из верхушечного доступа из 4-х и 2-камерной позиции. Для каждой стенки регистрировали движение верхней части базального и среднего сегментов; движение атриовентрикулярного кольца и верхушечного сегмента регистрировали для нижнеперегородочной, передней, задней и боковой стенок ЛЖ. Измерения в импульсном режиме проводили в режиме on-line. Устанавливали оптимальные фильтры и настройки усиления, чтобы минимизировать шум. Подобрав адекватный скоростной диапазон (15–20 см / с), контрольный объем размером меньше 5 мм располагали в центре исследуемого участка миокарда максимально параллельно направлению движения исследуемых структур. Рассчитывали максимальные скорости трех основных пиков (систолического S’’ и двух диастолических E’ и A’) и их отношение (E’ / A’).
По величине E / A трансмитрального кровотока выделяли два типа нарушения диастолической функции ЛЖ: нарушение релаксации, если Е / А<0,75, и рестриктивный тип, если Е / А>1,5. Если 0,75<Е / А<1,5, то состояние диа-столической функции ЛЖ определяли при помощи тканевой допплерографии, высчитывая скорость раннего диастолического наполнения (E’) и их отношение (Е / E’). Увеличение значения отношения Е / E’ более 13 соответствовало псевдонормальному типу диастолической дисфункции, тогда как Е / E’<8 характеризовала рассматривали, как нормальный тип диастолической функции ЛЖ.
ЭхоКГ проводили на 1–3 сутки от момента госпитализации и 12–15-е сутки заболевания или перед выпиской пациента из стационара.
Статистическую обработку результатов проводили с использованием пакета статистических программ SAS (Statistical Analysis System, SAS Institute Inc., США) – с применением параметрических и непараметрических алгоритмов вариационной статистики, учитывающих шкалы измерений каждого показателя. Для показателей, измеренных по интервальной шкале, рассчитывали средние значения, стандартные отклонения, ошибки среднего значения, медианы, интерквартильные расстояния и т. п. Для показателей, измеряемых по номинальной («наличие / отсутствие») или ранговой шкале, определяли частоту регистрации разных порядковых оценок показателя в процентах. Необходимые размеры выборок для последующих межгрупповых сравнений вычисляли по специальным формулам, основанным на χ2 критерии Фишера и t-критерии Стьюдента. При анализе межгрупповых различий для показателей, измеренных по интервальной шкале, рассчитывали значения t-критерия Стьюдента для независимых выборок. Значимость внутригрупповой динамики таких показателей за период лечения оценивали по соответствующим t-критериям для парных измерений.
Результаты
Как видно из приведенных в таблице 1 данных, рандомизация была успешной и группы практически не отличались по своим антропометрическим, анамнестическим и клиническим характеристикам.
На рисунке 1 представлены результаты измерений КДО и КСО ЛЖ у пациентов с ОКС в группах, леченных L-карнитином или плацебо, в начале и в конце госпитального периода. Введение L-карнитина на протяжении 12–15 дней привело к значимому уменьшению КСО и КДО (р=0,04 и р<0,0000 соответственно), в то время как при введении плацебо значимо увеличился КДО (р=0,0004) и имела место только тенденция к уменьшению КСО (недостоверно).
Таблица 1. Клиническая характеристика включенных пациентов
| Показатель | Группа плацебо (n=29) |
Группа L-карнитина
(n=29) |
p |
| Возраст, лет | 67±9,7 |
68±9 |
0,768 |
| Мужчины / женщины | 14 / 29 | 11 / 29 | 0,605 |
| Анамнестические данные | |||
| Работающие, % | 41 | 20 | 0,051 |
| Семейные, % | 75 | 48 | 0,769 |
| Курящие, % | 34 | 31 | 0,458 |
| Регулярные физические нагрузки, % | 0 | 30 | 0,820 |
| Жалобы при поступлении | |||
| ИМ в анамнезе, % | 41 | 44 | 0,174 |
| Сердцебиение, % | 10 | 24 | 0,151 |
| Ангинозные боли, % | 79 | 93 | 0,233 |
| Одышка, % | 20 | 40 | 0,339 |
| Слабость, % | 40 | 30 | 0,653 |
| Объективные данные | |||
| Рост, см | 164,3±7,2 | 163,8±7,3 | 0,878 |
| Масса тела, кг | 77±11,1 | 76,0±10,3 | 0,841 |
| ИМТ, кг / м2 | 25,62±9,7 | 28,7±3,2 |
0,385 |
| ЧСС, уд в мин | 77,4±12,8 |
84,1±13,7 |
0,060 |
| САД, мм рт. ст. | 135±15,8 | 137,8±11,8 | 0,672 |
| ДАД, мм рт. ст. | 80±10,5 |
80,6±11,3 |
0,913 |
| Нестабильная стенокардия | 9 (32,14 %) | 8 (27,59 %) | 0,711 |
| Тип ИМ первичный повторный |
11 (57,89 %) 8 (42,11 %) |
13 (61,90 %) 8 (38,10 %) |
0,721 |
| ИМ Q-образующий Не Q-образующий |
7 (36,84 %) 12 (63,16 %) |
6 (28,57 %) 15 (71,43 %) |
0,711 |
| ФК СН по NYHA | 1,7 | 1,6 | 0,824 |
Данные представлены в абсолютных цифрах, % от общего числа пациентов в группе, а также в виде средней величины и стандартного отклонения; р – достоверность различий между группами, леченных L-карнитином и плацебо.
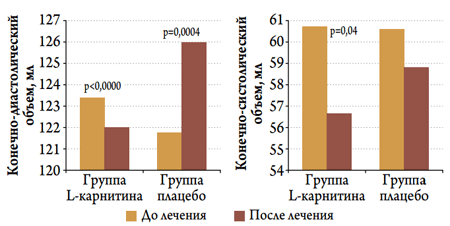
Рисунок 1. Динамика КДО и КСО ЛЖ у пациентов с ОКС в изучаемых группах в госпитальном периоде
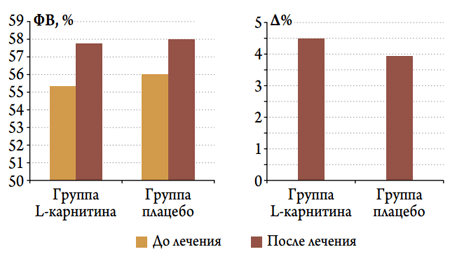
Рисунок 2. Динамика ФВ и ее изменения (∆) у пациентов с ОКС и исходно нормальной ФВ в изучаемых группах в госпитальном периоде
В целом в изучаемых группах не выявлено существенных различий по динамике ФВ – в обеих группах к концу госпитального периода было отмечено ее увеличение. Однако когда анализ изменений был проведен в подгруппах пациентов, исходно имевших нормальную (>50 %, рис. 2) или сниженную (<50 %, рис. 3) ФВ, то выявлено, что значимое увеличение ФВ происходило именно у пациентов со сниженной исходной ФВ, причем только в подгруппе больных, получавших L-карнитин, эта динамика была статистически значимой (рис. 3).
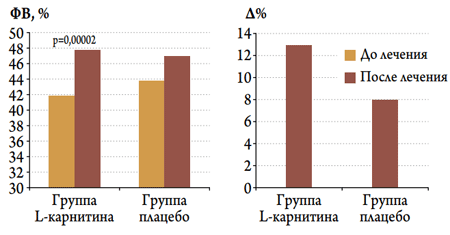
Рисунок 3. Динамика ФВ и ее изменения (∆) у пациентов с ОКС и исходно сниженной ФВ в изучаемых группах в госпитальном периоде
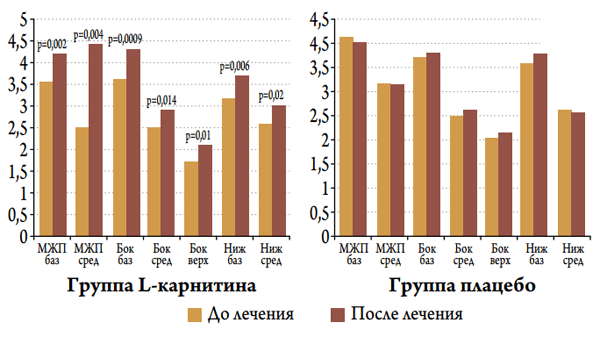
Рисунок 4. Динамика пиковой систолической скорости движения различных сегментов левого желудочка у пациентов с ОКС в изучаемых группах в госпитальном периоде
При проведении тканевой допплерографии установлено, что в группе больных, получавших L-карнитин, происходило достоверное увеличение пиковой систолической скорости движения миокарда различных сегментов ЛЖ (рис. 4). Так, наблюдалось достоверное увеличение пиковой систолической скорости (Sm) базального и среднего сегментов МЖП от 3,5±1,3 до 4,1±1,2 м / с (р<0,002) и от 2,7±1,2 до 3,2±1,2 м / с (р<0,004) соответственно. Увеличивалась Sm базального, среднего и верхушечных сегментов боковой стенки от 3,6±1,7 до 4,3±1,8 м / с (р<0,0008), от 2,5±1,3 до 2,9±1,2 м / с (р<0,01) и от 1,7±0,9 до 2,0±0,8 м / с (р<0,01) соответственно. Также увеличивалась Sm базальных и средних сегментов нижней стенки от 3,1±1,4 до 3,6±1,2 м / с (р<0,006) и от 2,6±1,1 до 2,7±0,4 м / с соответственно. В то время как в группе больных, получавших стандартную терапию и плацебо, достоверного увеличения Sm исследуемых сегментов миокарда ЛЖ не наблюдалось.
В обеих группах терапии на протяжении госпитального периода наблюдалась нормализация показателей диастолической функции ЛЖ и принципиальных различий в группах лечения выявлено не было (рис. 5). Важно отметить то, что наблюдалось снижение величины отношения E / E’ у пациентов с исходным значением более 13.
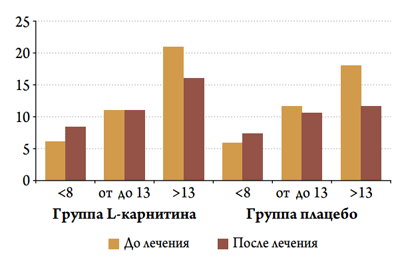
Рисунок 5. Величина отношения E / E’, измеренного в начале и в конце периода наблюдения в зависимости от ее исходного значения у больных с ОКС в изучаемых группах
Обсуждение
В проведенном нами исследовании показано, что L-карнитин, вводимый внутривенно в госпитальном периоде ОКС, позволяет уменьшить степень постинфарктного ремоделирования ЛЖ. В частности, именно в группе пациентов, леченных L-карнитином, произошло снижение КДО и КСО ЛЖ. В группе пациентов, получавших плацебо, напротив, при наблюдаемой тенденции к уменьшению КСО происходило значимое увеличение КДО, что можно рассматривать, как компенсаторную реакцию, направленную на поддержание сердечного выброса при ишемически / реперфузионном повреждении. Однако чрезмерное увеличение объемов сердца после острого миокардиального повреждения может служить неблагоприятным прогностическим признаком [8, 9].
Отмечено увеличение ФВ в обеих группах. Однако при анализе в подгруппах было выявлено, что у пациентов с исходно сниженной ФВ лишь терапия L-карнитином приводила к значимому ее увеличению, в то время как у пациентов, получавших плацебо, наблюдалась тенденция к уменьшению ФВ (недостоверно). Важность полученных данных подтверждается хорошо известными фактами о худшем прогнозе у пациентов с низкой ФВ и большими объемами полостей сердца, которые увеличиваются в постинфарктном периоде [10, 11].
Как указывалось ранее, активация трех основных систем (активация САС, РААС и окислительный стресс) главным образом принимают участие в постинфарктном ремоделировании сердца [3, 4]. Проведенные исследования с использованием β-АБ карведилола (исследование CAPRICORN), иАПФ (SAVE, AIRE, TRCE, SMILE), валсартана (VALLIANT), антагониста минералокортикоидных рецепторов эплеренона (EFESSUS) подтверждают возможность уменьшения степени ремоделирования миокарда и улучшения прогноза.
Поскольку L-карнитин играет ключевую роль в поддержании синтеза АТФ, можно полагать, что его экзогенное введение может уменьшать выраженность оксидативного стресса, вызванного ишемией / реперфузией. Данные о том, что L-карнитин уменьшает оксидативный стресс, получены в различных исследованиях [2]. В част-ности, в эксперименте на кардиомиоцитах крыс, где оксидативный стресс был вызван добавлением пероксида водорода (H2O2), L-карнитин предупреждал поражение миокарда, вызванное оксидативным стрессом, сохранял функцию митохондрий и частично предотвращал апоптоз кардиомиоцитов за счет увеличения уровня BCL-2, уменьшения Bax и выхода цитохрома С из митохондрий в клетки [12]. Таким образом, L-карнитин, снижая окислительный стресс, активирует антиапоптозные сигналы и снижает проапоптозные влияния. Соответственно можно ожидать уменьшения выраженности постинфарктного ремоделирования под влиянием L-карнитина. Действительно, многочисленные исследования свидетельствуют о позитивном влиянии L-карнитина на выраженность ишемически / реперфузионного повреждения сердца, на уменьшение зоны некроза миокарда [13]. Это сочетается с улучшением функционального постишемического восстановления [14] и ограничивает постинфарктное ремоделирование сердца [15, 16].
В двойном слепом плацебо-контролируемом исследовании CEDIM (Te L–Carnitine Ecocardiografa Digitalizzata Infarto Miocardico (CEDIM) [17], в кото-рое было включено 472 пациента с первичным передним ИМ, L-карнитин или плацебо вводили в течение 5 дней внутривенно в суточной дозе 9 г и затем внутрь в суточной дозе 6 г в течение 12 месяцев. Показано, что в группе получавших L-карнитин увеличение размеров сердца было выражено в достоверно меньшей степени, чем в группе плацебо. Так, к 12-му месяцу в группе L-карнитина КСО изменялся от 47,8±1,16 до 55,0±1,63 мл, в группе плацебо - от 48,8±1,53 до 58,9±1,75 мл. Разница в объеме к 6-му месяцу в группах была достоверной, p=0,03. Аналогично и КДО в группе получавших L -карнитин увеличивался в меньшей степени (от 90,9±2,33 до 99,3±2,06 мл), чем в группе плацебо (от 91,7±2,03 до 105,4±2,37 мл), и различия в величине КДО к 12-му месяцу между группами были достоверными (p=0,01). При этом не было значи-мых различий в величине ФВ к 12-му месяцу лечения (45,8±0,57 % против 45,2±0,52 %; p=0,46). Эти данные близки к тем, которые были получены в нашем наблюдении. В другом исследовании [18] этот положительный эффект не был подтвержден. Однако исследование [18] было кратковременным (3 месяца), с малым числом включенных больных (59 человек) и высокой пропорцией потерянных для наблюдения (22 % пациентов).
Полагают также, что L-карнитин может оказывать положительный эффект также за счет влияния на пре- и пост-кондиционирование миокарда [19]. В какой-то мере положительное влияние L-карнитина может быть подтверждено более выраженным снижением продолжительности QT и дисперсии QT у пациентов с ОКС [20].
Острая ишемия миокарда с последующей реперфу-зией приводит к нарушению локальной сократимости миокарда, и в настоящее время для оценки локальной сократимости миокарда часто используют тканевую допплерографию. Высокая информативность тканевой допплерографии при выявлении диссинергии миокарда подтверждена в эксперименте с острым нарушением коронарного кровоснабжения [21, 22], Показано, что параметры тканевой допплерографии имеют про-гностическое значение в отношении смерти при ОКС или ИМ [23-25]. Тканевая допплерография может представить данные об увеличенном давлении наполнения ЛЖ, которое еще не проявляется клинически [26]. При этом отношение E / E’ у пациентов с ИМ рассма-тривают, как мощный предиктор последующего ремо-делирования сердца и развивающейся постинфарктной СН [27]. По нашим данным, L-карнитин улучшал скорость движения отдельных сегментов стенок ЛЖ в отличие от плацебо, что свидетельствует о более раннем восстановлении сократительной функции у паци-ентов с ОКС и соответствует данным более ранних исследований [28-30].
В небольших исследованиях было показано, что лечение L-карнитином пациентов с СН с сохраненной ФВ приводило к улучшению показателей диастолической функции сердца, измеренной и по трансмитральному потоку, и по тканевой допплерографии [31]. Однако в нашем исследовании не было получено различий вели-чиы E / E’ между группами. В обеих группах происходила нормализация показателей при исходной величине более 13, которая может свидетельствовать о повышенном дав-лении наполнения [26].
Таким образом, внутривенное введение L-карнитина (Элькар для внутривенного и внутримышечного введения, компания ПИК-ФАРМА, Россия) пациентам в ранние сроки ОКС позволяет уменьшить выраженность постинфарктного ремоделирования сердца (предотвратить расширение полости ЛЖ) и улучшить параметры локальной сократимости миокарда в госпитальный период. Наиболее выраженный эффект может быть получен у пациентов с исходно сниженной ФВ.
1. Фомин И. В., Беленков Ю. Н., Мареев В. Ю., Агеев Ф. Т., Бадин Ю. В., Галявич А. С. и др. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации – данные ЭПОХА–ХСН. Журнал Сер-дечная Недостаточность. 2006;7 (3):112–5.
2. Асташкин Е. И. Глезер М. Г. Роль L -карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно-сосудистой системы. Кардиология и сердечно-сосудистая хирургия. 2012;5 (6):58–65.
3. Глезер М. Г. Фармакотерапевтические мероприятия, направленные на предупреждение постинфарктного ремоделирования сердца. Фарматека. 2009;15:48–54.
4. Глезер М. Г. , Асташкин Е. И. Патогенез постинфарктного ремоделирования сердца. Часть 1. Роль ренин-ангиотензиновой системы. Клиническая геронтология. 2000;1–2:54–60.
5. Dirksen MT, Laarman GJ, Simoons ML, Duncker DJ. Reperfusion injury in humans: a review of clinical trials on reperfusion injury inhibitory strategies. Cardiovasc Res. 2007 Jun 1;74 (3):343–55.
6. Efect of 48-h intravenous trimetazidine on short- and long-term out-comes of patients with acute myocardial infarction, with and without thrombolytic therapy; A double-blind, placebo-controlled, randomized trial. Te EMIP-FR Group. European Myocardial Infarction Project – Free Radicals. Eur Heart J. 2000 Sep;21 (18):1537–46.
7. Spagnoli LG, Corsi M, Villaschi S, Palmieri G, Maccari F. Myocardial carnitine defciency in acute myocardial infarction. Lancet. 1982 Jun 19;1 (8286):1419–20.
8. Pfefer MA, Pfefer JM. Ventricular enlargement and reduced survival afer myocardial infarction. Circulation. 1987 May;75 (5 Pt 2):IV93–7.
9. White HD, Norris RM, Brown MA, Brandt PW, Whitlock RM, Wild CJ. Lef ventricular end-systolic volume as a major determinant of survival afer recovery from myocardial infarction. Circulation. 1987 Jul;76 (1):44–51.
10. Suton M, Pfefer MA, Plappert T, Rouleau JL, Moye LA, Dagenais GR et al. Quantitative two-dimensional echocardiographic mea-surements are major predictors of adverse cardiovascular events afer acute myocardial infarction. Te protective efects of captopril. Circulation. 1994 Jan;89 (1):68–75.
11. Carstensen S, Bonarjee VV, Berning J, Edner M, Nilsen DW, Caidahl K. Efects of early enalapril treatment on global and regio-nal wall motion in acute myocardial infarction. CONSENSUS II Multi Echo Study Group. Am Heart J. 1995 Jun;129 (6):1101–8.
12. Mao CY, Lu HB, Kong N, Li JY, Liu M, Yang CY, Yang P. Levocarnitine protects H9c2 rat cardiomyocytes from H2O2-induced mitochon-drial dysfunction and apoptosis. Int J Med Sci. 2014 Aug 15;11 (11):1107–15.
13. Ura K, Hironaka Y, Sakurai I. Efect of carnitine on size limitation of experimental myocardial infarct. Am J Cardiovasc Pathol. 1990;3 (2):131–42.
14. Liedtke AJ, DeMaison L, Nellis SH. Efects of L-propionyl-L-car-nitine on mechanical recovery during refow in intact hearts. Am J Physiol. 1988 Jul;255 (1Pt 2):H169–76.
15. Micheleti R, Di Paola ED, Schiavone A, English E, Benati P, Capasso JM et al. Propionyl-L-carnitine limits chronic ventricular dilatation afer myocardial infarction in rats. Am J Physiol. 1993 Apr;264 (4 Pt 2):H1111–7.
16. Beyersdorf F, Acar C, Buckberg GD, Partington MT, Okamoto F, Allen BS et al. Studies on prolonged acute regional ischemia.
V. Metabolic support of remote myocardium during lef ventricular power failure. J Torac Cardiovasc Surg. 1989 Oct;98 (4):567–79.
17. Iliceto S, Scrutinio D, Bruzzi P, D’Ambrosio G, Boni L, Di Biase M et al. Efect of L-carnitine administration on lef ventricular remodeling afer acute anterior myocardial infarction: the L–Carnitine Ecocardiografa Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol. 1995 Aug;26 (2):380–7.
18. Iyer R, Gupta A, Khan A, Hiremath S, Lokhandwala Y. Does lef ventricular function improve with L-carnitine afer acute myocar-dial infarction? J Postgrad Med. 1999 Apr-Jun;45 (2):38–41.
19. Najaf M. Efects of postconditioning, preconditioning and perfu-sion of L-carnitine during whole period of ischemia / reperfusion on cardiac hemodynamic functions and myocardial infarction size in isolated rat heart. Iran J Basic Med Sci. 2013 Apr;16 (4):648–55.
20. Глезер М. Г., Киселева А. Е., Асташкин Е. И. Влияние L -карни-тина на дисперсию интервала QT у пациентов с острым коронарным синдромом. Кардиология. 2015;55 (3):4–9.
21. Derumeaux G, Ovize M, Loufoua J, Andre-Fouet X, Minaire Y, Cribier A, Letac B. Doppler tissue imaging quantitates regional wall motion during myocardial ischemia and reperfusion. Circulation. 1998 May 19;97 (19):1970–7.
22. Edvardsen T, Aakhus S, Endresen K, Bjomerheim R, Smiseth OA, Ihlen H. Acute regional myocardial ischemia identifed by 2-dimen-sional multiregion Doppler imaging tissue technique. J Am Soc Echocardiogr. 2000 Nov;13 (11):986–94.
23. Yu CM, Sanderson JE, Marwick TH, Oh JK. Tissue Doppler imaging a new prognosticator for cardiovascular diseases. J Am Coll Cardiol. 2007 May 15;49 (19):1903–14.
24. Richardson-Lobbedez M, Maréchaux S, Bauters C, Darchis J, Aufray Jl, Bauchart JJ et al. Prognostic importance of tissue Doppler-derived diastolic function in patients presenting with acute coronary syndrome: a bedside echocardiographic study. Eur J Echocardiogr. 2008 Sep;9 (5):594–8.
25. Hillis GS, Ujino K, Mulvagh SL, Hagen ME, Oh JK. Echocardio-graphic indices of increased lef ventricular flling pressure and dilation afer acute myocardial infarction. J Am Soc Echocardiogr. 2006 Apr;19 (4):450–6.
26. Рябова Т. Р., Соколов А. А., Рябов В. В. Возможности стресс-эхокардиографии при хронической сердечной недостаточности. Журнал Сердечная Недостаточность. 2014;15 (1):56–64.
27. Nie Y, Chen BX, Feng XH, Li ZP, Li WH, Li L, Gao W. Prognostic val-ues for in-hospital event rate of early E / Em in patients with acute myo-cardial infarction. Zhonghua Yi Xue Za Zhi. 2011 Sep;91 (34):2380–3.
28. Broderick TL, Quinney HA, Barker CC, Lopaschuk GD. Benefcial efect of carnitine on mechanical recovery of rat hearts reperfused afer a transient period of global ischemia is accompanied by a stimulation of glucose oxidation. Circulation. 1993 Mar;87 (3):972–81.
29. Nemoto S, Aoki M, Dehua C, Imai Y. Efects of carnitine on cardiac function afer cardioplegic ischemia in neonatal rabbit hearts. Ann Torac Surg. 2001 Jan;71 (1):254–9.
30. Keller VA, Toporof B, Raziano RM, Pigot JD, Mills NL. Carnitine sup-plementation improves myocardial function in hearts from ische mic dia-betic and euglycemic rats. Ann Torac Surg. 1998 Nov;66 (5):1600–3.
31. Serati AR, Motamedi MR, Emami S, Varedi P, Movahed MR. L-carnitine treatment in patients with mild diastolic heart failure is associated with improvement in diastolic function and symptoms. Cardiology. 2010;116 (3):178–82.

