Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Оригинальный ноотропный препарат для детей с рождения и взрослых с уникальным сочетанием активирующего и седативного эффектов
Коррекция ранних когнитивных нарушений у детей школьного возраста, оперированных в условиях тотальной внутривенной анестезии
Статьи Опубликовано в журнале:«АНЕСТЕЗИОЛОГИЯ И РЕАНИМАТОЛОГИЯ»; № 3; 2012; стр. 1-4.
А. М. Овезов, М. А. Лобов, М. В. Пантелеева, А. В. Луговой, П. С. Мятчин, И. Е. Гуськов
ГУ МОНИКИ им. М. Ф. Владимирского, Москва
Цель исследования — оценить возможность и эффективность применения гопантеновой кислоты для коррекции ранней послеоперационной когнитивной дисфункции у детей школьного возраста.
Материал и методы. В соответствии с критериями включения и исключения обследовано 40 детей школьного возраста (7—16 лет, физический статус ASAI—ASAII) с хирургической патологией: варикоцеле, крипторхизм, паховая грыжа. Проведена сравнительная оценка нейропсихологического статуса в до- и послеоперационном периоде у детей, оперированных в условиях тотальной внутривенной анестезии на основе (ТВА) пропофола и фентанила, рандомизированных на контрольную (без церебропротекции, 1-я группа, 20 детей) и опытную (с использованием церебропротекции гопантеновой кислотой в течение 1 мес после операции, 2-я группа, 20 детей) группы. Объем исследования: Гарвардский стандарт мониторинга, состав дыхательной смеси, биспектральный индекс, нейропсихологическое тестирование (проба Бурдона, тест "10 слов" и др.).
Результаты. При полной сопоставимости групп (по возрасту, физическому статусу и антропометрическим данным), равной продолжительности операции и эквипотенциальной дозировке препаратов выявлено, что при использовании ТВА на основе пропофола и фентанила в раннем послеоперационном периоде у детей школьного возраста развивается послеоперационная когнитивная дисфункция (ПОКД), которая без соответствующей коррекции сохраняется через 1 мес после вмешательства (как минимум) в 80% случаев. При применении церебропротекции гопантеновой кислотой (40 мг/кг • сут) выраженность ПОКД достоверно снижается либо нивелируется совсем к моменту выписки из стационара (3—7-е сутки при малотравматичных вмешательствах средней продолжительности), а через 1 мес после операции у 30% пациентов наблюдается улучшение когнитивных функций, что доказывает эффективность гопантеновой кислоты для лечения ПОКД.
Заключение. При применении у детей школьного возраста ТВА на основе пропофола и фентанила, показано превентивное назначение церебропротекторов мультимодального действия, не имеющих возрастных ограничений (например, гопантеновой кислоты в дозе 40 мг/кг • сут).
Ключевые слова: тотальная внутривенная анестезия, пропофол, детский возраст, послеоперационная когнитивная дисфункция, гопантеновая кислота, церебропротекция
Correction Of Early Cognitive Disorders In School-age Children, Operated Under Total Intravenous Anaesthesia
Ovezov A.M., Lobov M.A., Panteleeva M.V., Lugovoy A.V., Myatchin P.S., Guskov I.E.
The aim of the study was to assess the possibility and effectiveness of hopaten acid use for early postoperative cognitive dysfunction correction in children of school age.
Materials and methods. In compliance with inclusion and exclusion criteria, totally 40 children of school age (7-16 years old, ASA status I-II) with surgical pathology: (varicocele, cryptorchidism, inguinal hernia) were included. A comperative assessment of neuropsychic status during pre - and postoperativeare period in children, operated under propofol-fentanyl total intravenous anesthesia (TIVA) was conducted. All patients were randomized to the control (without cepebroprotection 1st group, 20 children) and experimental (using cepebroprotection with hopaten acid within 1 month after the operation, 2nd group, 20 children) groups. Dimension of the study: Harvard standard monitoring, respiratory gas composition, neuropsychic tests (Bourdon test, "10 words test", etc.)
Results. For full compatibility groups (age, ASA status and anthropometric data, equal operation duration and the equipotential drug dosage adjustment is revealed, that in group of propofol-fentanyl TIVA in the early postoperative period in school age children postoperative cognitive dysfunction (POCD) is developing, which in case of absence of the corresponding correction is maintained after 1 month after operation (at least) in 80% of cases. In the application of hopaten acid cerebroprotection (40 mg/kg per day) severity of POCD reliably is reduced or compensated by the time of discharge from the hospital (3-7-th day when non-traumatic interventions), and 1 month after the operation in 30% of patients experienced improvement of cognitive functions, which proves the effectiveness of hopaten acid for POCD treatment.
Conclusion. In case of propofol-fentanyl TIVA anesthesia in children of school age is indicated preventive prescription of multimodal cerebroprotectors without age limitations (for example hopaten acid (40 mg/kg per day) for POCD treatment.
Key words: total intravenous anaesthesia (TIVA), propofol, child age, postoperative cognitive dysfunction (POCD), hopaten acid, cerebroprotection
Введение.
Несмотря на появление в последние годы нового поколения эффективных и относительно безопасных анестетиков, проблема выбора анестезиологического пособия с позиций снижения риска развития церебральных осложнений сохраняет свою актуальность, особенно у детей [4—6, 9—13, 20, 21, 23].
Возможное патогенное влияние общих анестетиков и наркотических анальгетиков выражается в нарушении системной и регионарной гемодинамики, срыве ауторегуляции мозгового кровотока, прямом токсическом действии на нервные клетки и нарушении синтеза и высвобождения нейротрансмиттеров, что может приводить к возникновению интра- и постоперационных церебральных осложнений у пациентов любого возраста [4—7, 9, 10, 12, 16—18, 23, 24]. Наиболее распространенная форма церебральных осложнений общей анестезии — послеоперационная когнитивная дисфункция (ПОКД), т. е. когнитивное расстройство, развивающееся в ранний и сохраняющееся в поздний послеоперационный периоды, проявляющееся в виде нарушений памяти и других высших корковых функций (мышления, речи и т. п.) и подтвержденное данными нейропсихологического тестирования в виде снижения показателей тестирования в послеоперационный период не менее чем на 10% от дооперационного уровня [9, 22]. На наш взгляд, ПОКД следует рассматривать как одно из клинических проявлений послеоперационной энцефалопатии наряду с делирием, аффективными расстройствами и астенией [6, 17].
Как свидетельствуют данные литературы, ПОКД развивается при любом виде анестезиологического пособия, при применении анестетиков с доказанным нейропротективным действием наблюдается когнитивный дефицит в 1-е сутки после оперативного вмешательства. Возникновение послеоперационных когнитивных расстройств, как принято считать в настоящее время, имеет мультимодальную природу со следующими ведущими патогенетическими факторами [3—7, 9—13, 15—24]:
По словам J. Thomas [24], на сегодняшний день, "открывая любой анестезиологический журнал, трудно не обнаружить статьи о нейротоксичности анестетиков". Все возрастающий интерес современной анестезиологии к данной проблеме обусловлен прежде всего высокой частотой встречаемости ПОКД, нерешенностью вопроса о возможности ее предотвращения, увеличением сроков пребывания в стационаре и расходов на лечение, снижением качества жизни пациентов и выживаемости в течение 1-го года после операции [6, 7, 9, 12, 13, 16, 20]. Распространенность ПОКД во взрослой популяции в странах Европы и США определена в мультицентровом исследовании International Study of Postoperative Cognitive Dysfunction (ISPOCD1, ISPOCD2) в 1994—2000 гг., в котором было четко установлено, что ранняя (острая, до 7 сут после вмешательства) послеоперационная когнитивная дисфункция развивается в среднем у 19% больных моложе 40 и у 69% старше 60 лет. Стойкая ПОКД (в течение 3 мес после операции) отмечается у 6,7% лиц молодого и 24% пожилого возраста. Длительная ПОКД (на протяжении 1—2 лет) сохраняется у 10,4% больных, а более 2 лет — у 1—2% [9, 22].
Это — у взрослых! А что же у детей? До настоящего времени практически отсутствуют бесспорные данные о частоте развития ПОКД у детей при применении различных видов анестезиологического пособия, не определена структура когнитивных нарушений в зависимости от операции и анестезии, не существует единого алгоритма профилактики и коррекции послеоперационного когнитивного дефицита. Публикации по проблеме эпидемиологии и профилактике ПОКД у детей немногочисленны, особенно в отечественной литературе [4—6, 13, 17, 21]. В то же время большинство исследователей утверждают, что нейротоксическое действие препаратов для общей анестезии максимально выражено у детей, особенно младшей возрастной группы. Причем негативное влияние общей анестезии на головной мозг в раннем детском возрасте вызывает нарушение нейропсихологического развития, как в послеоперационном периоде, так и отсрочено [3—6, 10—13, 16—18, 20, 23]. По paзным данным, в том числе и нашим собственным наблюдениям, распространенность острой ПОКД у детей, подвергавшихся плановому хирургическому вмешательству (и не страдавших хроническими либо неврологическими заболеваниями), составляет при комбинированной общей анестезии (КОА) (нейролептанальгезии, атаралгезии, КОА на основе тиопентала-натрия, фентанила и закисно-кислородной смеси) до 90%, при тотальной внутривенной анестезии (ТВА) на основе кетамина 100% случаев (с сохранением нарушений долгосрочной памяти вплоть до 14 сут после операции!), при ТВА на основе пропофола и фентанила от 50 до 80% [3—6, 10, 12, 17—21, 23]. Эпидемиология стойкой и длительной ПОКД у детей практически не изучена [13].
По данным ГУ МОНИКИ им. М. Ф. Владимирского в периоперационном периоде при оперативных вмешательствах (разной длительности и травматичности), выполненных в условиях ТВА на основе пропофола, развивается синдром "ишемии/реперфузии" головного мозга и "двухволновая" активация свободнорадикального процесса (СРП). Через сутки после операции наблюдается диссоциация между параметрами СРП и антиоксидантной защиты (АОЗ), свидетельствующая о развитии окислительного стресса и ускорения генетически детерминированного апоптоза, что подтверждается иммунологическими данными: падением уровня свободных антител к глиофибриллярному кислому белку и протеину S-100 на 3-и сутки послеоперационного периода с последующей нормализацией показателей на 7-е сутки [5, 6, 17].
Результаты морфологических исследований, полученные нами в остром эксперименте, подтверждают повреждающее действие ТВА на основе пропофола на нейронную популяцию головного мозга неполовозрелых крыс. На 3-и сутки после внутрибрюшинной анестезии (пропофол 20 мг/кг) наблюдается почти двукратное увеличение измененных нейронов гиппокампа (относительно нормы) у кооперированных крыс. Патогистологические изменения проявляются в увеличении гиперхромных нейронов и нейронов с явлениями хроматолиза (набухание тел нейронов, просветление цитоплазмы, эктопия ядер и ядрышек), что было отмечено и другими исследователями [3, 6, 20, 23]. Последние экспериментальные данные (M. L. Pearn, Y, B. S. Hu, T. R. Niesman и соавт. [18] показали, что нейротоксическое действие пропофола (вплоть до инициации апоптоза), аналогичное таковому у изофлюрана, очевидно, реализуется через активацию р75-нейротрофин-рецепторов (p75NTR) с последующей деполимеризацией цитоскелета.
Таким образом, данные литературы указывают на наличие нейротоксичности практически у всех общих анестетиков и гипнотиков. С учетом этого становится очевидной необходимость профилактики и коррекции послеоперационной когнитивной дисфункции. Исходя из современных взглядов на патогенез ПОКД, средствами выбора для лечения когнитивных расстройств могут служить лекарства с поливалентным эффектом (антиоксидантным, антигипоксантным, ноотропным) либо комбинации нейропротекторов с разной направленностью действия. Подобное мультимодальное действие оказывает отечественный ноотропный препарат Пантагам (гопантеновая кислота), успешно применяемый в детской неврологии для терапии когнитивных расстройств [1].
Цель исследования — оценка возможности и эффективности применения гопантеновой кислоты для коррекции ранней послеоперационной когнитивной дисфункции у детей школьного возраста.
Материал и методы. В рамках рандомизированного открытого параллельно-группового клинического исследования после одобрения локального этического комитета ГУ МОНИКИ им. М. Ф. Владимирского (председатель—проф. В. А. Исаков) обследовано 40 детей (5 девочек и 35 мальчиков) в возрасте 7—16 лет, оперированных в плановом порядке в 2011 г. в отделении детской хирургии.
Критерии включения: информированное согласие пациентов и их родителей на участие в исследовании; возраст детей 7—16 лет; физический статус ASAI— ASAII; наличие врожденной хирургической патологии (паховые грыжи, варикоцеле, крипторхизм), являющейся показанием к плановому оперативному лечению; использование однотипного варианта анестезиологического обеспечения операций — ТВА на основе пропофола и фентанила; продолжительность операции от 30 до 90 мин.
Критерии исключения: отсутствие информированного согласия пациентов и их родителей на участие в исследовании; дети младше 7 лет и старше 16 лет; продолжительность операции менее 30 мин и более 90 мин; физический статус ASAI—ASAII; наличие тяжелой хронической и острой хирургической патологии, сопровождающейся нарушениями системного метаболизма, других органов и систем; наличие заболеваний нервной и сердечно-сосудистой систем.
Рандомизация: все пациенты были рандомизированы на 2 группы в соответствии с протоколом и задачами исследования. 1-ю группу составили 20 детей, не получавших в послеоперационном периоде нейропротективные средства (контроль). 2-ю группу составили 20 детей, получавших перорально гопантеновую кислоту (Пантогам) в дозе 40 мг/кг•сут в течение месяца, начиная с 1-х суток послеоперационного периода (опыт).
Анестезиологическое обеспечение было одинаковым у всех пациентов. Премедикация: внутримышечное введение атропина сульфата (0,01 мг/кг) супрастина (0,25—0,5 мг/кг) и дормикума (0, мг/кг) за 30—40 мин до подачи в операционную. Индукция: пропофол (2 мг/кг), фентанил (2 мкг/кг), эсмерон (0,6—0,8 мг/кг) с последующей установка ларингеальной маски (LMA) размера, соответствующего возрасту и массе тела. Поддержание анестезии пропофол (3,5—12 мг/кг•ч), фентанил (1,5—4,5 мкг/кг•ч), эсмерон (0,6 мг/кг•ч). ИВЛ осуществляли воздушно-кислородной смесью (FiO2 = 0,3) в режиме нормокапнии, использовали наркозно-дыхательный аппарат Draeger Primus. Интраоперационный мониторинг: ЭКГ, ЧСС, АД неинвазивное, SpO2, температура тела, анализ Fi и Et дыхательной смеси (Philips IntelliVue МР30), биспектральный индекс (BIS). Согласно Протоколу исследования у всех пациентов интраоперационно поддерживали примерно одинаковый уровень угнетения сознания: на значениях BIS = 40—60%.
Методы оценки когнитивных функций [2, 8, 14]: общеневрологическое обследование; проба Бурдона (определение коэффициента концентрации внимания); тест "10 слов" (оценка краткосрочной и долгосрочной памяти); шкала Спилбергера (определение уровня тревожности); шкала Коннерс (заполняется родителями для определения симптомов гиперактивности и дефицита внимания).
При оценке когнитивных функций в послеоперационном периоде ПОКД у детей верифицировали по ухудшению результатов пробы Бурдона и теста "10 слов" не менее чем на 10% по сравнению с исходными [22].
Этапы исследования: 1-й — предоперационный период (за 1 сут и до операции); 2-й — 1-е сутки после операции; 3-й — перед выпиской из стационара (на 3—7-е сутки после операции); 4-й — через 1 мес после операции.
Статистическую обработку (описательная статистика, парный и независимый t-критерий Стьюдента, критерий Вилкоксона, критерий Манна—Уитни) полученных результатов выполняли с помощью программы Statistica 7.0 ("Stat Soft", Inc., США). Нормальность распределения определяли тестами Шапиро—Уилка и Колмогорова—Смирнова. Данные представлены в виде Mean ± σ.
Результаты исследования и их обсуждение.
Группы были полностью сопоставимы по антропометрическим данным, половому составу (15% девочек в 1-й группе и 10% во 2-й, р = 0,635), физическому статусу, потребности в препаратах для ТВА, продолжительности оперативного вмешательства и анестезиологического пособия. Общая характеристика групп представлена в табл. 1.
Общая характеристика групп (M ± σ)
|
Характеристика групп |
1-я группа (n = 20) |
2-я группа (n = 20) |
M - W (U) Test, p |
| Возраст | 12,61 ± 2,97 | 14,70 ± 1,83 | 0,061 |
| Масса тела, кг | 47,89 ± 15,89 | 54,60 ± 10,08 | 0,375 |
| Пропофол, мг/кг • ч | 7,90 ± 2,65 | 7,10 ± 2,12 | 0,369 |
| Пропофол (всего), мг | 533,33 ± 179,95 | 680,0 ± 301,11 | 0,151 |
| Фентанил, мкг/кг•ч | 1,93 ± 1,37 | 1,95 ± 1,26 | 0,465 |
|
Фентанил (всего), мкг |
193,33 ± 88,37 |
255,00 ± 101,24 |
0,116 |
|
Длительность операции, мин |
37,00 ± 12,05 |
46,70 ± 31,52 |
0,677 |
|
Длительность анестезии, мин |
61,00 ± 12,58 |
68,20 ± 28,64 |
0,595 |
Клиническое течение использованного варианта ТВА характеризовалось малой вариабельностью мониторируемых параметров гемодинамики и гомеостаза на всех этапах операции, что указывало на его эффективность и адекватность анестезиологической защиты у всех обследованных. Необходимости в продленной ИВЛ не наблюдали ни в одном случае, LMA удаляли через 7—15 мин после окончания операции. Через 15—30 мин по достижении 10 баллов по шкале Aldrete пациентов переводили в палату.
Результаты нейропсихологического тестирования представлены в табл. 2 и на рис. 1—2. Поясняя полученные данные, отметим, что исходный психоневрологический статус у всех детей был нормальным: отсутствовала неврологическая патология, уровень развития соответствовал возрасту, показатели концентрации внимания — краткосрочной (в 100% норма) и долговременной памяти (в 100% норма) — были сопоставимы в обеих группах. У всех пациентов до операции наблюдали средний уровень тревожности, оценка по шкале Коннерс составила 23,47 ± 7,83 и 23,60 ± 9,54 балла в 1-й и 2-й группах соответственно (признаки гиперактивности и невнимательности), что объяснимо предоперационным стрессом.
Рис. 1. Динамика показателя краткосрочной памяти на этапах исследования (ось абсцисс).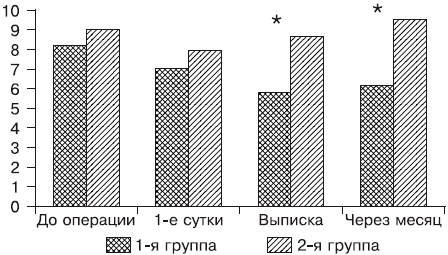
Рис. 2. Динамика показателя долгосрочной памяти на этапах исследования (ось абсцисс).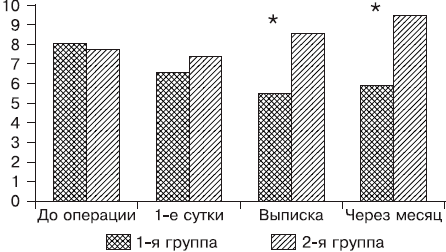
Таблица 2
Результаты теста проба Бурдона на этапах исследования (N ± σ)
| Этап исследования | Тест | 1-я группа (n = 20) | 2-я группа (n = 20) | M - W (U) Test, p |
| До операции | Показатель концентрации внимания | 1,20 ± 1,05 | 1,40 ± 0,67 | 0,248 |
| Устойчивость внимания на 1-й минуте | 2,24 ± 0,60 | 2,50 ± 0,45 | 0,332 | |
| Устойчивость внимания на 2-й минуте | 2,27 ± 1,13 | 2,57 ± 0,54 | 0,055 | |
| Время, затраченное на выполнение теста | 143,61 ± 30,57 | 128,00 ± 16,19 | 0,132 | |
| 1-е сутки после операции | Показатель концентрации внимания | 0,95 ± 0,76 | 1,59 ± 0,90 | 0,073 |
| Устойчивость внимания на 1-й минуте | 1,90 ± 0,51 | 2,61 ± 0,66 | 0,006 | |
| Устойчивость внимания на 2-й минуте | 1,92 ± 0,62 | 2,22 ± 0,43 | 0,100 | |
| Время, затраченное на выполнение теста | 163,33 ± 35,44 | 141,00 ± 21,83 | 0,064 | |
| При выписке из стационара | Показатель концентрации внимания | 0,43 ± 0,20 | 1,68 ± 1,33 | 0,001 |
| Устойчивость внимания на 1-й минуте | 1,92 ± 0,44 | 2,87 ± 0,62 | 0,001 | |
| Устойчивость внимания на 2-й минуте | 1,71 ± 0,37 | 2,30 ± 0,34 | 0,003 | |
| Время, затраченное на выполнение теста | 171,25 ± 23,66 | 123,00 ± 22,14 | 0,001 | |
| Через 1 мес после операции | Показатель концентрации внимания | 0,38 ± 0,19 | 3,44 ± 1,55 | 0,000 |
| Устойчивость внимания на 1-й минуте | 1,88 ± 0,36 | 2,83 ± 0,69 | 0,001 | |
| Устойчивость внимания на 2й минуте | 1,86 ± 0,35 | 2,78 ± 0,79 | 0,001 | |
| Время, затраченное на выполнение теста | 168,33 ± 14,58 | 124,00 ± 24,59 | 0,001 |
В 1-е сутки после операции отмечалось снижение более чем на 10% показателей краткосрочной памяти у 62,5% пациентов контрольной группы, показатели долгосрочной памяти ухудшились у 53% детей (р = 0,028 — здесь и далее в тексте по отношению к исходным данным). Во 2-й группе явления ПОКД в виде снижения мнестических показателей отмечались у 50% больных (р = 0,043). Перед выпиской из стационара нарушение краткосрочной памяти было диагностировано у 84% (р = 0,005), а долгосрочной — у 53% пациентов (р = 0,005) в 1-й группе, тогда как на фоне проводимой церебропротекции у пациентов 2-й группы показатели памяти восстановились до исходных значений (р = 0,138 и 0,441 соответственно). Через 1 мес мнестические показатели в контрольной группе оставались сниженными более чем на 10% (что подтверждало наличие ПОКД после данного варианта ТВА): у 90% пациентов краткосрочной памяти (р = 0,012) и 80% долгосрочной (р = 0,015). Во 2-й группе отсутствовали признаки когнитивного дефицита, а у 30% пациентов этой группы наблюдали увеличение показателей, особенно долгосрочной памяти (на 22%, р = 0,013). При сравнении групп между собой наблюдали достоверно лучшие показатели краткосрочной и долгосрочной памяти (см. рис. 1 и 2) при выписке и через 1 мес после операции у пациентов 2-й группы, что подтверждало терапевтический эффект гопантеновой кислоты при лечении ПОКД, обусловленной ТВА на основе пропофола и фентанила.
Показатели внимания, представленные в табл. 2, были сопоставимы с показателями памяти и менялись однонаправленно. В 1-е сутки после операции наблюдали снижение (более чем на 10% от исходных) показателей концентрации и устойчивости внимания у 62,5% пациентов 1-й группы (р = 0,008) и у 50% (р = 0,039) 2-й группы. Перед выпиской в контрольной группе показатели внимания достоверно снижались у 81% детей (р = 0,002), а у 50% отмечена неустойчивость внимания (р = 0,019). В группе коррекции на данном этапе дефицит внимания отмечали у 60% пациентов (p = 0,042) при нормализации устойчивости внимания. Через 1 мес после операции сохранялось снижение концентрации внимания у 80% (р = 0,008) больных 1-й группы при дефиците его устойчивости у 50% (р = 0,018). Во 2-й группе, напротив, показатели пробы Бурдона вернулись к исходным и незначительно улучшились.
При оценке тревожности ее средний уровень недостоверно снижался в 1-е сутки после проведения оперативного лечения и повышался при выписке. Через 1 мес показатель ситуационной тревожности в обеих группах в 90% соответствовал возрастной норме, что было лучше исходных значений. Умеренную тревожность наблюдали лишь у 10% всех пациентов, что было ниже исходных значений на 13% (р = 0,107) и 30% > (р = 0,012) в 1-й и 2-й группах соответственно.
Повторную оценку по шкале Коннерс выполняли через 1 мес после операции. Ее результаты свидетельствовали о сохранении признаков синдрома гиперактивности и невнимательности у пациентов 1-й группы на исходном уровне (26,22 ± 7,22 против 23,47 ± 7,83 исходно, р = 0,678). В опытной группе, уровень гиперактивности и невнимательности, напротив, снизился (16,70 ± 8,33 против 23,60 ± 9,54 исходно, р = 0,024).
Таким образом, можно утверждать, что при использовании ТВА на основе пропофола и фентанила в раннем послеоперационном периоде у детей школьного возраста возникает послеоперационная когнитивная дисфункция, которая сохраняется через 1 мес (как минимум) после вмешательства. Поэтому необходимо продолжать исследования по эпидемиологии ПОКД у детей разного возраста, особенно отсроченной и длительной форм когнитивных нарушений при вариантах анестезиологического пособия. При применении церебропротекции гопантеновой кислотой выраженность ПОКД достоверно снижается (либо нивелируется совсем) уже к моменту выписки из стационара (3—7-е сутки при малотравматичных вмешательствах средней продолжительности), а через 1 мес после операции у 30% пациентов наблюдается улучшение когнитивных функций, что доказывает эффективность препарата для лечения ПОКД.
Выводы
1. При использовании для анестезиологического обеспечения малотравматичных операций средней продолжительности ТВА на основе пропофола и фентанила в 1-е сутки послеоперационного периода у практически здоровых детей школьного возраста в 62,5% возникает ПОКД.
2. При отсутствии своевременной коррекции выявленных нарушений когнитивного потенциала у данного контингента больных к моменту выписки из стационара нарушения памяти сохраняются у 54—83% детей, а нарушения внимания — у 50—81%, т. е. частота явлений ПОКД повышается, сохраняясь на уровне 80% через 1 мес после операции.
3. Использование для церебропротекции у детей школьного возраста с первых суток послеоперационного периода гопантеновой кислоты в дозе 40 мг/кг эффективно нивелирует явления ПОКД уже к моменту выписки из стационара, а через 1 мес после операции у 30% пациентов на фоне приема препарата наблюдается достоверное повышение когнитивного потенциала по сравнению с исходным.
4. При применении у детей школьного возраста ТВА на основе пропофола и фентанила показано превентивное назначение церебропротекторов мультимодального действия, не имеющих возрастных ограничений, например гопантеновой кислоты.
ЛИТЕРАТУРА
1. Балканская С. В., Студеникин В. М., Кузенкова Л. М., Маслова О. И. Ноотропные препараты в коррекции когнитивных функций у детей с эпилепсией. Вопр. соврем. педиатр. 2007; 6 (2): 44—48.
2. Глозман Ж. М., Потанина А. Ю., Соболева А. Е. Нейропсихологическая диагностика в дошкольном возрасте. 2-е изд. СПб.: Питер; 2008.
3. Дубовая Т. К., Лобов М. А., Древаль А. А. и др. Гисто- и цитоархитектоника гиппокампа неполовозрелых крыс на фоне введения пропофола и мексидола. Бюл. экспер. биол. 2010; 4: 457—459.
4. Елькин И. О., Егоров В. М., Блохина С. И. Операционный стресс, общая анестезия и высшие психические функции. Екатеринбург: Клен; 2007.
5. Князев А. В. Церебральные и метаболические нарушения при оперативных вмешательствах под общим обезболиванием у детей: Автореф. дис. ... канд. мед. наук. М.; 2006.
6. Лобов М. А., Овезов A. M., Пантелеева М. В. и др. Патофизиологические и морфологические основы церебропротекции в периоперационном периоде. В кн.: Сборник материалов Научно-практической конф. "Современные аспекты лечения заболеваний нервной системы". Тверь; 2010. 28—34.
7. Федоров С. А., Большедворов Р. В., Лихванцев В. В. Причины ранних расстройств психики больного после операций, выполненных в условиях общей анестезии. Вестн. интенсив. тер. 2007; 4: 17—25.
8. Цветкова Л. С. Методика нейропсихологического обследования детей. М.: МГУ; 1998. 21—26.
9. Шнайдер Н. А. Новый взгляд на проблему послеоперационной когнитивной дисфункции. Острые и неотлож. состояния в практике врача 2008: 5—6: 64—67.
10. Creeley C. E., Olney J. W. The young: neuroapoptosis induced by anesthetics and what to do about it. Anesth. Analg. 2010; 110: 442—448.
11. DMaggio C., Sun L., Li G. Early childhood exposure to anesthesia and risk of developmental and behavioral disorders in a sibling birth cohort. Anesth.l Analg. 2011; 113: 1143—1151.
12. Eisenach J. C. Anesthesia and neurodevelopment in children. Time for an answer? Anesthesiology 2008; 109: 757—761.
13. Hansen T. H., Flick R. Anesthetic effects on the developing brain: Insights from epidemiolog. Anesthesiology 2009; 110: 1—3.
14. Kain Z. N., Mayes L. C., Caldwell-Andrews A. A. et al. Preoperative anxiety, postoperative pain, and behavioral recovery in young children undergoing surgery. Pediatrics 2006; 118: 651—658.
15. Kalkman C. J., Peelen L., Moons K. G. et al. Behavior and development in children, and age at the time of first anesthetic exposure. Anesthesiology 2009; 110: 805—812.
16. Krenk L., Rasmussen L. S., Kehlet H. New insights into the pathophysiology of postoperative cognitive dysfunction. Acta Anaesthesiol. Scand. 2010; 54 (8): 951—956.
17. Lobov M., Knyazev A., Ovezov A. et al. Perioperative prevention of early cognitive dysfunction in children. Intensive Care Med. 2010; 36 (Suppl. 2): 276.
18. Pearn M. L., Hu Y. B. S., Niesman I. R. et al. Propofol neurotoxicity is mediated by p75 neurotrophin receptor activation. Anesthesiology 2012; 116: 1—10.
19. Persson J. Wherefore ketamine? Curr. Opin. Anaesthesiol. 2010; 23: 455—460.
20. Perouansky M., Hemmings H. C. Neurotoxicity of general anesthetics. Anesthesiology 2009; 111: 1365—1371.
21. Rappaport B., Mellon R. D., Simone A., Woodcock J. Defining safe use of anesthesia in children. N. Engl. J. Med. 2011; 364: 1387—1390.
22. Rasmussen L. S., Larsen K., Houx P. et al. ISPOCD group. The assessment of postoperative cognitive function. Acta Anaesthesiol. Scand. 2001; 45: 275—289.
23. Stratmann G. Neurotoxicity of anesthetic drugs in the developing brain. Anesth. Analg. 2011; 113 (5): 1170—1179.
24. Thomas J., Crosby G., Drummond J. C., Todd M. Anesthetic neurotoxicity: A difficult dragon to slay. Anesth. Analg. 2011; 113 (5): 969—971.
Комментарии
ПРАКТИКА ПЕДИАТРА

