 invar.ru
invar.ru

Скин-кап – негормональное лечение хронических воспалительных заболеваний кожи, таких как псориаз, атопический дерматит, себорейный дерматит у взрослых и детей с 1 года*
Активированный пиритион цинка (скин-кап) в лечении легкой и среднетяжелой форм папулезно-бляшечного псориаза. Результаты рандомизированного, плацебо контролируемого исследования «антрацит»
СтатьиОпубликовано в журнале:
« В помощь практическому врачу » № 1, 2008
Кубанова А.А.
ФГУ «Центральный научно-исследовательский кожно-венерологический институт Росмедтехнологий», г. Москва
Целью настоящего рандомизированного, плацебо контролируемого исследования была оценка эффективности активированного пиритиона цинка (ПЦ) у пациентов с легким и среднетяжелым папулезно-бляшечным псориазом. В исследование было включено 60 пациентов со значениями индекса PGA 2-3 балла и индекса PASI <10 баллов, площадью поражения <10% поверхности тела. В качестве показателей эффективности оценивались: индексы PGA и PASI, площадь поражения, количество пациентов, которым потребовалось дополнительное назначение топических кортикостероидов (ТКС) после первой недели лечебного периода. Количество пациентов со снижением индекса PGA на 2 и более балла (основной показатель эффективности) составило 55% и 25% в группах активированного ПЦ и плацебо соответственно (р = 0,032). Среди больных, получавших ПЦ, было значительно больше пациентов, имевших снижение индекса PGA до 0 или 1 балла (значения «Чисто» или «Почти чисто») и индекса PASI на 50% и более, при этом в группе плацебо 30% пациентов были вынуждены использовать ТКС (против 5% в группе активной терапии; р = 0,013). В обеих группах было зарегистрировано незначительное количество побочных эффектов. Таким образом, применение активированного ПЦ при легком и среднетяжелом папулезно-бляшечном псориазе характеризуется выраженным эффектом, снижением потребности в использовании ТКС, а также высокой безопасностью и переносимостью.
Ключевые слова: псориаз, активированный пиритион цинка
Activated zinc pyrithione (Skin-cap) in the treatment of mild-to-moderate plaque type psoriasis. The results of randomized placebo-controlled trial ANTRATSIT.
Kubanova A.A.
Present randomized placebo-controlled trial with three weeks of double blind period was intended to evaluate the efficacy of activated zinc pyrithione (AZP) in mild-to-moderate plaque type psoriasis. Sixty patients with PGA score of 2 or 3, PASI score <10, body surface area involved (BSA) <10% were included in the study Outcome measures were PGA and PASI scores, BSA, proportion of patients that required additional administration of topical corticosteroids (TCS) after first week of double blind period. Proportions of patients with decrease in PGA score of >2 (main outcome measure) were 55% and 25% in AZP and placebo groups respectively (р = 0.032). In AZP group higher number of patients had PGA score of 0 or 1 ("clear" or "almost clear") and decrease of PASI score of >50%. 30% of patients in placebo group required TCS during double blind period compared to 5% in AZP group (р = 0.013). Insignificant numbers of adverse events were reported in both groups. In conclusion, AZP in patients with mild-to-moderate plaque type psoriasis was effective, reduced the requirement in TCS and had good safety profile.
Key words: Psoriasis, activated zinc pyrithione
Введение
Псориаз является распространенным кожным заболеванием и характеризуется существенно сниженным качеством жизни, нарушением социальной адаптации пациентов [1, 2]. В последние несколько десятилетий были достигнуты значительные успехи в лечении псориаза: разработаны эффективные протоколы ПУВА-терапии, обосновано применение цитостатиков и анти-ФНОα препаратов. Тем не менее это заболевание по-прежнему остается неизлечимым и сложноконтролируемым, а использующиеся подходы зачастую отличаются плохой переносимостью [3].
Большинство больных псориазом имеют легкое или среднетяжелое течение заболевания, однако именно эта группа является одной из наиболее сложных с терапевтической точки зрения [2]. Применение некоторых методов лечения, таких как ПУВА-терапия, цитостатиков, антиметаболитов, анти-ФНОα препаратов, может быть неоправдано в этой группе, поскольку, несмотря на эффективность, имеется значительное количество побочных эффектов [3]. Использование смол, антралина ограничивается их относительно низкой эффективностью и в ряде случаев может привести к малигнизации [3]. При легком и среднетяжелом папулезно-бляшечном псориазе назначение топических кортикостероидо вдалеко не всегда дает желаемый эффект [3]. Кроме того, топические кортикостероиды не могут использоваться длительное время в связи с развитием атрофии кожи, формированием толерантности и таким серьезным побочным эффектом, как генерализованный пустулезный псориаз [3]. Таким образом, поиск новых подходов к терапии легкого и среднетяжелого папулезно-бляшечного псориаза, которые бы отличались высокой эффективностью и приемлемой переносимостью при потенциальной возможности безопасного длительного применения, является актуальной задачей, решение которой позволит значительно улучшить качество жизни пациентов. В последние несколько десятилетий для местного лечения псориаза был предложен ряд нестероидных препаратов, включая Скин-кап (активированный пиритион цинка, ПЦ), препарат, отличающийся безопасностью и широким спектром фармакодинамических эффектов [4]. Целью настоящего исследования была оценка эффективности активированного ПЦ у пациентов с легким и среднетяжелым папулезно-бляшечным псориазом.
Материалы и методы
Для достижения поставленной цели в 2007 г. под общим руководством акад. Кубановой А.А. было проведено двойное слепое, рандомизированное, плацебо контролируемое исследование эффективности местного применения активированного пиритион цинка при легком и среднетяжелом папулезно-бляшечном псориазе (исследование «Антрацит»). Координаторы исследования: Кубанов А. А., Петровский Ф.И. В исследовании приняли участие 10 центров (фамилии исследователей приведены в алфавитном порядке): Абдрахманов Р.М. (Казань), Иванов О.Л. (Москва), Кунгуров Н.В. (Екатеринбург), Короткий Н.Г. (Москва), Надгериева О.В. (Москва), Новиков А.И. (Омск), Орлов Е.В. (Самара), Перламутров Ю.Н. (Москва), Самцов А.В. (Санкт-Петербург), Скрипкин Ю.К. (Москва).
Исследование состояло из трех периодов (см. рис. 1.). Первый период - двойное слепое, плацебо контролируемое исследование в параллельных группах продолжительностью 3 недели (далее по тексту двойной слепой период):
- активированный цинк пиритион 0,2 % (Скин-кап) аэрозоль 2 раза в день в течение 21±3 дня (далее по тексту группа активной терапии или группа активированного ПЦ);
- плацебо-контроль (основа Скин-капа) аэрозоль 2 раза в день в течение 21±3 дня (далее по тексту группа плацебо).
Рис. 1. Дизайн исследования
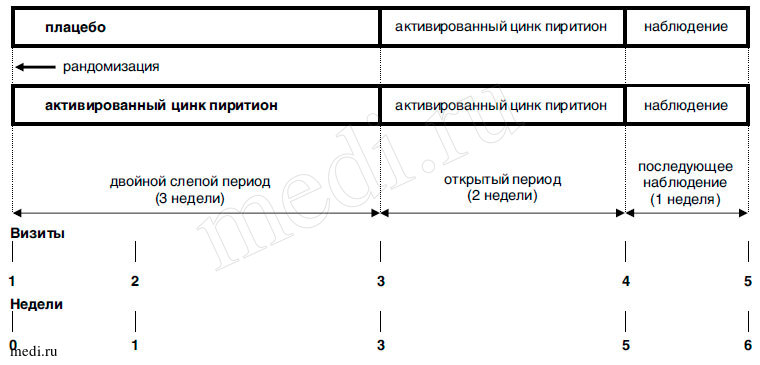
Пациенты рандомизировались в двойной слепой период исследования в группы плацебо и активной терапии в соотношении 1/2.
Второй период - открытое исследование в параллельных группах продолжительностью 2 недели; в течение открытого периода пациенты обеих групп получали активированный цинк пиритион 0,2 % (Скин-кап) аэрозоль 2 раза в день в течение 14±2 дня (далее по тексту открытый период).
- период последующего наблюдения продолжительностью 1 неделя, в течение которого пациенты получали терапию по усмотрению врача-исследователя.
Вводный период и период скрининга не были предусмотрены.
Во время визита 2 (через 1 неделю от начала двойного слепого периода) врач должен был оценить течение псориаза. При ухудшении течения заболевания и отсутствии положительной динамики с момента визита 1 врач должен был рекомендовать топический кортикостероид мометазон; при улучшении - поставить пациента в известность о возможности использования топического кортикостероида мометазона в случае возможного ухудшения состояния.
В исследование было рандомизировано 60 пациентов в возрасте от 18 до 60 лет с диагнозом легкого и среднетяжелого папулезно-бляшечного псориаза, значениями индекса PGA 2-3 балла и индекса PASI <10 баллов, площадью поражения <10% поверхности тела. До рандомизации, а также в течение двойного слепого периода пациенты не должны были применять топические кортикостероиды (за исключением мометазона между визитами 2 и 3), системные кортикостероиды, препараты дегтя, антралин, лечебные шампуни, включая шампуни от перхоти, препараты салициловой кислоты, иммуносупрессанты, ПУВА-терапию.
В исследование не включались больные с псориатическим артритом, псориазом ладоней, стоп, ногтей, пустулезным псориазом.
В качестве показателей эффективности оценивались:
- доля пациентов, у которых было достигнуто снижение индекса PGA на 2 и более балла к окончанию двойного слепого периода (основной показатель эффективности);
- значение индекса PGA;
- доля больных, у которых к окончанию двойного слепого периода было достигнуто снижение индекса PASI на 50% по сравнению с исходным;
- значение индекса PASI;
- площадь поражения;
- доля пациентов, которым потребовалось дополнительное назначение топических кортикостероидов после первой недели лечебного периода;
- среднее значение качества жизни по вопроснику DLQI (вопросник использовался с любезного разрешения проф. Finlay A. Y);
- удовлетворенность пациентов препаратом (по данным открытого периода исследования).
В настоящей статье представлены результаты оценки индексов тяжести течения псориаза PGA, PASI, площади поражения, потребности в применении топического кортикостероида, а также побочных явлений. Индекс PGA (глобальный индекс тяжести течения псориаза) является общим представлением врача о тяжести течения псориаза, состоит из шести категорий (от «чисто» до «тяжелая»), поэтому легко интерпретируется [5]. Клинически значимым изменением этого индекса, свидетельствующим о выраженном результате лечения, является его снижение на 2 балла. Индекс PASI (индекс площади и тяжести псориаза) несколько сложнее и учитывает не только тяжесть отдельных симптомов заболевания, но также площадь поражения [5]. Минимальным клинически значимым изменением этого показателя является его снижение на 50% и более.
Статистическая обработка проводилась при помощи пакета программ Statistica for Windows 6.0. (StatSoft, США). Для сравнения частот качественных признаков (в таблицах сопряженности 2 х 2) использовался критерий χ2 с поправкой по Йетсу или 2-сторонний точный критерий Фишера. Для таблиц сопряженности 2 х 2 рассчитывалось отношение шансов и 95%-ный доверительный интервал отношения шансов. Для сравнения количественных и полуколичественных признаков в несвязанных выборках использовался U-критерий Манна-Уитни, для сравнения попарно связанных - критерии Вилкоксона и ANOVA Фридмана. Качественные данные представлены в виде абсолютных или относительных (%) частот. При приведении клинической характеристики пациентов количественные данные представлены в виде среднего арифметического и среднеквадратичного отклонения, при сравнении средних - в виде среднего арифметического и 95%-го доверительного интервала. Разницу значений считали значимой при р <0,05.
Результаты
В исследование было включено 60 пациентов с легким и среднетяжелым папулезно-бляшечным псориазом: 40 в группу активированного ПЦ и 20 в группу плацебо. В начале исследования пациенты обеих групп имели схожую клиническую и половозрастную характеристику, без достоверных различий в каком-либо из изучавшихся показателей (табл. 1).
Таблица 1. Исходная клиническая характеристика изучавшихся групп
| Показатель | Активированный ПЦ (n=40) | Плацебо (n=20) | Р | |||
| Среднее | СКО | Среднее | СКО | |||
| Мужчины, % | 53% | 60% | 0,783 | |||
| Возраст, лет | 41,18 | 11,50 | 39,50 | 14,39 | 0,712 | |
| Индексы тяжести течения псориаза | PGA | 2,58 | 0,55 | 2,75 | 0,64 | 0,390 |
| PASI | 4,80 | 2,32 | 5,61 | 2,96 | 0,293 | |
| Площадь поражения, % от площади поверхности тела | 5,30 | 3,00 | 5,84 | 3,14 | 0,587 | |
| Стаж заболевания, лет | 11,58 | 12,12 | 13,43 | 10,64 | 0,248 | |
| Качество жизни по вопроснику DLQI | 9,93 | 6,62 | 11,20 | 5,39 | 0,410 | |
В сравнении с больными, получавшими плацебо, уже через одну неделю исследования пациенты группы активной терапии имели достоверно меньшие значения индексов, характеризующих тяжесть течения псориаза. К окончанию двойного слепого периода исследования данное различие стало еще более выраженным (табл. 2).
Таблица 2. Динамика индексов PGA и PASI в ходе исследования
| Визит | Индекс | Активированный ПЦ (n = 40) | Плацебо (n = 20) | Р | ||||
| Среднее | 95% ДИ | Среднее | 95% ДИ | |||||
| Нижняя граница |
Верхняя граница |
Нижняя граница |
Верхняя граница |
|||||
| Визит 2 | PGA | 2,00 | 1,84 | 2,16 | 2,50 | 2,18 | 2,82 | 0,003 |
| PASI | 3,32 | 2,71 | 3,93 | 4,77 | 3,51 | 6,02 | 0,046 | |
| Визит 3 | PGA | 1,20 | 1,03 | 1,37 | 1,90 | 1,50 | 2,30 | 0,001 |
| PASI | 2,01 | 1,56 | 2,46 | 3,27 | 2,18 | 4,36 | 0,041 | |
| Визит 4 | PGA | 0,85 | 0,61 | 1,09 | 1,05 | 0,69 | 1,41 | 0,282 |
| PASI | 1,18 | 0,71 | 1,66 | 1,49 | 0,95 | 2,02 | 0,133 | |
Доли пациентов, имевших снижение индекса PGA на 2 и более балла (основной показатель эффективности) во время двойного слепого периода, составили 55% и 25% в группах активированного ПЦ и плацебо соответственно (р = 0,032; ОШ = 3,67; 95% ДИ для ОШ 1,117-12,034). Кроме того, к окончанию этого этапа исследования среди больных, получавших активный препарат, было значительно больше имевших снижение индекса PGA до 0 или 1 балла (значения «Чисто» или «Почти чисто») и индекса PASI на 50% и более (рис. 2). Среднее снижение индекса PASI в ходе двойного слепого периода исследования составило 60% (95% ДИ 53,7-66,3) и 40% (95% ДИ 26,3-54,6) в группах активированного ПЦ и плацебо соответственно (р = 0,030). Рассматривая эти результаты, стоит учитывать, что 30% пациентов в группе плацебо во время двойного слепого периода использовали мометазон (против 5% в группе активной терапии; рис. 2).
Рис. 2. Индексы тяжести течения псориаза и потребность в топическом кортикостероиде в течение двойного слепого периода исследования.
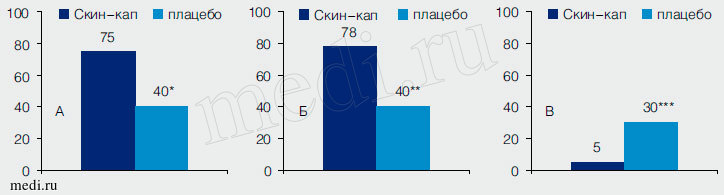
A. Доли пациентов, имевших снижение индекса PGA до 0 или 1 балла; * - р = 0,018.
Б. Доли пациентов, имевших снижение индекса PASI на 50% и более; ** - р = 0,010.
B. Доли пациентов, получавших мометазон; *** - р = 0,013.
В связи с существенными различиями в количестве пациентов, использовавших мометазон в ходе двойного слепого периода, оценка основного показателя эффективности также проводилась в группах больных, не применявших топический кортикостероид. Доли пациентов (не получавших мометазон), имевших снижение индекса PGA на 2 и более балла в течение двойного слепого периода, составили 58% и 14% в группах активированного ПЦ и плацебо соответственно (р = 0,011; ОШ = 8,25; 95% ДИ для ОШ 1,617-42,091). Таким образом, дополнительный анализ подтверждает значимость и достоверность основного.
Необходимо отметить, что достоверные изменения индекса PGA (в сравнении с исходным значением) были отмечены в группе активированного ПЦ уже через 1 неделю (на визите 2): 2,58 балла (95% ДИ 2,399-2,751) на визите 1 и 2,00 (95% ДИ 1,8382,162) на визите 2 (р<0,001). Подобных изменений индекса PGA в группе больных, получавших плацебо, зарегистрировано не было.
В течение открытого периода исследования, когда больные обеих групп использовали активированный ПЦ, индексы PGA и PASI продолжали снижаться, по завершении исследования достоверных различий этих показателей между группами установлено не было.
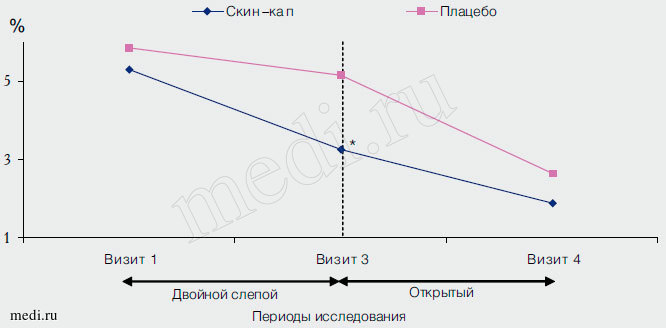
К окончанию двойного слепого периода 50% пациентов группы активированного ПЦ и 20% больных группы плацебо имели снижение площади поражения на 50% и более (р = 0,029; ОШ = 4,00; 95% ДИ для ОШ 1,136-14,085), а по завершении исследования - 78 и 60% соответственно (различие недостоверно). Средние значения площади поражения были существенно ниже среди получавших активированный ПЦ (рис. 3).
Рис. 3. Динамика площади поражения в ходе исследования. * - р<0,05 в сравнении с группой плацебо. Прерывистой линией показана граница двойного слепого и открытого периодов исследования.
В ходе исследования было зарегистрировано 5 нежелательных явлений (2 в группе активированного ПЦ и 3 в группе плацебо); ни одно из них не было расценено врачами-исследователями как серьезное.
Обсуждение
Данное исследование является первым, в котором с использованием валидизированных показателей было установлено, что активированный ПЦ существенно превосходит плацебо при применении у больных легким и среднетяжелым папулезно-бляшечным псориазом. В качестве основных показателей, по которым оценивалась эффективность терапии, были выбраны глобальный индекс тяжести течения псориаза (индекс PGA) и индекс площади и тяжести псориаза (индекс PASI). Эти показатели являются стандартными и широко используются при оценке результатов местной и системной терапии псориаза [5]. Применение индексов PGA и PASI позволило получить результаты, которые можно легко сопоставить с данными исследований, проведенных ранее и/или изучавших эффективность других препаратов.
Рис. 4. Изменения выраженности проявлений псориаза в зависимости от продолжительности терапии у одного из больных, получавших активированный пиритион цинка в рамках исследования.
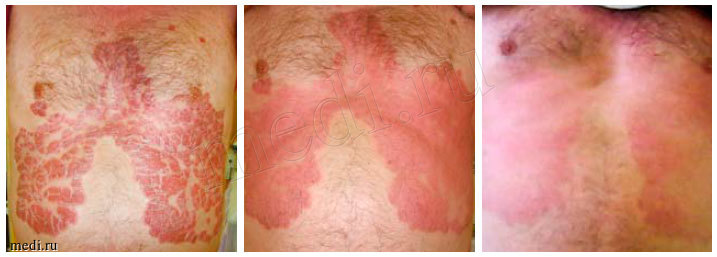
В целом эффективность активированного ПЦ, продемонстрированную в этой работе, можно охарактеризовать как очень высокую (рис. 4). Сравнение результатов исследования «Антрацит» с данными, опубликованными ранее, позволяет говорить о том, что эффективность этого препарата при папулезно-бляшечном псориазе, не требующем системной терапии, сопоставима с таковой топических кортикостероидов в сочетании с аналогами витамина D3. Так, было показано, что применение клобетазола в сочетании с кальципотриолом позволяет в течение 2-4 недель достичь улучшения течения заболевания до категорий «чисто» или «почти чисто» у 55% пациентов [6]. В исследовании «Антрацит» в группе получавших активный препарат таких больных было 75%. Сравнение динамики индекса PASI с данными других исследований также свидетельствует о сопоставимости клинических эффектов активированного ПЦ и комбинации топических кортикостероидов и аналогов витамина D3. Было установлено, что среднее снижение индекса PASI от исходного составляет 67% и 63% при использовании кальципотриола / бетаметазона (4 недели терапии) и кальципотриола/ клобетазола (2-4 недели терапии) соответственно [6, 7]; в проведенном исследовании в группе активированного ПЦ это значение составляет 60%.
Очень важным результатом является установленное снижение потребности в применении топического кортикостероида в группе активной терапии. Согласно требованиям программы исследования через одну неделю терапии (визит 2) врач должен был рекомендовать пациенту использование топического кортикостероида в случае ухудшения состояния или отсутствия положительной динамики, а также предупредить пациента о возможности применения топического кортикостероида в случае ухудшения состояния, при этом больным выдавалась соответствующая памятка. В группе активированного ПЦ на втором визите не было сделано ни одного назначения мометазона. Всего в течение двойного слепого периода среди получавших активную терапию только 5% пациентов (2 из 40) использовали топический кортикостероид. Таким образом, применение активированного ПЦ было успешным (без учета выраженности эффекта) у 95% больных, что, несомненно, является очень хорошим результатом.
Относительно высокие результаты терапии при использовании плацебо, по всей вероятности, связаны с тем, что в течение двойного слепого периода 30% больных в этой группе получали мометазон. Кроме того, необходимо отметить, что эффективность основы местных препаратов (плацебо) при папулезно-бляшечном псориазе достаточно высока. Например, было показано, что в схожей группе больных применение плацебо может сопровождаться снижением PASI на 30% (в исследовании «Антрацит» - 40%) [8].
Продемонстрированная высокая клиническая эффективность активированного ПЦ обусловлена уникальным разнонаправленным механизмом действия этого препарата. Известно, что в основе патогенеза псориаза лежит хроническое Т-клеточное воспаление [9]. Кроме того, важным патогенетическим звеном является также угнетение апоптоза кератиноцитов и иммунокомпетентных клеток [9]. Ранее было показано, что активированный ПЦ в течение первых суток применения при псориазе приводит к снижению количества нейтрофилов в дерме и эпидермисе, уменьшению лимфоцитарной инфильтрации [10]. Данные эффекты предшествовали активации апоптоза, поэтому способствовали выраженному и быстрому противовоспалительному эффекту ПЦ [10]. Это объясняет, почему статистически значимое снижение индекса PGA наблюдалось уже через одну неделю его использования. Помимо противовоспалительной активности ПЦ обладает выраженным проапоптогенным действием в отношении тимоцитов и лимфоцитов селезенки мыши, а также линий Т- и В-лимфоцитов человека как за счет увеличения экспрессии BimL, BimEL и BimS, антагонистов антиапоптотических факторов Bcl-2 и Bcl-xL, так и благодаря нарушению проницаемости мембран с их деполяризацией, высвобождением из митохондрий цитохрома С, сборке апоптосомы и активации каспазного каскада без промежуточной стимуляции экспрессии проапоптогенных факторов [4, 11]. Было показано, что ПЦ в концентрации 400 пМ активирует апоптоз тимоцитов мыши так же, как дексаметазон в концентрации в 2,5 раза выше (1 мкМ) [11]. Вместе с тем необходимо отметить, что при псориазе применение топических кортикостероидов не приводит к существенной активации апоптоза даже в течение 2 недель терапии [12]. По всей вероятности, стимуляция программируемой клеточной гибели не является значимым механизмом рассасывания псориатических бляшек при использовании этого класса лекарственных средств [12]. В отличие от топических кортикостероидов, применение ПЦ при неосложненном бляшечном псориазе сопровождается скачкообразным ростом активности апоптоза клеток нижних слоев эпидермиса через 48 часов от начала терапии и полной нормализацией гистологической картины к 14 дню лечения [10]. Таким образом, способность влиять на ключевые звенья патогенеза псориаза, вероятно, является основой продемонстрированной в исследовании «Антрацит» клинической эффективности этого лекарственного средства.
Активированный ПЦ обладает очень хорошим профилем безопасности, практически не всасывается с поверхности кожи, не имеет раздражающего и повреждающего действия даже при аппликации 20% составов (концентрация, в 100 раз превышающая содержание ПЦ в креме и аэрозоле Скин-кап) [13, 14]. Важно отметить, что активированный ПЦ оказывает существенно меньшее влияние на плотность эпидермальных клеток Лангерганса в сравнении с топическими кортикостероидами. Располагаясь внутри эпидермиса, клетки Лангерганса выполняют ключевую роль в инициации иммунного ответа; снижение их количества может оказать негативное влияние на состояние резистентности кожи [15]. Отличная переносимость препарата нашла подтверждение и в проведенном исследовании. Было зарегистрировано крайне незначительное количество нежелательных явлений, что еще раз подтверждает безопасность активированного ПЦ при местном применении.
Совокупность имеющихся в настоящее время и полученных в исследовании «Антрацит» данных о фармакодинамике активированного ПЦ, его клинической эффективности и безопасности позволяет рекомендовать это средство как одно из наиболее эффективных для местной терапии легкого и среднетяжелого папулезно-бляшечного псориаза. Применение активированного ПЦ характеризуется быстрым и выраженным положительным результатом лечения, снижением потребности в использовании топических кортикостероидов, а также высокой безопасностью и переносимостью.
ЛИТЕРАТУРА
- Rapp S.R., Feldman S.R., Exum L. et al. Psoriasis causes as much disability as other major medical diseases. J Am Acad Dermatol. 1999. Vol. 41. P. 401-407.
- Langley R.G.B, Krueger G.G., Griffiths C.E.M. Psoriasis: epidemiology, clinical features, and quality of life. Ann Rheum Dis. 2005. Vol. 64. P. 18-23.
- Nast A., Kopp I., Augustin M. et al. German evidence-based guidelines for the treatment of Psoriasis vulgaris (short version). Arch Dermatol Res. 2007. Vol. 299. P. 111-138.
- Скрипкин Ю.К., Петровский Ф.И., Феденко Е.С. и др. Активированный пиритион цинка («Скин-кап»). Механизмы действия. Клиническое применение. Российский аллергологаческий журнал. 2007. № 3. с. 70 - 75.
- Feldman S.R. Krueger G.G. Psoriasis assessment tools in clinical trials. Ann Rheum Dis. 2005. Vol. 64. P. 65-68.
- Lahfa M, Mrowietz U, KoenigM. et al. Calcitriol ointment and clobetasol propionate cream: a new regimen for the treatment of plaque psoriasis. Eur J Dermatol. 2003. Vol. 13(3). P. 261-265.
- van de Kerkhof P.C., Wasel N, Kragballe K. et al. A two-compound product containing calcipotriol and betamethasone dipropionate provides rapid, effective treatment of psoriasis vulgaris regardless of baseline disease severity. Dermatology. 2005. Vol. 210(4). P. 294-299.
- Anstey A. V., Kragballe K. Retrospective assessment of PASI 50 and PASI 75 attainment with a calcipotriol/betamethasone dipropionate ointment. Int J Dermatol. 2006. Vol. 45(8). P. 970-975.
- Krueger J.G., Bowcock A. Psoriasis pathophysiology: current concepts of pathogenesis. Ann Rheum Dis. 2005. Vol. 64. P. 30-36.
- Rowlands C.G., Danby F.W. Histopathology of psoriasis treated with zinc pyrithione. Am. J. Dermatopathol. 2000. Vol. 22(3). P. 272-276.
- Mann J.J., Fraker P.J. Zinc pyrithione induces apoptosis and increases expression of Bim. Apoptosis. 2005. Vol. 10(2). P. 369-379.
- Castelijns F.A., Gerritsen M.J., van Vlijmen-Willems I.M. et al. The epidermal phenotype during initiation of the psoriatic lesion in the symptomless margin of relapsing psoriasis. J Am Acad Dermatol. 1999. Vol. 40(6 Pt 1). P. 901-909.
- Guthery E., Seal L.A., Anderson E.L. Zinc pyrithione in alcohol-based products for skin antisepsis: persistence of antimicrobial effects. Am. J. Infect. Control. 2005. Vol. 33(1). P. 15-22.
- Lansdown A.B. Physiological and toxicological changes in the skin resulting from the action and interaction of metal ions. Crit. Rev. Toxicol. 1995. Vol. 25(5). P. 397-462.
- Латий О.В., Белоусова И.Э., Самцов А.В. Иммуногистологические особенности применения препарата Скин-кап в сравнении с наружными стероидами у больных атопическим дерматитом. Вестник дерматологии и венерологии. 2005. № 1. C. 46-50.
