Роль ацетил-L-карнитина в лечении симптомов депрессии: систематический обзор и метаанализ (реферат)
СтатьиОпубликовано в журнале:
« РМЖ » № 11 2018
М.Л. Бабаян, к. м. н., ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, ОСП НИКИ педиатрии им. академика Ю.Е. Вельтищева, г. Москва
РЕЗЮМЕ
Цель исследования: дефицит ацетил-L-Kapнитина (АЛК), по-видимому, играет определенную роль в риске развития депрессии, одной из причин которой может быть нарушение регуляции переноса жирных кислот через внутреннюю мембрану митохондрий. Однако данные о приеме АЛК у людей весьма ограниченны. Мы провели систематический обзор и метаанализ, исследуя влияние АЛК на депрессивные симптомы в рандомизированных клинических исследованиях (РКИ).
Материал и методы: проведен поиск литературы в основных базах данных (без ограничений по языку) с момента их создания вплоть до 30 декабря 2016 г. Для анализа были взяты те РКИ, в которых в исследуемой группе назначали только АЛК или АЛК в сочетании с антидепрессантами, а в контрольной группе - плацебо/без терапии или антидепрессанты.
Результаты исследования: 12 РКИ (в 11 из которых применена монотерапия АЛК) в общей сложности включили 791 участника (из них 65% женщин, средний возраст участников - 54 года). Данные, полученные из 9 РКИ (231 пациент, принимавшие АЛК, против 216 пациентов, получавших плацебо, и 20 - без терапии), показали, что при приеме АЛК значительно уменьшились симптомы депрессии (стандартизованная разность средних (СРС) = -1,10; 95% доверительный интервал (ДИ) от -1,65 до -0,56). В 3-х РКИ, сравнивающих АЛК и антидепрессанты (по 162 пациента в каждой группе), АЛК продемонстрировал аналогичную эффективность в снижении симптомов депрессии в сравнении с антидепрессантами (СРС=0,06; 95% ДИ = -0,22-0,34), при этом частота побочных эффектов была значительно ниже в группе АЛК. Анализ показал, что прием АЛК наиболее эффективен у пожилых людей.
Выводы: препараты АЛК значительно снижают депрессивные симптомы по сравнению с плацебо/отсутствием терапии, оказывая сопоставимый эффект с таковым у антидепрессантов, но с меньшим количеством побочных эффектов. Необходимо проведение дальнейших масштабных исследований для того, чтобы подтвердить или опровергнуть эти данные.
Ключевые слова: ацетил-L-карнитин, депрессия, метаанализ, антидепрессанты.
Для цитирования: Роль ацетил-L-карнитина в лечении симптомов депрессии: систематический обзор и метаанализ (реферат) //РМЖ. 2018. № 00. С. 1-6.
ABSTRACT
Acetyl-L-Carnitine Supplementation and the Treatment of Depressive Symptoms: A Systematic Review and Meta-Analysis (summary)
Aim: Deficiency of acetyl-L-carnitine (ALC) seems to play a role in the risk of developing depression, indicating a dysregulation of fatty acid transport across the inner membrane of mitochondria. However, data about ALC supplementation in humans are limited. We thus conducted a systematic review and meta-analysis investigating the effect of ALC on depressive symptoms across randomized controlled trials (RCTs).
Patients and Methods: a literature search in major databases, without language restriction, was undertaken from inception until 30 December 2016. Eligible studies were RCTs of ALC alone or in combination with antidepressant medications, with a control group taking placebo/no intervention or antidepressants.
Results: twelve RCTs (11 of which were ALC monotherapy) with a total of 791 participants (mean age 54 years,% female 65%) were included. Pooled data across nine RCTs (231 treated with ALC versus 216 treated with placebo and 20 no intervention) showed that ALC significantly reduced depressive symptoms (SMD = -1.10, 95% CI -1.65 to -0.56). In three RCTs comparing ALC versus antidepressants (162 for each group), ALC demonstrated similar effectiveness compared with established antidepressants in reducing depressive symptoms (SMD = 0.06,95% CI -0.22 to 0.34). In these latter RCTs, the incidence of adverse effects was significantly lower in the ALC group than in the antidepressant group. Subgroup analyses suggested that ALC was most efficacious in older adults.
Conclusions: ALC supplementation significantly decreases depressive symptoms compared with placebo/no intervention, while offering a comparable effect with that of established antidepressant agents with fewer adverse effects. Future large scale trials are required to confirm/refute these findings.
Key words: acetyl-L-carnitine, depression, meta-analysis, antidepressants.
For citation: Acetyl-L-Carnitine Supplementation and the Treatment of Depressive Symptoms: A Systematic Review and Meta-Analysis (summary) //RMJ. 2018. № 00. P. 1-6.
Введение
По результатам проведенного в 2010 г. глобального изучения распространенности различных болезней в мире установлено, что депрессия является одной из ведущих причин нетрудоспособности и затрагивает более 350 млн людей во всем мире [1]. Депрессия часто сопряжена со значительным снижением качества жизни, сопутствующими соматическими заболеваниями [2, 3] и с повышенной смертностью [4]. Поэтому профилактика и лечение депрессий являются приоритетными направлениями здравоохранения [5]. Депрессии подвержены представители любого пола и возраста, часто ей сопутствуют мигрень [6], фибромиалгия [7] и сахарный диабет [2]. Установлено несколько факторов, повышающих риск возникновения депрессии. В некоторых исследованиях показано, что изменения метаболизма жирных кислот и липидного обмена возникают у лиц с депрессией [8]. Предполагается, что карнитин может модулировать активность некоторых нейротрофических факторов, клеточных мембран, нейротрансмиттеров в нервных тканях, воздействовать на липидный обмен, поэтому все большее число исследований проводится с целью установления роли L-карнитина в лечении депрессии [9].
На клеточном уровне L-карнитин действует как переносчик жирных кислот через внутреннюю мембрану митохондрий, где происходит ß-окисление[10].
Особый интерес представляет ацетил-L-карнитин (АЛК). Он легче проходит гематоэнцефалический барьер, чем свободный L-карнитин, и, следовательно, его антидепрессивный эффект может быть более выраженным, чем у неацетилированного L-карнитина [11]. АЛК играет важную роль в метаболических процессах: ускоряет утилизацию ацетил-КoA в митохондриях во время окисления жирных кислот, усиливает продукцию ацетилхолина, стимулирует синтез протеинов и мембранных фосфолипидов, предотвращает избыточную гибель нейронов [12]. По данным магнитнорезонансной томографии, прием АЛК может быть эффективным при лечении старческой депрессии [13]. Этот эффект, по-видимому, связан с нормализацией уровня фосфомоноэфиров в префронтальной области мозга [13]. В недавнем систематическом обзоре [14] отмечено, что АЛК может быть эффективным средством при депрессиях, особенно в случаях повышенного риска развития побочных эффектов при приеме антидепрессантов. К такой категории лиц относятся люди старшего возраста. Представленный обзор позволяет расширить понимание роли АЛК.
Проведенный метаанализ, основанный на индивидуальных рандомизированных клинических исследованиях (РКИ), дает более точное представление об эффективности АЛК в лечении депрессии, чем результаты отдельных исследований.
Цель нашего исследования: проведение анализа имеющихся в настоящее время данных об использовании АЛК в качестве антидепрессанта в сравнении с плацебо (или без терапии) либо в сравнении со стандартными антидепрессантами.
Материал и методы исследования
Два исследователя независимо друг от друга проводили поиск литературы по следующим базам данных: PubMed, EMBASE, SCOPUS, Кокрановскому центральному регистру контролируемых исследований и Clinicaltrials.gov без ограничений по языку оригинальной статьи, начиная от момента создания базы данных и до 30 декабря 2016 г. Анализировались РКИ по изучению эффективности АЛК при депрессии, симптомы которой оценивались при помощи утвержденных шкал [15,16].
Критерии включения исследований в метаанализ:- тип исследования - РКИ;
- прием АЛК (независимо от пути введения) отдельно или как дополнительная терапия при лечении антидепрессантами;
- данные о симптомах депрессии, оцениваемых с помощью утвержденных шкал (например, шкала оценки депрессии Гамильтона [17]).
Не включались в метаанализ исследования, проводившиеся не на людях или без участия контрольной группы, без использования утвержденных шкал для оценки депрессии, без оценки депрессии, а также с использованием помимо АЛК других препаратов.
Сбор данных
Два независимых исследователя собирали ключевые данные из исследований, удовлетворяющих критериям включения, и вносили их в стандартизированную таблицу Excel. Анализировалась следующая информация: сведения об авторах, год публикации, страна, суточная доза АЛК, ключевые точки исследования, продолжительность наблюдения (в неделях), средний возраст и доля женщин в основной и контрольной группах. Учтены данные о нежелательных явлениях (НЯ), отмеченных в ходе исследований.
Оценка результатов исследований
Анализировались изменения симптомов депрессии относительно исходного уровня у лиц, получавших АЛК, в сравнении с таковыми у тех, кто получал плацебо/не получал терапии или принимал антидепрессанты. Если в исследовании использовались несколько тестов для оценки депрессии, то в метаанализ включались данные Шкалы оценки депрессии Гамильтона [17], поскольку эта шкала наиболее часто использовалась во включенных в метаанализ исследованиях.
Два автора оценивали качество исследований с использованием шкалы Джадада для оценки качества и риска ошибок в анализе данных РКИ [18].
Статистический анализ
Статистический анализ выполнен при помощи программы «Комплексный метаанализ 3».
Анализировалась стандартизованная разность средних (СРС) значений в основных группах наблюдения и группах контроля, с 95% доверительным интервалом (ДИ), используя модель со случайными эффектами [19].
Частота НЯ сравнивалась между группами, получавшими АЛК, и группами контроля, с использованием отношения вероятностей, рассчитанного как количество НЯ, отмеченное в наблюдении, деленное на количество пациентов каждой группы.
Степень гетерогенности выборки оценивалась с помощью критерия I2. Для всех расчетов статистически значимым считалось значение p<0,05.
Результаты исследования
Из найденных 509 статей в метаанализ включены I2 удовлетворявших всем критериям отбора [20-31]. В исследованиях приняли участие 393 пациента, получавших АЛК, и 398 пациентов в группах контроля.
В одном из 12 РКИ [24] АЛК был назначен в качестве дополнительного препарата к традиционному антидепрессанту в основной группе (n=20), а пациенты контрольной группы получали только антидепрессант (n=20). В остальных 11 исследованиях пациенты основной группы получали монотерапию АЛК (n=373), а пациенты контрольной группы не получали терапии/получали плацебо (n=216) или принимали антидепрессант (n=162). Первичный диагноз большой депрессии был установлен в 3-х РКИ [23-25] (АЛК, n=48; контроль, n=48), и одно РКИ [30] включало лиц с симптомами депрессии (АЛК, n=12; контроль, n=12). Все исследования проводились на территории Европы.
РКИ, в которых группа контроля не получала терапии или принимала плацебо
По результатам 9 РКИ [20, 22-26, 28-30] были выделены основная группа, куда вошел 231 пациент, принимающие АЛК, средний возраст которых составил 55,8±8,4 года (из них 59,7% женщин), и контрольная группа из 236 пациентов в возрасте 56,3±8,3 года (62,1% женщин). Большинству пациентов был установлен диагноз «большое депрессивное расстройство/депрессия» и назначена терапия АЛК в дозировке 3 г/сут. Период наблюдения в среднем составил 8 нед. (3-24 нед.).
Как показано в таблице 1, у пациентов, принимавших АЛК, выраженность симптомов депрессии значительно снизилась в сравнении с группой контроля (СРС = -1,10; 95% ДИ = -1,65,-0,56; p<0,001; I2 = 86%).
Регрессионный метаанализ и анализ чувствительности
Поскольку среди РКИ, сравнивающих эффективность АЛК и плацебо/без терапии, была выявлена существенная гетерогенность (I2=86%), были исследованы потенциальные причины этого явления. Исследование, включающее участников с эпизодической мигренью [26], показало самый высокий СРС (-1,89; 95% ДИ=-2,59 -1,1,18), а у включенных в РКИ пациентов, страдающих минимальной печеночной энцефалопатией [28], был зафиксирован самый незначительный результат.
Анализ данных показал, что наиболее выраженный эффект от терапии АЛК был достигнут у пациентов в старшей возрастной группе (6 РКИ [20-23, 25, 30]; СРС= -1,52; 95% ДИ = -2,09-0,96; p<0,001; I2=73%) в сравнении с более молодыми пациентами (3 РКИ [26, 28, 29]; СРС = -0,35; 95% ДИ = -0,75-0,05; p=0,093; I2=56%). При сравнении группы монотерапии АЛК с группой контроля (без терапии или принимающие плацебо) СРС составила -1,10 (95% ДИ = -1,70,-0,49; p<0,001; I2=87%).
Терапия более высокими дозами АЛК была связана с лучшими результатами в тестах, оценивающих симптомы депрессии (ß = -0,54; 95% ДИ = 0,99, -0,11; p=0,01; I2=0,54), тогда как ни продолжительность наблюдения (ß = 0,03; 95% ДИ = -0,42, 0,47; p=0,914), ни базовый уровень выраженности депрессивных симптомов (ß = 0,03; 95% ДИ = -0,05, 0,11; p=0,413) не влияли на эти результаты.
РКИ, в которых группа контроля принимала антидепрессанты
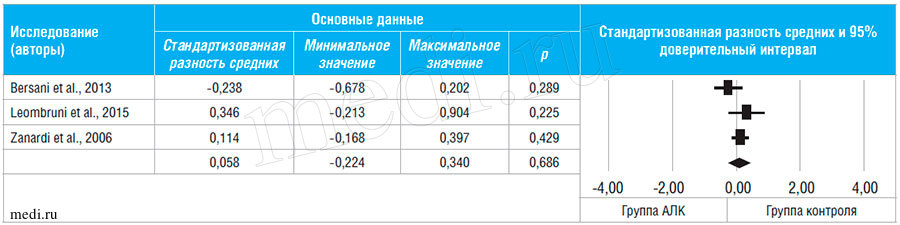
В 3-х РКИ [21, 27, 31] приняли участие 162 пациента в основной группе терапии АЛК (средний возраст 58,6±10,7 года, 73,9% женщин) и 162 пациента в группе контроля, получавших антидепрессанты (флуоксетин - 39 пациентов [21], дулоксетин - 29 [27], амисульприд - 94 пациента [31]).
Два РКИ включали пациентов с дистимией, а 1 РКИ - с фибромиалгией. Средняя продолжительность наблюдения составила 12 (7-12) нед. Анализ суммарных данных 3-х РКИ продемонстрировал, что эффективность терапии АЛК сопоставима с эффективностью терапии традиционными антидепрессантами, назначаемыми для купирования симптомов депрессии (СРС=0,06; 95% ДИ = -0,22, 0,34; p=0,686; I2=31%; табл. 2).Нежелательные явления
В тех исследованиях, где группа контроля не принимала препаратов или принимала плацебо, частота возникновения НЯ в основной (принимающей АЛК) и контрольной группах была схожей (отношение шансов (ОШ) = 0,86, 95% ДИ = 0,46,1,63; p=0,648) в 3-х РКИ [26, 28, 29].
Таблица 1. Эффективность АЛК в сравнении с эффективностью в группе контроля, не получающей терапии/принимающей плацебо
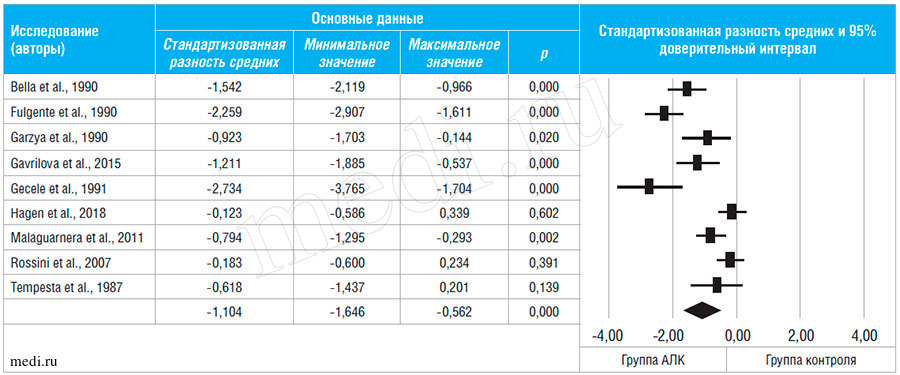
Таблица 2. Эффективность терапии в группе АЛК и в группе контроля, принимающей антидепрессанты
И напротив, использование АЛК было связано со значительно меньшим риском побочных эффектов (ОШ=0,21; 95% ДИ = 0,12, 0,36; p<0,001) по сравнению с использованием антидепрессантов в 3-х РКИ [21, 27, 31], особенно в отношении НЯ со стороны желудочно-кишечного тракта и нервной системы.
Обсуждение
Проведенный метаанализ является первым исследованием, обобщающим РКИ, в которых подтверждена эффективность АЛК у пациентов с симптомами депрессии. Полученные сравнительные данные свидетельствуют о том, что прием АЛК в качестве монотерапии позволяет существенно снизить симптомы депрессии. Более того, АЛК оказывает действие, сопоставимое с таковым при применении антидепрессантов. Важно отметить, что частота НЯ при приеме АЛК схожа с частотой в группе, получающей плацебо, и значительно ниже (на 79%), чем в группе терапии антидепрессантами.
Существует несколько механизмов, посредством которых АЛК оказывает антидепрессивное действие. Во-первых, благодаря нейропластическим свойствам, которые АЛК оказывает на некоторые области мозга, задействованные в развитии депрессии, в частности на гиппокамп [14]. Также АЛК может способствовать повышению количества нейротрофического фактора мозга и связыванию глутамата [32]. Более того, АЛК может приводить к увеличению экспрессии рецепторов mGLU2 в головном мозге, особенно в области гиппокампа и префронтальной зоне коры головного мозга [14]. Во-вторых, нарушение метаболизма мембранных молекул и липидов играет важную роль в патофизиологическом механизме депрессий [14]. Дефицит миоинозитола, по-видимому, имеет важное значение для развития депрессии [33]. На моделях животных АЛК приводила к увеличению миоинозитола, и это могло дополнительно способствовать ее антидепрессивному действию [34]. В-третьих, АЛК, видимо, участвует в модуляции нейротрансмиттеров, задействованных при депрессии. Назначение АЛК может способствовать увеличению уровня серотонина в коре головного мозга [35]. Другие данные свидетельствуют о том, что долгосрочный прием АЛК увеличивает выход дофамина и серотонина в мезокортиколимбических областях и, возможно, защищает от острого стрессового воздействия [36].
Кроме того, как явствует из двух метаанализов [37, 38], прием АЛК способствовал уменьшению боли, которая часто встречается при депрессии [39]. Как известно, боль - один из главных факторов риска развития депрессии [40], хотя его часто недооценивают [41]. Боль, особенно хроническая, ощущается не только физически, но и эмоционально [42]. Для пациента это комплексное ощущение, влияющее на настроение, поведение и качество жизни, увеличивающее риск развития депрессии на фоне других факторов, таких как социальная изоляция, неподвижность и зависимость от лекарств. Поэтому неудивительно, что боль может формировать депрессию [43]. Следует отметить, что лечение боли благотворно сказывается на симптомах депрессивного состояния. Таким образом, можно предположить, что АЛК уменьшает симптомы депрессии, в т. ч. за счет сопутствующего снижения болевого синдрома. Прием АЛК при выявлении боли и депрессии имеет особое значение у пациентов с мигренью [6] и фибромиалгией [7], где эти два состояния взаимосвязаны. В случае фибромиалгии амитриптилин продемонстрировал аналогичную эффективность при лечении боли и депрессивных симптомов [44].
В нашем метаанализе показано, что назначение АЛК ведет с существенному и клинически значимому уменьшению симптомов депрессии в сравнении с группой контроля (без терапии или получающей плацебо), в соответствии с общими принципами, используемыми для интерпретации СРС (<0,2 - небольшой эффект, 0,5 - средний и 0,8 - значительный) [45], а СРС=0,5 считается эффективной при депрессии [46]. В анализе чувствительности и метарегрессионном анализе установлено, что АЛК более эффективен у пожилых пациентов, нежели у молодых. В группе пациентов старшего возраста АЛК значимо улучшал симптоматику депрессии в отличие от группы плацебо, а в группе более молодых пациентов достоверных отличий не найдено. Однако точный механизм этого явления установить не удалось, и необходимы дальнейшие исследования в этом направлении. Метаанализ показал, что при назначении более высоких доз АЛК происходило более выраженное улучшение состояния пациентов, страдающих депрессией. Также необходимо отметить, что согласно предварительному метаанализу на основании 3-х РКИ (в т. ч. исследования, в котором 162 пациента получали АЛК и 162 - антидепрассанты) АЛК оказывает сопоставимое с антидепрессантами действие на клиническую картину депрессии, однако сопровождается гораздо меньшим риском развития побочных эффектов. Это наблюдение представляет большой интерес, поскольку может указать на альтернативу использованию антидепрессантов для лечения таких пациентов, однако необходимы дальнейшие исследования для подтверждения или опровержения данного вывода.
Недавний метаанализ [47], включающий 34 исследования и 4769 пациентов с постоянным депрессивным расстройством, позволил установить, что при дополнительном приеме АЛК отмечается более низкая частота возникновения любых НЯ при приеме антидепрессантов, что улучшает приверженность лекарственной терапии. По данным большого наблюдательного исследования, включившего 60 706 пациентов 65 лет и старше, установлено, что до 89% пожилых людей в течение своей жизни использовали антидепрессанты, но применение этих лекарств, к сожалению, связано с некоторыми негативными последствиями, такими как падения, сердечно-сосудистые заболевания и смертность [48]. Поэтому необходимо искать альтернативные препараты для лечения депрессии у пожилых пациентов, и АЛК представляется одним из наиболее перспективных препаратов.
Результаты нашего исследования должны интерпретироваться с учетом некоторых его ограничений. Во-первых, несколько РКИ, включенных в этот метаанализ, вызывают некоторые вопросы из-за отсутствия информации о «заслеплении», распределении или выбывании при последующем наблюдении. Поэтому необходимо провести дополнительные РКИ для того, чтобы подтвердить или опровергнуть наши выводы. Во-вторых, нельзя исключать и так называемую систематическую ошибку, связанную с предпочтительной публикацией положительных результатов исследования. (Однако, по всей видимости, эта ошибка не сильно повлияла на результаты исследования.) В-третьих, размер групп, попавших в этот метаанализ, слишком мал, а период наблюдения - короток. В-четвертых, среди пациентов наблюдалась значительная геторогенность (поправку на которую по возможности мы делали. В частности, были объединены данные РКИ с оценкой использования АЛК при различных диагнозах (дистимия, депрессия, фибромиалгия и др.). Мы смогли увидеть эффективность АЛК в РКИ, включавших контрольные группы с использованием плацебо/без терапии.
Заключение
Прием АЛК способствовал более выраженному снижению симптомов депрессии в сравнении с приемом плацебо плацебо/без терапии. АЛК обладает сопоставимой с антидепрессантами эффективностью и гораздо меньшим риском развития НЯ. Будущие РКИ с большим размером выборки и включением здоровых участников могут стать важными для понимания роли АЛК в предотвращении развития депрессии.
Реферат подготовлен по материалам статьи N. Veronese, B. Stubbs, M. Solmi et al. Acetyl-L-Carnitine Supplementation and the Treatment of Depressive Symptoms: A Systematic Review and Meta-Analysis // Psychosomatic Medicine. 2018. Vol. 80. P. 154-159.
- Ferrari A. J., Charlson F. J., Norman R. E. et al. Burden of depressive disorders by country, sex, age, and year: findings from the global burden of disease study. 2010. PLoS Med. 2013. Vol. 10. P.e1001547.
- Vancampfort D., Correll C. U., Galling B. et al. Diabetes mellitus in people with schizophrenia, bipolar disorder and major depressive disorder: a systematic review and large scale meta-analysis. World Psychiatry. 2016. Vol. 15. P.166-174.
- Vancampfort D., Mitchell A. J., De Hert M. et al. Type 2 diabetes in patients with major depressive disorder: a meta-analysis of prevalence estimates and predictors. Depress Anxiety. 2015. Vol. 32. P.763-773.
- Cole M. G., Dendukuri N. Risk factors for depression among elderly community subjects: a systematic review and meta-analysis. Am J Psychiatry. 2003. Vol. 160. Р.1147-1156.
- Chisholm D., Sweeny K., Sheehan P. et al. Scaling-up treatment of depression and anxiety: a global return on investment analysis. Lancet Psychiatry. 2016. Vol. 3. Р.415-424.
- Bruti G., Magnotti M. C., Iannetti G. Migraine and depression: bidirectional comorbidities? Neurol Sci. 2012. Vol. 33 (suppl 1). P.S107-109.
- Bernik M., Sampaio T. P., Gandarela L. Fibromyalgia comorbid with anxiety disorders and depression: combined medical and psychological treatment. Curr Pain Headache Rep. 2013. Vol. 17. Р.358.
- Peet M., Murphy B., Shay J., Horrobin D. Depletion of omega-3 fatty acid levels in red blood cell membranes of depressive patients. Biol Psychiatry 1998. Vol. 43. Р.315-319.
- Jones L. L., McDonald D.A., Borum P. R. Acylcarnitines: role in brain. Prog Lipid Res. 2010. Vol. 49. Р.61-75.
- Steiber A., Kerner J., Hoppel C. L. Carnitine: a nutritional, biosynthetic, and functional perspective. Mol Aspects Med. 2004. Vol. 25. Р.455-473.
- Pettegrew J. W., Levine J., McClure R. J. Acetyl-L-carnitine physical-chemical, metabolic, and therapeutic properties: relevance for its mode of action in Alzheimer's disease and geriatric depression. Mol Psychiatry 2000. Vol. 5. Р.616-632.
- Di Cesare Mannelli L., Ghelardini C., Toscano A. et al. Theneuropathy-protective agent acetyl-L-carnitine activates protein kinase C-gamma and MAPKs in a rat model of neuropathic pain. Neuroscience. 2010. Vol. 165. Р.1345-1352.
- Pettegrew J. W., Levine J., Gershon S. et al. 31P-MRS study of acetyl-L-carnitine treatment in geriatric depression: preliminary results. Bipolar Disord. 2002. Vol. 4. Р.61-66.
- Wang S. M., Han C., Lee S. J. et al. A review of currentevidence for acetyl-L-carnitine in the treatment of depression. J Psychiatr Res. 2014. Vol. 53. Р.30-37.
- Liberati A., Altman D. G., TetzlaffJ. et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009. Vol. 6. P.e1-34.
- Stroup D. F., Berlin J. A., Morton S. C. et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) Group. JAMA. 2000. Vol. 283. Р.2008-2012.
- Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry. 1960. Vol. 23. Р.56-62.
- Jadad A. R., Moore R. A., Carroll D. et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996. Vol. 17. Р.1-12
- Higgins J. P.T., Green S. Cochrane handbook for systematic reviews of interventions. The Cochrane Collaboration 2008. Available at: https://dhosth.files.wordpress. com/2011/12/cochrane-handbook-for-systematic-reviews-of-interventions.pdf. Accessed April 20, 2016.
- Bella R., Biondi R., Raffaele R., Pennisi G. Effect of acetyl-L-carnitine on geriatric patients suffering from dysthymic disorders. Int J Clin Pharmacol Res. 1990. Vol. 10. Р.355-360.
- Bersani G., Meco G., Denaro A. et al. L-Acetylcarnitine in dysthymic disorder in elderly patients: a double-blind, multicenter, controlled randomized study vs. fluoxetine. Eur Neuropsychopharmacol. 2013. Vol. 23. Р.1219-1225.
- Fulgente T., Onofrj M., Del Re M. L. et al. Laevo-acetylcarnitine (Nicetile®) treatment of senile depression. Clin Trials J. 1990. Vol. 27. Р.155-163.
- Garzya G., Corallo D., Fiore A. et al. Evaluation of the effects of L-acetylcarnitine on senile patients suffering from depression. Drugs Exp Clin Res. 1990. Vol. 16. Р.101-106.
- Gavrilova S. I., Kalyn Y. B., Safarova T. P. et al. Optimization of the efficacy and safety of antidepressant therapy in patients of a geriatric psychiatric unit. Zh Nevrol Psikhiatr Im S.. Korsakova. 2015. Vol. 115. Р.24-32.
- Gecele M., Francesetti G., Meluzzi A. Acetyl-L-carnitine in aged subjects with major. depression: clinical efficacy and effects on the circadian rhythm of cortisol. Dementia. 1991. Vol. 2. Р.333-337.
- Hagen K., Brenner E., Linde M. et al. Acetyl-L-carnitine versus placebo for migraine prophylaxis: a randomized, triple-blind, crossover study. Cephalalgia. 2015. Vol. 35. Р.987-995.
- Leombruni P., Miniotti M., Colonna F. et al. A randomised controlled trial comparing duloxetine and acetyl L-carnitine in fibromyalgic patients: preliminary data. Clin Exp Rheumatol. 2015. Vol. 33. P.S82-85.
- Malaguarnera M., Bella R., Vacante M. et al. Acetyl-L-carnitine reduces depression and improves quality of life in patients with minimal hepatic encephalopathy. Scand J Gastroenterol. 2011. Vol. 46. Р.750-759.
- Rossini M., Di Munno O., Valentini G. et al. Double-blind, multicenter trial comparing acetyl L-carnitine with placebo in the treatment of fibromyalgia patients. Clin Exp Rheumatol. 2007. Vol. 25. Р.182-188.
- Tempesta E., Casella L., Pirrongelli C. et al. L-Acetylcarnitine in depressed elderly subjects. A cross-over study vs placebo. Drugs Exp Clin Res. 1987. Vol. 13. Р.417-423.
- Zanardi R., Smeraldi E. A double-blind, randomised, controlled clinical trial of acetyl-L-carnitine vs. amisulpride in the treatment of dysthymia. Eur Neuropsychopharmacol. 2006. Vol. 16. Р.281-287.
- Zanelli S. A., Solenski N. J ., Rosenthal R. E., Fiskum G. Mechanisms of ischemic neuroprotection by acetyl-L-carnitine // Ann N YAcad Sci. 2005. Vol. 1053. P. 153-161.
- Chiappelli J., Rowland L. M., Wijtenburg S. A. et al. Evaluation of myo-inositol as a potential biomarker for depression in schizophrenia. Neuropsychopharmacology. 2015. Vol. 40. Р.2157-2164.
- Nakamura J., Koh N., Sakakibara F. et al. Polyol pathway hyperactivity is closely related to carnitine deficiency in the pathogenesis of diabetic neuropathy of streptozotocin-diabetic rats. J Pharmacol Exp Ther. 1998. Vol. 287. Р.897-902.
- Smeland O. B., Meisingset T. W., Borges K., Sonnewald U. Chronic acetyl-L-carnitine alters brain energy metabolism and increases noradrenaline and serotonin content in healthy mice. Neurochem Int. 2012. Vol. 61. Р.100-107.
- Tolu P., Masi F., Leggio B. et al. Effects of long-term acetyl-L-carnitine administration in rats: I. Increased dopamine output in mesocorticolimbic areas and protection toward acute stress exposure. Neuropsychopharmacology. 2002. Vol. 27. Р.410-420.
- Li S., Li Q., Li Y. et al. Acetyl-L-carnitine in the treatment of peripheral neuropathic pain: a systematic review and meta-analysis of randomized controlled trials. PLoS One. 2015. Vol. 10. P.e0119479.
- Veronese N., Sergi G., Stubbs B. et al. Effect of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy: a systematic review and meta-analysis. Eur Geriatr Med. 2017. Vol. 8. Р.117-122.
- Stubbs B., Koyanagi A., Thompson T. et al. The epidemiology of back pain and its relationship with depression, psychosis, anxiety, sleep disturbances, and stress sensitivity: data from 43 low- and middle-income countries. Gen Hosp Psychiatry. 2016. Vol. 43. Р.63-70.
- Stubbs B., Vancampfort D., Veronese N. et al. Depression and pain: primary data and meta-analysis among 237 952 people across 47 low- and middleincome countries. Psychol Med. 2017. Р.1-12.
- Thompson T., Correll C. U., Gallop K. et al. Is pain perception altered in people with depression? A systematic review and meta-analysis of experimental pain research. J Pain. 2016. Vol. 17. Р.1257-1272.
- Bair M. J., Robinson R. L., Katon W., Kroenke K. Depression and pain comorbidity: a literature review. Arch Intern Med. 2003. Vol. 163. Р.2433-2445.
- Gerrits M. M., van Oppen P., van Marwijk H. W. et al. Pain and the onset of depressive and anxiety disorders. Pain. 2014. Vol. 155. Р.53-59.
- Rico-Villademoros F., Slim M., Calandre E. P. Amitriptyline for the treatment of fibromyalgia: a comprehensive review. Expert Rev Neurother. 2015. Vol. 15. Р. 1123-1150.
- Cohen J. A coefficient of agreement for nominal scales. Educ Psychol Meas. 1960. Vol. 20. Р.37-46.
- Cuijpers P., Turner E. H., Koole S. L. et al. What is the threshold for a clinically relevant effect? The case of major depressive disorders. Depress Anxiety. 2014. Vol. 31. Р.374-378.
- Meister R., von WolffA., Mohr H. et al. Comparative safety of pharmacologic treatments for persistent depressive disorder: a systematic review and network meta-analysis. PLoS One. 2016. Vol. 11. P.e0153380.
- Coupland C., Dhiman P., Morriss R. et al. Antidepressant use and risk of adverse outcomes in older people: population based cohort study. BMJ. 2011. Vol. 343. P.d4551.
Полный список литературы Вы можете найти на сайте rmj.ru



