Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
• Оригинальный ноотропный препарат с противотревожным действием
• Активирует умственную деятельность, улучшает эмоциональное состояние
Возможности применения рац-гопантеновой кислоты в комплексном лечении тревожно-депрессивных расстройств у больных с хронической ишемией головного мозга
СтатьиОпубликовано в Журнале Неврологии и психиатрии им. С.С.Корсакова. № 11.2016.с. 45-57
А.Б. Гехт2, Л.С. Канаева1*, А.С. Аведисова1' 2, М.П. Марачев1' 2, К.В. Захарова1, 2, Г.К. Дашкина2, Е.В. Куликова2
1ФГБУ «Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского» Минздрава РФ, Москва, Россия;
2ГБУЗ «Научно-практический психоневрологический центр» Департамента здравоохранения Москвы, Москва, Россия
Цель исследования. Оценка эффективности и переносимости рац-гопантеновой кислоты (пантогам актив) у больных с тревожно-депрессивным расстройством на фоне хронической ишемии головного мозга.
Материал и методы. Были обследованы 50 больных; 1-ю (основную) группу составили 30 пациентов, 2-ю (контрольную) — 20. Всем больным проводилась стандартная терапия антидепрессантами, но в терапию пациентов основной группы был дополнительно включен пантогам актив в средней суточной дозе 1200 мг. Длительность терапии рац-гопантеновой кислотой составила 21 день. Проводились психопатологическое, психометрическое, а также подробное соматическое обследования больных.
Результаты. Применение комбинации пантогама актив с антидепрессантами, особенно у больных с тревожно-депрессивным расстройством на фоне хронической ишемии головного мозга, способствовало развитию отчетливого сбалансированного когнитотропного, антидепрессивного и анксиолитического эффектов, а также улучшению соматических показателей. При комбинированной терапии снижалось общее число нежелательных явлений (реже отмечались сонливость и головная боль).
Заключение. В процессе сочетанной терапии антидепрессантами и пантогамом актив происходит быстрая и достоверная редукция тревожных, депрессивных и когнитивных нарушений.
Ключевые слова: рац-гопантеновая кислота, ноотропные препараты, депрессия, тревога, антидепрессанты, когнитивное функционирование, показатели здоровья.
Possible applications of rac-hopantenic acid in the treatment of anxiety and depressive disorders in patients with chronic cerebral ischemia
A.B. Gekht2, L.S. Kanaeva, A.S. Avedisova, M.P. Marachev, K.V. Zakharova, G.K. Dashkina, E.V. Kulikova
Serbsky Federal Medical Research Center for Psychiatry and Narcology, Moscow, Russia; Scientific and Practical Neuropsychiatric Center, Moscow Health Department, Moscow, Russia
Objective. To evaluate the efficacy and tolerability of rac-hopantenic acid (pantogam activ) in patients with mixed anxiety-depressive disorder and anxiety-depressive disorder with chronic cerebral ischemia.
Material and methods. A total of 50 patients were examined (30 patients in the main group, 20 patients in the control one). All patients received standard therapy with SSRI antidepressants. Rac-hopantenic acid at a daily dose of 1200 mg was included in the complex therapy of patients of the main group. Duration of the therapy with rac-hopantenic acid was 21 days. Psychopathological, psychometric and detailed somatic examinations were performed.
Results. In the main group, the combination of pantogam activ and antidepressants promoted distinct balanced nootropic, antidepressant and anxiolytic effects, as well as the improvement of health outcomes. The reduced total number of adverse events (less frequent drowsiness and headaches) was noted as well.
Conclusion. The rapid and reliable reduction of anxiety, depression and cognitive impairment during concomitant therapy with antidepressants and pantogam activ was identified.
Keywords: rac-hopantenic acid, nootropics drugs, depression, anxiety, antidepressants, cognitive functioning, health indicators.
Введение
В последние годы наблюдается рост интереса к соотношению когнитивных нарушений и расстройств тревожно-депрессивного спектра. Данная ситуация отчасти обусловлена новыми сведениями нейробиологических и нейровизуализационных исследований, согласно которым при депрессивных расстройствах выявляются структурно-функциональные изменения в лимбических (гиппокамп, миндалевидное тело, передняя часть поясной извилины) и корковых (префронтальная кора) структурах головного мозга — областях, ответственных в том числе и за когнитивное функционирование [1—3], а также выявлением общих генетических, метаболических, нейромедиаторных, гормональных, иммунных, трофических и нейропластических звеньев между когнитивными нарушениями и депрессией [4, 5].
При тревожно-депрессивных расстройствах были отмечены 2 типа когнитивной дисфункции: когнитивный дефицит и когнитивные искажения. Первый тип не является ведущим феноменом, выражен незначительно и представлен в основном нарушениями концентрации внимания и памяти, которые развиваются, как правило, после третьего эпизода депрессии [5]. Основное место в структуре депрессии отводится когнитивной дисфункции второго типа — так называемым когнитивным искажениям, к которым относят идеи виновности, осуждения, греховности, отчаяния, малоценности, бесперспективности будущего и др. [6]. По мнению S. Moylan и соавт. [7], когнитивный дефицит относиться к «холодной» (эмоционально-независимая) когниции, в то время как когнитивные искажения являются «горячей» когницией, так как тесно связаны с эмоциями. Пропорционально увеличению тяжести депрессии нарастает и тяжесть когнитивных нарушений и искажений. При этом «холодная» когниция проявляется заторможенностью мышления, а «горячая» — бредовым уровнем симптоматики [8]. Таким образом, при аффективных расстройствах наблюдается зависимость когнитивных нарушений от тяжести депрессивных расстройств.
Другие взаимоотношения формируются между когнитивными нарушениями и тревожно-депрессивной симптоматикой при органическом поражении головного мозга. При анализе условий формирования аффективных расстройств в этих случаях большое значение придают нарушению баланса функциональной активации полушарий головного мозга. Манифестация депрессии может быть связана с преимущественным раздражением и/или относительной активацией правого полушария, поскольку ему принадлежит основная роль в осуществляемой на корковом уровне регуляции эмоций и настроения. Когнитивный дефицит при органических аффективных расстройствах становится основным симптомом психического заболевания, по наличию которого и ставится клинический диагноз, при этом аффективная составляющая занимает подчиненное положение. Многие авторы [9, 10] указывают на изменение психопатологической структуры депрессии, которая характеризуется рудиментарностью и незавершенностью аффективных проявлений.
Наличие когнитивных нарушений в структуре депрессии и тревоги поднимает проблему их коррекции. Традиционно лидирующее положение в стандартах лечения аффективных расстройств (как депрессивных, так и тревожных) отводится антидепрессантам [11, 12]. Однако в отношении их когнитотропных эффектов ведутся активные дискуссии: одни исследователи указывают на положительную динамику когнитивного функционирования при курсовом лечении тимоаналептиками [13], другие — на негативные эффекты, получившие название «поведенческой токсичности» [14]. Соответственно разные точки зрения обосновывают или оспаривают необходимость использования для лечения больных с расстройствами тревожно-депрессивного спектра при наличии органической неполноценности лекарственных средств, обладающих прокогнитивным действием (ноотропным и нейропротективным).
Ноотропные средства (греч. ноос: — мышление, разум; «тропос» — стремление, сродство) первоначально описаны в 1972 г. К. Giurgea как средства, избирательно влияющие на память, внимание, концентрацию и не имеющие побочных эффектов обычных психостимуляторов. Данные клинические эффекты достигаются за счет двух взаимосвязанных основных механизмов действия: метаболического и нейропротективного. Воздействие на метаболизм нервной клетки осуществляется путем стимуляции обменных процессов в нервной ткани, оптимизации уровня обмена веществ и нейротрофического действия. Нейропротективное действие в свою очередь обусловлено процессами улучшения окислительно-восстановительных реакций, уменьшения агрессивного действия продуктов перекисного окисления липидов, улучшения состояния мембраны нейронов, позитивного влияния на нейротрансмиссию и процессы нейропластичности [15, 16]. В современной литературе благодаря основным эффектам ноотропные препараты называют нейрометаболическими церебропротекторами [15].
В ходе испытаний уже известных ноотропных препаратов неожиданно были открыты их свойства, заключающиеся в способности оказывать дополнительные психотропные и соматотропные эффекты. Так, у целого ряда препаратов данной группы были выявлены антиастеническое, анксиолитическое, антидепрессивное, вегетостабилизирующее действия, что способствовало расширению показаний и их широкому использованию в клинической практике [15—17].
Пока отсутствует общепринятая классификация ноотропных препаратов. Наибольшее признание получила классификация, предложенная Т.А. Ворониной, С.Б. Середениным [17], согласно которой была выделена группа «истинных» ноотропных препаратов, для которых способность улучшать мнестические функции является основным, а иногда и единственным эффектом, и группа ноотропных препаратов смешанного действия («неистинные» ноотропные препараты), у которых мнестический эффект дополняется, а нередко и перекрывается дополнительными не менее значимыми проявлениями действия. При этом отмечается, что именно последние обладают более мощным действием в сочетании с минимальными побочными эффектами.
Относительно недавно отечественными учеными был синтезирован новый ноотропный препарат — пантогам актив, активным веществом которого является D-, L-гопантеновая кислота, или рац-гопантеновая кислота (смесь равных количеств D- и L-стереоизомеров гопантеновой кислоты). На основании целого ряда теоретических предпосылок и экспериментальных наблюдений показано, что D (R)- и L(S)-стереоизомеры гопантеновой кислоты дополняют действие друг друга, что способствует значительному повышению терапевтической эффективности препарата и приобретению новых свойств, несколько отличных от препаратов гопантеновой кислоты первого поколения. Установлено, что рац-гопантеновая кислота взаимодействует как с ГАМК Б-рецепторами, так и за счет L-изомера влияет на Д2-дофаминовые и на небензодиазепиновые ГАМК А-рецепторы, что приводит к появлению легкого анксиолитического эффекта, который сочетается с мягким активирующим и более выраженным ноотропным, противосудорожным действиями. В экспериментах на животных показано, что пантогам актив обладает отчетливой ноотропной активностью, что выражается в его способности устранять амнезию условного рефлекса пассивного избегания, улучшать обучение условному рефлексу пассивного избегания и оптимизировать сложное экстраполяционное поведение избавления. Также выявлено, что пантогам актив обладает отчетливым и противосудорожным эффектом. Он малотоксичен при однократном и длительном введении. Применение препарата в течение 1 мес не влияет на состояние периферической системы крови и внутренних органов (эти результаты были получены при исследовании пантогама актив в терапевтических и субтерапевтических дозах).
Клинические исследования препарата [18—21] показали его эффективность у пациентов с когнитивными расстройствами и астеноневротической симптоматикой как в результате органических заболеваний головного мозга различного генеза, так и в структуре невротических расстройств. Отмечено, что препарат обладает нейровегетотропным и когнитотропным действиями, улучшая базовые показатели когнитивной деятельности — кратковременную и долговременную память, объем и концентрацию внимания. Дополнительные эффекты проявляются антиастеническим и мягким активирующим, а также анксиолитическим действиями. Последнее развивается с 1-й недели лечения и нарастает к 2—4-й неделе терапии и характеризуется снижением раздражительности, выраженности ситуационно провоцированных страхов и направленных в будущее тревожных опасений. Пантогам актив отличается также хорошими показателями переносимости: транзиторные побочные эффекты при его применении развиваются редко и ограничиваются шумом в голове, сонливостью, легкими и кратковременными нарушениями сна.
В клинических исследованиях было также установлено, что пантогам актив не вызывает развитие гиперстимуляции у больных сердечно-сосудистой патологией (артериальная гипертензия I—II степени, период восстановления после острого коронарного синдрома, ИБС, ХСН I— II) [20—22].
Цель исследования — оценка эффективности и переносимости препарата пантогам актив у больных со смешанным тревожно-депрессивным расстройством и тревожно-депрессивным расстройством на фоне хронической ишемии головного мозга.
Материал и методы
Критериями включения больных в исследование являлись наличие у пациентов в соответствии с критериями МКБ 10 смешанного тревожно-депрессивного расстройства (рубрика F41.2) и тревожно-депрессивного расстройства на фоне хронической ишемии головного мозга (F06.3), подтвержденные обследованием невролога, возраст от 55 лет и старше, письменное согласие больных на участие в исследовании. Критериями исключения были склонность к аллергическим реакциям, в том числе гиперчувствительность, к препаратам пантогам или пантогам актив в анамнезе, прием запрещенных протоколом исследования препаратов, другие психические расстройства, зависимость от психоактивных веществ, суицидальные мысли, состояния, угрожающие жизни пациента.
Информированное согласие у всех пациентов, включенных в данное исследование, было получено до проведения каких-либо процедур.
В исследование были включены 50 пациентов. Все пациенты методом простой рандомизации распределялись на две группы: 1-я (основная) группа состояла из 30 человек. Всем больным данной группы помимо стандартного лечения антидепрессантами (СИОЗС) назначался пантогам актив, 2-я группа была контрольной. Всем 20 больным этой группы проводилась только стандартная терапия антидепрессантами из группы СИОЗС. Как показано в табл. 1, обе группы были сопоставимы по социодемографическим и клиническим показателям. Средний возраст больных в 1-й группе был 64,2±6,78 года, в контрольной — 63,05±6,77 года. Процентное соотношение мужчин и женщин составило в 1-й группе 3 (10%)/27 (90%), в контрольной — 1 (5%)/19 (95%). В большинстве случаев пациенты имели среднее/среднее специальное или высшее образование (16 (53%)/14 (47%) — 1-я группа, 10 (50%)/10 (50%) — 2-я группа. Профессиональная деятельность больных характеризовалась значительным превалированием незанятых (пенсионеры и неработающие): 25 (83%) — 1-я группа, 17 (85%) — 2-я группа над трудоустроенными больными 5 (17%) — 1-я группа, 3 (15%) — 2-я группа. Анализ семейного статуса пациентов выявил равное число одиноких лиц 15 (50%) — 1-я группа и 10 (50%) — 2-я группа.
Таблица 1.
Социодемографическая характеристика больных
| Показатель | 1-я группа (основная) (n=30) | 2-я группа (контрольная) (n=20) |
| Средний возраст | 64,2±6,78 года | 63,05± 6,77 года |
| мужчины | 3 (10%) | 1 (5%) |
| женщины | 27 (90%) | 19 (95%) |
| Образование | ||
| высшее | 14 (47%) | 10 (50%) |
| среднее/среднее специальное | 16 (53%) | 10 (50%) |
| Профессиональная занятость | ||
| занятые | 5 (17%) | 3 (15%) |
| незанятые | 25 (83%) | 17 (85%) |
| Семейный статус | ||
| состоящие в браке | 15 (50%) | 10 (50%) |
| одинокие | 15 (50%) | 10 (50%) |
Как видно из табл. 2, в основной группе в 17 (56,7%) случаях диагностировалось смешанное тревожное и депрессивное расстройство и в 13 (43,3%) случаях — органическое тревожно-депрессивное расстройство. В контрольной группе оба расстройства были представлены с одинаковой частотой по 10 (50%) пациентов (табл. 2). Средняя длительность состояния в основной группе составила 6,03±3,93 мес, а в контрольной — 6,7±3,16 мес. Средняя длительность заболевания, как и число перенесенных эпизодов во 2-й группе (11,1±12,66 и 5,33±4,16 соответственно) превышали аналогичные показатели в 1-й группе (5,03±6,54 и 2,33±6,54 соответственно). Однако статистически значимых различий по данному показателю между изучаемыми группами выявлено не было.
Таблица 2.
Клиническая характеристика больных в исследуемых группах
| Клинический показатель | 1-я группа | 2-я группа |
| Смешанное тревожное и депрессивное расстройство | 17 (56,67%%) | 10 (50%) |
| Органическое тревожно-депрессивное расстройство | 13 (43,33%) | 10 (50%) |
| Средняя длительность состояния (мес) | 6,03±3,93 | 6,7±3,16 |
| Средняя длительность заболевания (годы) | 5,03±6,54 | 11,1±12,66 |
| Число перенесенных эпизодов | 2,33±6,54 | 5,33±4,16 |
Сопутствующая соматическая патология в основной и контрольной группах была представлена гипертонической болезнью — у 20 (67%) пациентов и 13 (65%) соответственно и цереброваскулярной болезнью головного мозга — у 19 (67%) и 12 (60%) соответственно (табл. 3). Помимо сердечно-сосудистых заболеваний в 1-й группе достаточно распространенным было заболевание опорно-двигательного аппарата (остеохондроз позвоночника) — 16 (53%) больных.
Таблица 3.
Сопутствующая патология в исследуемых группах больных
| Сопутствующая патология | Группа терапии | |||
| основная | контрольная | |||
| абс. | % | абс. | % | |
| Сердечно-сосудистые заболевания (ИБС) | 2 | 7 | 3 | 15 |
| Гипертоническая болезнь | 20 | 67 | 13 | 65 |
| Цереброваскулярная болезнь головного мозга | 19 | 63 | 12 | 60 |
| Остеохондроз позвоночника | 16 | 53 | 5 | 25 |
| Заболевания ЖКТ (хронический гастрит) | 1 | 3 | 2 | 10 |
Оценка эффективности и переносимости исследуемого препарата осуществлялась с помощью следующих опросников и тестов: госпитальной шкалы тревоги и депрессии (HADS), опросника здоровья EQ-SD-3L, монреальской шкалы оценки когнитивных функций (МоСА тест), шкалы побочных явлений UKU.
Статистический анализ результатов проводился при помощи программы SPSS 17.0 for Windows. Статистически значимыми считались различия при p<0,05.
Продолжительность терапии во всех группах составила 3 нед. Состояние больных оценивалось до начала лечения (фоновое обследование) и на 21-й день. При фоновом обследовании также проводилось соматическое обследование с оценкой лабораторных показателей крови и мочи и ЭКГ.
В соответствии с протоколом исследования пантогам актив назначали в дозах от 900 до 1800 мг/сут, средняя суточная доза составила 1200 мг/сут. Помимо исследуемого препарата больным назначали антидепрессанты из группы СИОЗС (табл. 4). Отдавалось предпочтение таким тимоаналептикам, как эсциталопрам (10 (33%) основная группа и 12 (60%) — контрольная), пароксетин (6 (20%)), флувоксамин (5 (16%)), реже больные получали сертралин (3 (10%)) и венлафаксин (4(13%)). Несмотря на то что венлафаксин относится к антидепрессантам с двойным механизмом действия, учитывалось наличие у него дозозависимого эффекта, когда в дозе, не превышающей 75 мг/сут, (в которой он назначался больным) он оказывал воздействие только на серотониновую систему, что приближало данный препарат к СИОЗС. В контрольной группе больным назначались те же самые препараты: эсциталопрам (9 (60%)), реже пароксетин (3 (15%)), флувоксамин, сертралин (у 2 (10%)) и велафаксин (1 (5%)).
Таблица 4.
Тимоаналептическая терапия в исследуемых группах больных
| Антидепрессант | 1-я (основная) группа | 2-я (контрольная) группа | ||
| абс. | % | абс. | % | |
| Венлафаксин | 4 | 13 | 1 | 5 |
| Эсциталопрам | 10 | 33 | 12 | 60 |
| Пароксетин | 6 | 20 | 3 | 15 |
| Флувоксамин | 6 | 16 | 2 | 10 |
| Сертралин | 4 | 10 | 2 | 10 |
Для нормализации сна допускалось также кратковременное назначение бензодиазепиновых транквилизаторов в дозе, эквивалентной 10 мг/сут диазепама: не более 4 дней в течение 1-й недели и не более 2 дней — в течение 2-й недели. Начиная с 3-й недели терапии назначение бензодиазепинов было недопустимым. Всего в исследовании бензодиазепины (феназепам в дозе 1 мг/сут) назначались в течение 1-й недели (2—3 дня) 5 пациентам основной группы и 3 пациентам контрольной группы; в течение 2-й недели (2 дня) — 1 пациенту основной группы и 2 пациентам контрольной группы.
В соответствии с протоколом исследования запрещалось назначение ноотропных/вазоактивных препаратов, нейролептиков, нормотимиков. При необходимости допускалось применение гипотензивных, кардиотропных и других соматотропных препаратов. Число пациентов, принимавших соматотропные препараты указанных выше групп, составило в 1-й — 20, во 2-й — 13.
Все пациенты завершили участие в исследовании.
Результаты
Эффективность курсового лечения в исследуемых группах больных
Улучшение когнитивных функций в 1-й группе было более выраженным, чем во 2-й (рис. 1). Так, в 1-й группе были получены статистически достоверные различия по сравнению с фоном по суммарным значениям МоСА-теста (20,96±2,9 — до лечения; 23,22±2,9 — на 21-й день; р<0,0001). Во 2-й группе существенные различия улучшения когнитивного дефицита отсутствовали.
Рис. 1. Динамика общего балла МоСА-теста в процессе лечения в исследуемых группах больных, баллы. 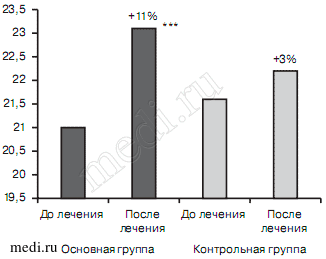
Различия по сравнению с периодом до лечения, установленные с помощью теста Уилкоксона: *** — р<0,0001. Различия между группами, установленные с использованием U-теста по методу Манна—Уитни.
Восстановление когнитивных функций в основной группе происходило относительно равномерно. Были выявлены статистически значимые различия по сравнению с фоном лечения по показателям зрительно-конструктивных/исполнительных навыков (2,78±1,2 — до лечения; 3,33±1,2 — 21-й день; р<0,001), внимания (4,15±1,1 — до лечения; 4,56±1,9 — 21-й день; р<0,05), абстракции (1,11±0,7 — до лечения; 1,37±0,5 — 21-й день; р<0,001) и отсроченного воспроизведения (2,11±1,5 — до лечения и 3,15±1,4 — 21-й день; р<0,0001). По показателю состояния речи динамика была незначительной (2,44±0,7 — до лечения; 2,52±0,7 — на 21-й день), а по называнию предметов отсутствовала (3±0 — как до, так и после лечения). Во 2-й группе улучшение показателей когнитивных функций было незначительным или вовсе отсутствовало. В конце курсового лечения статистически достоверные различия между группами отмечались по показателям речи и способности к абстракции (р<0,05) (табл. 5).
Таблица 5.
Динамика показателей когнитивного функционирования по МоСА-тесту в процессе лечения в исследуемых группах больных, баллы
| Когнитивные показатели | Основная | Контрольная | ||
| до лечения | 21-й день | до лечения | 21-й день | |
| Зрительно-конструктивные/исполнительные навыки | 2,78±1,2 | 3,33±1,2** | 3,45±1,1 | 3,85±1,1 |
| Называние предметов | 3±0 | 3±0 | 2,85±0,4 | 2,9±0,4 |
| Внимание | 4,15±1,1 | 4,56±1,9* | 4,25±0,97 | 4,25±1,1 |
| Речь | 2,44±0,7 | 2,52±0,7 | 2,1±0,7 | 2,15±0,7# |
| Способность к абстракции | 1,11±0,7 | 1,37±0,5** | 1,05±0,8 | 0,95±0,9# |
| Отсроченное воспроизведение | 2,11 ± 1,5 | 3,15±1,4*** | 2,2±1,6 | 2,4±1,6 |
| Ориентация | 5,96±1,2 | 5,96±1,2 | 5,9±0,3 | 5,95±0,2 |
Примечание. Здесь и в табл. 6—7: различия по сравнению с фоном, установленные с помощью теста Уилкоксона: ** — р<0,001, *** — р<0,0001. Различия между группами, установленные с использованием и-теста по методу Манна—Уитни: # — р<0,05.
Степень выраженности тревоги и депрессии на момент включения в исследование соответствовала субклиническому уровню как в 1-й, основной (9,2±3,3 и 10,6±2,6 соответственно) так и во 2-й, контрольной (9,15±1,9 и 9,9±2,4 соответственно) группах. Редукция суммарного балла, а также балла депрессии и тревоги по шкале HADS на 21-й день терапии по сравнению с периодом до лечения были выявлены как в основной (15,8±5,7 и 19,5±4,5 соответственно (р<0,001), 8,2±2,9 и 10,6±2,6 (р<0,0001), 7,7±3,6 и 9,2±3,3 соответственно (р<0,001)), так и в контрольной (15,4±4,9 и 19±3,3 (р<0,001), 7,8±2,6 и 9,9±2,4 (р<0,001), 7,65±2,9 и 9,15±1,9 соответственно (р<0,001)) группах. Статистически достоверные различия между группами отсутствовали. При этом величина терапевтического эффекта в обеих группах была одинаковой в отношении суммарного балла шкалы HADS (по 19%) и выраженности тревоги (по 16%). Однако в основной группе редукция симптомов депрессии была более выраженной по сравнению с контрольной группой (—23 и —11% соответственно). В 1-й группе наибольшее обратное развитие отмечалось по показателям двигательной заторможенности и активности (рис. 2).
Рис. 2. Редукция выраженности депрессии и тревоги по шкале HADS в исследуемых группах больных, баллы. 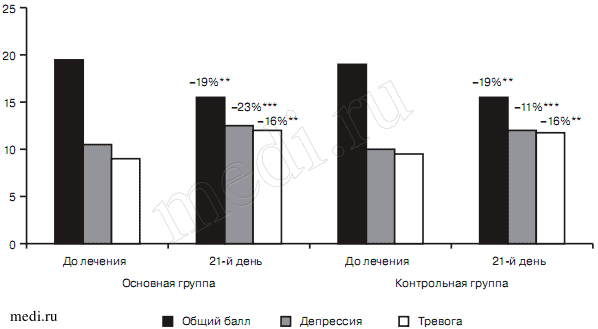
Здесь и на рис. 3—12: различия по сравнению с фоном, установленные с помощью теста Уилкоксона: ** — р<0,001, *** — р<0,0001. Различия между группами, установленные с использованием U-теста по методу Манна—Уитни.
Данные самоопросника оценки состояния здоровья EQ-5D-3L при 1-м визите в обеих группах выявили более выраженные нарушения по показателям тревога/депрессия (2,04±0,62 — 1-я группа, 2±0,46 — 2-я) и боль/дискомфорт (2±0,49 — 1-я группа, 1,65±0,59 — 2-я группа), которые приводили к ухудшению и других показателей здоровья (подвижность, деятельность и др.). В процессе лечения в 1-й группе в большей степени уменьшались выраженность боли/дискомфорта (от 2±0,49 — до лечения, до 1,67±0,51 — на 21-й день; р<0,001) и тревоги/депрессии (2,04±0,62 и 1,59±0,55 соответственно; р<0,001). Во 2-й группе существенная редукция отмечалась только по показателям тревоги/депрессии (2±0,46 до лечения и 1,5±0,51 — на 21-й день; р<0,001) (рис. 3). Статистически достоверные различия между изученными группами отсутствовали.
Рис. 3. Показатели шкалы здоровья EQ-5D-3L в исследуемых группах больных в процессе лечения, баллы до и после терапии.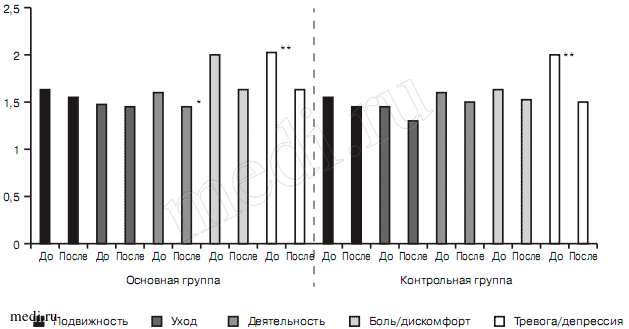
В обеих группах до лечения больные оценивали состояние своего здоровья по визуальной шкале здоровья EQ VAS как среднее: 50,93±0,44 балла в основной группе и 55,25±12,4 — в контрольной). К концу 3-й недели лечения в основной группе отмечалось статистически достоверное улучшение указанной оценки (66,85±0,5, p<0,0001), в то время как в контрольной группе этого не наблюдалось (64,6±13,33) (рис. 4).
Рис. 4. Динамика показателей визуальной шкалы здоровья EQ VAS в исследуемых группах больных в процессе лечения.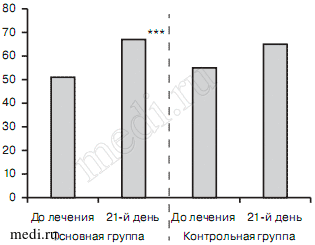
Эффективность терапии у больных со смешанным тревожным и депрессивным расстройством
При смешанном тревожном и депрессивном расстройстве к 21-му дню терапии улучшение когнитивных функций по суммарному показателю шкалы МоСА-теста в 1-й основной группе достигало значимых различий по сравнению с данными до лечения (21,6±2,26 — до лечения, 23,8±2,52 — 21-й день; р<0,0001), в то время как во 2-й, контрольной группе изменения происходили на уровне тенденций (23,2±2,49 — до лечения, 24,6±2,32 — на 21-й день; р=0,078) (рис. 5).
Рис. 5. Суммарный балл по шкале МоСА-теста при смешанном тревожном и депрессивном расстройствах в исследуемых группах больных до и после терапии, баллы.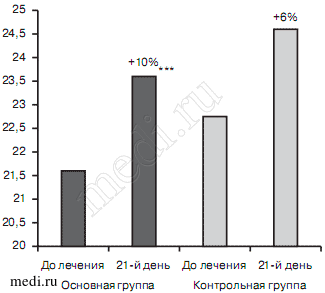
Анализ восстановления когнитивной деятельности в 1-й группе имел неравномерный характер в отношении отдельных функций. У больных в первую очередь наблюдалось улучшение показателя отсроченного воспроизведения (2,3±0,33 — до лечения и 3±1,31 — на 21-й день; р<0,05) и в меньшей степени внимания (3,9±0,88 и 4,3±1,05 соответственно; р=0,058) и способности к понимаю абстракции (1,1±0,59 — до лечения, 1,3±0,46 — на 21- й день; р=0,083) (табл. 6). В контрольной группе когнитотропный эффект в большей степени отмечался по показателю зрительно-конструктивных/исполнительных навыков (4,1±0,74 — до лечения, 4,7±0,48 — 21-й день; р=0,058). По показателю зрительно-конструктивных/исполнительных навыков были получены статистически достоверные различия между группами с превосходством в контрольной группе как по фоновым значениям, так и по баллу на 21-й день терапии (р<0,001).
Таблица 6.
Динамика суммарного балла по шкале МоСА-теста при смешанном тревожном и депрессивном расстройствах в исследуемых группах больных
| Показатель | Основная группа | Контрольная группа | ||
| до лечения | 21-й день | до лечения | 21-й день | |
| Зрительно-конструктивные/исполнительные навыки | 2,9±0,8 | 3,2±1,26 | 4,1±0,74## | 4,7±0,48 р=0,058## |
| Называние предметов | 3±0 | 3±0 | 3±0 | 2,9±0,32 |
| Внимание | 3,9±0,88 | 4,3±1,05 p=0,058 | 4,3±0,95 | 4,5±0,71 |
| Речь | 2,5±0,64 | 2,6±0,74 | 2±0,67 | 2,1±0,57 |
| Способность к пониманию абстракции | 1,1±0,59 | 1,3±0,46 p=0,083 | 1,4±0,7 | 1,4±0,7 |
| Отсроченное воспроизведение | 2,3±0,33 | 3±1,31* | 3,1 ± 1,45 | 3±1,7 |
| Ориентация | 6±0 | 6±0 | 5,9±0,32 | 6,0±0 |
Примечание. Различия по сравнению с фоном, установленные с помощью теста Уилкоксона: ** — р<0,001, *** — р<0,0001. Различия между группами, установленные с использованием U-теста по методу Манна—Уитни: ## — р<0,05.
У больных со смешанным тревожным и депрессивным расстройством показатели выраженности тревоги и депрессии соответствовали субклиническому уровню как в основной (8,5±2,99/10,9±1,68), так и в контрольной (8,6±1,84/8,9±2,55) группах. При этом выраженность депрессии в 1-й группе приближалась к клинически очерченному состоянию. Положительная динамика в 1-й группе к концу наблюдения была более выраженной в отношении симптомов депрессии (10,9±1,68 — до лечения, 8,1±3,14 — на 21-й день; р<0,001), в то время как в контрольной группе были выявлены статистически достоверные различия по сравнению с показателями до лечения как по симптомам депрессии (8,9 ± 2,55 до лечения и 7±2,91 — 21-й день, р<0,05), так и по симптомам тревоги (8,6±1,84 и 6,5±3,03 соответственно; р<0,05) (рис. 6). Статистически достоверные различия между изученными группами отсутствовали.
Рис. 6. Показатели шкалы HADS в изученных группах больных со смешанным тревожным и депрессивным расстройствами, баллы до и после терапии.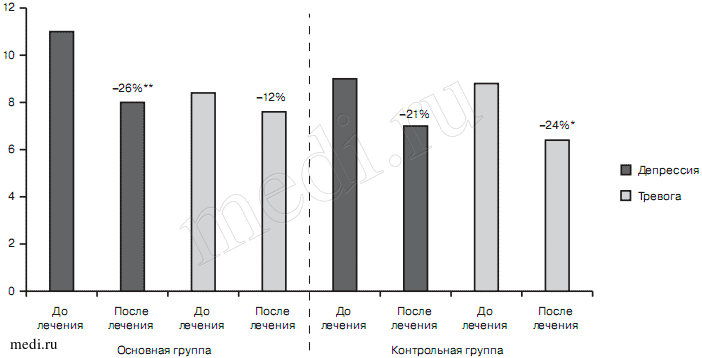
При анализе динамики показателей шкалы здоровья EQ-5D-3L при смешанном тревожном и депрессивном расстройствах были выявлены статистически достоверные различия между 21-м днем терапии и фоном в основной группе по признаку тревога/депрессия (2,1±0,46 — до лечения, 1,5±0,52. — на 21-й день; р<0,05) (рис. 7). В контрольной группе существенной динамики не отмечалось. Статистически достоверные различия между изученными группами отсутствовали.
Рис. 7. Показатели шкалы здоровья EQ-5D-3L в исследуемых группах больных со смешанным тревожным и депрессивным расстройствами до и после терапии, баллы.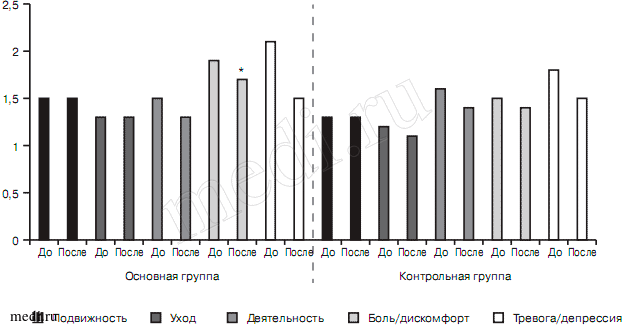
При смешанном тревожном и депрессивном расстройствах оценка больными состояния своего здоровья по шкале EQ VAS соответствовала средним значениям как в основной (52,3±11,32), так и в контрольной (59,5±10,9) группах. При этом положительная динамика была более выраженной в 1-й группе (65,7±10,5 — 21-й день, р<0,001) в отличие от 2-й (70,2±13,6). Эти данные отражены на рис. 8.
Рис. 8. Показатели шкалы EQ VAS в исследуемых группах больных со смешанным тревожным и депрессивным расстройствами.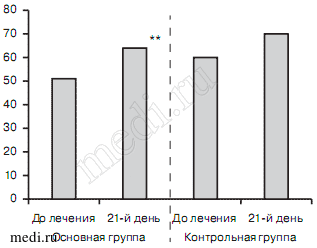
Эффективность терапии при органическом тревожно-депрессивном расстройстве
При органическом тревожно-депрессивном расстройстве до лечения суммарные значения когнитивных нарушений как в основной (20,2±3,61), так и в контрольной (19,5±3,45) группах были более выраженными, чем при смешанном тревожном и депрессивном расстройствах. При этом положительная динамика данного показателя была более выраженной в основной группе (+11%), в то время как в контрольной она отсутствовала (0%). Статистически значимых различий между группами не было (рис. 9).
Рис. 9. Динамика суммарного балла по шкале МоСА-теста в исследуемых группах больных с органическим тревожно-депрессивным расстройством в процессе терапии.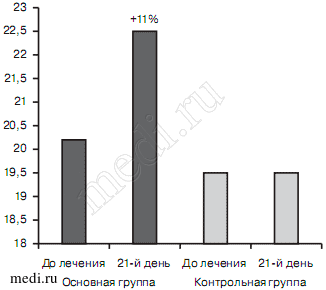
Динамика показателей когнитивного функционирования в основной группе в целом была равномерной: отмечалось статистически значимое по сравнению с фоном улучшение зрительно-конструктивных/исполнительных навыков (2,6±1,56 — до лечения, 3,5±1,17 — на 21-й день; р<0,05), способности к абстракции (1,2±0,83 — до лечения, 1,5±0,52 — на 21-й день; р<0,05), отсроченного воспроизведения (1,9±1,78 — до лечения, 3,3±1,5 — на 21-й день; р<0,001) и на уровне тенденции — внимания (4,4±1,24 — до лечения, 4,8±0,84 — на 21-й день; р=0,098). Не претерпевали каких-либо изменений способность к называнию предметов (3±0 — до лечения и на 21-й день) и состояние речи (2,4±0,79 — до лечения и на 21-й день). В контрольной группе по всем показателям когнитивных функций статистические различия между фоновыми значениями и 21-м днем терапии отсутствовали. Различия между изучаемыми группами достигали статистически значимого уровня по показателю способности к абстракции (р<0,001) и отсроченному воспроизведению (р<0,05), а также уровня тенденции по зрительно-конструктивным/исполнительным навыкам (р=0,09) (табл. 7).
Таблица 7.
Динамика показателей шкалы МоСА-теста в исследуемых группах больных с органическим тревожно-депрессивным расстройством в процессе терапии, баллы
| Когнитивные показатели | Основная группа | Контрольная группа | ||
| до лечения | 21-й день | до лечения | 21-й день | |
| Зрительно-конструктивные/исполнительные навыки | 2,6±1,56 | 3,5±1,17* | 2,8±1,03 | 3±0,94 |
| Называние предметов | 3±0 | 3±0 | 2,7±0,48 | 2,9±0,32 |
| Внимание | 4,4±1,24 | 4,8±0,84 | 4,2±1,03 | 4±1,33 |
| Речь | 2,4±0,79 | р=0,098 2,4±0,67 | 2,2±0,63 | 2,2±0,79 |
| Способность к абстракции | 1,2±0,83 | 1,5±0,52* | 0,9±0,82 | 0,7±0,85## |
| Отсроченное воспроизведение | 1,9±1,78 | 3,3±1,5 ** | 1,3±1,16 | 1,8±0,32# |
| Ориентация | 5,9±0,29 | 5,9±0,29 | 5,9±0,32 | 5,9±0,32 |
При тревожно-депрессивном расстройстве на фоне хронической ишемии головного мозга фоновые показатели тревоги и депрессии также соответствовали субсиндромальному уровню как в основной (10,5±2,8/10,3±3,52), так и в контрольной (8,6±2,11/10,8±1,93) группах. При этом редукция значений до лечения в процессе терапии была более выраженной в основной группе как по подшкале депрессии (10,3±3,52 — до лечения и 7,8±3,32 — на 21-й день; р<0,001), так и подшкале тревоги (10,5±2,8 и 7,9±3,32 соответственно; р<0,001), в то время как в контрольной группе значительной редукции подвергалась лишь подшкала депрессии (10,8±1,93 — до лечения, 9,7±2 — на 21-й день, — 10% (р<0,05)). Суммарный показатель подшкалы тревоги в контрольной группе имел тенденцию к незначительному увеличению общего счета (8,6±2,11 — до лечения, 8,8±2,49 — на 21-й день) (рис. 10). Статистически значимые различия между группами не обнаруживались.
Рис. 10. Динамика показателей шкалы HADS в изученных группах больных с органическим тревожно-депрессивным расстройством в процессе терапии.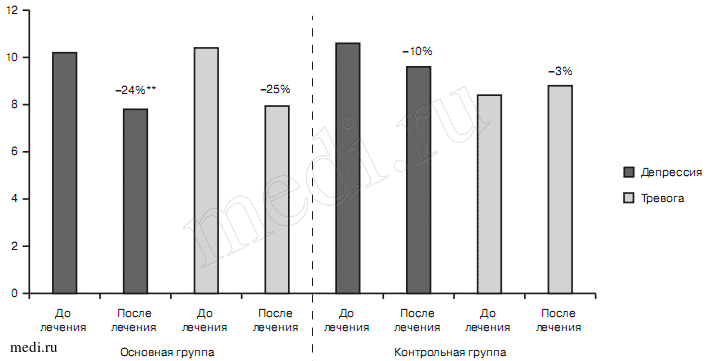
Также при органическом тревожно-депрессивном расстройстве в 1-й группе наблюдалась более выраженная динамика по шкале EQ-5D-3L по показателю боль/дискомфорт (2,2±0,58 — до лечения, 1,7±0,49 — на 21-й день; р<0,05), тревога/депрессия (2±0,43 — до лечения, 1,7±0,48 — на 21-й день, р<0,05) и шкале EQ VAS (49,2±9,96 — до лечения, 68,3±9,84 — на 21-й день; р<0,001) (рис. 11 и 12). Во 2-й группе было выявлено существенное улучшение показателей тревога/депрессия (2,2±0,42 — до лечения, 1,5±0,53 — на 21-й день; р<0,001) и по шкалы EQ VAS (51±12,9 — до лечения, 59±11 — на 21-й день; р<0,001). Превосходство в улучшении показателей по шкале EQ VAS в 1-й группе достигало статистически достоверного уровня (р<0,05).
Рис. 11. Показатели шкалы EQ-5D-3L в исследуемых группах больных с органическим тревожно-депрессивным расстройством до и после лечения.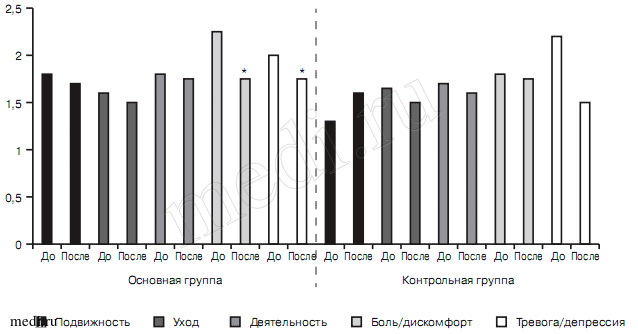
Рис. 12. Динамика показателей по шкале EQ VAS в исследуемых группах больных с органическим тревожно-депрессивным расстройством.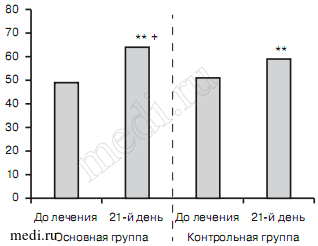
Переносимость пантогама актив
Нежелательные явления (НЯ), выявленные врачом, наблюдались у 23 из 30 пациентов основной группы, проходивших курсовое лечение комбинированной терапией СИОЗС и пантогамом актив, и у 19 из 20 больных контрольной группы. Всего было зарегистрировано 88 случаев НЯ, в среднем 3,26 на 1 пациента в 1-й группе и 96 случаев НЯ, в среднем 4,8 на 1 пациента во 2-й. В обеих группах преобладали психические и вегетативные НЯ, среди которых наиболее распространенными были жалобы на нарушение концентрации внимания — у 13 (14,77%) в 1-й группе и у 12 (12,5%) больных во 2-й группе, сонливость/ седацию — 15 (17,1%) — в 1-й группе и 19 (19,76%) — во 2-й группе, увеличение продолжительности сна — у 8 (9,12%) в 1-й группе и у 7 (7,28%) — во 2-й группе, тошнота/рвота — 6 (6,84%) в 1-й группе и 9 (9,36%) — во 2-й группе. В то же время между больными основной и контрольной групп выявлялись различия в спектре НЯ по ряду симптомов. Так, в 1-й группе отмечалось некоторое преобладание по симптому астения/усталость/повышенная утомляемость — у 6 (6,84%) — в 1-й группе и 3 (3,12%) — во 2-й. Это могло быть связано с назначением транквилизаторов. В контрольной группе — головная боль напряжения — 1 (1,14%) больной — в 1-й группе и 3 (3,42%) — во 2-й, а также диарея — 3 (3,42%) пациента в 1-й группе и 6 (6,24%) — во 2-й. В обеих группах редкими НЯ являлись депрессия (2,28%), напряжение/внутреннее беспокойство (2,28%), увеличение сновидений (4,56%), дистония (4,56%), сердцебиение/тахикардия (3,42%). Такие симптомы, как снижение памяти, гиперкинезы, акатизия, парестезии, сухость во рту, зуд, горечь во рту отмечались лишь в единичных случаях. Обобщенные данные представлены в табл. 8. Все НЯ купировались самостоятельно и не требовали медикаментозной коррекции. Ни один пациент не отказался от терапии по причине НЯ.
Таблица 8.
Частота НЯ по шкале побочных явлений UKU в изученных группах больных
| НЯ | Основная группа | Контрольная группа | ||
| абс. | % | абс. | % | |
| Психические | ||||
| нарушение концентрации | 14,77 | 13 | 12,5 | 12 |
| астения/усталость/повышенная утомляемость | 6,84 | 6 | 3,12 | 4 |
| сонливость/седативный эффект | 17,1 | 15 | 19,76 | 19 |
| снижение памяти | 1,14 | 1 | 2,08 | 2 |
| депрессия | 2,28 | 2 | 3,12 | 3 |
| напряжение/внутреннее беспокойство | 2,28 | 2 | 3,12 | 3 |
| увеличение продолжительности сна | 9,12 | 8 | 7,28 | 7 |
| уменьшение продолжительности сна | — | 0 | 2,0 | 2 |
| увеличение сновидений | 4,56 | 4 | — | 0 |
| Неврологические | ||||
| дистония | 4,56 | 4 | 1,04 | 1 |
| гиперкинезы | 3,42 | 3 | — | 0 |
| акатизия | — | 0 | 2,08 | 2 |
| парестезии | 2,28 | 2 | — | 0 |
| Вегетативные | ||||
| сухость во рту | 2,28 | 2 | — | 0 |
| тошнота/рвота | 10,6 | 9 | 9,36 | 9 |
| диарея | 3,42 | 3 | 6,24 | 6 |
| полиурия | 1,14 | 1 | 3,12 | 3 |
| сердцебиение/тахикардия | 3,42 | 3 | 3,12 | 3 |
| повышенная потливость | 1,14 | 1 | — | 0 |
| Другие | ||||
| зуд | 2,28 | 2 | — | 0 |
| нарушение эрекции | — | 0 | 3,12 | 3 |
| головная боль | 3,42 | 3 | 8,32 | 8 |
| напряжения | 3,42 | 3 | 8,32 | 8 |
| мигренозная | — | 0 | — | 0 |
| горечь во рту | 2,28 | 2 | — | 0 |
| брадикардия | — | 0 | 2,08 | 2 |
| Всего | 100 | 88 | 100 | 96 |
| Число НЯ на 1 больного | 3,26 | 4,8 | ||
Обсуждение
В настоящее время ноотропные препараты являются самыми назначаемыми лекарственными средствами в России. Они оказывают метаболическое и нейропротективное действия, что проявляется не только в улучшении когнитивного функционирования больных, но и в уменьшении выраженности астении, тревоги, стабилизации показателей вегетативных функций, улучшении микроциркуляции и др.
В последние десятилетия особый интерес исследователей сосредоточился на веществах, влияющих на систему ГАМК, в том числе на новом отечественном препарате — пантогам актив. Предыдущие исследования этого лекарственного средства продемонстрировали его высокую эффективность при психических, соматических и неврологических заболеваниях. Причем было выявлено наличие у данного препарата не только антиастенического, но и мягкого анксиолитического действия, а также возможность снижения НЯ ряда психотропных препаратов.
В настоящем исследовании было установлено, что эффективность пантогама актив в отношении коррекции когнитивных и тревожно-депрессивных расстройств различается в зависимости от характера психической патологии. Так, на 21-й день терапии был выявлен отчетливый когнитотропный эффект при комбинированном использовании пантогама актив и тимоаналептиков. Причем характер восстановления когнитивной деятельности у больных с тревожно-депрессивным состоянием на фоне хронической ишемии головного мозга был равномерным и затрагивал практически все функции (зрительно-конструктивные/исполнительные навыки, способность к абстракции, отсроченное воспроизведение и внимание). В то же время при смешанном тревожном и депрессивном расстройствах улучшение когнитивных функций носило неравномерный характер: преимущественно улучшалось отсроченное воспроизведение и в меньшей степени — внимание и способности к абстракции.
Редукция симптомов депрессии и тревоги по шкале была более выраженной у больных с тревожно-депрессивным состоянием органического генеза, в то время как у больных со смешанным тревожно-депрессивным расстройством в большей степени снижалась выраженность симптомов депрессии.
Субъективные показатели по шкале EQ-5D-3L улучшались как в основной группе, где назначался пантогам актив, так и в контрольной группе. Причем в первом случае в большей степени уменьшалась выраженность депрессии/тревоги и болевых ощущений/дискомфорта. Скорее всего именно это приводило к повышению подвижности и активности больных, в том числе и в отношении самообслуживания.
Сочетанное назначение пантогама актив и антидепрессантов привело не только к снижению числа, но и к более благоприятному спектру НЯ: у пациентов уменьшалась сонливость и головные боли.
Что касается ограничений данного исследования, то можно отметить его недостаточную длительность и разброс показателей в изученных группах вследствие малой выборки больных. Тем не менее несмотря на довольно короткий период применения, полученные результаты показывают, что включение пантогама актив способствует улучшению когнитивного статуса и повышению эффективности и безопасности базовой терапии психотропными препаратами у пациентов с тревожно-депрессивными расстройствами.
Таким образом, проведенное исследование показало положительное влияние включения пантогама актив в терапию тревожно-депрессивных расстройств и выявило потенцирование препаратом пантогамом актив действия антидепрессантов (СИОЗС) у пациентов с тревожно-депрессивным расстройством на фоне хронической ишемии головного мозга с развитием более выраженного когнитотропного, антидепрессивного и анксиолитического эффектов, а также улучшение оценки больными состояния своего здоровья. При смешанном тревожном и депрессивном расстройствах сочетанное применение пантогама актив и антидепрессантов не демонстрировало преимуществ по сравнению с монотерапией тимоаналептиками в отношении степени редукции тревоги и депрессии, в то время как отмечались положительные когнитотропные эффекты и улучшение показателя оценки больными состояния своего здоровья. Отмечены хорошая переносимость и безопасность препарата и его сочетаемость с другими лекарственными средствами. При назначении пантогама актив в сочетании с антидепрессантами группы СИОЗС снижалось общее число НЯ, преимущественно за счет сонливости и головной боли.
ЛИТЕРАТУРА
1. Lorenzetti V, Allen NB, Fornito A, Yücel M. Structural brain abnormalities in major depressive disorder: a selective review of recent MRI studies. J Affect Disord. 2009;117(1-2):1-17. doi: 10.1016/j.jad.2008.11.021
2. McKinnon MC, Yucel K, Nazarov A, MacQueen GM. A meta-analysis examining clinical predictors of hippocampal volume in patients with major depressive disorder. J Psychiatry Neurosci. 2009;34(1):41-54.
3. Goeldner C, Ballard TM, Knoflach F et al. Cognitive impairment in major depression and the mGlu2 receptor as a therapeutic target. Neuropharmacology. 2013;64:337-346. doi: 10.1016/j.neuropharm.2012.08.001
4. Jaworska N, MacMaster FP, Foster J, Ramasubbu R. The influence of 5-HTTLPR and Val66Met polymorphisms on cortical thickness and volume in limbic and paralimbic regions in depression: a preliminary study. BMC Psychiatry. 2016;16: 61. doi: 10.1186/s 12888-016-0777-x
5. Papazacharias A, Nardini M. The relationships between depression and cognitive deficits. Psychiatria Danubina. 2012;24(suppl 1):179-182.
6. Kovacs M, Beck AT. Maladpative cognitive structures in depression. Am J Psychiatry. 1978;135:525-533. doi: 10.1176/ajp.135.5.525
7. Moylan S, Maes M, Wray NR, Berk M. The neuroprogressive nature of major depressive disorder: pathways to disease evolution and resistance, and therapeutic implications. Mol Psychiatry. 2013;18(5):595-606. doi: 10.1038/mp.2012.33
8. Холмогорова А.Б., Пуговкина О.Д. Основные этапы и направления изучения когнитивных дисфункций при депрессиях. Медицинская психология в России. Электронный научный журнал. 2015;6(35).
9. Смулевич А.Б. Депрессии в общей медицине. Руководство для врачей. М.: Медицинское информационное агентство. 2001.
10. Канаева Л.С. Аффективные расстройства при неврологической патологии. Психическое здоровье. 2016;1(116):45-55.
11. Аведисова А.С. Подходы к оценке терапии психотропными препаратами. Психиатрия и психофармакотерапия. 2004;1:3-6.
12. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб.: Медицинское информационное агентство. 1995.
13. Borkowska A, Drozdz W, Ziolkowska-Kochan M, Rybakowski J. Enhancing effect of mirtazapine on cognitive functions associated with prefrontal cortex in patients with recurrent depression. Neuropsychopharmacologia Hungarica. 2007;IX/3:3:131-136.
14. Аведисова А.С., Спасова С.А. Влияние антидепрессантов на интеллектуально-мнестические функции как отражение их поведенческой токсичности. Социальная и клиническая психиатрия. 2000;2:30-34. heskaja psihiatrija. 2000;2:30-34. (In Russ.).
15. Путилина М.В. Современные представления о ноотропных препаратах. Лечащий врач: Журнал для практикующего врача. 2006;5:10-14.
16. Котова О.В. Ноотропные препараты в современной медицине. РМЖ. 2011;29.
17. Воронина Т.А., Середенин С.Б. Ноотропные препараты, достижения и новые проблемы. Экспериментальная и клиническая фармакология. 1998;61:4:3-9.
18. Медведев В.Э., Епифанов А.В. Терапия невротических, связанных со стрессом, и соматоформных расстройств у пациентов с гипертонической болезнью. Российский психиатрический журнал. 2011;1:55-61.
19. Канаева Л.С., Вазагаева Т.И., Ястребова В.В. Перспективы применения препарата Пнтогам актив у больных с астеническими расстройствами. Психиатрия и психофармакотерапия. 2010;11:8:34-39.
20. Смулевич А.Б., Волель Б.А., Терновая Е.С., Никитина Ю.М. Применение препарата пантогам актив D-, L-гопантеновая кислота) в терапии когнитивных и тревожных расстройств у пациентов с артериальной гипертензией. Журнал неврологии и психиатрии. 2015;12. doi: 10.17116/jnevro0201511511240-49
21. Баранов А.П., Струтынский А.В., Ойноткинова О.Ш., Баранова А.А., Тришина В.В., Голубев Ю.Ю., Кружалов А.Н. Возможности ноотропной терапии в лечении пациентов с хронической сердечной недостаточностью и тревожно-депрессивными расстойствами. РМЖ. Кардиология. 2016;9:572-578.

