Клинические исследования
СтатьиПредыдущий раздел | Оглавление | Следующий раздел
SOVRIAD® Клинические исследования
QUEST 1 и QUEST 2:
Оценка эффективности Sovriad® в тройной терапии ХГС 1-ого генотипа у пациентов, не получавших терапию ранее («наивных»)
Дизайн исследования: «наивные» пациенты
| QUEST-1 и QUEST-2 - «наивные» пациенты | ||
| Тип исследования | Сводные данные из исследований QUEST-1 и QUEST-2 . Рандомизированное, двойное слепое, Тип исследования плацебо контролируемое, проводимые в двух группах, мультицентровые исследования Фазы III | |
| Пациенты |
785 «наивных» пациентов с ХГС 1-ого генотипа с компенсированным заболеванием печени | |
| Дизайн | Sovriad® группа (n=521) 150 мг капсулы, один раз в день и ПР в течение 12 недель или 36 недель (в зависимости от уровня РНК ВГС на неделе 4 и недели 12) | Плацебо группа (n=264) Плацебо и ПР в течение 12 недель, затем ПР в течение 36-ти недель |
| Первичная конечная точка |
Доля пациентов, достигших УВО12 после запланированного окончания терапии | |
Результаты лечения
| Результаты лечения | Sovriad® Тройная терапия (n=521) % (n/N) | ПР (n=264) % (n/N) |
| Обобщенный УВО12 (G1a and G1b) | 80 (419/521)* | 50 (132/264) |
| Генотип 1a | 75 (191/254) | 47 (62/131) |
| Без Q80K | 84 (138/165) | 43 (36/83) |
| С Q80K | 58 (49/84) | 52 (23/44) |
| Генотип 1b | 85 (228/267) | 53 (70/133) |
| Результаты для всех пациентов без УВО12 | ||
| Неудача на терапии | 8 (42/521) | 33 (87/264) |
| Рецидив | 10 (47/470) | 15 (26/172) |
Sovriad® - увеличивает вероятность излечения большего числа пациентов
80% пациентов, ранее не получавших терапию, достигли УВО12 с Sovriad® по сравнению с 50% в группе двойной терапии с ПР
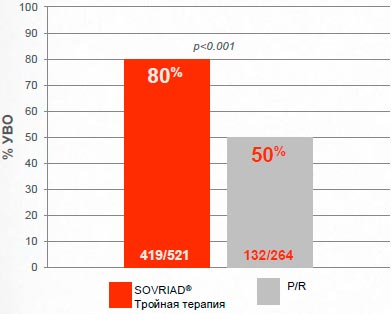
Сводные данные из QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
Sovriad® обеспечивает достижение БВО* с последующим УВО большему числу пациентов
78% пациентов, ранее не получавших терапию, достигали БВО на неделе 4 по сравнению с 12% в группе только на двойной терапии
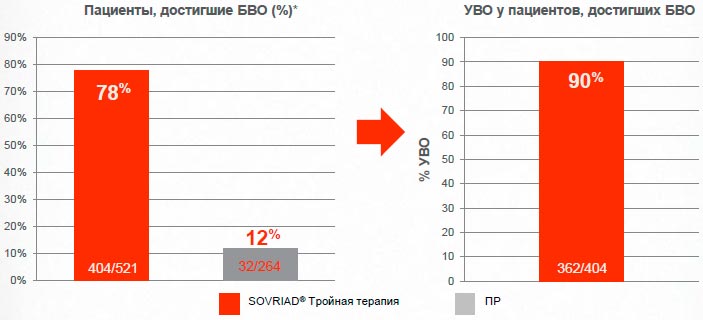
Сводные данные из QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
*БВО = быстрый вирусологический ответ, РНК ВГС <25 МЕ/мл не определяется на неделе 4.
Sovriad® обеспечивает достижение УВО большему числу пациентов даже в группах, трудно поддающихся лечению
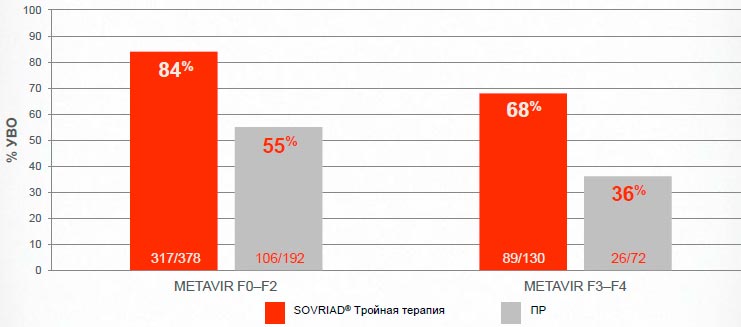
Сводные данные из QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
Sovriad® обеспечивает достижение УВО большему числу пациентов независимо от подтипа G1
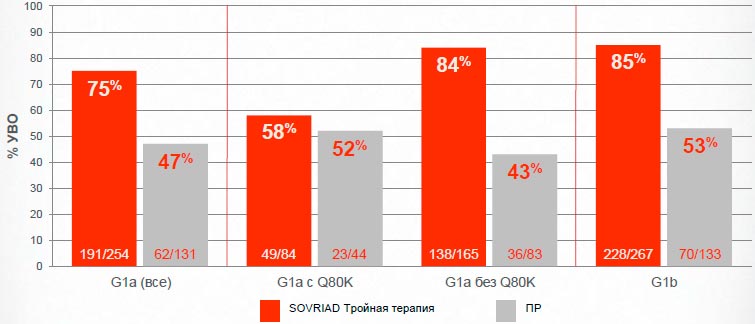
Сводные данные из QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
Европейская когорта: Sovriad® обеспечивает достижение УВО большему числу пациентов по сравнению с двойной терапией
В Европе 87% пациентов, не получавших ранее лечение, достигли УВО12 на терапии с Sovriad® по сравнению с 53% на двойной терапии
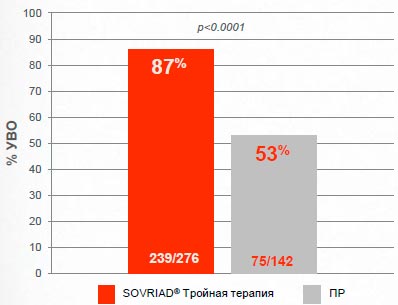
Сводные данные из QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
Европейская когорта: Sovriad® обеспечивает достижение целевых уровней РНК ВГС уже на 4-ой неделе лечения большему числу пациентов
91% пациентов, ранее не получавших терапию, достигли целевых значений уровня РНК ВГС ниже 25 МЕ/мл уже на 4-ой неделе терапии*
*Критерий «терапия по ответу» - уровень РНК ВГС <25 МЕ/мл определяемый/неопределяемый на неделе 4 и <25 МЕ/мл неопределяемый на неделе 12
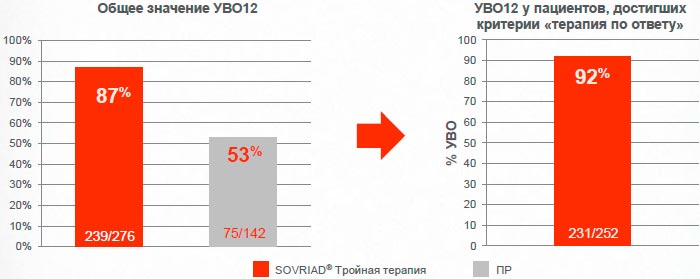
Сводные данные из QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
PROMISE:
Оценка эффективности Sovriad® в тройной терапии у взрослых пациентов с ХГС 1-ого генотипа с рецидивом в анамнезе
Дизайн исследования: рецидив в анамнезе
| PROMISE - пациенты с рецидивом в анамнезе | ||
|
Тип исследования |
Рандомизированное, двойное слепое, плацебо контролируемое, проводимые в двух группах, мультицентровое исследование Фазы III | |
| Пациенты |
393 пациента с ХГС 1-ого генотипа и компенсированным заболеванием печени с рецидивом в анамнезе после терапии пегилированным интерфероном и рибавирином (ПР). Рецидив -неопределяемая РНК ВГС на момент окончания предыдущего лечения и определяемый уровень РНГ ВГС в период последующего наблюдения | |
| Дизайн | Sovriad® группа (n=260) 150 мг капсулы, один раз в день и ПР в течение 12 недель или 36 недель (в зависимости от уровня РНК ВГС на неделе 4 и недели 12) | Плацебо группа (n=133) Плацебо и ПР в течение 12 недель, затем ПР в течение 36-ти недель |
| Первичная конечная точка |
Доля пациентов, достигших УВО12 после запланированного окончания терапии | |
Результаты исследования
| Результаты лечения | Sovriad® Тройная терапия (n=260) % | ПР (n=133) % |
| Обобщенный УВ012 (G1a и G1b) | 79 (206/260)* | 36 (48/133) |
| Генотип 1а | 70 (78/111) | 28(15/54) |
| Без Q80K | 78 (62/79) | 26 (9/34) |
| С Q80K | 47 (14/30) | 30 (6/20) |
| Генотип 1Ь | 86 (128/149) | 43 (34/79) |
| Результаты для всех пациентов без УВ012 | ||
| Неудача на терапии | 3 (8/260) | 27 (36/133) |
| Рецидив | 18(46/249) | 48 (45/93) |
Sovriad® обеспечивает достижение УВО большему числу пациентов с рецидивом в анамнезе
79% пациентов с рецидивом в анамнезе достигли УВО12 на тройной терапии с Sovriad® по сравнению с 36% пациентов в группе на двойной терапии с ПР
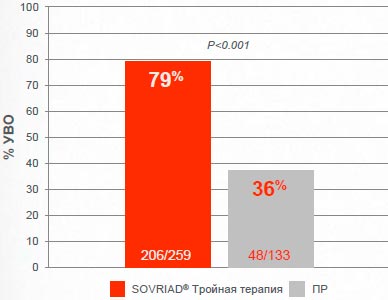
PROMISE исследование; Анализ в соответствии с назначенным лечением (ITT)
Sovriad® обеспечивает достижение БВО* с последующим УВО большему числу пациентов с рецидивом в анамнезе
77% пациентов с рецидивом в анамнезе достигли БВО по сравнению с 3% на двойной терапии
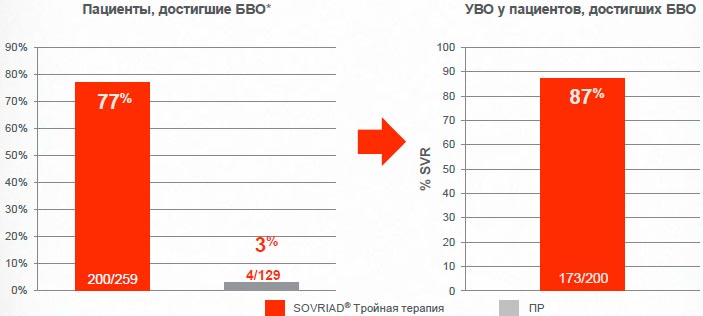
PROMISE исследование; Анализ в соответствии с назначенным лечением (ITT)
*БВО = быстрый вирусологический ответ, РНК ВГС <25 МЕ/мл не определяется на неделе 4.
Sovriad® обеспечивает достижение УВО большему числу пациентов с рецидивом в анамнезе даже в группах, трудно поддающихся лечению
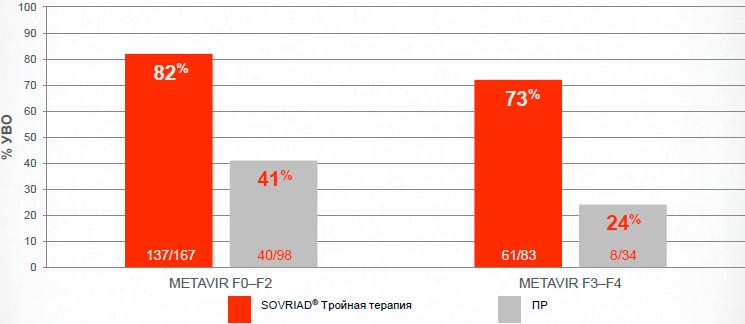
PROMISE исследование; Анализ в соответствии с назначенным лечением (ITT)
Sovriad® обеспечивает достижение УВО большему числу пациентов с рецидивом в анамнезе независимо от подтипа G1
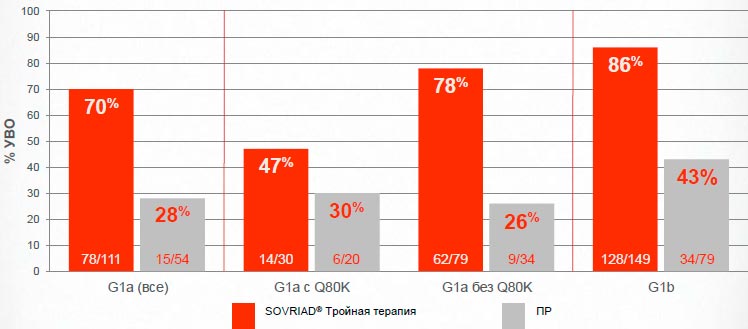
PROMISE исследование; Анализ в соответствии с назначенным лечением (ITT)
Исключены пациенты, по которым не было информации о полморфизме перед лечением
Европейская когорта: Sovriad® обеспечивает достижение УВО большему числу пациентов с рецидивом в анамнезе
В Европе, 88% пациентов с рецидивом в анамнезе достигли УВО12 на тройной терапии с Sovriad® по сравнению с 43% пациентов в группе на двойной терапии ПР
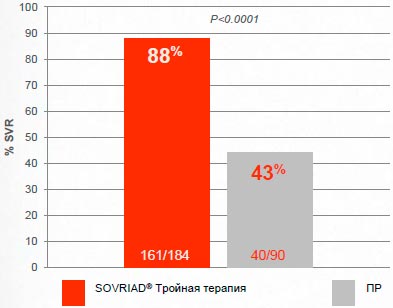
PROMISE исследование; Анализ в соответствии с назначенным лечением (ITT)
Европейская когорта: Sovriad® обеспечивает достижение целевых уровней РНК ВГС уже на 4-ой неделе лечения большему числу пациентов с рецидивом в анамнезе
94% пациентов с рецидивом в анамнезе достигли целевых уровней РНК ВГС ниже 25 МЕ/мл уже на 4-ой неделе терапии*
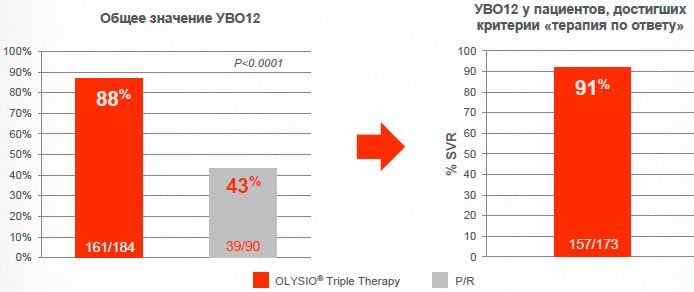
Pooled data from QUEST-1/-2; Анализ в соответствии с назначенным лечением (ITT)
* Критерий «терапия по ответу» - уровень РНК ВГС <25 МЕ/мл определяемый/неопределяемый на неделе 4 и <25 МЕ/мл неопределяемый на неделе 12
ASPIRE:
Оценка эффективности Sovriad® у взрослых пациентов с ХГС 1-ого генотипа с частичным или нулевым ответом в анамнезе
Дизайн исследования: частичный или нулевой ответ в анамнезе
| ASPIRE - рецидив, частичный/нулевой ответ в анамнезе | ||
|
Тип исследования |
Рандомизированное, двойное слепое, плацебо контролируемое, проводимые в семи группах, мультицентровое исследование Фазы II | |
| Пациенты |
462 пациента (с рецидивом, частичным или нулевым ответом в анамнезе) с ХГС 1-ого генотипа и компенсированным заболеванием печени | |
| Дизайн | Sovriad® группа (n=396) Одна капсула в день в течение 12, 24 или 48 недель (150 мг - рекомендуемая доза для Sovriad®) | Плацебо группа (n=66) Плацебо и ПР в течение 48 недель |
| Первичная конечная точка |
Доля пациентов, достигших УВО24 после запланированного окончания терапии | |
Sovriad® обеспечивает достижение УВО24 большему числу пациентов с частичным/нулевым ответом в анамнезе
65% (15/23) пациентов с частичным ответом в анамнезе и 35% (6/17) пациентов с нулевым ответом в анамнезе достигли БВО* на неделе 4 по сравнению с 0% у пациентов с нулевым или частичным ответом на двойной терапии
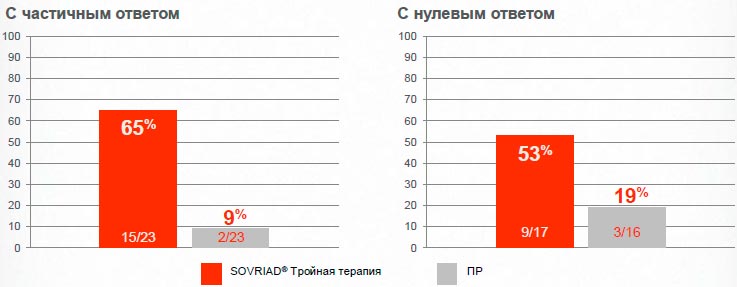
ASPIRE исследованиеI; Фаза IIb (сводная доза S0VRIAD®150 мг, 12 недель терапии)
* БВО = быстрый вирусологический ответ, РНК ВГС <25 МЕ/мл не определяется на неделе 4.
Sovriad® обеспечивает достижение УВО24 большему числу пациентов с частичным и нулевым ответом (METAVIR F3-4)
Sovriad® обеспечивает лучший прогноз для пациентов, которые нуждаются в этом больше всего
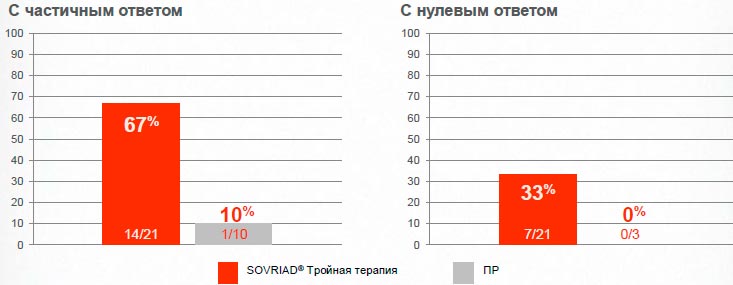
ASPIRE исследованиеI; Фаза IIb (сводная доза Sovriad®150 мг, 12 недель терапии)
Sovriad® обеспечивает достижение УВО24 большему числу пациентов с частичным ответом в анамнезе независимо от подтипа G1
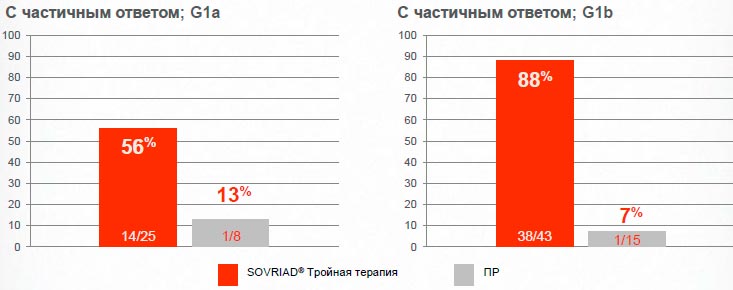
ASPIRE исследованиеI; Фаза IIb (сводная доза Sovriad®150 мг, 12 недель терапии)
В программе клинических исследований полиморфизм Q80K polymorphism наблюдался, в целом, у 6% пациентов 1-ого генотипа
Sovriad® обеспечивает достижение УВО24 большему числу пациентов с нулевым ответом в анамнезе независимо от подтипа G1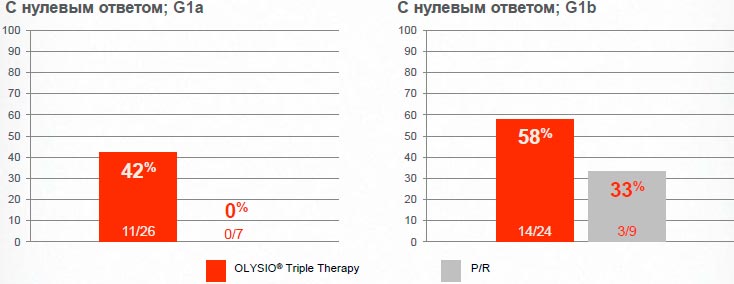
ASPIRE исследованиеI; Фаза IIb (сводная доза Sovriad®150 мг, 12 недель терапии)
В программе клинических исследований полиморфизм Q80K polymorphism наблюдался, в целом, у 6% пациентов 1-ого генотипа
ATTAIN:
Оценка эффективности Sovriad® у взрослых пациентов с ХГС 1-ого генотипа в сравнении с телапревиром
Дизайн исследования: Sovriad® в сравнении с ингибитором протеазы (ИП) первой волны
| ATTAIN- SOVRIAD® в сравнении с ИП первой волны | ||
| Тип исследования |
Рандомизированное, двойное слепое, double-dummy, проводимое в двух группах, мультицентровое исследование Фазы III по оценке эффективности Sovriad® + ПР в течение 12 недель с последующей терапией ПР в течение 36 недель в сравнении с телапревиром + ПР в течение 12 недель с последующей терапией ПР в течение 36 недель. Исследование состояло из периода скрининга (максимум 6 недель), периода терапии (48 недель) и периода после окончания терапии (до 72 недель, начиная от начала терапии). | |
| Пациенты |
Пациенты должны были пройти, по крайней мере, один задокументированный предыдущий курс терапии с ПЭГ-интерфероном а-2а или ПЭГ-интерфероном a-2b в комбинации с рибавирином (по меньшей мере 12 недель для пациентов с нулевым ответом и 20 недель для пациентов с частичным ответом) | |
| Дизайн | Sovriad® 150 мг капсулы, один раз в день и ПР в течение 12 недель с последующей терапией ПР в течение до 36 недель | Телапревир По 175 мг капсулы три раза в день и ПР в течение 12 недель с последующей терапией ПР в течение до 36 недель |
| Первичная конечная точка |
Доля пациентов, достигших УВО12 после запланированного окончания терапии | |
Sovriad® обеспечивает УВО, сопоставимый с телапревиром, как у пациентов с нулевым, так и с частичным ответом в анамнезе
Sovriad® обеспечивает лучший прогноз для пациентов, которые нуждаются в этом больше всего
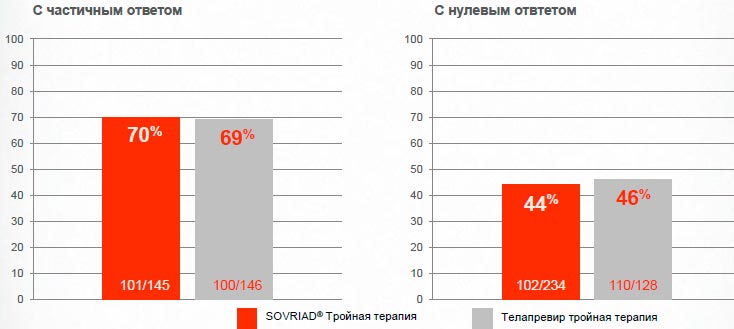
ATTAIN исследование
C212:
Дизайн исследования: ко-инфекция ВИЧ
|
C212 - ко-инфекция ВИЧ | ||
| Тип исследования |
Открытое, в одной группе исследование Фазы III | |
| Пациенты |
106 пациентов с ХГС 1-ого генотипа и с ВИЧ-инфекцией, которые не получали ранее терапию или с рецидивом, нулевым или частичным ответом на предшествующую терапию ПР, исключая пациентов с циррозом | |
| Дизайн | «Наивные» (n=53) / с рецидивом (n=15) 150 мг капсулы Sovriad® один раз в день и ПР в течение 12 недель с последующей терапией ПР в течение 24 или 48 недель согласно определенным протоколом критериям «терапия по ответу» | С частичным (n=10) / с нулевым ответом (n=28) 150 мг капсулы Sovriad® один раз в день и ПР в течение 12 недель с последующей терапией ПР в течение 48 недель согласно определенным протоколом критериям «терапия по ответу» |
| Первичная конечная точка |
Доля пациентов, достигших УВО12 после запланированного окончания терапии | |
Sovriad® демонстрирует высокую частоту излечения у пациентов с сопутствующей ВИЧ-инфекцией, включая пациентов с продвинутым фиброзом
Профиль безопасности Sovriad® сопоставим у пациентов с ХГС и пациентов с ХГС + ВИЧ
Менее 1% пациентов прекратили терапию из-за возникновения неблагоприятных явлений
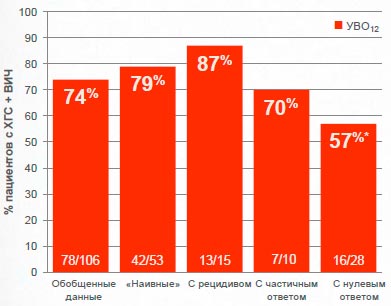
C212 исследование: Анализ в соответствии с назначенным лечением (ITT)
*P<0.001 ПР-только исторический контроль (УВО12 контроль: 29% «наивные» пациенты и 5.4% с нулевым ответом).
Предыдущий раздел | Оглавление | Следующий раздел
