ИЦК и автоматизированная система анестезии на основе дипривана
СтатьиОпубликовано в журнале:
Вестник интенсивной терапии »» N3 / 2000 В.В. Лихванцев, В.В. Субботин, А.В. Ситников, И.Ю. Васецкий, А.Н. Казанниковац
Институт хирургии им. А.В. Вишневского РАМН, Москва
Можно соглашаться или не соглашаться с учеными, предрекающими скорую и безусловную победу ТВА в их извечном споре со сторонниками ингаляционной анестезии, но нельзя не признать тот факт, что появление Дипривана придало ощутимый импульс развитию внутривенных методик. Если иметь ввиду последние, то, пожалуй, лишь изрядный скептик усомнится в медицинских преимуществах способов анестезии, основанных на использовании пропофола. В стремлении еще более усовершенствовать метод велик соблазн автоматизировать процесс управления анестезией, что немедленно и попытались сделать, используя идеологию TCI (Target Controlled Infusion) - "инфузии по целевой концентрации (ИЦК)".
ИЦК, применительно к анестезии, определяется как "инфузионная система, которая позволяет анестезиологу выбрать (задать) целевую концентрацию анестетика в крови, необходимую для достижения эффекта и затем контролировать глубину анестезии, изменяя ее (целевую концентрацию)" - т.н. "внутривенный испаритель" [6]. Важно подчеркнуть, что ИЦК не является замкнутой автоматизированной системой управления процессом анестезии. "Обратная связь", т.е. выработка суждения о реальной глубине анестезии и изменение "целевой концентрации" производится анестезиологом "вручную" по критериям, определяемым врачом.
Теория "инфузии по целевой концентрации" была предложена Kruger-Theimer Е. [9] в 1968 г., как минимум, за 18 лет до начала клинического применения пропофола. Используя фармакокинетические модели, автор разработал математический аппарат, позволяющий рассчитать скорость инфузии препарата для достижения его заданной концентрации в крови. Впервые продемонстрировал клинические возможности ИЦК для анестезии Schwilden Н. (1981), тогда как коммерческая модель "Диприфьюзора" - устройства для проведения ИЦК Диприваном, была создана на основе работ White М. & Kenny GNC (1990) и Mulder SM, Engberg FHM & Janssen CT (1995). Следует оговориться, однако, что данная модель, возможно, самая популярная, но далеко не единственная попытка автоматизировать процесс инфузии пропофола [7, 8, 13]. ИЦК уже апробирована и нашла горячих приверженцев и в нашей стране [1, 5]. Тем не менее, представляется, что метод только выиграл бы, если бы была найдена возможность ввести в систему обратную связь.
Ранее нами была доказана эффективность интраоперационного информационного анализа ЭЭГ для оценки глубины и адекватности общей анестезии [3, 10]. Попытка использовать указанный метод в качестве "обратной связи" и совместить его с преимуществами ИЦК и послужили причиной выполнения настоящей работы.
Общая характеристика больных и методы исследования
Исследование проведено у 134 больных (56 мужчин и 78 женщин) физического статуса ASA II-III, оперированных на органах брюшной полости (резекция желудка, холецистэктомия, реконструктивные операции на желчных путях). Средний возраст больных - 56+/-12 лет, продолжительность операции - 176+/-33 мин.
Все пациенты получали стандартную премедикацию: седативные препараты на ночь накануне операции и седуксен 10 мг + фентанил 100 мкг в/м за 0,5 ч до индукции.
Индукцию проводили последовательным внутривенным введением Дипривана (2,1+/-0,4 мг/кг), фентанила (5 мкг/кг) и Нимбекса (0,15 мг/кг). После интубации трахеи начинали ИВЛ кислородно-воздушной смесью (FiO2 - 40%) аппаратом ADU2/AS3 Datex-Ohmeda (Финляндия), релаксацию обеспечивали болюсным ведением Нимбекса (0,2 мг/кг*час).
В случайном порядке, определяемом каждый раз в день операции с помощью компьютера, больные в зависимости от метода поддержания анестезии попадали в одну из трех исследуемых групп:
1. ТВА на основе Дипривана и фентанила с инфузией гипнотика через инфузомат (Graseby 3500, Великобритания) - 43 человека;
2. ТВА на основе Дипривана и фентанила с инфузией гипнотика по целевой концентрации (ИЦК) с помощью инфузомата со встроенным Диприфьюзором (Graseby 3500 "Diprifusor", Великобритания) - 39 человек;
3. ТВА на основе Дипривана и фентанила с инфузией гипнотика по целевой концентрации (ИЦК) с помощью инфузомата со встроенным Диприфьюзором (Graseby 3500 "Diprifusor", Великобритания) - 52 человека;
При этом,
- в группе 1 скорость инфузии Дипривана выбирали в соответствии с разработками отделения анестезиологии Института хирургии им. А.В. Вишневского РАМН [4]. Оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики. Анестезиолог самостоятельно выбирал достаточную, по его мнению, скорость инфузии. Мониторинг информационной насыщенности ЭЭГ (ИнЭЭГ), в данной группе использовали только для ретроспективной оценки глубины и адекватности общей анестезии.
- в группе 2 инфузию Дипривана проводили в соответствии со следующим алгоритмом, приближенном к рекомендациям компании "AstraZeneca" [13, 14, 15]. Анестезиолог, если это не создавало значительных трудностей, не должен был нарушать нижний (3,5 мкг/мл) и верхний (5,3 мкг/мл) пределы целевых концентраций препарата. Оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики. Мониторинг информационной насыщенности ЭЭГ (ИнЭЭГ), в данной группе использовали только для ретроспективной оценки глубины и адекватности общей анестезии.
- в группе 3 целевую концентрацию Дипривана выбирали в соответствии с оценкой эффективности анестезии, о которой судили на основании мониторинга информационной насыщенности ЭЭГ (ИнЭЭГ).
Полученные данные обрабатывались методами вариационной статистики с помощью стандартного пакета программ Microsoft Exel.
Результаты и их обсуждение
Во второй исследуемой группе, в соответствии с заданным алгоритмом, целевая концентрация Дипривана (Кц) устанавливалась в диапазоне от 3,5 до 5,3 мкг/мл. Таким образом, скорость инфузии препарата составляла от 10,0 до 13,5 мг/кг*час, что составило, в итоге, 10,5+/-0,7 мг/кг*час. Избранная тактика привела
- к развитию явной (снижение АДс более чем на 20% от исходных значений) гипотонии у 47,6% пациентов. Учитывая ограничения на снижение скорости инфузии Дипривана, установленные выбранным протоколом у больных данной группы, коррекция гипотонии проводилась уменьшением доз фентанила, увеличением темпа инфузии и заменой кристаллоидных растворов на коллоиды, назначением адреномиметиков (мезатон - в следовых количествах). У трех больных (6,9%), тем не менее, пришлось уменьшить целевую концентрацию Дипривана ниже установленных границ.
- уменьшению ОПС на 27,6% (р<0,01) по отношению к исходному уровню, что объясняется, по-видимому, известным вазодилятирущим эффектом пропофола.
- снижению СИ (на 13,4% по отношению к исходу; р<0,05), за счет снижения УИ (на 17,4%, соответственно, р<0,05). Таким образом, помимо снижения ОПС, пропофол, в тех дозах, которые были использованы в данной группе, обладает, вероятно, и прямым угнетающим действием на сократимость миокарда, что характерно для подавляющего большинства известных общих анестетиков и гипнотиков.
В первой группе средняя скорость введения Дипривана составила 6,9+/-1,6 мг/кг*час, т.е. на 34,3% (р<0,05) меньше, чем рекомендуется для методики ИЦК. В данной группе не было зарегистрировано случаев стойкой гипотонии, а снижение СИ (на 9,7% по отношению к исходному уровню; р>0,05) было статистически недостоверно. ОПС снижалось на 11,7% (р<0,05), не выходя за пределы нормальных значений.
На основании комплексной оценки клинических признаков эффективности анестезии и динамики ИнЭЭГ, было зарегистрировано 5 непродолжительных эпизодов недостаточной защиты и только у 3 пациентов - случаи чрезмерного углубления анестезии.
В третьей группе изменение целевой концентрации дипривана контролировалось врачом на основании, в первую очередь, интраоперационной динамики ИнЭЭГ. В результате, средняя целевая концентрация Дипривана в группе составила Кц - 2,2 мкг/мл (что соответствовало скорости инфузии 6,3+/-2,2 мг/кг*час, существенно не отличающейся от показателя в первой группе). Это не удивительно, если учесть, что "разработки отделения" как раз и складывались на основании электрофизиологического мониторинга. Большая ошибка среднего по отношению к больным первой группы, по-видимому, объясняется индивидуальной чувствительностью к препарату, отслеживать которую позволяет анализ ИнЭЭГ.
На рис. 2 представлена автоматизированная наркозная карта больной Ф., которой выполнена холецистэктомия в условиях ИЦК с контролем глубины анестезии по величине ИнЭЭГ. Из представленного рисунка видно, что гладкое течение анестезии обеспечивается относительно редкими сменами целевой концентрации Дипривана. Становится очевидным, также, что скорость инфузии более 10 мг/кг*час необходима лишь на отдельных, наиболее травматичных, и, что очень важно, предсказуемых этапах операции, тогда как большую часть времени вполне достаточно обеспечить подачу Дипривана со скоростью 5-7 мг/кг*час (Кц - 1,9-2,7 мкг/мл). Понятно, что методика исключает возможность появления эпизодов как неоправданно глубокой, так и поверхностной анестезии, что называется, "по определению".
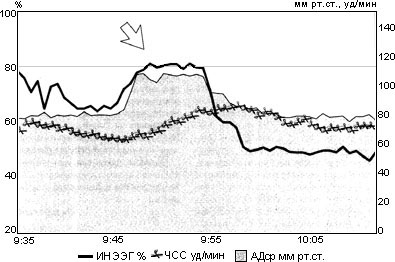
Рис. 1. Фрагмент автоматизированной наркозной карты больной Б.
Примечания: стрелкой обозначен эпизод неэффективной анестези
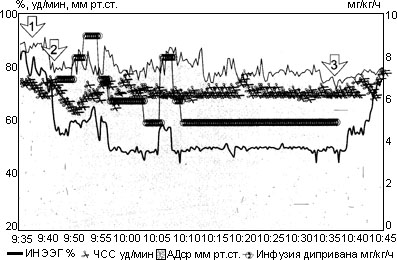
Рис. 2. Автоматизированная наркозная карта больной Ф.
Примечания: 1 стрелка - болюсное введение Дипривана; 2 стрелка - начало инфузии Дипривана; 3 стрелка - окончание инфузии Дипривана
При условии ревизии рекомендуемых доз 66,7% квалифицированных анестезиологов отделения отдали предпочтение ИЦК, что, в целом, совпадает с данными опросов, проводимых зарубежными коллегами. 33% врачей напрямую связали обнаруженные различия с преимуществами ИЦК, остальные затруднились с ответом (1 анестезиолог) или высказали мнение о большем удобстве в работе. Кстати, удобство в работе с готовыми к употреблению шприцами с Диприваном оценили все врачи и сестры-анестезистки отделения.
Возникает закономерный вопрос: "Можно ли полностью исключить участие врача в проведении анестезии, передоверив процесс компьютеру?" Отрицательный ответ очевиден и связан не только с возможными сбоями в работе системы обратной связи (кстати, несмотря на все программные ухищрения, достаточно чувствительной к помехам). Даже при относительно простых операциях, не требующих управления гемодинамикой, изменений режима ИВЛ и коррекции тактики инфузионно-трансфузионной терапии, остается еще немало проблем, решать которые в состоянии только врач. Кроме того, возможно, к счастью, медицина слишком консервативная специальность, чтобы анестезиолог чувствовал себя комфортно вдали от больного. Тем не менее, после нескольких месяцев работы никто уже не воспринимал монитор ИнЭЭГ, как "досадную помеху" в работе. Повышение безопасности анестезии, облегчение процесса принятия решения и большую уверенность и спокойствие отметили все анестезиологи.
Таким образом, мониторинг ИнЭЭГ в сочетании с инфузией Дипривана по целевой концентрации, названный авторами "автоматизированной системой анестезии", - достаточно эффективный метод проведения ТВА на основе Дипривана и фентанила.
При условии коррекции рекомендуемых доз ИЦК сама по себе обладает определенными преимуществами перед "дозированной инфузией" пропофола (то есть при введении пропофола при помощи дозирующего устройства без использования ИЦК). В противном случае, помимо риска чрезмерного углубления значительно возрастает и стоимость анестезии как в связи с повышенным расходом Дипривана, так и определяемая изменением тактики инфузионно-трансфузионной и медикаментозной терапии.
Кроме того, ИЦК - удобное подспорье любому анестезиологу (особенно начинающему) и существенная помощь слабооснащенным клиникам, т.к. стоимость диприфьюзора (как альтернативы испарителю при ингаляционной анестезии) куда как меньше стоимости современного наркозно-дыхательного аппарата. Чрезвычайно удобна и готовая к употреблению форма Дипривана в шприцах, которая в сочетании с диприфьюзором практически исключает возможность ошибки при подготовке и проведении анестезии.
Хочется надеяться, что широкое использование в клиниках автоматизированной системы ТВА на основе Дипривана и фентанила ждет нас в недалеком будущем.
Литература
1. А.А. Бунятян с соавт. Вестник интенсивной терапии, 1999, 1, 3.
2. В.В. Лихванцев. Автореф. докт. мед. наук, 1991, М, 34 с.
3. В.В. Лихванцев с соавт. Анестез. и реаниматол., 1996, 4, 46.
4. В.В. Лихванцев с соавт. Вестник интенсивной терапии. 1999, 1, 12.
5. Флеров Е.В. с соавт. Анестезиология и реаниматология, 2000, 2, 20.
6. Egan TD., In "Textbook of Intravenous Anesthesia", 1997, Baltimore, Williams & Wilkins, 517 p.
7. Glass P. el al., Anesthesiology, 1989, 71 (3А). A277.
8. Join U. et al, Anesthesiology, 1994, 81 (3А), А549.
9. Kruger-Theimer E. Eur. J. Pharm., 1968, 4, 3/7.
10. Likhvantsev W. et al. Br. J. Anaesth, 1998, 80 (Suppl), S1, 37.
11. Mulder SM, Engberg FHM. &Janssen CT. Anaesthesia, Br. J. Anaesth, 1995, 44 (Suppl. 1), 22.
12. Schwilden H. Eur. J. Pharm., 1981, 20, 379.
13. Schuttler J. el al., Anaesthesia, 1988, 43 (Suppl), 2.
14. Servin FS, Marchand-Maillet F, & Desmonts JM. Anaestesia, 1998, 53 (Suppl 1), 72.
15. Sminhoe CF et al. Anaestesia, 1998, 53 (Suppl 1), 61.
16. Struys M., Versichelen L., & Roily G. Anaestesia, 1998, 53 (Suppl 1), 68.
17. White М. & Kenny GNC. Anaesthesia. 1990, 45, 204.
