Гиалуроновая кислота при внутрисуставном введении: зависимость эффекта от молекулярной массы
СтатьиОпубликовано в журнале:
«РУССКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ»; ТОМ 5; 2021; стр. 1-6.
Ю.С. Филатова, В.Р. Гауэрт
ФГБОУ ВО ЯГМУ Минздрава России, Ярославль, Россия
Резюме
В статье обсуждается ведение пациентов с остеоартритом коленных суставов согласно алгоритмам ESCEO 2019 г. Акцент делается на втором этапе при персистенции симптомов остеоартрита. В статье уделяется внимание средствам на основе гиалуроновой кислоты (ГК) для внутрисуставного введения. Проведен анализ исследований, в которых доказан противовоспалительный механизм действия средств на основе ГК при внутрисуставном введении, а также приведены результаты исследований, в которых гистологические данные свидетельствуют о том, что ГК предотвращает деградацию хряща и может способствовать его регенерации. Данные этих исследований показывают, что повторные инъекции ГК не только эффективны, но и безопасны. В литературе имеются сведения о том, что на фоне лечения ГК увеличивается время до эндопротезирования, снижается необходимость в приеме нестероидных противовоспалительных препаратов и опиоидов. В статье обсуждается молекулярный вес ГК и приводятся данные исследований, подтверждающие наибольшую эффективность ГК со средним и высоким молекулярным весом.
Ключевые слова: остеоартрит, коленный сустав, гиалуроновая кислота, внутрисуставное введение.
Intra-articular hyaluronic acid: dependence of the effect on molecular weight
Yu.S. Filatova, V.R. Gawert
Yaroslavl State Medical University, Yaroslavl, Russian Federation
Abstract
The article discusses the patient management with knee osteoarthritis according to the ESCEO 2019 algorithm. The focus is on the second stage in the persistence of osteoarthritis signs. The article pays attention to the means based on hyaluronic acid for intra-articular injection. It also provides the study analysis that proved the anti-inflammatory mechanism of action of hyaluronic acid-based drugs during intraarticular administration, as well as the study results in which histology data indicated that hyaluronic acid prevents cartilage degradation and can promote its regeneration. These researches show that repeated injections of hyaluronic acid are not only effective, but also safe. In the literature, there is evidence that during treatment, the time to endoprosthesis increases, as well as the need for taking NSAIDs and opioids decreases. The article discusses the molecular weight of hyaluronic acid, providing research data confirming the greatest efficacy of hyaluronic acid with medium and high molecular weight.
Keywords: osteoarthritis, knee joints, hyaluronic acid, intraarticular injection.
Введение
Остеоартрит (ОА) — заболевание суставов, основными звеньями патогенеза которого являются клеточный стресс и деградация внеклеточного матрикса. Они возникают в результате макро- или микроповреждений, активирующих патологические адаптивные восстановительные реакции, в т. ч. провоспалительные пути иммунной системы [1]. По оценкам Федеральной службы государственной статистики РФ за 2019 г., болезни костно-мышечной системы занимают значимое место в структуре инвалидности наравне с сердечно-сосудистыми и онкологическими заболеваниями. Не последнюю роль среди этих болезней играет ОА [2]. В настоящее время распространенность заболевания неуклонно растет. На ОА приходится 36 млн амбулаторных приемов и 750 тыс. госпитализаций в год. В развитых странах экономические затраты на ОА составляют 1,5-2% ВВП в год [3]. Клинические проявления и прогрессирование ОА не представляют угрозы для жизни больных, но боль, которая является постоянным симптомом заболевания, и ограничение функции суставов приводят к выраженному ухудшению качества жизни, развитию временной и стойкой нетрудоспособности. На фоне этого происходит прогрессирование сопутствующих заболеваний, что приводит к повышению риска общей смертности. В 2016 г. Международное общество по изучению остеоартрита (Osteoarthritis Research Society International, OARSI) совместно с Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) признали ОА серьезным заболеванием [4]. В России распространенность ОА тоже высока и достигает 13%. По данным Минздрава России, за 5 лет (2011-2016 гг.) отмечено увеличение заболеваемости ОА с 32,3 до 35,7 на 1000 населения. В последние годы в процессе изучения ОА существенно изменились представления о его патогенезе. В настоящее время ОА рассматривается не как дегенеративное, а как воспалительное заболевание. Разнообразие и различная степень выраженности отдельных звеньев патогенеза привели к выделению нескольких фенотипов ОА. Изменение понимания патогенеза заболевания меняет и подходы к терапии с акцентом на персонализированное лечение.
Рекомендации по ведению пациентов с ОА
В настоящее время терапия ОА регламентируется документами, которые разработаны профессиональными сообществами. ESCEO (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, Европейское общество по клиническим и экономическим аспектам остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата) были разработаны рекомендации, которые определяют последовательный выбор лечебных мероприятий для пациентов с ОА коленных суставов. Они были представлены в 2014 г. [5], а в 2016 г. дополнены [6]. В 2019 г. опубликованы новые рекомендации, в которых учтены последние доказательства безопасности и эффективности препаратов, в настоящее время использующихся для лечения ОА [7]. В разработанной схеме рекомендуется пошаговое назначение терапии (рис. 1).
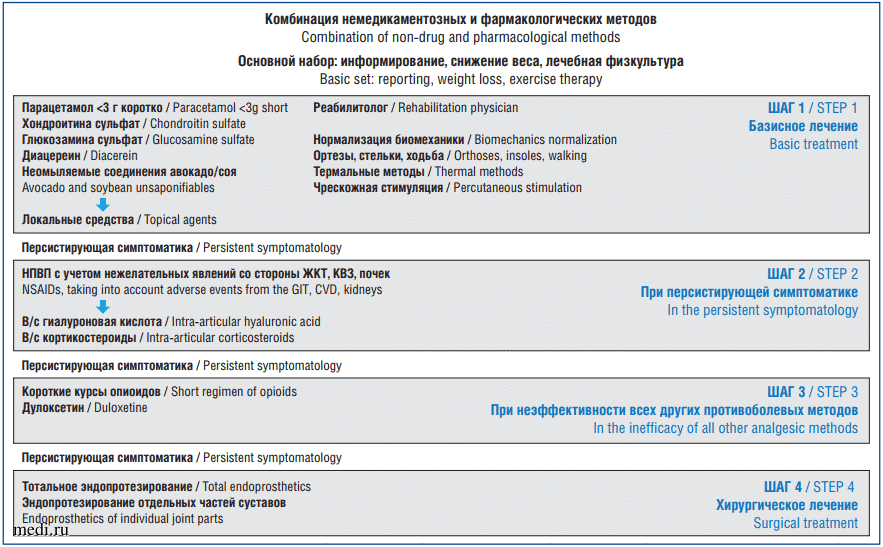 Рис. 1. Алгоритмы рекомендаций ESCEO для лечения ОА коленных суставов, 2019 г.
Рис. 1. Алгоритмы рекомендаций ESCEO для лечения ОА коленных суставов, 2019 г.Fig. 1. ESCEO algorithm recommendations for the treatment of knee joint OA, 2019.
При персистенции симптомов ОА показано назначение гиалуроновой кислоты (ГК) как в виде монотерапии, так и в сочетании с препаратами других групп. Рассмотрим более подробно эффекты ГК.
Противовоспалительные и регенерирующие механизмы действия ГК
Физиологическая роль ГК хорошо описана многими исследователями [8-10]. В целом ГК может участвовать в различных клеточных процессах (дифференцировка клеток, пролиферация и т. д.) и выполнять физиологические функции (смазка, гидратационный баланс) [9, 10]. ГК обладает уникальными реологическими свойствами и является составной частью суставного хряща, хорошо изучена важная роль ГК в функционировании суставов, причем не только здоровых, но и суставов с ОА [11], а также других тканей организма [12]. Изучая фармакологическое действие ГК, Е. Maheu [13], G.M. Campo [14] и J. Jerosch. [15] в своих исследованиях доказали, что ГК снижает активность провос палительных медиаторов, продуцирующих нейропептиды, высвобождаемые активированными синовиальными клетками. Также авторы описали взаимодействие ГК с болевыми рецепторами и ее анальгетические свойства.
L.W. Moreland [10] в своем исследовании отметил, что ГК может снижать механочувствительность болевых рецепторов. ГК также может уменьшить боль при ОА за счет снижения синтеза простагландина E2 и брадикинина.
При ОА синовит играет важную роль в индуцировании боли, отека и скованности при ОА [16], а тяжесть синовита коррелирует с высоким риском прогрессирования ОА коленных суставов [17]. Было проведено исследование, в котором было показано, что ГК ингибирует активность матриксных металлопротеиназ и аггреканаз, которые, по крайней мере частично, участвуют в деградации хряща ОА в результате их индукции провоспалительными цитокинами, такими как интерлейкин-1 (ИЛ-1) [18]. Поэтому предполагается, что ГК модифицирует структурное повреждение суставов и скорость прогрессирования ОА в дополнение к симптом-модифицирующему эффекту [19].
Что касается репаративной функции ГК, то J.L. Cook et al. [20] предположили, что внутрисуставное введение ГК оказывает прямое влияние на хондроциты или синовиоциты и продукцию трансформирующего фактора роста (Transforming growth factor beta, TGF-p), основного фибробластного фактора роста (Fibroblast growth factors, FGF) и инсулиноподобного фактора роста (Insulin-like growth factor, IGF). Гистологические данные подтвердили, что ГК предотвращает деградацию хряща и может способствовать его регенерации. Другими авторами [14] также представлены доказательства того, что лечение ГК смягчает гипертрофию синовиальной оболочки и увеличивает количество синовиальных фибробластоподобных клеток при одновременном уменьшении количества макрофагов, лимфоцитов, тучных клеток и адипоцитов. ГК, согласно их мнению, обеспечивает защиту хряща путем подавления продукции провоспалительных цитокинов, свободных радикалов и протеолитических ферментов в синовиальной жидкости.
В большом количестве клинических исследований было обнаружено, что ГК снижает прогрессирование ОА. ГК является медленно действующим препаратом, который может быть использован профилактически или терапевтически в качестве противовоспалительного симптом-модифицирующего препарата [20, 21].
В нескольких клинических исследованиях было обнаружено, что внутрисуставные инъекции ГК замедляют сужение суставного пространства на рентгеновских снимках и останавливают прогрессирование дегенерации хряща при последующей артроскопии [22, 23].
Препараты с различной молекулярной массой ГК
В литературе обсуждается эффективность препаратов ГК с различной молекулярной массой. Еще 20 лет назад K.D. Brandt et al. проанализировали эффективность 3 еженедельных инъекций ГК со средней и низкой молекулярной массой у пациентов с ОА. Через 6 мес. ГК со средней молекулярной массой обеспечивала более существенное уменьшение боли по шкале WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index, Индекс остеоартрита университетов Западного Онтарио и Макмастера), чем низкомолекулярная ГК (на 22,9±1,4 мм и 18,4±1,5 мм соответственно; p=0,021). Также в группе, где использовалась ГК со средней молекулярной массой, отмечалось значительно больше пациентов, ответивших на терапию по критериям OARSI/OMERACT (Outcome Measures in Rheumatoid Arthritis Clinical Trials, оценка исходов ревматоидного артрита в клинических исследованиях), по сравнению с группой, получавшей низкомолекулярную ГК (соответственно 73% и 58%, p=0,001) [24]. В дальнейшем данные этого исследования были неоднократно подтверждены [25, 26].
В рандомизированном двойном слепом контролируемом исследовании более чем 400 пациентам с ОА коленного сустава проводили 3-недельные внутрисуставные инъекции ГК с промежуточной молекулярной массой (800-1500 кДа) и более низкой молекулярной массой (500-730 кДа). Эти инъекции уменьшали умеренную или сильную боль через 6 мес. до 50% от исходных значений. Функция суставов улучшилась в той же степени, и в среднем более 65% пациентов ответили на лечение. При этом авторы отмечают, что лечение ГК со средней молекулярной массой может быть более эффективно, чем лечение ГК с низкой молекулярной массой, в отношении симптомов ОА коленного сустава в течение 6 мес. при аналогичной безопасности [27].
В настоящее время существует множество препаратов ГК, которые отличаются технологией производства и молекулярной массой. Препараты ГК с молекулярной массой 500-800 кДа чаще всего животного происхождения, в то время как при производстве препаратов с более высокой молекулярной массой используется метод бактериальной ферментации или синтеза, что позволяет избежать негативных последствий. Так, в исследовании R.D. Altman было продемонстрировано, что препараты с низкой молекулярной массой животного происхождения чаще вызывают нежелательные явления, такие как аллергическая реакция и реактивный синовит, в то время как препараты ГК, прошедшие бактериальную ферментацию, показали хорошую эффективность и высокую безопасность [28].
В исследовании А. Asari et al. [29] было продемонстрировано, что ГК с молекулярной массой 800 кДа слабо защищала от потери хряща, однако использование ГК с молекулярной массой 1900 кДа оказывало выраженное хондропротективное действие. ГК со средней молекулярной массой (около 2000 кДа) проникает в поврежденные ткани гораздо эффективнее, чем высокомолекулярная ГК.
Уникальные вязкоупругие свойства ГК придают синовиальной жидкости амортизирующие и смазывающие свойства. ГК ограничивает вход больших белков плазмы и клеток в синовиальную жидкость, но облегчает обменные процессы между синовиальными капиллярами и хрящом и другими тканями сустава. Кроме того, ГК может образовывать перицеллюлярную оболочку вокруг клеток, взаимодействовать с провоспалительными медиаторами и связываться с клеточными рецепторами, такими как CD44 и RHAMM (receptor for hyaluronate-mediated motility — рецептор для опосредованной гиалуронатом подвижности), где он модулирует клеточную пролиферацию, миграцию и экспрессию генов. Показано, что все эти физико-химические и биологические свойства ГК зависят от ее молекулярной массы. Экспериментальные данные свидетельствуют о том, что связывание ГК с клеточными рецепторами зависит от ее молекулярного размера. ГК с низкой молекулярной массой часто вызывает противоположный клеточный ответ по сравнению с ГК высокой и средней молекулярной массы. Исследования на животных моделях ОА показали, что ГК со средней молекулярной массой в целом более эффективна в снижении показателей синовиального воспаления и восстановлении реологических свойств синовиальной жидкости (вязкоиндукции), чем ГК с высокой (более 3 мДа) молекулярной массой [30].
В исследовании Е. Maneiro et al. из хряща, полученного при эндопротезировании суставов у пациентов с ОА, выделяли хондроциты, которые культивировали в течение 24 ч для обнаружения простагландина Е2 и в течение 48 ч для измерения оксида азота (NO). После этого их инкубировали с ГК и стимулировали ИЛ-1 в концентрации 5 нг/мл. В исследовании использовали два препарата ГК: с молекулярной массой 500-730 кДа и более 6000 кДа. В результате препарат с молекулярной массой 500-730 кДа снижал синтез как ИЛ-1-индуцированного NO, так и простагландина E2 на 70% и 45% соответственно, в отличие от ГК 6000 кДа, при применении которой не было продемонстрировано подобных результатов [31].
Как низкомолекулярные, так и среднемолекулярные гиалуронаты обладают значительной эффективностью в лечении пациентов с ОА коленного сустава, о чем свидетельствуют результаты исследования среди пациентов в Японии [32].
В недавнем исследовании (2021 г.) оценивали влияние внутрисуставного введения ГК на гистопатологические характеристики хряща и диска височно-нижнечелюстного сустава, индуцированного ОА у кроликов. Было продемонстрировано восстановление хряща и суставного диска через 30 дней, при этом препараты со средней молекулярной массой оказывали лучшее воздействие на суставную ткань, чем препараты с высокой молекулярной массой. Однако через 135 дней в обеих группах наблюдался регресс восстановления суставной ткани, что подтверждает необходимость регулярных курсов терапии для сохранения полученного эффекта [33].
При изучении механизмов анальгетического эффекта при внутрисуставном введении ГК в исследовании S. Gotoh было обнаружено, что ГК с молекулярной массой 2-2,5 мДа оказывала более сильное и длительное анальгетическое действие, чем препараты ГК с более высокой молекулярной массой [34].
Таким образом, важно учитывать молекулярную массу ГК при назначении препаратов для лечения ОА. Согласно вышеизложенным данным применение Ферматрона 1% и Ферматрона плюс с молекулярной массой ГК 1,9 мДа и 2-2,5 мДа соответственно максимально соответствует основной концепции терапии ОА — безопасности и эффективности. Их использование при внутрисуставном введении способствует снижению болевого синдрома с минимальным риском нежелательных явлений.
В большом количестве клинических испытаний было установлено, что ГК безопасна и хорошо переносится пациентами с ОА при внутрисуставном введении [35, 36].
Во многих рандомизированных клинических исследованиях и метаанализах на сегодняшний день доказано превосходство использования ГК при ОА коленных суставов над плацебо и НПВП [37]. Часть экспертов считают, что внутрисуставное введение ГК имеет более благоприятный профиль безопасности, чем прием НПВП [38]. Назначение ГК может стать хорошей альтернативой последним при лечении ОА. Особое внимание следует уделить назначению препаратов ГК пожилым пациентам и пациентам с высокой коморбидностью. Препараты ГК не только способствуют снижению интенсивности болевого синдрома при ОА, но и улучшают функцию суставов, при этом длительность эффекта может сохраняться до 6 мес. [39-41]. Эффективность и безопасность внутрисуставного введения ГК были продемонстрированы на практике [42].
Длительность применения ГК и отдаленные результаты
В последнее время часто обсуждаются вопросы длительности применения ГК. A. Concoff et al. [43] показали преимущества повторных курсов применения ГК. В метаанализе 30 исследований авторами было продемонстрировано значительное достоверное преимущество повторных курсов (2-4 курса) в группах пациентов, которым внутрисуставно вводили ГК, в сравнении с группами получающих плацебо. Аналогичные данные получены в систематическом анализе R. Altman, выполненном в 2018 г. [44]. Исследователи также отметили, что повторные внутрисуставные инъекции ГК являются эффективными и безопасными. В литературе приводятся данные о том, что лечение препаратами ГК способствует увеличению времени до эндопротезирования, снижает потребность в приеме НПВП и опиоидов. Отдаленные результаты влияния терапии ГК (необходимость эндопротезирования) были изучены при ретроспективном анализе базы данных пациентов, которые подверглись эндопротезированию с 2007 г. по 2011 г., 7000 из них получали ГК и 19 627 не получали этот препарат. В исследовании было доказано, что каждый последующий курс инъекций ГК увеличивал время до проведения эндопротезирования. После 4 или более курсов внутрисуставного введения ГК необходимость в эндопротезировании отодвигалась приблизительно на 2,2 года [45]. Эти данные свидетельствуют о позитивном влиянии терапии ГК на прогрессирование ОА коленных суставов.
Опыт применения ГК В российской практике
На российском фармацевтическом рынке доступно средство, замещающее синовиальную жидкость, — Ферматрон на основе гиалуроната натрия. Он изготавливается путем бактериальной ферментации, стерилизация производится по методу микромембранной фильтрации с сохранением максимальной нативности препарата, рН-ста билизация проводится фосфатным буферным раствором, идентичным человеческому, и поддерживает рН 7,4. Имеет оптимальный молекулярный вес ГК — 1,1-2,2 млн Да. Весь цикл производства — от синтеза действующего вещества до упаковки — проходит на заводе-изготовителе в Великобритании. На каждом этапе производства осуществляется строгий контроль качества.
А.С. Михайловой и соавт. было проведено сравнительное исследование эффективности и безопасности средств ГК с высокой и средней молекулярной массой (Ферматрон). Результаты исследования показали устойчивое купирование обеих составляющих болевого синдрома (боли покоя и движения) в группе, получавшей ГК, что свидетельствует о преимуществе данного средства в оказании противоболевого действия [46].
Е.А. Беляевой и О.С. Авдеевой было проведено ретроспективное исследование с целью изучения влияния вискосапплементарной терапии средством на основе ГК Ферматрон на потребность в эндопротезировании коленных суставов у 766 пациентов с ОА. Было показано, что различия в потребности в эндопротезировании после 1 и 3 курсов терапии достоверны во всех возрастных группах (p<0,05). Эти различия обусловлены снижением интенсивности боли и расширением объема движений в целевом суставе у пациентов, которым проводилось внутрисуставное введение ГК [47].
Существует немало споров по поводу параартикулярного введения ГК. При изучении параартикулярного введения Ферматрона при ОА коленных суставов была доказана его эффективность. Так, в исследовании В.П. Попова и соавт. отмечался значимый положительный эффект при данном способе введения ГК, который проявлялся в уменьшении или полном купировании боли в коленных суставах и значительном улучшении функции сустава. Полученные результаты сохранялись в течение длительного времени — в среднем 6,8±1,4 мес. Авторы исследования считают, что эффективность внутрисуставного введения и эффективность параартикулярного введения сопоставимы. Таким образом, параартикулярное введение средств на основе ГК может стать хорошей альтернативой при лечении ОА коленных суставов, поскольку такой способ введения удобен и достаточно безопасен [48].
Заключение
ОА является социально значимым заболеванием, его распространенность неуклонно растет. Прогрессирование заболевания приводит к ухудшению качества жизни, развитию нетрудоспособности и повышению риска общей смертности за счет прогрессирования сопутствующих заболеваний. Поэтапное ведение пациентов с ОА коленных суставов, согласно рекомендациям ESCEO 2019 г., позволит уменьшить выраженность боли и замедлить прогрессирование заболевания у пациентов. Особое внимание в практике необходимо уделить средствам ГК, которые с годами доказали свою эффективность и безопасность в долгосрочной перспективе, они способны оказывать влияние на процесс регенерации хряща и замедлять прогрессирование ОА коленных суставов. При выборе ГК-содержащего средства следует обращать внимание на молекулярную массу и технологию производства.
Благодарность
Редакция благодарит компанию «Система Плюс» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgement
Editorial Board is grateful to Sistema Plus JSC for the assistance in technical edition of this publication.
Сведения об авторах:
Филатова Юлия Сергеевна — к.м.н., доцент кафедры терапии им. Е.Н. Дормидонтова Института последипломного образования ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5;
Гауэрт Вероника Рудольфовна — к.м.н., ассистент кафедры терапии им. Е.Н. Дормидонтова Института последипломного образования ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5;
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует.
About the authors
Yulia S. Filatova — Cand. of Sci. (Med), Associate Professor of the Department of Therapy named after E.N. Dormidontov, Institute of Postgraduate Education, Yaroslavl State Medical University; 5, Revolyutsionnaya str., Yaroslavl, 150000, Russian Federation; ORCID iD 0000-0003-3024-9483.
Veronika R. Gawert — Cand. of Sci. (Med), Assistant Professor of the Department of Therapy named after E.N. Dormidontov, Institute of Postgraduate Education, Yaroslavl State Medical University; 5, Revolyutsionnaya str., Yaroslavl, 150000, Russian Federation;
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interest. Received 19.03.2021, revised 07.04.2021, accepted 22.04.2021.
Литература/References
1. Du Souich P. Absorption, distribution and mechanism of action of SYSADOAS. Pharmacol Ther. 2014;142(3):362-374.
2. Мартынов А.И., Наумов A.B., Верткин А.Л. и др. Ведение больных с остеоартритом и коморбидностью в общей врачебной практике: мнение экспертов, основанное на доказательной медицине. Лечащий врач. 2015;04:39-46. [Martynov A.I., Naumov A.V., Vertkin A.L. et al. Management of patients with osteoarthritis and comorbidity in general medical practice: expert opinion based on evidence-based medicine. Lechashchiy vrach. 2015;04:39-46 (in Russ.)].
3. Hiligsmann M., Cooper C., Arden N. et al. Health economics in the field of osteoarthritis: an expert’s consensus paper from the European Society for Clinical and Economic Aspects of Osteoroporis and Osteoarthritis (ESCEO). Semin Arthritis Rheum. 2013;43(3):303-313.
4. March L., Cross M., Lo C. et al. Osteoarthritis: A Serious Disease. Osteoarthritis Research Society International; 2016.
5. Bruyere O., Cooper C., Pelletier J.P. et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin Arthritis Rheum. 2014;44(3):253-263.
6. Bruyere O., Cooper C., Pelletier J.P. et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis-From evidence-based medicine to the real-life setting. Semin Arthritis Rheum. 2016;45(4 Suppl): S3-11.
7. Bruyere O., Honvo G., Veronese N. et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum. 2019;49(3):337-350.
8. Chernos M., Grecov D., Kwok E. et al. Rheological study of hyaluronic acid derivatives. Biomed Eng Lett. 2017;7:17-24.
9. Migliore А., Procopio S. Effectiveness and utility of hyaluronic acid in osteoarthritis. Clin Cases Miner Bone Metab. 2015;12:31-33.
10. Moreland L.W. Intra-articular hyaluronan. (hyaluronic acid) and hyalans for the treatment of osteoarthritis: mechanism of action. Arthr Res Ther. 2003;5:54-67.
11. Bannuru R.R., Natov N.S., Dasi U.R. et al. Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis-meta-analysis. Osteoarthr Cartil. 2011;19(6):611-619.
12. Liang J., Jiang D., Noble P.W. Hyaluronan as a therapeutic target in human diseases. Adv Drug Deliv Rev. 2016;97:186-203.
13. Maheu E., Rannou F., Reginster J.Y. Efficacy and safety of hyaluronic acid in the management of osteoarthritis: evidence from real-life setting trials and surveys. Semin Arthritis Rheum. 2016;45(4 Suppl): S28-S33.
14. Campo G.M., Avenoso A., Campo S. et al. Differential effect of molecular mass hyaluronan on lipopolysaccharide-induced damage in chondrocytes. Innate Immun. 2010;16:48-63.
15. Jerosch J. Effects of glucosamine and chondroitin sulfate on cartilage metabolism in OA: outlook on other nutrient partners especially omega-3 fatty acids. Int J Rheumatol. 2011;2011:1-17. DOI: 10.1155/2011/969012.
16. Cooper C., Rannou F., Richette P. et al. Use of intraarticular hyaluronic acid in the Management of Knee Osteoarthritis in clinical practice. Arthritis Care Res (Hoboken). 2017;69(9):1287-1296.
17. Liu L., Ishijima M., Futami I. et al. Correlation between synovitis detected on enhanced-magnetic resonance imaging and a histological analysis with a patient-oriented outcome measure for Japanese patients with end-stage knee osteoarthritis receiving joint replacement surgery. Clin Rheumatol. 2010;16:1185-1190.
18. Julovi S.M., Ito H., Nishitani K. et al. Hyaluronan inhibits matrix metalloproteinase-13 in human arthritic chondrocytes via CD44 and P38. J Orthop Res. 2011;16:258-264.
19. Goldberg V.M., Goldberg L. Intra-articular hyaluronans: the treatment of knee pain in osteoarthritis. J Pain Res. 2010;3:51-56.
20. Cook J.L., Hung C.T., Kuroki K. et al. Animal models of cartilage repair. Bone Joint Res. 2014;3(4):89-94.
21. Carapeba G.O.L., Cavaleti P., Nicacio G.M. et al. Intra-articular hyaluronic acid compared to traditional conservative treatment in dogs with osteoarthritis associated with hip dysplasia. Evid-Based Compl Altern Med. 2016;2016:20726921.
22. Petrella R.J., Wakeford C. Pain relief and improved physical function in knee osteoarthritis patients receiving ongoing hylan G-F 20, a high-molecular-weight hyaluronan, versus other treatment options: data from a large real-world longitudinal cohort in Canada. Drug Des Devel Ther. 2015;9:5633-5640.
23. Jubb R.W., Piva S., Beinat L. et al. A one-year, randomized placebo. (saline). controlled clinical trial of 500-730 kDa sodium hyaluronate. (Hyalgan). on the radiological change in osteoarthritis of the knee. Int J Clin Pract. 2003;57:467-474. PMID: 12918884.
24. Brandt K.D. Efficacy and safety of intraarticular sodium hyaluronate in knee osteoarthritis. ORTHOVISC Study Group. Clin Orthop Relat Res. 2001;(385):130-143.
25. Hatoum H.T., Fierlinger A.L., Lin S.J., Altman R.D. Cost-effectiveness analysis of intra-articular injections of a high molecular weight bioengineered hyaluronic acid for the treatment of osteoarthritis knee pain. J Med Econ. 2014;17(5):326-337.
26. Navarro-Sarabia F., Coronel P., Collantes E. et al. AMELIA study group. A 40-month multicentre, randomised placebo-controlled study to assess the efficacy and carry-over effect of repeated intra-articular injections of hyaluronic acid in knee osteoarthritis: the AMELIA project. Ann Rheum Dis. 2011;70(11):1957-1962.
27. Berenbaum F., Grifka J., Cazzaniga S. et al. A randomized, double-blind, controlled trial comparing two intra-articular hyaluronic acid preparations differing by their molecular weight in symptomatic knee osteoarthritis. Ann Rheum Dis. 2012;71:1454-1460.
28. Altman R.D., Bedi A., Karlsson J. et al. Product Differences in Intraarticular Hyaluronic Acids for Osteoarthritis of the Knee. Am J Sports Med. 2016;44(8):2158-2165.
29. Asari A., Miyauchi S., Matsuzaka S., et al. Molecular weightdependent effects of hyaluronate on the arthritic synovium. Arch Hislol Cytol. 1998:61:125-135.
30. Ghosh P., Guidolin D. Potential mechanism of action of intra-articular hyaluronan therapy in osteoarthritis: are the effects molecular weight dependent? Semin Arthritis Rheum. 2002;32(1):10-37.
31. Maneiro E., de Andres M.C., Fernandez-Sueiro J.L. et al. The biological action of hyaluronan on human osteoartritic articular chondrocytes: the importance of molecular weight. Clin Exp Rheumatol. 2004;22(3):307-312.
32. Mochizuki T., Ikari K., Yano K., Okazaki K. Comparison of patient-reported outcomes of treatment with low- and intermediate molecular weight hyaluronic acid in Japanese patients with symptomatic knee osteoarthritis: A prospective, randomized, single-blind trial. Asia-Pacific journal of sports medicine, arthroscopy, rehabilitation and technology. 2020;21:22-26.
33. Iturriaga V., Vasquez B., Bornhardt T., Del Sol M. Effects of low and high molecular weight hyaluronic acid on the osteoarthritic temporomandibular joint in rabbit. Clin Oral Investig. 2021 Jan 3.
34. Gotoh S., Onaya J., Abe M. et al. Effects of the molecular weight of hyaluronic acid and its action mechanisms on experimental joint pain in rats. Ann Rheurn Dis. 1993;52:817-822.
35. Bowman S., Awad M.E., Hamrick M.W. et al. Recent advances in hyaluronic acid based therapy for osteoarthritis. Clin Trans Med. 2018;7:6.
36. Richette P. Hyaluronic acid: Still useful in knee osteoarthritis? Joint Bone Spine. 2017;84(6):655-656.
37. Hermans J., Reijman M., Goossens L.M. et al. A cost utility analysis of high molecular weight hyaluronic acid for knee osteoarthritis in everyday clinical care in patients in the working age. An economic evaluation of a randomized clinical trial. Arthritis Care Res (Hoboken). 2018;70(1):89-97.
38. Ishijima M., Nakamura T., Shimizu K. et al. Intra-articular hyaluronic acid injection versus oral non-steroidal anti-inflammatory drug for the treatment of knee osteoarthritis: a multi-center, randomized, open-label, non-inferiority trial. Arthritis Res Ther. 2014;16(1): R18.
39. Стребкова E.A., Алексеева Л.И. Эффективность внутрисуставной терапии препаратами гиалуроновой кислоты у больных остеоартритом. Современная ревматология. 2019;13(2):96-104. [Strebkova E.A., Alekseeva L.I. Efficiency of intra-articular hyaluronic acid therapy in patients with osteoarthritis. Sovremennaya Revmatologiya. 2019;13(2):96-104 (in Russ.)].
40. Campbell K.A., Erickson B.J., Saltzman B.M. et al. Is local viscosupplementation injection clinically superior to other therapies in the treatment of osteoarthritis of the knee: a systematic review of overlapping meta-analyses. Arthroscopy. 2015;31(10):2036-2045.
41. Xing D., Wang B., Liu Q. et al. Intra-articular hyaluronic acid in treating knee osteoarthritis: a PRISMA-compliant systematic review of overlapping meta-analysis. Sci Rep. 2016;6:32790.
42. Филатова Ю.С., Соловьев И.Н. Тактика ведения пациентов с остеоартритом: взгляд ревматолога и травматолога-ортопеда. Медицинский совет. 2020;19:89-97. [Filatova Yu.S., Solovyov I.N. Management tactics for patients with osteoarthritis: a joint view of a rheumatologist and an orthopedic traumatologist. Meditsinskiy sovet. 2020;19:89-97 (in Russ.)].
43. Concoff A., Sancheti P., Niazi F. et al. The efficacy of multiple versus single hyaluronic acid injections: a systematic review and meta-analysis. BMC Musculoskelet Disord 2017;18(1):542.
44. Altman R., Hackel J., Niazi F. et al. Efficacy and safety of repeated courses of hyaluronic acid injections for knee osteoarthritis: A systematic review. Semin Arthritis Rheum. 2018;48(2):168-175.
45. Abbott T., Altman R.D., Dimef R. et al. Do hyaluronic acid injections delay total knee replacement surgery? Arthritis Rheum. 2013;65: S910-S911.
46. Михайлова А.С., Теплякова O.B., Соколова Л.А. Влияние локальной терапии гонартроза препаратами гиалуроновой кислоты различной молекулярной массы на динамику альгофункциональных показателей. Фарматека. 2011;19(232):74-78. [Mikhailova A.S., Teplyakova O.V., Sokolova L.A. Influence of local therapy of gonarthrosis with hyaluronic acid preparations of different molecular weight on the dynamics of algofunctional indicators. Farmateka. 2011;19(232):74-78 (in Russ.)].
47. Беляева E.A., Авдеева О.С. Влияние вискосапплементарной терапии с использованием гиалуроната натрия на потребность в эндопротезировании коленных суставов при остеоартрозе. РМЖ. 2017;25:1898-1904. [Belyaeva E.A., Avdeeva O.S. Effect of viscosupplementary therapy with sodium hyaluronate on the need for the knee replacement in osteoarthrosis. RMJ. 2017;25:1898-1904 (in Russ.)].
48. Попов В.П., Корощенко С.А., Ларин М.А. Оптимальное использование препаратов гиалуроновой кислоты при суставной патологии. РМЖ. Медицинское обозрение. 2017;1:12-14. [Popov V.P., Koroshchenko S.A., Larin M.A. Optimal use of hyaluronic acid for joint pathology treatment. RMJ. Medical review. 2017;1:12-14 (in Russ.)].
