Инфузия дипривана с регуляцией по целевой концентрации, как компонент общей анестезии при операциях с искусственным кровообращением
СтатьиОпубликовано в журнале:
Вестник интенсивной терапии »» N3 / 2000 И.А. Козлов, С.В. Воронин, В.М. Магилевец
НИИ трансплантологии и искусственных органов МЗ РФ, Москва
После периода интенсивного научного поиска [16, 20, 22] и создания коммерческой системы Diprifusor [10] инфузия Дипривана (пропофола) с регуляцией по целевой концентрации (ЦК) прочно заняла свое место при анестезиологическом обеспечении различных хирургических операций [1, 5, 13, 14, 18]. Это - первый вошедший в клинику методический прием, обеспечивающий реальное применение фармакокинетических параметров. Однако в кардиоанестезиологии опыт использования методики остается ограниченным. В ряде публикаций отмечают ее известные преимущества (плавная индукция со снижением расхода препарата, надежное управление глубиной анестезии, быстрое послеоперационное пробуждение) при вмешательствах с искусственным кровообращением (ИК) [9, 12, 15]. Вместе с тем сообщают, что в этой клинической ситуации возможны эпизоды дестабилизации гемодинамики [9, 12]. Опубликованы данные о несоответствии задаваемых и истинных плазменных концентраций пропофола во время гипотермического ИК [6], что может усложнять применение методики.
Изложенное определило цель настоящего исследования: оценить клиническую эффективность инфузии Дипривана с регуляцией по ЦК и особенности ее применения во время вмешательств с ИК в сравнении с пациентами, оперируемыми по поводу другой хирургической патологии.
Материал и методы
Обследовали 42 больных в возрасте от 16 до 67 лет, которых разделили на 2 группы. Пациентов 1-й группы (17 мужчин и 13 женщин в возрасте 43+/-2 г с массой тела 73+/-3 кг) оперировали с ИК, длительность которого составила 108+/-8 мин. Тяжесть их исходного состояния соответствовала III-IV (3,5+/-0,1) функциональному классу по номенклатуре Нью-Йоркской ассоциации кардиологов. В этой группе 24 (80%) пациентам выполнили протезирование 1-2 клапанов, 4 (13,3%) - коррекцию врожденных пороков сердца, осложненных легочной гипертензией и 2 (6,7%) - аортокоронарное шунтирование. В 6 (20%) наблюдениях ИК проводили в нормотермическом режиме, в остальных (80%) - при гипотермии 28-26°С.
Во 2-ю группу (контроль) вошли 4 мужчины и 8 женщин в возрасте 42+/-4 года с массой тела 69+/-4 кг. Двум (16,7%) пациентам выполнили остеосинтез грудины после кардио-хирургических вмешательств и 10 (83,3%) - различные урологические и общехирургические операции после предшествовавшей трансплантации почки.
Отличий по возрасту и антропометрическим показателям между группами не было, однако исходное состояние больных в 1-й было значительно более тяжелым в связи с наличием некорригированной патологии сердца. Предоперационное состояние пациентов контрольной группы, несмотря на перенесенные ранее кардиохирургические и трансплантационные операции, было относительно удовлетворительным.
Инфузию Дипривана проводили с помощью дозаторов Graseby 3500-Diprifusor (Graseby) и шприцев, предварительно заполненных препаратом (Diprivan-PFS, Zeneca). Управляющий алгоритм, реализованный в системе Diprifusor, предусматривает достижение и поддержание концентрации анестетика в крови (Ккр), на уровне, обеспечивающем максимальное сближение Ккр с концентрацией анестетика в точке эффекта (Кэф). Этот уровень и является, собственно, ЦК [10, 19], клиницист же задает и изменяет Ккр
Для премедикации за 40 мин до операции всем пациентам внутримышечно назначали промедол в дозе 0,3+/-0,01 мг/кг. Вводную анестезию начинали после 10-минутной преоксигенации путем инфузии Дипривана.
Начальную Ккр выставляли на уровне 1,5 мкг/мл; при недостаточном клиническом эффекте ее повышали, индивидуально подбирая необходимую величину. После засыпания больных на фоне вспомогательной вентиляции легких вводили фентанил (в 1-й группе - 5+/-0,3, во 2-й - 2,8+/-0,3 мкг/кг; р<0,05) и миорелаксант (векурониум, мивакуриум или атракуриум) в общепринятых дозах и выполняли интубацию трахеи. Анестезию поддерживали инфузией Дипривана, регулируемой по ЦК, дискретным введением фентанила (в 1-й группе - 3,4+/-0,2, во 2-й - 2,9+/-0,4 мкг/кг/ч; р>0,05) и ингаляцией смеси N2O (33-66%) с О2. Изменения Ккр во время операций осуществляли в зависимости от клинических признаков глубины общей анестезии и динамики показателей кровообращения.
ИВЛ проводили аппаратами Servoventilator 900D (Siemens) или Excel 210SE (ВОС Ohmeda), ИК - аппаратами Stockert с мембранными оксигенаторами при индексе объемной скорости перфузии 2,4-2,5 л/мин/м по методике, принятой в институте.
Анализировали время от начала инфузии Дипривана до засыпания (Вз) и от завершения введения препарата до пробуждения (Вп). У пациентов, ИВЛ которым прекращали в операционной (в 1-й группе - 21, во 2-й - 11 больных), оценили также время от завершения введения Дипривана до экстубации трахеи (Вэт).
Среднее артериальное давление (АДср) инвазивным методом и частоту сердечных сокращений (ЧСС) у пациентов 1-й группы оценивали с помощью мониторной системы UCW (SpaceLabs) на этапах: 1 - до индукции (исходный), 2 - потеря вербального контакта, 3 - перед интубацией, 4 - сразу после интубации, 5 - перед кожным разрезом, 6 - 1 мин после кожного разреза, 7 - 1 мин после полного хирургического доступа, 8 - перед ИК, 9 - середина ИК, 10 - конец ИК, 11 - конец операции, 12 - пробуждение. Во 2-й группе АДср и ЧСС контролировали неинвазивно с помощью монитора Viridia М3 (Hewlett Packard) на этапах 1-7 и 11, 12. Ккр и Кэф по показаниям программы Diprifusor проанализировали на указанных этапах, начиная со 2-го.
Оценивали дозировки Дипривана во время индукции и поддержания анестезии, а также общий расход препарата. В 1-й группе отдельно изучали дозировки препарата в предперфузионный период, во время и после ИК.
Проанализировали использование симпатомиметических кардиотоников и вазопрессоров.
Данные обработали статистическими методами с помощью коммерческих программ. Рассчитывали средние величины (М), частоту признаков (Р) и ошибки средних (m). Достоверность отличий оценивали по t-критерию Стьюдента.
Результаты и обсуждение
Потерю вербального контакта с больными 1-й группы отмечали при Ккр 2,4+/-0,1 мкг/мл и Кэф 1,7+/-0,1 мкг/мл (рис. 1). У пациентов 2-й группы эти концентрации были несколько выше: Ккр - 3,1+/-0,3 мкг/мл (р<0,05) и Кэф - 2,3+/-0,4 (р>0,05). Во всех наблюдениях качество вводной анестезии по клиническим признакам было вполне удовлетворительным.
В процессе углубления и поддержания анестезии у кардиохирургических больных и Kкp, и Кэф были значимо (на 0,8-1 мкг/мл) ниже, чем в контрольной группе. Пробуждение пациентов обеих групп происходило при одинаковых концентрациях - около 1 мкг/мл.
Индукционная дозировка Дипривана в 1-й группе достигала 2,3+/-0,1 мг/кг. В процессе поддержания анестезии дозировки составили: в предперфузионный период - 5,3+/-0,2 мг/кг/ч, во время и после ИК - 4,4+/-0,2 и 3,2+/-0,2 мг/кг/ч. Общий расход Дипривана колебался от 874 до 4030 (1626+/-100) мг. Во 2-й группе индукционная дозировка - 2,4+/-0,3 мг/кг, поддерживающая - 5,1+/-0,5 мг/кг/ч при общем расходе препарата - 455-2582 (958+/-168) мг. В предперфузионный период значимых отличий в назначении Дипривана у кардиохирургических пациентов и в контрольной группе не было. Однако общая дозировка Дипривана в 1-й группе была значимо ниже: 4,6+/-0,1 и 6,2+/-0,6 мг/кг/ч (р<0,05).
Таблица 1. Временные характеристики начального и завершающего этапов пособия при использовании инфузии Дипривана с регуляцией по ЦК
| Временные показатели, мин |
Группы | |
| 1-я | 2-я | |
| Вз | 2-14 (7+/-0,5) | 2-18 (7,8+/-1,4) |
| Вп | 6-33 (15+/-1) | 2-18 (8+/-2)* |
| Вэт | 28-104 (57+/-4) | 8-55 (20+/-4)* |
| Длительность: анестезии операции |
208-468 (289+/-10) 160-424 (253+/-11) |
60-312 (142+21)* 40-280 (118+/-18)* |
Засыпание больных обеих групп (табл. 1) на фоне автоматически регулируемой инфузии Дипривана происходило практически одинаково. Вп и Вэт в 1-й группе оказались существенно продолжительней. Вместе с тем отметим, что у кардиохирургических больных, несмотря на удлинение операции и общей анестезии на 2,3-2,5 ч и значимо больший, по сравнению с контролем, расход Дипривана, Вп увеличивалось только на 7 мин. Отличие Вэт было более существенным, однако это представляется вполне закономерным, учитывая, что темп активизации пациентов после операций с ИК определяется не только регрессом постмедикации, но и комплексом сложных задач по коррекции различных звеньев гомеостаза [3]. У исходно тяжелых пациентов необходим строго индивидуальный выбор уровня ЦК. Клиницисты, использовавшие автоматически регулируемую инфузию Дипривана в кардиоанестезиологии, сообщают о возможности поддержания ЦК в пределах 1-4 мкг/мл [6, 9, 12, 15, 17]. Указывают, что во время и после ИК средний уровень ЦК может быть снижен [6]. Наши данные вполне соответствуют этим рекомендациям.
Ни у одного из больных продленная послеоперационная ИВЛ не была обусловлена выраженной постмедикацией. Быстрая активизация кардиохирургических пациентов была вполне выполнимой даже после большого расхода Дипривана. Например, в одном из наблюдений больной проснулся через 13 мин после введения 2776 мг Дипривана и через 58 мин был полностью активизирован.
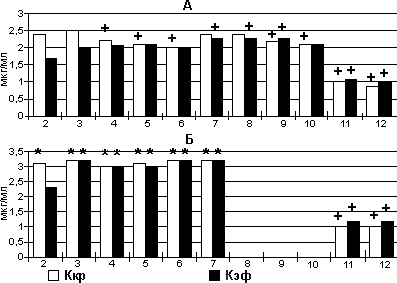
Рис. 1. Динамика Ккр и Кэф в процессе инфузии Дипривана с регуляцией по ЦК при операциях с ИК (А) и в контрольной группе (Б).
По осям абсцисс - этапы исследования. Звездочка (*) - достоверность (р<0,05) межгрупповых отлчичий, крестик (+) - достоверность (р<0,05) отличий с этапом 3.
Ранее мы не располагали опытом раннего прекращения ИВЛ после операций на открытом сердце при введении столь значительных доз Дипривана. Считали, что в результате назначения более 1000 мг препарата возможна значимая постмедикация [2].
Внедрение в практику инфузии с регуляцией по ЦК обусловило принципиальный пересмотр взглядов. В настоящее время полагаем, что общий расход препарата не является значимым предиктором качества пробуждения. Можно предположить, что инфузия Дипривана, регулируемая на основе трехкамерной фармакокинетической модели [1, 8, 13, 19], не только обеспечивает надежное поддержание анестезии, независимо от длительности пособия, но и оптимизирует условия для биотрансформации препарата и его быстрой элиминации.
Достижение гипнотического состояния в результате инфузии Дипривана у больных 1-й группы сопровождалось снижением АДср на 19% по сравнению с исходом (рис. 2). Параллельно на 12% урежалась ЧСС. Углубление анестезии перед интубацией трахеи приводило к дальнейшей депрессии кровообращения: АДср уменьшалось на 22% по сравнению с этапом 1, а ЧСС - на 15%. После интубации наблюдали тенденцию к повышению АДср и ЧСС, которые, оставались умеренно сниженными по сравнению с исходным уровнем.
Период стабилизации анестезии (этап 5) также характеризовался уменьшением обоих параметров. После разреза кожи и в процессе выполнения дальнейшего хирургического доступа АДср было снижено по сравнению с этапом 1 на 8-13%, а ЧСС - на 12-18%.
У большинства пациентов уменьшение АДср и ЧСС в предперфузионный период не имело клинической значимости. Ни в одном наблюдении на этапах стабилизации и поддержания анестезии не назначали симпатомиметических кардиотоников и вазопрессоров. У 2 (6,6%) пациентов с тяжелыми клапанными пороками введение Дипривана пришлось прекратить за 15-25 мин до начала ИК вследствие развития дестабилизации кровообращения на фоне хирургических манипуляций в полости перикарда.
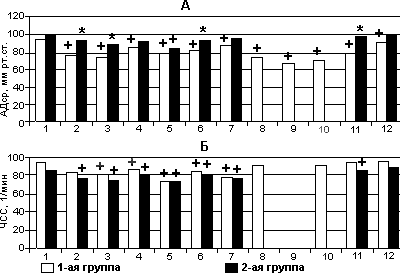
Рис. 2. Динамика АДср (А) и ЧСС (Б) в процессе инфузии Дипривана с регуляцией по ЦК у обследованных больных.
По осям абсцисс - этапы исследования. Звездочка (*) - достоверность (р<0,05) межгрупповых отличий, крестик (+) - достоверность (р<0,05) отличий с этапом 1.
Во время ИК и в постперфузионный период изменения показателей кровообращения у больных 1-й группы в целом соответствовали гемодинамическому профилю, типичному для операций на открытом сердце.
В равной степени это относится и к терапии симпатомиметическими препаратами. Большинству (63%) больных после ИК назначали "почечные" дозы допамина (2,2+/-0,2 мкг/кг/мин). Умеренно выраженные нарушения насосной функции сердца потребовали использования добутамина (3+/-0,3 мкг/кг/мин) в 22% наблюдений. Показания к введению норадреналина (78 нг/кг/мин) возникли только у 1 (3,3%) больного. Остановить инфузию Дипривана после ИК были вынуждены у 1 (3,3%) пациента с нарастающими признаками острой сердечной недостаточности.
У пациентов контрольной группы (рис. 1) при засыпании и в течение вводной анестезии (этапы 2-4) наблюдали тенденцию (р>0,05) к уменьшению АДср на 6-11% по сравнению с этапом 1; перед кожным разрезом уменьшение показателя на 15% становилось достоверным. В дальнейшем АДср практически не отличалось от исходного уровня. Динамика ЧСС в течение всей анестезии характеризовалась урежением на 4-14%.
Межгрупповое сравнение свидетельствует, что у больных с некорригированной сердечной патологией на фоне инфузии Дипривана с регуляцией по ЦК депрессия кровообращения выражена в несколько большей степени, чем у пациентов контрольной группы. Это отличие сохранялось и в конце операции, а при пробуждении практически исчезало. Отметим, что, предпринимая это сравнение, ожидали более выраженной разницы, поскольку операции с ИК являются одной из наиболее сложных моделей для оценки новой методики анестезии.
Полагаем, что полученные результаты вполне убедительно подтверждают полную приемлемость инфузии Дипривана с регуляцией по ЦК как компонента общей анестезии при кардиохирургических вмешательствах. Эту точку зрения разделяет большинство клиницистов, располагающих аналогичным опытом. Сообщают об эффективной анестезиологической защите при использовании автоматически регулируемой инфузии Дипривана в сочетании с альфентанилом, суфентанилом и ремифентанилом [6, 9, 12, 15].
Обратили внимание, что во время операций с ИК значения Ккр и Кэф на отдельных этапах исследования не совпадают. При углублении и поддержании анестезии (рис. 1, этапы 3-10) среднее расхождение концентраций составило 0,09+/-0,05 мкг/мл. В контрольной группе Ккр и Кэф на этапах 3-7 практически полностью совпадали (расхождение 0,02+/-0,01 мкг/мл; р<0,05 при межгрупповом сравнении). Совпадение значений задаваемой Ккр и расчетной Кэф свидетельствует о стабильном достижении и поддержании ЦК [13, 19], что наблюдали в контрольной группе. Необходимость изменять Ккр во время этих анестезий возникала 3,7+/-0,4 раза за операцию. В течение вмешательств с ИК изменения режимов инфузии выполняли 9,8+/-0,3 раза. На сходную частоту изменений ЦК (11,7 раза за операцию) указывают и другие исследователи [12].
Вероятность эпизодов гемодинамической нестабильности во время кардиохирургических операций закономерно возрастает в результате манипуляций в полости перикарда, канюляции магистральных сосудов и в ранний постперфузионный период. Именно на этих этапах в 10% наших наблюдений пришлось отказаться от введения Дипривана и перейти к поддержанию анестезии повышенными дозами фентанила. У других пациентов изменяли Ккр. Вазодилатирующие эффекты Дипривана хорошо известны [2, 7], поэтому на начальном этапе накопления клинического опыта автоматически регулируемого поддержания анестезии предпочитали именно такой прием.
Вместе с тем, частота отказов от инфузии Дипривана с регуляцией по ЦК оказалась ниже, чем частота этой вынужденной лечебной меры при обычной технике введения препарата [4]. Считают [6, 12], что развитие артериальной гипотензии на фоне инфузии Дипривана прежде всего создает показания к интенсивной инфузионной терапии и лишь при ее неэффективности к снижению ЦК и/или назначению симпатомиметических препаратов. Подобная тактика не всегда применима у тяжелых пациентов с клапанной патологией сердца, особенно при легочной гипертензии. Полагаем, что в таких наблюдениях предпочтительней уменьшать Ккр до 1 мкг/мл и менее, что позволяет у большинства пациентов продолжать введение Дипривана. Качество комбинированной общей анестезии при этом не ухудшается. Сообщают, что уровень ЦК 1 мкг/мл в сочетании с суфентанилом обеспечивает эффективную анестезиологическую защиту и быструю послеоперационную активизацию больных с митральными пороками сердца, в том числе и осложненными значительной легочной гипертензией [9].
Определенные особенности использования инфузии Дипривана с регуляцией по ЦК возможны непосредственно во время общей экстракорпоральной перфузии. После начала ИК теоретически вероятно падение плазменной концентрации препарата в результате гемодилюции и абсорбции на полимерных материалах оксигенатора и магистралей [11]. Сопоставление задаваемых и реально определенных концентраций пропофола, показало что в течение ИК различия между ними оказались меньше, чем в предперфузионный период [6]. Это позволило авторам считать фармакокинетическую модель, рассчитанную для практически здоровых лиц, вполне приемлемой у кардиохирургических пациентов.
В наших наблюдениях использование системы Diprifusor во время ИК не имело специфических особенностей. Вместе с тем отметили, что при проведении ИК в нормотермическом режиме была необходима более высокая ЦК (Kкp и Кэф 2,6+/-0,2 мкг/мл), чем при гипотермии (Ккр 2,1+/-0,1, Кэф 2,2+/-0,1 мкг/мл; р<0,05). Можно полагать, что гипотермия вызывает определенные изменения фармакокинетики и фармакодинамики Дипривана, однако этот вопрос нуждается в дальнейшем изучении.
В целом, результаты исследования позволяют констатировать, что инфузия Дипривана с регуляцией по ЦК является высокоэффективным компонентом надежного достижения и поддержания общей анестезии во время операций с ИК. Можно полагать, что дальнейшие исследования позволят выработать алгоритмы применения методики на отдельных наиболее травматичных этапах кардиохирургических вмешательств. Это упростит поддержание анестезии в сложных клинических ситуациях и создаст реальные предпосылки для максимально широкого внедрения автоматического управления анестезией даже у наиболее тяжелых пациентов.
Заключение
Опыт использования инфузии Дипривана с регуляцией по ЦК при операциях на открытом сердце свидетельствует о больших перспективах и целесообразности широкого внедрения в практику этого методического приема. Использование последнего значимо упрощает назначение оптимальных индивидуализированных дозировок препарата и обеспечивает предсказуемое послеоперационное пробуждение больных.
У кардиохирургических пациентов методика имеет некоторые особенности (меньший уровень ЦК, необходимость чаще, чем при обычных операциях изменять режим инфузии), что, однако, не снижает ее прикладной ценности.
Особенно целесообразно применение инфузии Дипривана с регуляцией по ЦК при ориентации клиницистов на максимально раннюю активизацию кардио-хирургических пациентов, которая становится все более популярной в мировой практике благодаря значимым клиническим и экономическим преимуществам [9, 15, 21].
Впервые в клинической анестезиологии появилась реальная возможность не только анализировать, но и использовать на различных этапах пособия фармакокинетические модели, благодаря чему открываются новые перспективы для научных исследований.
Литература
1. А.А. Бунятян, Е.В. Флеров, В.И. Стамов, К.М. Толмачев. Тотальная внутривенная анестезия пропофолом (диприваном) по целевой концентрации. Вестник инт. тер., 1999, N1. с 3-11.
2. И.А. Козлов, С.М. Маркин. Пропофоловая общая анестезия в кардиохирургии - от имплантаций электро-кардиостимуляторов до операций на открытом сердце. Приложение к журналу Вестник инт. тер., 1995, с. 9-15.
3. И.А. Козлов, С.М. Маркин, И.Е. Пиляева, А.В. Алферов. Раннее прекращение ИВЛ (экстубация трахеи в операционной) у больных, оперированных с искусственным кровообращением. Анест. и реаниматол., 1995, No 2, с. 16-19.
4. С.М. Маркин. Дисс. канд. мед. наук. Ранняя активизация больных после операций с искусственным кровообращением. М., 1997.
5. Aouizerate P., Dume L., Bouleau D. et al. Pharmacokinetic evaluation of a computerized target-controlled infusion system: application topropofol in orthopedic surgery. Therapie, 1998, Vol. 53, p. 543-51.
6. Barvais L., Rausin I., Glen J.B. et at. Administration of propofol by target-controlled infusion in patients undergoing coronary artery surgery. J. Cardiothorac. Vasc. Anesth., 1996, Vol. 10, p. 877-883.
7. Bell J., Sartain J., Wilkinson G.A.L., Sherry K.M. Propofol and fentanyl anaesthesia for patients with low cardiac output state undergoing cardiac surgery: comparison with high-dose fentanyl anaesthesia., Br. J. Anaesth., 1994, , Vol. 7 3, p. 162-166.
8. Coetzee J.F., Glen J.B., Wium C.A., Boshoff L. Pharmacokinetic model selection for target controlled infusion of propofol, Anaesthesiology, 1995, Vol. 82, p. 1328-1345.
9. D'Atellis N., Nicolas-Robin A., Delayance S. et al. Early extubation after mitral valve surgery: A target controlled infusion of propofol and low-dose sufentanil. J. Cardiothorac. Vasc. Anaesth., 1997, Vol. 11, p. 467-473.
10. Glen J.B. The development of Diprifusor: a TCI system for propofol. Anaesthesia, 1998, Vol 53 (Sup.1), p. 13-21.
11. Hynynen M., Hammaren E., Rosenherg P.H. Propofol sequestration within the extracorporeal circuit. Can. J. Anaesth, 1994, Vol. 41, p. 583-588.
12. Jain U., Body S.C., Bellows W. et al. Multicenter study of target controlled infusion of propofol-sufentanH or sufentanil-midazolam for coronary artery bypass graft surgery. Multicenter Study of Perioperative Ischemia (McSPI) Research Group. Anesthesiology, 1996, Vol. 85, p. 522-535.
13. Кеnnу G.N., Sutcliffe N.P. Target-controlled infusions: stress free anesthesia? J. Clin. Anesth., 1996, Vol. 8 (Sup. 3). p. 15S-20S.
14. Leonard I.E., Myles P.S. Target-controlled intravenous anaesthesia with bispectral index monitoring for thoracotomy in a patient with severely impaired left ventricular function. Anaesth. Intensive Care, 2000, Vol. 28, p. 318-321.
15. Olivier P., Sirieix D., Dassier P. et al. Continuous infusion of remifentanil and target-controlled infusion of propofol for patients undergoing cardiac surgery: a new approach for scheduled early extubation. J. Cardiothorac Vasc. Anesth., 2000. Vol. 14. p. 29-35.
16. Schuttler J., Kloos S., Schwilden H., Stoeckel H. Total intravenous anaesthesia with propofol and alfentanil by computer-assisted infusion. Anaesthesia, 1988, Vol. 43 (Sup.), p.2-7.
17. Seitz W., Lubbe N., Schaps D., Haverich A. Propofol zur Einleitung und Aufrechterhaltung der Hypnose bei lwronarchi-rurgischen Eingriffen. Ergebrnsse human pharmakologischer Untersuchungen. Ahaesthesist, 1991, Bd.40, S. 145-52.
18. Struys M., Versichelen L., Byttebier G. et al. Clinical usefulness of the bispectral index for titrating propofol target effect-site concentration. Anaesthesia, 1998, Vol 53, p. 4-12.
19. Struys M.M., De Smet Т., Depoorter B. et al. Comparison of plasma compartment versus two methods for effect compartment-controlled target-controlled infusion for propofol. Anesthesiology, 2000, Vol. 92, p. 399-406.
20. Taylor I., White M., Kenny G.N.C. Assessment of the value and pattern of use of a target controlled propofol infusion system. Int. J. Clin. Monitoring and Computing, 1993, Vol. 10, p. 17 5-180.
21. Veintemilla F.A., Zambrano J.A., Egas J.J., Avllin C., Coloma C. Anaesthesia and early extubation in cardiac surgery. In: Abstracts of 12th World Congress of Anaesthesiologists, Montreal, 2000, p. 303.
22. White M., Kenny G.N.C. Intravenous propofol anaesthesia using a computerised infusion system. Anaesthesia, 1990, Vol. 45, P.204-209.
