Хронический вирусный гепатит С (2021) . Клинические рекомендации.
Статьи
Хронический вирусный гепатит С
Кодирование по Международной статистической
классификации болезней и проблем, связанных со здоровьем: В18.2
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
ID:516
Разработчик клинической рекомендации
Одобрено Научно-практическим Советом Минздрава РФ
Оглавление
Список сокращений
** – указывается в конце названия лекарственного препарата или комбинации лекарственных препаратов, означает их принадлежность к списку ЖНЛВП
# – указывается в начале названия лекарственного препарата или схемы лекарственных препаратов, применяющихся не по медицинской инструкции (off-label)
Anti-HCV – антитела к вирусу гепатита С
Anti-HBc – антитела к ядерному антигену вируса гепатита В
HBcAg – hepatitis B core antigen, ядерный антиген вируса гепатита В
HBsAg – hepatitis B surface antigen, поверхностный антиген вируса гепатита В
HBV – hepatitis B virus, вирус гепатита В
HCVcAg – hepatitis C virus core antigen, ядерный антиген вируса гепатита С
HCV hepatitis C virus, вирус гепатита С
HIV – human immunogenicity virus, вирус иммунодефицита человека
MELD – model of end liver disease, расчетный индекс, характеристика тяжести терминальной стадии болезни печени
NS3/4A ингибиторы – противовирусные средства для лечения гепатита C, блокируют неструктурные белки NS3 и NS4A вируса гепатита С (J05AЕ ингибиторы протеаз)
NS5A ингибиторы – противовирусные средства для лечения гепатита C, блокируют неструктурный белок NS5A вируса гепатита С (J05AХ прочие противовирусные препараты)
АЛТ – аланиновая аминотрансфераза
АСТ – аспарагиновая аминотрансфераза
АФП – альфа-фетопротеин
ВГВ – вирус гепатита В
ВГС – вирус гепатита С
ВЕЛ+СОФ** – велпатасвир + софосбувир**
ВН – вирусная нагрузка
ВИЧ – вирус иммунодефицита человека
ВРВ – варикозно расширенные вены
ГГТ – гамма-глутамилтрансфераза
ГЛЕ+ПИБ** – глекапревир + пибрентасвир**
ГРА+ЭЛБ** – гразопревир + элбасвир**
ГТ – генотип
ГЦК – гепатоцеллюлярная карцинома
ДАК** – даклатасвир**
ДСВ; ОБВ+ПТВ/р** – дасабувир; омбитасвир + паритапревир + ритонавир**
ДНК – дезоксирибонуклеиновая кислота
ЖНЛВП – жизненно необходимые и важнейшие лекарственные препараты
ЛЕД+СОФ – ледипасвир + софосбувир
МЕ – международная единица
МКБ 10 – Международная классификация болезней 10-го пересмотра
НРВ** – нарлапревир**
НРВ**/р**– нарлапревир**, бустированный ритонавиром**
ОТП – ортотопическая трансплантация печени
ПегИФН** – Пэгинтерферон альфа-2a (40 кДа)** или Пэгинтерферон альфа 2b **
ПППД – противовирусные препараты прямого действия
ПТИ – протромбиновый индекс
РБВ** – рибавирин**
РНК – рибонуклеиновая кислота
р/д – раз в день
СКФ – скорость клубочковой фильтрации
СОФ** – софосбувир**
таб. – таблетка
УЗИ – ультразвуковое исследование
УВО – устойчивый вирусологический ответ
УВО12 – устойчивый вирусологический ответ через 12 недель после окончания терапии
ХБП – хроническая болезнь почек
ХВГС – хронический вирусный гепатит С
ЦП – цирроз печени
Термины и определения
Вирусная нагрузка (ВН) – количество вирусной РНК в крови, измеряется в МЕ/мл.
Генотипы вируса гепатита С – варианты вируса гепатита С, разделяются на основании различий в нуклеотидной последовательности определенных областей генома вируса. В клинической практике имеют большое значение для подбора схемы противовирусного лечения, в случае если применяются генотип-специфические препараты.
Гепатит – воспаление в ткани печени, характеризуется наличием некровоспалительных изменений в биоптате печени.
Гепатоцеллюлярная карцинома – злокачественное образование печени, является одним из возможных неблагоприятных исходов хронического вирусного гепатита С, возникает, как правило, на фоне сформированного цирроза печени.
Коинфекция – инфицирование двумя и более инфекционными агентами. В случае хронического вирусного гепатита С обычно применяется в отношении сочетания с вирусами гепатита В, Д и ВИЧ.
Пангенотипный – характеристика лекарственного средства или группы средств, эффективных в отношении всех наиболее распространенных генотипов вируса гепатита С.
Устойчивый вирусологический ответ (УВО) – отсутствие в крови РНК вируса гепатита С через 12 после окончания терапии.
Фиброз печени – процесс замещения паренхиматозной ткани печени соединительной тканью, является универсальной реакцией организма на хроническое повреждение.
Цирроз печени – терминальная стадия хронического заболевания печени, характеризуется замещением паренхимы соединительной тканью и нарушением архитектуры органа. На ранних этапах при сохраненной функции печени называется компенсированным, при потере функции – декомпенсированным.
APRI – некоммерческий расчетный индекс фиброза печени, метод неинвазивной диагностики. Может использоваться в качестве альтернативного при недоступности эластометрии печени.
FIB-4 – некоммерческий расчетный индекс фиброза печени, метод неинвазивной диагностики. Может использоваться в качестве альтернативного при недоступности эластометрии печени.
METAVIR – популярная система оценки степени воспаления (от А0 до А3) и фиброза (от F0 по F4) в ткани печени. Применяется как для характеристики биоптата печени, так и для оценки фиброза печени неинвазивными методами (например, при эластометрии печени или расчете индекса фиброза) (см. Приложение Г).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Хронический вирусный гепатит С (ХВГС) – хроническое воспалительное заболевание в течение более 6 месяцев с преимущественным поражением ткани печени вследствие инфицирования вирусом гепатита С (ВГС или HСV – hepatitis С virus), которое может привести к тяжелым последствиям – циррозу (ЦП), раку печени (гепатоцеллюлярной карциноме, ГЦК) и летальному исходу [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Возбудителем ХВГС является ВГС, который представляет собой небольшой гепатотропный РНК-вирус из семейства Flaviviridae. Вирус состоит из нуклеокапсида, состоящего из сердцевинного (ядерного) белка (HCVcAg) и одноцепочечной (+) РНК, и белково-липидной оболочки, содержащей аполипопротеин Е (апоЕ) человека и вирусные белки Е1 и Е2. Вирусный геном кодирует 10 различных белков, среди которых 3 описанных выше структурных и 7 неструктурных (p7, NS2, NS3, NS4A, NS4B, NS5A и NS5B) [2].
Выделяют 8 генотипов (ГТ) [3], которые обозначаются арабскими цифрами от 1 до 8, и несколько десятков субтипов ВГС, которые обозначаются латинскими буквами. Наибольшее клиническое значение имеют субтипы ГТ 1: а и b. Генотипы и субтипы различаются в последовательностях приблизительно на 30% и 20% соответственно. Вариабельность генома вируса обусловливает изменения в строении антигенных детерминант, которые определяют выработку специфических антител. Это препятствует элиминации вируса из организма и созданию эффективной вакцины против ВГС [4,5].
Инфицирование ВГС в большей доле случаев (55-85%) приводит к хроническому течению заболевания и примерно у четверти больных приводит в течение последующих десятилетий к развитию ЦП, что, в свою очередь, может служить основой для формирования ГЦК [6]. Довольно часто ввиду преимущественного бессимптомного течения инфекции заболевание впервые проявляется осложнениями ЦП.
Ведущим патогенетическим механизмом при ХВГС является нарушение взаимодействия иммунных клеток с инфицированными ВГС гепатоцитами. Повреждение печеночной ткани в большей степени является результатом реализации иммунного ответа в очаге воспаления, а не цитопатического действия вируса [7]. В печени накапливаются иммунокомпетентные клетки, часть из которых (NK-клетки, цитотоксические T-лимфоциты) обладают высокой цитотоксичностью и способностью повреждать гепатоциты [8]. В результате контакта инфицированных гепатоцитов с CTL-лимфоцитами (компонента адаптивного иммунного ответа) происходит запуск апоптоза. Отмечается дефицит Т-системы, депрессия макрофагов, ослабление системы интерфероногенеза, отсутствие специфического антителогенеза в отношении антигенов вирусов, что в конечном итоге нарушает адекватное распознавание и элиминацию иммунной системой антигенов вирусов на поверхности гепатоцитов [8-11].
У больных с выраженным Т-клеточным ответом происходит полная элиминация ВГС после перенесенного острого гепатита С. Вследствие взаимодействия вируса и иммунной системы происходит угнетение активности CTL-лимфоцитов белками вируса. В результате этого при ХВГС формируется иммунологическая толерантность к вирусу [12].
Действие вируса при ХВГС и вызванные им иммунологические реакции обусловливают не только повреждение печени, но и других органов и тканей. Концепция системных поражений при ХВГС заключается в возможности репликации вируса вне печени, а именно в тканях лимфоидного и нелимфоидного происхождения [13]. Размножение вируса в иммунокомпетентных клетках (лимфоцитах) приводит к нарушению их иммунологической функции. Сохранение ВГС в моноцитах является основной причиной реинфекции после трансплантации печени у больных тяжелыми формами ХВГС [10].
Среди факторов хозяина, влияющих на исход и течение ХВГС, имеет значение возраст на момент инфицирования, злоупотребление алкоголем, коинфицирование гепатотропными вирусами, нарушения липидного обмена и др. [14,15].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
\
По оценочным данным в мире у 1% населения (порядка 71 млн человек) выявляются антитела к ВГС (anti-HCV), среди которых 2/3 хронически инфицированы, и 1/3 выздоровели самостоятельно или вследствие излечения. Заболевание шире распространено в Африке и Азии (почти 3% населения), в то время как в Америке и Европе оно выявляется у 1,5-2,0% [17]. Достоверная распространённость ХВГС в РФ остаётся неизвестной, расчетное число пациентов может достигать 4,9 млн [16]. По данным Роспотребнадзора в субъектах РФ по состоянию на 01.01.2017 на диспансерном учёте состояло 591 830 пациентов с ХВГС [16].
В России самым распространенными являются ГТ 1 (52,6%, из них 3,7% приходятся на субтип 1а и 48,9% – на субтип 1b) и ГТ 3 (39,6%), гораздо реже встречается ГТ 2 (7,8%). Генотипы 4-6 встречаются менее чем в 0,01% случаев, ГТ 7 и 8 – крайне редко [16]. С появлением пангенотипных схем противовирусного лечения ХВГС клиническое значение ГТ ВГС постепенно утрачивается, однако остается еще ряд генотип-специфичных препаратов, перед применением которых необходимо уточнять ГТ ВГС.
Источником инфекции является больной человек. Наиболее значимым является парентеральный путь передачи (при употреблении внутривенных наркотических препаратов, медицинских манипуляциях, травмирующих косметических процедурах, включая маникюр и педикюр, нанесение татуировок и установку пирсинга), существенно реже – половой и вертикальный пути передачи [18].
Риск профессионального заражения медицинских работников при случайном уколе игрой, контаминированной инфицированной кровью, составляет около 1,8%. При попадании крови пациента на поврежденную кожу или неповрежденные слизистые медицинского работника риск инфицирования значительно меньше, а попадание ее на неповреждённую кожу безопасно. В связи с этим риск заражения для медицинского персонала мал. Риск инфицирования пациента от заражённого медицинского работника крайне мал [18]. Риск перинатальной передачи инфекции составляет 5-10% и мало зависит от способа родоразрешения, однако возрастает при наличии коинфекции ВИЧ у матери до 14-16% [18]. Низкая концентрация вируса в секретах половых желез и органах определяют низкий риск его передачи половым путем: около 0,5% в год при незащищенном половом контакте в моногамной гетеросексуальной паре, около 0,4-1,8% в год среди лиц, оказывающих сексуальные услуги [19], около 0,8% в год среди мужчин, практикующих секс с мужчинами с моноинфекцией ВГС (при коинфекции ВИЧ он выше в 4 раза) [20].
ВГС обладает сравнительно невысокой устойчивостью к воздействию факторов окружающей среды. Известно, что вирус устойчив к нагреванию до 50°С, полная его инактивация наступает через 30 минут при температуре 60°С и через 2 минуты при температуре 100°С. Вирус чувствителен к ультрафиолетовому облучению и воздействию растворителей липидов [21].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класcификации болезней и проблем, связанных со здоровьем
B18.2 – хронический вирусный гепатит С.
Применявшийся ранее код Z22.5 для носителей вирусного гепатита был исключен из последнего пересмотра МКБ 10.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Заболевание классифицируют в зависимости от ГТ ВГС, а также наличия ЦП и внепеченочных проявлений.
1.5.1 По стадиям:
0 – без фиброза;
1 – слабовыраженный фиброз;
2 – умеренный фиброз;
3 – выраженный фиброз;
4 – тяжелый фиброз.
1.5.2 По генотипу ВГС:
1 – генотип 1
-
Генотип 1а
-
Генотип 1b
2 – генотип 2 (в том числе 2k1b)
3 – генотип 3
4 – генотип 4
5 – генотип 5
6 – генотип 6
7 – генотип 7
8 – генотип 8
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
У большинства пациентов заболевание протекает бессимптомно и выявляется при обследовании в рамках диспансеризации, догоспитальной подготовки, при посещении гастроэнтеролога по поводу диспепсических явлений (как правило, не связанных прямо с наличием ХВГС) и других специалистов (гинекологов, урологов, стоматологов и т.д.). От времени инфицирования до установления диагноза может пройти несколько лет. В ряде случаев первым проявлением заболевания являются В-клеточные лимфопролиферативные или иммунологически обусловленные внепеченочные заболевания (криоглобулинемический васкулит, в том числе с синдромом Рейно; интерстициальные заболевания легких; гломерулонефрит; синдром Шегрена; артрит и др.). У достаточного числа пациентов диагноз устанавливается только после манифестации осложнений ЦП: кровотечение из варикозно расширенных вен (ВРВ) пищевода и желудка и развития асцита [22,23].
При физикальном осмотре в отсутствии ЦП патологических проявлений, как правило, нет [22].
Активность трансаминаз может быть как повышенной, так и в пределах референсных значений. В некоторых случаях отмечается периодическое повышение активности АЛТ. В крови обнаруживаются anti-HCV и РНК ВГС. Активность АЛТ в пределах нормальных значений не свидетельствует об отсутствии изменений в печени, и пациенты не могут рассматриваться как «здоровые носители». Было показано, что 30-50% случаев у таких больных может быть диагностирован ЦП [24,25]. Часто в начальной стадии компенсированного ЦП отмечаются лишь похудание, астенизация, снижение работоспособности. При осмотре выявляют увеличение печени с ее уплотнением и спленомегалию. Однако у 20% больных в начальной стадии ЦП протекает бессимптомно, и его обнаруживают, как правило, случайно во время профилактического осмотра или обследования по поводу другого заболевания.
Цирроз печени развивается, как правило, в 25-35% случаев ХВГС. Вероятность его развития составляет 7,3% в год (5,1-9,5%). У многих пациентов ЦП в исходе ХВГС впервые диагностируется по данным гистологического исследования биоптата печени. Темпы декомпенсации ЦП составляют 5,5% в год. Вероятность развития в течение года синдрома портальной гипертензии у больных с компенсированным ЦП составляет 3,6%, печеночной энцефалопатии – 0,4%, ГЦК – 1,5% [24,26,27].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии диагноза ХВГС:
Диагноз ХВГС устанавливается на основании наличия антител к вирусу гепатита С (Определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови, далее везде в тексте – anti-HCV) и РНК вируса гепатита С (Определение РНК вируса гепатита C (Hepatitis C virus) в крови методом ПЦР, качественное исследование, далее везде в тексте – РНК ВГС) или ядерного антигена ВГС (Определение Core-антигена вируса гепатита C (Hepatitis C virus) в крови, далее везде в тексте – HCVcAg) на протяжении более 6 месяцев [1].
2.1 Жалобы и анамнез
Специфических жалоб, характерных для ХВГС, нет. Заболевание, как правило, протекает бессимптомно, и довольно часто манифестирует осложнениями ЦП (асцит, кровотечение из ВРВ пищевода и желудка, печеночная энцефалопатия) [28]. В ряде случаев первыми проявлениями заболевания выступают иммунологически обусловленные внепеченочные проявления [23].
2.2 Физикальное обследование
При физикальном осмотре, как правило, никаких изменений не выявляется. Возможно наличие признаков ЦП (асцит, «печеночные ладони», ВРВ брюшной стенки, отеки, спленомегалия). При развитии иммунологически обусловленных внепеченочных проявлений имеют место соответствующие изменения [23].
2.3 Лабораторные диагностические исследования
На этапе скрининга
Скрининг на наличие ХВГС основан на выявлении anti-HCV. Если обнаружены anti-HCV, следует обязательно провести анализ на РНК ВГС. В случае если анализ на РНК ВГС недоступен, допустимо провести тест на HCVcAg. Этот антиген в сыворотке или плазме крови также является маркером репликации ВГС. Анализ HCVcAg менее чувствителен, чем РНК ВГС (нижний предел обнаружения эквивалентен приблизительно 500-3000 МЕ/мл РНК ВГС, в зависимости от ГТ ВГС [28,29]). В редких случаях HCVcAg не обнаруживается при определяемой РНК ВГС [30].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарии: отношение к группе повышенного риска устанавливается, как правило, на основании слов пациента (место работы, реципиент в анамнезе, введение инъекционных наркотиков, половые партнеры, семейный анамнез и т.д.).
К группе повышенного риска относятся:
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендации А (уровень достоверности доказательств – 5)
Комментарии: наличие anti-HCV в сочетании с РНК ВГС (или HCVcAg) характерно как для пациентов с ХВГС, так и пациентов с острым гепатитом С. Концентрация РНК ВГС (или HCVcAg) у больных с острым гепатитом С может значительно колебаться, вплоть до неопределяемого уровня. Таким образом, пациентам с неопределяемой РНК ВГС (или HCVcAg), необходимо повторно провести анализ РНК ВГС (или HCVcAg) через 12 и 24 недели после отрицательного результата, с тем чтобы убедиться в клиренсе ВГС (самостоятельное выздоровление от острого гепатита С) или подтвердить формирование ХВГС.
На этапе постановки диагноза:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 5)
Комментарии: ГТ ВГС имеет значение только при планировании генотип-специфичных противовирусных препаратов. При доступности пангенотипных препаратов это обследование не требуется.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: течение ХВГС может влиять на клеточный состав крови, однако убедительных доказательств таких изменений в отсутствии ЦП и лимфопролиферативных заболеваний, индуцированных ВГС, нет. В случае формирования ЦП чаще всего наблюдается тромбоцитопения различной степени выраженности, реже другие варианты цитопений.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: в отсутствии признаков ЦП клиническое значение активности трансаминаз и других показателей функции печени (билирубин, альбумин) невелико. Оно приобретает большее значение, если имеет место сочетанная патология печени. У пациентов с ЦП в исходе ХВГС тяжесть поражения гепатоцитов и признаки декомпенсации имеют решающее значение в выборе тактики ведения пациента, препаратов ПВТ, прогнозе течения заболевания [39]. Кроме того, АЛТ и АСТ могут использоваться для самостоятельной оценки выраженности фиброза печени (например, индексы APRI, FIB-4) в отсутствии возможности выполнить инструментальное обследование [42] (см. Приложение Г). Оценка функции почек (креатинин) необходима при планировании схем ПВТ, содержащих софосбувир** [40,41].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Уровень убедительности рекомендации А (уровень достоверности доказательств -1)
Комментарии: риск развития ГЦК на стадии ЦП составляет приблизительно 1-5% в год. Вероятность летального исхода в течение первого года после постановки диагноза у пациентов с ГЦК составляет 33 %.
На этапе ПВТ:
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарий: препараты современной ПВТ обладают высокой безопасностью и эффективностью, в связи с чем необходимости в лабораторном мониторинге во время ПВТ без применения рибавирина** нет.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: закономерности между скоростью элиминации ВГС во время ПВТ и вероятностью УВО нет, в связи с чем необходимости в контроле РНК ВГС во время лечения нет [48].
На этапе диспансерного наблюдения:
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Комментарий: после успешной ПВТ anti-HCV сохраняются длительно в подавляющем большинстве случаев, поэтому этот анализ не может использоваться для определения реинфицирования у пациентов с опытом элиминации ВГС. Доля пациентов, у которых anti-HCV постепенно исчезают, очень мала, и срок этого исчезновения неизвестен.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: отсутствие РНК ВГС через 12 недель после завершения ПВТ соответствует излечению от ХВГС, так как поздний рецидив возникает менее чем в 0,2% случаев [48].
Уровень убедительности рекомендаций А (уровень достоверности доказательств –1)
Комментарий: риск развития ГЦК на стадии ЦП составляет около 1-5% в год. Вероятность летального исхода в течение первого года после постановки диагноза у пациентов с ГЦК составляет 33%.
2.4 Инструментальные диагностические исследования
На этапе постановки диагноза:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: УЗИ органов брюшной полости и забрюшинного пространства проводится для диагностики ГЦК, признаков портальной гипертензии (увеличения селезенки, расширения вен портальной системы), асцита, исключения сопутствующей патологии желудочно-кишечного тракта, что в некоторых случаях может иметь решающее значение в определении стадии заболевания и тактики лечения. ЦП и ГЦК в исходе ХВГС могут протекать бессимптомно и выявляться только по данным УЗИ. При обнаружении в печени образования, подозрительного на ГЦК, следует продолжить исследования согласно клиническим рекомендациям по диагностике и лечению ГЦК.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: неинвазивная диагностика позволяет с высокой точностью определить стадию фиброза. Она может быть выполнена с помощью эластометрии печени (должна быть выполнена на валидизированном аппарате), либо с помощью сывороточных тестов. При недоступности эластометрии могут использоваться некоммерческие расчетные показатели, основанные на результатах лабораторного обследования (например, расчет индексов APRI, FIB-4, см. Приложения Г2, Г3).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Биопсия печени является инвазивной процедурой с риском развития осложнений, поэтому ее следует проводить только в случае, если не удается получить результат с помощью применения неинвазивных методов [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Эндоскопический осмотр выполняется для диагностики степени ВРВ пищевода и желудка, а также при наложении клипс и лигатур при кровотечении или его профилактики из вен пищевода у пациентов с ЦП. Возможно проведение процедуры в условиях седации, что требует предварительной консультации и сопровождения анестезиолога.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
На этапе диспансерного наблюдения:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: у данных пациентов сохраняется риск развития ГЦК, несмотря на элиминацию вируса из организма, поэтому им рекомендовано проведение профилактического обследования для ее раннего выявления.
2.5 Иные диагностические исследования
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Цель лечения ХВГС – элиминация ВГС для профилактики осложнений ХВГС (включая ЦП, ГЦК, смерть), улучшение качества жизни и предотвращение дальнейшей передачи ВГС в популяции. Вирус гепатита С не образует высокостабильных внутриклеточных форм генетического материала, поэтому может быть элиминирован из организма полностью [1]. Показателем элиминации вируса из организма является стойкое достижение неопределяемого уровня РНК вируса в крови, которое оценивают через 12 недель после окончания терапии (УВО12) [29,30].
На выбор тактики лечения оказывают влияние следующие факторы [68]:
3.1 Показания к началу противовирусной терапии
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: лечение ХВГС показано всем больным, так как в настоящее время применяются высокоэффективные и безопасные препараты, которые позволяют добиться УВО в подавляющем большинстве случаев.
Для лечения ХВГС применяются противовирусные препараты прямого действия (ПППД). Те из них, которые входят в список ЖНЛВП, отмечаются знаком **. ПППД представляют собой ингибиторы различных неструктурных белков вируса. Второй корень названия ПППД указывает на то, какой конкретно белок он ингибирует: «-превир» – NS3/NS4A, «-асвир» – NS5А, «-бувир» – NS5B. Выбор препаратов для лечения и длительность лечения зависят от стадии фиброза, наличия и класса ЦП, ГТ вируса, опыта предшествующей терапии ХВГС, наличия сопутствующих заболеваний (в частности, хронической болезни почек (ХБП)), некоторых препаратов сопутствующей терапии. В зависимости от эффективности при различных ГТ выделяют пангенотипные схемы (эффективны при всех ГТ вируса) и генотип-специфические (эффективны только при определенных ГТ ВГС). В табл. 1 представлены лекарственные средства и их компоненты, применяющиеся в РФ.
Табл. 1.
Компоненты, входящие в состав лекарственных средств прямого противовирусного действия, и лекарственные средства прямого противовирусного действия, одобренные для применения в РФ (представлены в алфавитном порядке).
| Ингибирующие NS3/4A | Ингибирующие NS5A | Ингибирующие NS5B |
|
|
|
|
Фиксированные комбинированные ПППД:
а - входят в состав комбинированных препаратов;
б - ритонавир** (РТВ**) – фармакокинетический бустер, не обладает противовирусной активностью, используется с НРВ** и ПТВ для увеличения их концентрации в крови.
- с ХВГС с исходом в ЦП (включая декомпенсированный ЦП);
- с выраженным фиброзом (F3 по METAVIR);
- с клинически значимыми внепеченочными проявлениями;
- с рецидивом ХВГС после трансплантации печени;
- с риском быстрого развития заболевания печени по причине сопутствующих заболеваний (хронический вирусный гепатит В, ВИЧ-инфекция, сахарный диабет и др., после трансплантации других органов кроме печени);
- с высоким риском передачи инфекции [1,69].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Большинство ПППД безопасно, но особенности их фармакокинетики могут приводить к значимому взаимодействию с другими препаратами, принимаемыми пациентом.
3.2 Лечение пациентов без цирроза печени и с компенсированным циррозом печени
Поскольку наличие опыта предшествующей терапии и ЦП существенно влияет на эффективность ПВТ, ее состав и длительность различается в зависимости от наличия этих факторов. В связи с этим пациентов с ХВГС принято разделять на несколько групп:
Лечение пациентов с декомпенсированным ЦП рассматриваются отдельно в разделе 3.9 «Трансплантация печени» и в Приложении А3.
Принципы перелечивания после неуспешного курса ПППД (ингибиторующими NS3/4А и/или ингибиторующими NS5A) рассматриваются в разделе 3.4.
-Велпатасвир+Софосбувир** [76,79]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Глекапревир + Пибрентасвир** [85]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Даклатасвир** + Софосбувир** [105,107,208,218-220]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
-Гразопревир + Элбасвир** [93,207, 221-224]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Даклатасвир** + Нарлапревир** + Ритонавир** [109]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** при генотипе 1b,
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** + Рибавирин** при генотипе 1а [98,99]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Ледипасвир + Софосбувир [90, 225]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Нарлапревир** + Софосбувир** + Ритонавир** [110,209]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Табл. 2.
Схемы ПВТ ХВГС для пациентов без предшествующего опыта ПВТ и без цирроза печени в зависимости от генотипа (лекарственные средства представлены в алфавитном порядке).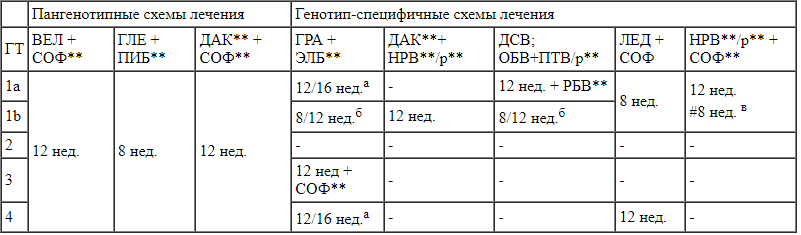
ВЕЛ+СОФ** – велпатасвир + софосбувир** (100/400 мг) 1 таб. 1р/д;
ГЛЕ+ПИБ** – глекапревир + пибрентасвир** (3 таб. одновременно, по 100/40 мг каждая) 1р/д;
ДАК** + СОФ** – даклатасвир** 60 мг 1 таб. 1р/д + софосбувир** 400 мг 1 таб. 1р/д;
ГРА+ЭЛБ** – гразопревир + элбасвир** 100/50 мг 1 таб. 1р/д;
ДАК** + НРВ**/р** – даклатасвир** 60 мг 1р/д + нарлапревир** 200 мг 1 р/д (2 таб. одновременно, по 100 мг каждая) + ритонавир** 100 мг 1р/д;
ДСВ; ОБВ+ПТВ/р** – дасабувир (1 таб. по 250 мг 2 р/д); омбитасвир + паритапревир + ритонавир** (2 таб. одновременно 1р/д, по 12,5/75/50 мг каждая);
ЛЕД+СОФ – ледипасвир + софосбувир 90/400 мг 1 таб. 1р/д;
НРВ**/р** + СОФ** – нарлапревир** 200 мг 1 р/д (2 таб. одновременно, по 100 мг каждая) + ритонавир** 100 мг 1р/д + софосбувир** 400 мг 1 таб. 1р/д;
а - при ВН не более 800 000 МЕ/мл срок лечения 12 недель; 16-недельный курс совместно с РБВ** следует рассмотреть при ВН ВГС >800 000 ME/мл и/или при наличии полиморфизмов NS5A;
б - у пациентов со слабовыраженным фиброзом (F0-2) 8 недель, с фиброзом F3-F4 по METAVIR – 12 недель.
в - у пациентов со слабовыраженным фиброзом (F0-2) и ВН менее 1 000 000 МЕ/мл можно рассмотреть длительность 8 недель по решению врачебной комиссии.
-Велпатасвир + Софосбувир** [76, 79]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Глекапревир + Пибрентасвир** [83-85,229]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 4)
-Даклатасвир** + Софосбувир** при генотипе 1, 2 и 4 [106,107,218]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Даклатасвир** + Софосбувир** + Рибавирин** при генотипе 3 [210, 218]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Гразопревир + Элбасвир** [93,207, 223, 226]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** при генотипе 1b,
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** + Рибавирин** при генотипе 1а [98, 102]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Ледипасвир + Софосбувир или Ледипасвир + Софосбувир + Рибавирин** [89-92,213-217]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
Табл. 3.
Схемы ПВТ ХВГС для пациентов с компенсированным циррозом печени без предшествующего опыта ПВТ в зависимости от генотипа (лекарственные средства представлены в алфавитном порядке).
ВЕЛ+СОФ** – велпатасвир + софосбувир** (100/400 мг) 1 таб. 1р/д;
ГЛЕ+ПИБ** – глекапревир + пибрентасвир** (3 таб. одновременно, по 100/40 мг каждая) 1р/д;
ДАК**+СОФ** – даклатасвир** 60 мг 1 таб. 1р/д + софосбувир** 400 мг 1 таб. 1р/д;
ГРА+ЭЛБ** – гразопревир + элбасвир** 100/50 мг 1 таб. 1р/д;
ДСВ; ОБВ+ПТВ/р** – дасабувир (1 таб. по 250 мг 2 р/д); омбитасвир + паритапревир + ритонавир** (2 таб. одновременно 1р/д, по 12,5/75/50 мг каждая);
ЛЕД+СОФ – ледипасвир + софосбувир 90/400 мг 1 таб. 1р/д;
а - при ВН не более 800 000 МЕ/мл срок лечения 12 недель; 16-недельный курс совместно с РБВ** следует рассмотреть при ВН ВГС >800 000 ME/мл и/или при наличии полиморфизмов NS5A;
б - для ГТ 3 можно рассмотреть добавление РБВ**;
в - в случае недоступности иных схем лечения.
-Велпатасвир + Софосбувир** [76, 79]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Глекапревир + Пибрентасвир** [83-85]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
- Даклатасвир** + Софосбувир** [106,107,210,211,218]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Гразопревир + Элбасвир** [93,207, 223, 226]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** при генотипе 1b,
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** + Рибавирин** при генотипе 1а [98, 102]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Ледипасвир + Софосбувир или Ледипасвир+Софосбувир + Рибавирин** [89-92,213-217]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
Табл. 4.
Схемы ПВТ ХВГС для пациентов, не ответивших на предшествующую терапию ПегИФН** + РБВ** ± СОФ** или СОФ** + РБВ**, без цирроза печени в зависимости от генотипа (лекарственные средства представлены в алфавитном порядке).
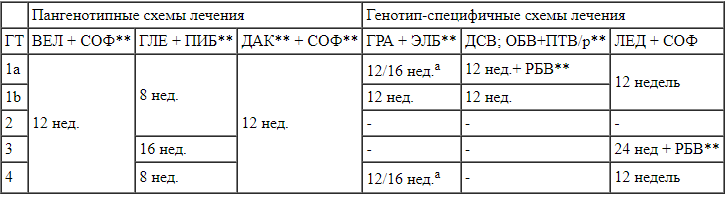
ВЕЛ+СОФ** – велпатасвир + софосбувир** (100/400 мг) 1 таб. 1р/д;
ГЛЕ+ПИБ** – глекапревир + пибрентасвир** (3 таб. одновременно, по 100/40 мг каждая) 1р/д;
ДАК** + СОФ** – даклатасвир** 60 мг 1 таб. 1р/д + софосбувир** 400 мг 1 таб. 1р/д;
ГРА+ЭЛБ** – гразопревир + элбасвир** 100/50 мг 1 таб. 1р/д;
ДСВ; ОБВ+ПТВ/р** – дасабувир (1 таб. по 250 мг 2 р/д); омбитасвир + паритапревир + ритонавир** (2 таб. одновременно 1р/д, по 12,5/75/50 мг каждая);
ЛЕД+СОФ – ледипасвир + софосбувир 90/400 мг 1 таб. 1р/д;
а – при ВН не более 800 000 МЕ/мл срок лечения 12 недель; 16-недельный курс совместно с РБВ** следует рассмотреть при ВН ВГС >800 000 ME/мл и/или при наличии полиморфизмов NS5A.
-Велпатасвир + Софосбувир** [76, 79]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Глекапревир + Пибрентасвир** [84,85]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Даклатасвир** + Софосбувир** [106,107, 218, 227]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
-Даклатасвир** + Софосбувир** + Рибавирин** [108,210,211, 218]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Гразопревир + Элбасвир** [93,207]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** при генотипе 1b,
-Дасабувир; Омбитасвир + Паритапревир + Ритонавир** + Рибавирин** при генотипе 1а [98,102]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
-Ледипасвир + Софосбувир или Ледипасвир+Софосбувир + Рибавирин** [90-92,213-217]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 3)
Табл. 5.
Схемы ПВТ ХВГС для пациентов, не ответивших на предшествующую терапию, ПегИФН** + РБВ** ± СОФ** или СОФ** + РБВ**, с компенсированным циррозом печени в зависимости от генотипа (лекарственные средства представлены в алфавитном порядке).
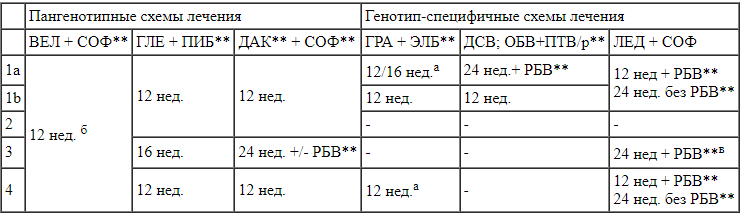
ВЕЛ+СОФ** – велпатасвир + софосбувир** (100/400 мг) 1 таб. 1р/д;
ГЛЕ+ПИБ** – глекапревир + пибрентасвир** (3 таб. одновременно, по 100/40 мг каждая) 1р/д;
ДАК** + СОФ** – даклатасвир** 60 мг 1 таб. 1р/д + софосбувир** 400 мг 1 таб. 1р/д;
ГРА+ЭЛБ** – гразопревир + элбасвир** 100/50 мг 1 таб. 1р/д;
ДСВ; ОБВ+ПТВ/р** – дасабувир (1 таб. по 250 мг 2 р/д); омбитасвир + паритапревир + ритонавир** (2 таб. одновременно 1р/д, по 12,5/75/50 мг каждая);
ЛЕД+СОФ – ледипасвир + софосбувир 90/400 мг 1 таб. 1р/д;
а - при ВН не более 800 000 МЕ/мл срок лечения 12 недель; 16-недельный курс совместно с РБВ** следует рассмотреть при ВН ВГС >800 000 ME/мл и/или при наличии полиморфизмов NS5A;
б - для ГТ 3 можно рассмотреть добавление РБВ**;
в - в случае недоступности иных схем лечения.
Все схемы ПВТ для лечения пациентов с ХВГС (всех ГТ ВГС) с ЦП (в т.ч. декомпенсированным) или без него, с опытом предшествующей ПВТ или без него, суммированы также в Приложении А3.
3.3 Контроль терапии
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Большинство современных препаратов ПВТ ХВГС хорошо переносятся, однако в ряде случаев необходимо добавлять РБВ** (для некоторых схем, особенно для пациентов с ЦП) – препарат, одним из основных побочных эффектов которого является не иммунный гемолиз. При применении РБВ** следует контролировать общий развернутый (клинический) анализ крови и при необходимости проводить коррекцию терапии.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
3.4 Перелечивание
В большинстве случаев (95-100%) применение ПППД приводит к УВО, однако в редких случаях достичь УВО не удается.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии:
3.5 Патогенетическая терапия
Патогенетической терапии для пациентов с ХВГС нет.
3.6 Симптоматическая терапия
Симптоматической терапии для пациентов с ХВГС нет.
3.7 Хирургическое лечение
Уровень достоверности рекомендации С (уровень убедительности доказательств – 4)
Комментарий: дообследование проводится в соответствии с протоколом ведения пациентов из листа ожидания в трансплантологическом центре.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
3.8 Внепеченочные проявления хронического вирусного гепатита С
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: ХВГС может проявиться внепеченочными иммунологически обусловленными состояниями (криоглобулинемический васкулит, в том числе с синдромом Рейно, интерстициальные заболевания легких, гломерулонефрит, синдром Шегрена, артрит и другие), а также неходжкинскими В-клеточными лимфомами. Во всех случаях следует назначить ПППД по описанным выше схемам. Раннее начало ПВТ значительно снижает риск развития внепеченочных проявлений.
3.9 Коинфекция
3.9.1 Коинфекция ВГС/ВИЧ
Пациенты с ХВГС и коинфекцией ВИЧ относятся к группе, требующей безотлагательной ПВТ ХВГС [1,69]. Течение ХВГС у ВИЧ-инфицированных зависит от степени выраженности иммунодефицита, обусловленного ВИЧ. Вероятность развития тяжелого поражения печени особенно высока при снижении CD4 лимфоцитов менее 200/мкл. Прогрессирование, связанное с поражением печени, обусловлено повышением концентрации вируса в крови (в 2-8 раз) на фоне выраженного иммунодефицита. Коинфекция ВИЧ и ВГС приводит к увеличению частоты развития осложнений, а также связанной с этими заболеваниями смертности. Антиретровирусная терапия коинфицированных ВГС/ВИЧ больных ассоциирована с возможным риском нарушения функций печени вследствие ее гепатотоксичности [130,131].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: все схемы ПВТ на основе ПППД требуют учета межлекарственных взаимодействий. Одним из удобных способов оценки межлекарственных взаимодействий является использование Ливерпульской таблицы лекарственных взаимодействий в Интернет ресурсе.
3.9.2 Коинфекция ВГС/ВГВ
Пациенты с ХВГС и коинфекцией вирусом гепатита В (ВГВ) относятся к группе, требующей безотлагательной ПВТ ХВГС [1,69]. Коинфекция ВГС/ВГВ ускоряет прогрессирование заболевания и увеличивает риск развития ГЦК [138,139].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: поскольку ВГС, как правило, подавляет репликацию ВГВ, устранение первого вируса может привести к реактивации второго. Поэтому при лечении ХВГС следует тщательно контролировать маркеры активности ВГВ, и при их увеличении назначить ПВТ инфекции, вызванной ВГВ. Эту терапию также можно назначить с профилактической целью на срок лечение ХВГС и далее в течение 12 недель после ее успешного завершения.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
3.10 Пациенты с хронической болезнью почек
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1) Комментарии: на сегодня накоплено достаточно клинического опыта применения софосбувира** у пациентов с тяжелой ХБП [153-155], что позволяет рекомендовать софосбувир**-содержащие схемы ПВТ всем таким пациентам без коррекции доз ПППД.
- Глекапревир + пибрентасвир** для всех ГТ ВГС;
- Дасабувир; омбитасвир + паритапревир + ритонавир** для ГТ 1;
- Элбасвир + гразопревир** для ГТ 1, 4;
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
- Велпатасвир + софосбувир** (для всех ГТ);
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
- Даклатасвир** 1 таб. (60 мг) 1 р/д + #софосбувир** 1 таб. (400 мг) 1 р/д (для всех ГТ);
-
Ледипасвир + cофосбувир (для ГТ 1 и 4).
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
3.11 Трансплантация печени
3.11.1 Противовирусная терапия ХВГС у больных с декомпенсированным циррозом печени, находящихся в Листе ожидания трансплантации печени
Целями ПВТ ХВГС у больных с декомпенсированным ЦП, находящихся в Листе ожидания ортотопической трансплантации печени (ОТП), являются:
Улучшение функции печени оценивается по клиническим показателям, а также по шкалам Child-Pugh (см. Приложение Г) и MELD (для подсчета этого индекса можно использовать любой интернет-ресурс). Улучшение оценки MELD наблюдается у 60% больных с декомпенсированным ЦП, завершивших курс ПВТ. Это улучшение тем более вероятно и тем сильнее выражено, чем ниже оценка MELD до начала терапии.
До 25-30% больных с декомпенсированным ЦП могут иметь стойкое улучшение (компенсацию) ЦП, что позволяет вывести их из Листа ожидания ОТП. Выживаемость таких пациентов на протяжении 3-х лет не ниже, чем в группе реципиентов печени, которым была проведена ОТП, сопоставимых по исходной MELD [118,119,158-162].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии: для ПВТ пациентов с декомпенсированным ЦП строго противопоказано использование препаратов, ингибирующих NS3/4.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
3.11.2 Противовирусная терапия инфекции, вызванной вирусом гепатита С, у реципиентов печени
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: частота УВО у реципиентов печени с компенсированной болезнью трансплантата, получивших запланированный курс ПВТ, составляет более 95%. УВО ассоциируется с замедлением прогрессирования фиброза и улучшением выживаемости трансплантата и реципиентов.
3.12 Беременные
Беременность, по-видимому, не оказывает негативного влияния на течение ХВГС. Активность АЛТ в сыворотке крови снижается в течение I и III триместров беременности и повышаются после родов. Уровень РНК ВГС повышается в течение I и III триместров, достигая пика в течение III триместра, и снижается после родоразрешения. Эти события, вероятно, обусловлены иммуносупрессивными эффектами беременности и увеличением объема материнской плазмы [191,192]. Передача ВГС от матери ребенку встречается с общей частотой от 5% до 15% [193,194]. Убедительных данных о негативном влиянии ВГС на развитие плода и исход беременности нет. Есть отдельные сообщения о влиянии ЦП на течение беременности и ее исход. Так, беременные женщины с ЦП подвергаются повышенному риску неблагоприятных исходов для матери (например, преэклампсия, геморрагические осложнения и смерть) и для плода (например, преждевременные роды, низкая масса тела при рождении и неонатальная смерть). Женщины с ЦП в исходе ХВГС должны быть проинформированы об этих возможных осложнениях [195,196].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: на сегодня не существует крупномасштабных клинических испытаний, оценивающих безопасность ПППД при беременности. Специальные исследования ПВТ СОФ** и ЛЕД+СОФ во время беременности продемонстрировали хорошую безопасность для плода. Данных об использовании пангенотипных схем во время беременности в настоящее время нет.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: РБВ** обладает тератогенным свойством, то есть может вызвать аномалии развития и гибель плода. Его не следует назначать беременным женщинам или женщинам детородного возраста, которые могут забеременеть во время лечения РБВ** или в течение 6 месяцев после прекращения РБВ**. Кроме того, следует помнить, что РБВ** аналогичным образом может вызывать врожденные дефекты у плода, в случае если мужчина получал РБВ**, когда женщина забеременела от него. Таким образом, для избегания беременности во время лечения РБВ** и в течение не менее 6 месяцев после этого лицам с детородным потенциалом крайне важно использовать по крайней мере 2 формы эффективной контрацепции. Консультирующему врачу необходимо задокументировать обсуждение потенциальных тератогенных эффектов РБВ** в медицинской карте пациента.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: грудное вскармливание не представляет риска для передачи ВГС от матери ребенку, поскольку частота инфицирования детей по результатам исследований сопоставима в группах на грудном вскармливании и на искусственном вскармливании. Однако в случае повреждения сосков и кровотечения из этих повреждений возникает риск инфицирования ребенка от матери с ХВГС вследствие передачи ВГС через кровь.
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Для пациентов с ХВГС специализированные реабилитационные мероприятия не разработаны.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1 Специфическая профилактика
Специфическая профилактика ХВГС в настоящее время не разработана.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
5.2 Неспецифическая профилактика
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
5.3 Диспансерное наблюдение
- Всем пациентам с ХВГС – анализ крови биохимический общетерапевтический, УЗИ органов брюшной полости (комплексное) и забрюшинного пространства, эластометрия печени (при ее недоступности могут использоваться некоммерческие расчетные показатели, основанные на результатах лабораторного обследования, например, расчет индексов APRI, FIB-4);
- Всем пациентам с ХВГС с исходом в ЦП в дополнение к вышеперечисленному - общий (клинический) анализ крови (развернутый), определение протромбинового (тромбопластинового) времени, ЭГДС.
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарий: пациенты с anti-HCV, у которых отсутствует РНК ВГС после проведенной ПВТ ХВГС в течение 12 недель, считаются излечившимся от ХВГС и подлежат снятию с диспансерного наблюдения.
Уровень убедительности рекомендации A (уровень достоверности доказательств – 1)
6. Организация оказания медицинской помощи
Медицинская помощь оказывается в форме:
Условия оказания медицинских услуг
Медицинская помощь оказывается в виде:
Медицинская помощь взрослым больным с ХВГС может оказываться в следующих условиях:
Первичная медико-санитарная помощь пациентам оказывается в амбулаторных условиях и в условиях дневного стационара.
Первичная доврачебная медико-санитарная помощь в амбулаторных условиях осуществляется в фельдшерско-акушерских пунктах.
Первичная врачебная медико-санитарная помощь осуществляется врачом-терапевтом участковым, врачом общей практики (семейным врачом) в амбулаторных условиях.
Первичная специализированная медико-санитарная помощь осуществляется врачом-инфекционистом или врачом-гастроэнтерологом медицинской организации, оказывающим медицинскую помощь пациентам в амбулаторных условиях.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается в условиях стационара врачами-инфекционистами и другими врачами-специалистами и включает в себя профилактику, диагностику, лечение заболеваний и состояний, требующих использования специальных методов и сложных медицинских технологий, а также медицинскую реабилитацию.
Лечение пациентов осуществляется в условиях круглосуточного или дневного стационара по направлению врача-терапевта участкового, врача общей практики (семейного врача), врача-инфекциониста, врача-гастроэнтеролога, медицинских работников, выявивших ХВГС.
Больные ХВГС должны находиться под наблюдением до достижения УВО12, а при наличии фиброза печени F3-4 по METAVIR пожизненно.
Показанием к экстренной госпитализации служит развитие острой печеночной недостаточности, в том числе печеночной энцефалопатии и острой печеночной недостаточности на фоне хронической.
Медицинская помощь пациентам ХВГС оказывается в соответствии с утвержденным стандартом специализированной медицинской помощи
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Отсутствует.
Критерии оценки качества медицинской помощи
| № | Критерии качества | Выполнено Да/нет |
Этап постановки диагноза |
||
| 1. | Выполнено Определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови | |
| 2. | Выполнено определение РНК вируса гепатита C (Hepatitis C virus) в крови методом ПЦР, качественное исследование или определение Core-антигена вируса гепатита C (Hepatitis C virus) в крови | |
| 3. | Выполнено определение генотипа вируса гепатита C (Hepatitis C virus), в случае если планируется генотип-специфичная схема ПВТ | |
| 4. | Выполнен общий развернутый (клинический) анализ крови | |
| 5. | Выполнен анализ крови биохимический общетерапевтический с оценкой АЛТ, АСТ, общего билирубина и его фракций (свободный и связанный билирубин), креатинина | |
| 6. | Пациентам с ЦП выполнено определение протромбинового (тромбопластинового) времени в крови или в плазме | |
| 7. | Пациентам с выраженным и тяжелым фиброзом печени (F3-F4 по METAVIR) определен уровень АФП | |
| 8. | Выполнено УЗИ органов брюшной полости (комплексное) | |
| 9. | Выполнена оценка фиброза печени (эластометрия печени и/или расчетные индексы фиброза и/или биопсия печени) | |
| 10. | Выполнена эзофагогастродуоденоскопия (пациентам с ЦП) | |
Этап ПВТ |
||
| 1. | В случае применения РБВ** выполнен общий развернутый (клинический) анализ крови каждые 2-4 недели ПВТ | |
| 2. | Выполнено определение РНК вируса гепатита C (Hepatitis C virus) в крови методом ПЦР, качественное исследование исходно и через 12 недель после окончания терапии | |
Этап диспансерного наблюдения |
||
| 1. | Пациентам с выраженным и тяжелым фиброзом печени (F3-F4 по METAVIR) определен уровень АФП 1 раз в полгода | |
| 2. | Выполнена оценка фиброза печени 1 раз в год (эластометрия печени и/или расчетные индексы фиброза и/или биопсия печени) | |
| 3. | Пациентам с выраженным и тяжелым фиброзом печени (F3-F4 по METAVIR) выполнено УЗИ органов брюшной полости (комплексное)1 раз в полгода | |
| 4. | Пациентам с ЦП выполнена эзофагогастродуоденоскопия 1 раз в год | |
Список литературы
1. EASL recommendations on treatment of hepatitis C: Final update of the series. J Hepatol 2020 Nov;73(5):1170-1218.
2.
Dubuisson J, Cosset FL. Virology and cell biology of the hepatitis C virus life cycle: an update. J Hepatol. 2014;61(1 Suppl):3-13.
3.Sergio M Borgia, et al. Identification of a novel hepatitis c virus genotype from punjab, india: expanding classification of hepatitis c virus into 8 genotypes. J Infect Dis. 2018 Oct 20;218(11):1722-1729.
4.
Дунаева, Н. В. Структурно-функциональная организация генома вируса гепатита С. Вопросы вирусологии. – 2006. – № 51 (2). – С. 10 – 14.
5.
Irshad M, Gupta P, Irshad K. Immunopathogenesis of liver injury during hepatitis c virus infection. Viral Immunol. 2019;32(3):112-205.
6.
Lingala S, Ghany MG. Natural history of hepatitis C. Gastroenterol Clin North Am. 2015;44(4):717-34.
7.
Yamane, D. Liver injury and disease рathogenesis in chronic hepatitis C. Curr Top Microbiology Immunology 2013;369:263-288.
8.
Семенов, А. В. Особенности популяционного состава CXCRS-положительных лимфоцитов периферической крови больных хроническим гепатитом С. Журнал микробиологии, эпидемиологии и иммунобиологии. – 2013. –№ 6. – С. 69 – 76.
9.
Елезов, Д. С. Анализ популяций Т-хелперных клеток памяти, экспрессирующих хемокиновые рецепторы CXCR3 и CCR6, в периферической крови больных хроническим вирусным гепатитом С. Бюллетень экспериментальной биологии и медицины. – 2015. – № 160 (8). – С. 204 – 208.
10.
Lohr, H. F. HCV replication in mononuclear cells simulates anti-HCV-secreting B cells and reflects nonresponsiveness to interferon-alfa. J. Med. Virol. 1995;46(4):314-21.
11.
Арсентьева, Н. А. Хемокиновые рецепторы CXCR3 и CCR6 и их лиганды в печени и крови больных хроническим вирусным гепатитом С. Бюллетень экспериментальной биологии и медицины. – 2015. – № 8. – С. 218 – 222.
12.
Давидович, Н. В. Иммунный ответ при вирусном гепатите С: ведущая роль натуральных киллеров. Ж. «Вестник Северного (Арктического) федерального университета». – 2015. – №4. – C. 68 – 78.
13.
Хронический вирусный гепатит. Под ред. В. В. Серова, З. Г. Апросиной. – М: Медицина. – 2002. – 384 с.
14.
Дудина, К. Р. Факторы прогрессирующего течения хронического гепатита С. Ж. Лечащий врач. – 2013. – №10. – С. 36.
15.
Сухорук, А. А. Цирроз печени как исход хронического гепатита С. Журнал инфектологии. – 2014. –№ 6(1). – С. 67 – 71.
16.
Пименов Н.Н., Комарова С.В., Карандашова И.В., Цапкова Н.Н., Волчкова Е.В., Чуланов В.П. Гепатит С и его исходы в России: анализ заболеваемости, распространенности и смертности до начала программы элиминации инфекции. Инфекционные болезни, 2018, т.16, №3, с. 37-45
17.
WHO Global hepatitis report, 2018
18.
Alter MJ. Epidemiology of hepatitis C virus infection. World J Gastroenterol. 2007;13(17):2436-41.
19.
Terrault NA. Sexual activity as a risk factor for hepatitis C. Hepatology. 2002;36(5 Suppl 1):99-105.
20.
Chan DP, Sun HY, Wong HT, Lee SS, Hung CC. Sexually acquired hepatitis C virus infection: a review. Int J Infect Dis. 2016;49:47-58.
21.
Жданов, К. В. Вирусные гепатиты. СПб.: Фолиант. – 2011. – 304 с.
22.
Wang LS, D"souza LS, Jacobson IM. Hepatitis C – a clinical review. J Med Virol. 2016;88(11):1844-55.
23.
Kuna L, Jakab J, Smolic R, Wu GY, Smolic M. HCV Extrahepatic Manifestations. J Clin Transl Hepatol. 2019;7(2):172-182.
24.
Ющук, Н. Д. Инфекционные болезни: национальное руководство – 2-е изд., переработанное и доп. М.: ГЭОТАР-Медиа, 2019. – 1104 с.
25.
Майер, К. П. Гепатит и последствия гепатита. Практич. рук. Пер. с нем. – 2-е изд.// М: ГЭОТАР- МЕД, 2004. – С. 265, 467 – 479; 491 – 503.
26.
Сухорук, А. А. Цирроз печени как исход хронического гепатита С. Журнал инфектологии. – 2014. – Т. 6, № 1. – С. 67 – 71.
27.
Билалова, А. Р. Клинико-лабораторная характеристика хронических гепатитов и циррозов печени различной этиологии. Архивъ внутренней медицины. – 2015. – № 2(22). – С. 8 – 14.
28.
Chevaliez S, Soulier A, Poiteau L, Bouvier-Alias M, Pawlotsky JM. Clinical utility of hepatitis C virus core antigen quantification in patients with chronic hepatitis C. J Clin Virol 2014;61:145–148.
29.
Heidrich B, Pischke S, Helfritz FA, Mederacke I, Kirschner J, Schneider J, et al. Hepatitis C virus core antigen testing in liver and kidney transplant recipients. J Viral Hepat 2014;21:769–779.
30.
Freiman JM, Tran TM, Schumacher SG, White LF, Ongarello S, Cohn J,et al. Hepatitis C core antigen testing for diagnosis of hepatitis C virusinfection: a systematic review and meta-analysis. Ann Intern Med 2016;165:345–355.
31.
Håvard Midgard, Amanda Weir, et al. HCV epidemiology in high-risk groups and the risk of reinfection. J Hepatology 2016;65:33-45.
32.
WHO. Global health sector strategy on viral hepatitis, 2016–2021.
33.
Arase Y, Ikeda K, Chayama K, Murashima N, Tsubota A, Suzuki Y, et al. Fluctuation patterns of HCV-RNA serum level in patients with chronic hepatitis C. J Gastroenterol 2000;35:221–225.
34.
Cividini A, Cerino A, Muzzi A, Furione M, Rebucci C, Segagni L, et al. Kinetics and significance of serum hepatitis C virus core antigen in patients with acute hepatitis C. J Clin Microbiol 2003;41:2144-46
35.Michael J. Zoratti, et al. Pangenotypic direct acting antivirals for the treatment of chronic hepatitis C virus infection: A systematic literature review and meta-analysis. E Clinical Medicine. 2020 Jan; 18: 100237.
36.
Amir A. Qamar, Norman D. Grace, et al. Incidence, prevalence, and clinical significance of abnormal hematologic indices in compensated cirrhosis. Clinical gastroenterology and hepatology 2009;7:689-695.
37.
Sheehan, Vivien A., et al. Hepatitis C and neutropenia. Current Opinion in Hematology 2014;21:58-63.
38.
Weksler B B. Review article: the pathophysiology of thrombocytopenia in hepatitis C virus infection and chronic liver disease. Aliment Pharmacol Ther 2007: Nov;26 (Suppl 1):13-9.
39.
Zohair Ahmed, Umair, et al. Liver function tests in identifying patients with liver disease. Clin Exp Gastroenterol. 2018;11:301-307.
40.
Saxena, V. Safety and efficacy of sofosbuvir-containing regimens in hepatitis C-infected patients with impaired renal function. Liver Int. 2016;36:807-816.
41.
Bhamidimarri, K. R. Safety, efficacy and tolerability of half-dose sofosbuvir plus simeprevir in treatment of hepatitis C in patients with end stage renal disease. J. Hepatol. 2015;63: 763-765.
42.
Uroš Karić, et al. FIB-4 and APRI scores for predicting severe fibrosis in chronic hepatitis C - a developing country"s perspective in DAA era. J Infect Dev Ctries 2018; 12(3):178-182.
43.
Michael F. Harrison. The Misunderstood Coagulopathy of Liver Disease: A Review for the Acute Setting. West J Emerg Med. 2018 Sep; 19(5): 863-871.
44.
Gupta, S. Test characteristics of alpha-fetoprotein for detecting hepatocellular carcinoma in patients with hepatitis C. A systemic review and critical analysis. Med. 2003;139:46-50.
45.
Di Bisceglie, A. M. Serum alpha-fetoprotein levels in patients with advanced hepatitis C: results from the HALT-C Trial. J. Hepatol. 2005;43:434- 441.
46.
AASLD-IDSA Pannel on HCV Guidance. 2016. Monitoring patients who are starting hepatitis C treatment, are on treatment, or have completed therapy. Recommendations for testing, managing, and treating hepatitis C. AASLD-IDSA, Alexandria, VA.
47.
Treatment optimisation for hepatitis C in the era of combination direct-acting antiviral therapy: a systematic review and meta-analysis. Wellcome Open Research 2019, 4:132 Last updated: 13 Nov 2019.
48.
Sarrazin C, Isakov V, Svarovskaia ES, Hedskog C, Martin R, Chodavarapu K, et al. Late relapse versus hepatitis C virus reinfection in patients with sustained virologic response after sofosbuvir-based therapies. Clin Infect Dis 2017;64:44-52.
49.
Chevaliez S, Pawlotsky JM. Diagnosis and management of chronic viral hepatitis: antigens, antibodies and viral genomes. Best Pract Res Clin Gastroenterol 2008;22:1031–1048.
50.
Kamili S, Drobeniuc J, Araujo AC, Hayden TM. Laboratory diagnostics for hepatitis C virus infection. Clin Infect Dis 2012;55:43-48.
51.
Takaki A, Wiese M, Maertens G, Depla E, Seifert U, Liebetrau A, et al. Cellular immune responses persist and humoral responses decrease two decades after recovery from a single-source outbreak of hepatitis C. Nat Med 2000;6:578–582.
52.
Кулюшина, Е. А. Возможности ультразвукового исследования в диагностике хронических гепатитов и циррозов печени с позиций доказательной медицины. Медицинская визуализация. – 2009. – № 6. – С. 122 – 124.
53.
Singal, A. Meta-analysis: surveillance with ultrasound for early stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther. 2009;30:37-47.
54.
Castera, L. Prospective comparison of two algorithms combining non-invasive methods for staging liver fibrosis in chronic hepatitis C. J. Hepatol. 2010;52:191-198.
55.
Tsochatzis, E. A. Cost-effectiveness of noninvasive liver fibrosis tests for treatment decisions in patients with chronic hepatitis C. Hepatology. 2014;60(3):832-843.
56.
Zhang, W. Liver stiffness measurement, better than APRI, Fibroindex, Fib-4, and NBI gastroscopy, predicts portal hypertension in patients with cirrhosis. Cell Biochem Biophys. 2015;71(2):865-873.
57.
Castera, L. Noninvasive evaluation of portal hypertension using transient elastography. J. Hepatol. 2012;56(3):696-703.
58.
Chen, T., et al. Occult cirrhosis diagnosed by transient elastography is a frequent and under-monitored clinical entity. Liver Int. 2015;35(10):2285-2293.
59.
Nahon P, Bourcier V, Layese R, Audureau E, Cagnot C, Marcellin P, et al. Eradication of hepatitis C virus infection in patients with cirrhosis reduces risk of liver and non-liver complications. Gastroenterology 2017;15 2:142-56.
60.
Шерцингер, А. Г. Роль эндоскопии в выборе лечения больных портальной гипертензией. Анналы хирургической гепатологии. – 2015. – T. 20(2). – P. С. 20 – 30.
61.
Thabut D, Bureau C, Layese R, Bourcier V, Hammouche M, Cagnot C, et al. Validationof Baveno VI criteria for screening and surveillance of esophageal varices in patients with compensated cirrhosis and a sustained response to antiviral therapy. Gastroenterology 2019;156:997–1009.
62.
Кулюшина, Е. А. Синдромальный подход в лучевой диагностике цирроза печени. Клинические перспективы гастроэнтерологии, гепатологии. – 2009. – T. 6. – С.10 – 16.
63.
Трефилов, А. А. Лучевая диагностика гепатоцеллюлярного рака на фоне цирроза печени. Диагностическая и интервенционная радиология. – 2014. –T. 8(2-2). – С. 70 – 80.
64.
Teefey, S. A. Detection of primary hepatic malignancy in liver transplant candidates: prospective comparison of CT, MR imaging, US, and PET. Radiology 2003;226:533-542.
65.
Ющук, Н. Д. Протокол диагностики и лечения больных вирусными гепатитами В и С. Рос. журн. гастроэнтерол. гепатол. колопроктол. – 2010. – T. 20(6). – С. 4 – 60.
66.
Chen, T. Occult cirrhosis diagnosed by transient elastography is a frequent and under-monitored clinical entity. Liver Int. 2015;35(10):2285-2293.
67.
Шерцингер, А. Г. Роль эндоскопии в выборе лечения больных портальной гипертензией. Анналы хирургической гепатологии. – 2015. – T. 20(2). – P. С. 20 – 30.
68.
Zehui Yan, Yuming Wang. Viral and host factors associated with outcomes of hepatitis C virus infection (review). Molecular medicine reports 2017;15(5):2909-2924.
69.
Jakobsen JC, Nielsen EE, Feinberg J, et al. Direct-acting antivirals for chronic hepatitis C (Review). Cochrane Database of Systematic Reviews 2017, Issue 6. Art. No.: CD012143.
70.
Benjamin Schulte, Maximilian Wübbolding, Fiona Marra, et al. Frequency of Potential Drug–Drug Interactions in the Changing Field of HCV Therapy. Open Forum Infectious Diseases 2020;7(2).
71.
Pawlotsky JM. Retreatment of hepatitis C virus-infected patients with direct-acting antiviral failures. Semin Liver Dis 2019;39:354-368.
72.
Vermehren J, Susser S, Dietz J, von Hahn T, Petersen J, Hinrichsen H, et al. Retreatment of patients who failed DAA-combination therapies: realworld experience from a large hepatitis C resistance database. J Hepatol 2016;64(2):188.
73.
Sorbo MC, Cento V, Di Maio VC, Howe AYM, Garcia F, Perno CF, et al. Hepatitis C virus drug resistance associated substitutions and their clinical relevance: update 2018. Drug Resist Updat 2018;37:17-39.
74.
Poordad F, Pol S, Asatryan A, Buti M, Shaw D, Hezode C, et al. Glecaprevir/ pibrentasvir in patients with HCV genotype 1 or 4 and prior directacting antiviral treatment failure. Hepatology 2018;67:1253-1260.
75.
Wyles D, Weiland O, Yao B, Weilert F, Dufour JF, Gordon SC, et al. Retreatment of patients who failed glecaprevir/pibrentasvir treatment for hepatitis C virus infection. J Hepatol 2019;70:1019-1023.
76.
Feld JJ, Jacobson IM, Hezode C, Asselah T, Ruane PJ, Gruener N, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med 2015;373:2599-2607.
77.
Foster GR, Afdhal N, Roberts SK, Brau N, Gane EJ, Pianko S, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med 2015;373:2608-2617.
78.
Esteban R, Pineda JA, Calleja JL, Casado M, Rodriguez M, Turnes J, et al. Efficacy of sofosbuvir and velpatasvir, with and without ribavirin, in patients with hepatitis C virus genotype 3 infection and cirrhosis. Gastroenterology 2018;155:1120-1127.
79.
Mangia A, Milligan S, Khalili M, Fagiuoli S, Shafran S, Carrat F, et al. Global real-world evidence of sofosbuvir/velpatasvir as a simple, effective regimen for the treatment of chronic hepatitis C patients: integrated analysis of 12 clinical practice cohorts. J Hepatol 2019;70(Suppl.).
80.
Zeuzem S, Foster GR, Wang S, Asatryan A, Gane E, Feld JJ, et al. Glecaprevir- pibrentasvir for 8 or 12 weeks in HCV genotype 1 or 3 infection. N Engl J Med 2018;378:354–369.
81.
Kwo PY, Poordad F, Asatryan A, Wang S, Wyles DL, Hassanein T, et al. Glecaprevir and pibrentasvir yield high response rates in patients with HCV genotype 1-6 without cirrhosis. J Hepatol 2017;67:263-271.
82.
Toyoda H, Chayama K, Suzuki F, Sato K, Atarashi T, Watanabe T, et al. Efficacy and safety of glecaprevir/pibrentasvir in Japanese patients with chronic genotype 2 hepatitis C virus infection. Hepatology 2018;67:505-513.
83.
Flamm SL, Wyles DL, Wang S, Mutimer DJ, Rockstroh JK, Horsmans YJ, et al. Efficacy and safety of glecaprevir/pibrentasvir for 8 or 12 weeks in treatment-naïve patients with chronic HCV genotype 3: an integrated Phase 2/3 analysis. Hepatology 2017;66(Suppl.):35A.
84.
Krishnan P, Schnell G, Tripathi R, Ng T, Reisch T, Beyer J, et al. Pooled resistance analysis in HCV genotype 1-6-infected patients treated with glecaprevir/pibrentasvir in phase 2 and 3 clinical trials. J Hepatol 2017;66(Suppl. 1):500.
85.
Wei L, Wang G, Alami NN, Xie W, Heo J, Xie Q, et al. Glecaprevir/pibrentasvir to treat chronic hepatitis C virus infection in Asia: two multicentre, phase 3 studies - a randomised, double-blind study (VOYAGE-1) and an open-label, single-arm study (VOYAGE-2). Lancet Gastroenterol Hepatol 2020;5:839-849.
86.
Forns X, Lee SS, Valdes J, Lens S, Ghalib R, Aguilar H, et al. Glecaprevir plus pibrentasvir for chronic hepatitis C virus genotype 1, 2, 4, 5, or 6 infection in adults with compensated cirrhosis (EXPEDITION-1): a single-arm, open-label, multicentre phase 3 trial. Lancet Infect Dis 2017;17:1062-1068.
87.
Wyles D, Poordad F, Wang S, Alric L, Felizarta F, Kwo PY, et al. Glecaprevir/ pibrentasvir for hepatitis C virus genotype 3 patients with cirrhosis and/or prior treatment experience: a partially randomized phase 3 clinical trial. Hepatology 2018;67:514-523.
88.
Brown Jr RS, Buti M, Rodrigues L, Chulanov V, Chuang WL, Aguilar H, et al. Glecaprevir/pibrentasvir for 8 weeks in treatment-naive patients with chronic HCV genotypes 1-6 and compensated cirrhosis: the EXPEDITION-8 trial. J Hepatol 2020;72:441-449.
89.
Gupta N, Mbituyumuremyi A, Kabahizi J, Ntaganda F, Muvunyi CM, Shumbusho F, et al. Treatment of chronic hepatitis C virus infection in Rwanda with ledipasvir-sofosbuvir (SHARED): a single-arm trial. Lancet Gastroenterol Hepatol 2019;4:119-126.
90.
Zeng QL, Xu GH, Zhang JY, Li W, Zhang DW, Li ZQ, et al. Generic ledipasvir-sofosbuvir for patients with chronic hepatitis C: a real-life observational study. J Hepatol 2017;66:1123-1129.
91.
Manns M, Samuel D, Gane EJ, Mutimer D, McCaughan G, Buti M, et al. Ledipasvir and sofosbuvir plus ribavirin in patients with genotype 1 or 4 hepatitis C virus infection and advanced liver disease: a multicentre, open-label, randomised, phase 2 trial. Lancet Infect Dis 2016;16:685-697.
92.
Charlton M, Everson GT, Flamm SL, Kumar P, Landis C, Brown Jr RS, et al. Ledipasvir and sofosbuvir plus ribavirin for treatment of HCV infection in patients with advanced liver disease. Gastroenterology 2015;149:649-659.
93.
Jacobson IM, Lawitz E, Kwo PY, Hezode C, Peng CY, Howe AYM, et al. Safety and efficacy of elbasvir/grazoprevir in patients with hepatitis C virus infection and compensated cirrhosis: an integrated analysis. Gastroenterology 2017;152:1372-1382.
94.
Zeuzem S, Serfaty L, Vierling J, ChengW, George J, Sperl J, et al. The safety and efficacy of elbasvir and grazoprevir in participants with hepatitis C virus genotype 1b infection. J Gastroenterol 2018;53:679-688.
95.
Kramer JR, Puenpatom A, Erickson KF, Cao Y, Smith D, El-Serag HB, et al. Real-world effectiveness of elbasvir/grazoprevir in HCV-infected patients in the US Veterans Affairs Healthcare System. J Viral Hepat 2018;25:1270-1279.
96.
Flamm SL, Bacon B, Curry MP, Milligan S, Nwankwo CU, Tsai N, et al. Real-world use of elbasvir-grazoprevir in patients with chronic hepatitis C: retrospective analyses from the TRIO network. Aliment Pharmacol Ther 2018;47:1511-1522.
97.
Hernandez-Conde M, Fernandez I, Perello C, Gallego A, Bonacci M, Pascasio JM, et al. Effectiveness and safety of elbasvir/grazoprevir therapy in patients with chronic HCV infection: results from the Spanish HEPA-C real-world cohort. J Viral Hepat 2019;26:55-64.
98.
Wedemeyer H, Craxi A, Zuckerman E, Dieterich D, Flisiak R, Roberts SK, et al. Real-world effectiveness of ombitasvir/paritaprevir/ritonavir±dasabuvir±ribavirin in patients with hepatitis C virus genotype 1 or 4 infection: a meta-analysis. J Viral Hepat 2017;24:936–943.
99.
Welzel TM, Asselah T, Dumas EO, Zeuzem S, Shaw D, Hazzan R, et al. Ombitasvir, paritaprevir, and ritonavir plus dasabuvir for 8 weeks in previously untreated patients with hepatitis C virus genotype 1b infection without cirrhosis (GARNET): a single-arm, open-label, Phase 3b trial. Lancet Gastroenterol Hepatol 2017;2:494–500.
100.
Andreone P, Colombo MG, Enejosa JV, Koksal I, Ferenci P, Maieron A, et al. ABT-450, ritonavir, ombitasvir, and dasabuvir achieves 97% and 100% sustained virologic response with or without ribavirin in treatment- experienced patients with HCV genotype 1b infection. Gastroenterology 2014;147:359–365.
101.
Agarwal K, Dumas EO, Gaeta GB, Lee S, Streinu-Cercel A, Schott E, et al. Long-term clinical outcomes in HCV genotype 1-infected patients receiving ombitasvir/paritaprevir/ritonavir and dasabuvir±ribavirin: first interim safety and efficacy results from TOPAZ-I. Hepatology 2016;64:427.
102.
Welzel TM, Isakov V, Trinh R, Streinu-Cercel A, Dufour JF, Marinho RT, et al. Efficacy and safety of ombitasvir, paritaprevir/ritonavir and dasabuvir without ribavirin in patients with HCV genotype 1b with or without compensated cirrhosis: pooled analysis across 5 clinical trials. J Hepatol 2016;64:824.
103.
Wei L, Hou J, Luo Y, Heo J, Chu CJ, Duan ZP, et al. ONYX-I: safety and efficacy of ombitasvir/paritaprevir/ritonavir and dasabuvir in Asian adults with genotype 1b chronic hepatitis C virus (HCV) infection. A randomized, double-blind, placebo-controlled study. Hepatology 2016;64:432A.
104.
Feld JJ, Moreno C, Trinh R, Tam E, Bourgeois S, Horsmans Y, et al. Sustained virologic response of 100% in HCV genotype 1b patients with cirrhosis receiving ombitasvir/paritaprevir/r and dasabuvir for 12 weeks. J Hepatol 2016;64:301–307.
105.
Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T,Jacobson I, et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med 2014;370:211–221.
106.
Poordad F, Schiff ER, Vierling JM, Landis C, Fontana RJ, Yang R, et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation recurrence. Hepatology 2016;63:1493–1505.
107.
Nelson DR, Cooper JN, Lalezari JP, Lawitz E, Pockros PJ, Gitlin N, et al. All- Oral 12-week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY-3 Phase 3 Study. Hepatology 2015;61:1127–1135.
108.
Leroy V, Angus P, Bronowicki JP, Dore GJ, Hezode C, Pianko S, et al. Daclatasvir, sofosbuvir, and ribavirin for hepatitis C virus genotype 3 and advanced liver disease: A randomized phase III study (ALLY-3+). Hepatology 2016;63:1430–1441.
109.
Климова Е.А., Бурневич Э.З., Чуланов В.П. и соавт. Эффективность и безопасность безинтерфероновой комбинации нарлапревир/ритонавир и даклатасвир в популяции российских пациентов с хроническим гепатитом С. Tер. архив. – 2019. – № 91(8). – С. 67 – 73.
110. Климова Е.А., Бурневич Э.З., Чуланов В.П. и соавт. Нарлапревир, ритонавир и софосбувир у пациентов с хроническим гепатитом С, инфицированных генотипом 1 вируса, без цирроза печени. Инф. болезни: новости, мнения, обучение. – 2020. Том 9, № 1 (9). – С. 50 – 56.
111.
Terrault NA, Pawlotsky JM, McHutchison J, Anderson F, Krajden M, Gordon S, et al. Clinical utility of viral load measurements in individuals with chronic hepatitis C infection on antiviral therapy. J Viral Hepat 2005;12:465-472.
112.
Pierre Pradat, et al. Ribavirin at the era of novel direct antiviral agents for the treatment of hepatitis c virus infection: relevance of pharmacological monitoring. Advances in Hepatology Volume 2014, Article ID 493087, 13 pages.
113.
Ludovico Abenavoli, Marta Mazza, Piero L. Almasio. The optimal dose of ribavirin for chronic hepatitis C: From literature evidence to clinical practice. Hepat Mon. 2011;11(4):240-246.
114.
Fried MW, Shiffman ML, Reddy KR, Smith C, Marinos G, Goncales Jr FL, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002;347:975-982.
115.
Hadziyannis SJ, Sette Jr H, Morgan TR, Balan V, Diago M, Marcellin P, et al. Peginterferon-alpha2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med 2004;140:346-355.
116.
Manns MP, McHutchison JG, Gordon SC, Rustgi VK, Shiffman M, Reindollar R, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001;358:958-965.
117.
Fried MW. Side effects of therapy of hepatitis C and their management. Hepatology 2002;36 (Suppl. 1):S237-S244.
118.
Kalyan RB, Sanjaya KS, Paul M. Hepatitis C Virus and Liver Transplantation. Gastroenterology & Hepatology 2017;13(4):214-220.
119.
Gee I, Alexander G. Liver transplantation for hepatitis C virus related liver disease. Postgrad Med J 2005;81:765-771.
120.
Elizabeth C Verna, Robert S Brown, Jr. Hepatitis C virus infection in liver transplant candidates and recipients. Last updated: Apr 12, 2021.
121.
Ríos Castellanos, E. Endoscopic injection of cyanoacrylate glue versus other endoscopic procedures for acute bleeding gastric varices in people with portal hypertension. Cosp. Cochrane Database Syst Rev. 2015;5:1018.
122.
Хубутия, М. Ш. Эндоскопическое лигирование в остановке и профилактике кровотечения из варикозно расширенных вен пищевода и желудка/ М. Ш. Хубутия, Т. П. Пинчук, С. С. Согрешилин// Клинические перспективы гастроэнтерологии, гепатологии. – 2012. – V. 1. – P. 10 – 15.
123.
Шишин, К. В. Лигирование варикозно расширенных вен пищевода как метод профилактики кровотечений портального генеза/ К. В. Шишин, И. Г. Бакулин, И. Ю. Недолужко// Фарматека. – 2016. – V. 2. – P. 31 – 35.
124.
Fagiuoli, S. Consensus conference on TIPS management: Techniques, indications, contraindications/ S. Fagiuoli, R. Bruno, W. Debernardi Venon et al.// AISF TIPS Special Conference. Dig Liver Dis. 2017;49(2):121-137.
125.
Khan, S. Portosystemic shunts versus endoscopic therapy for variceal rebleeding in patients with cirrhosis/ S. Khan, S. C. Tudur, P. Williamson, R. Sutton// Cochrane Database Syst Rev. 2006;4:553.
126.
Aithal GP, Palaniyappan N, China L, et al. Guidelines on the management of ascites in cirrhosis. Gut. 2021;70(1):9-29.
127.
Negro F, Forton D, Craxi A, Sulkowski MS, Feld JJ, Manns MP. Extrahepatic morbidity and mortality of chronic hepatitis C. Gastroenterology 2015;149:1345-1360.
128.
Mahale P, Engels EA, Li R, Torres HA, Hwang LY, Brown EL, et al. The effect of sustained virological response on the risk of extrahepatic manifestations of hepatitis C virus infection. Gut 2018;67:553-561.
129.
Negro F. Expanded benefits of curing the extrahepatic manifestations of HCV infection. Gut 2018;67:1917-1919.
130.
Lacombe, K. HIV and viral hepatitis coinfections: advances and challenges. Gut 2012;61(Suppl 1):47-58.
131.
Qurishi, N. Effect of antiretroviral therapy on liver-related mortality in patients with HIV and hepatitis C virus coinfection. Lancet 2003;22, 362 (9397):1708-1713.
132.
Naggie S, Cooper C, Saag M, Workowski K, Ruane P, Towner WJ, et al. Ledipasvir and sofosbuvir for HCV in patients coinfected with HIV-1. N Engl J Med 2015;373:705-713.
133.
Townsend KS, Osinusi A, Nelson AK, Kohli A, Gross C, Polis MA, et al. High efficacy of sofosbuvir/ledipasvir for the treatment of HCV genotype 1 in patients coinfected with HIV on and off antiretroviral therapy: results from the NIAID ERADICATE trial. Hepatology 2014;60:240A-241A.
134.
Wyles D, Brau N, Kottilil S, Daar E, Workowski K, Luetkemeyer A, et al. Sofosbuvir/velpatasvir fixed dose combination for 12 weeks in patients coinfected with HCV and HIV-1: the Phase 3 ASTRAL-5 study. J Hepatol 2016;64:S188-S189.
135.
Wyles DL, Sulkowski MS, Eron JJ, Trinh R, Lalezari J, Slim J, et al. TURQUOISE-I: 94% SVR12 in HCV/HIV-1 coinfected patients treated with ABT-450/r/ombitasvir, dasabuvir and ribavirin. Hepatology 2014;60:1136A-1137A.
136.
Rockstroh JK, Nelson M, Katlama C, Lalezari J, Mallolas J, Bloch M, et al. Efficacy and safety of grazoprevir (MK-5172) and elbasvir (MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE COINFECTION): a non-randomised, open-label trial. Lancet HIV 2015;2:e319-e327.
137.
Luetkemeyer AF, McDonald C, Ramgopal M, Noviello S, Bhore R, Ackerman P. 12 weeks of daclatasvir in combination with sofosbuvir for HIV-HCV coinfection (ALLY-2 study): efficacy and safety by HIV combination antiretroviral regimens. Clin Infect Dis 2016;62:1489-1496.
138.
Konstantinou D, Deutsch M. The spectrum of HBV/HCV coinfection: epidemiology, clinical characteristics, viral interactions and management. Ann Gastroenterol 2015;28:221-8.
139.
Donato F, Boffetta P, Puoti M. A meta-analysis of epidemiological studies on the combined effect of hepatitis B and C virus infections in causing hepatocellular carcinoma. Int J Cancer 1998;75(3):347-54.
140.
De Monte A, Courjon J, Anty R, Cua E, Naqvi A, Mondain V, et al. Direct-acting antiviral treatment in adults infected with hepatitis C virus: Reactivation of hepatitis B virus coinfection as a further challenge. J Clin Virol 2016;78:27-30.
141.
Wang C, Ji D, Chen J, Shao Q, Li B, Liu J, et al. Hepatitis due to reactivation of hepatitis B virus in endemic areas among patients with hepatitis C treated with direct-acting antiviral agents. Clin Gastroenterol Hepatol 2017;15:132-136.
142.Marcus M Mücke,et al. Hepatitis B virus reactivation during direct-acting antiviral therapy for hepatitis C: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2018 Mar;3(3):172-180.
143.
Yi-Fen Shih, Chun-Jen Liu. Hepatitis c virus and hepatitis B virus co-infection.
144.
Calvaruso V, Ferraro D, Licata A, Bavetta MG, Petta S, Bronte F, et al. HBV reactivation in patients with HCV/HBV cirrhosis on treatment with direct-acting antivirals. J Viral Hepat. 2018;25:72-79.
145.
Belperio PS, Shahoumian TA, Mole LA, Backus LI. Evaluation of hepatitis B reactivation among 62920 veterans treated with oral hepatitis C antivirals. Hepatology 2017;66:27-36.
146.
Pockros PJ, Reddy KR, Mantry PS, Cohen E, Bennett M, Sulkowski MS, et al. Efficacy of direct-acting antiviral combination for patients with hepatitis C virus genotype 1 infection and severe renal impairment or end-stage renal disease. Gastroenterology 2016;150:1590-1598.
147.
Roth D, Nelson DR, Bruchfeld A, Liapakis A, Silva M, Monsour Jr H, et al. Grazoprevir plus elbasvir in treatment-naive and treatment-experienced patients with hepatitis C virus genotype 1 infection and stage 4– 5 chronic kidney disease (the C-SURFER study): a combination phase 3 study. Lancet 2015;386:1537-1545.
148.
Bruchfeld A, Roth D, Martin P, Nelson DR, Pol S, Londono MC, et al. Elbasvir plus grazoprevir in patients with hepatitis C virus infection and stage 4–5 chronic kidney disease: clinical, virological, and healthrelated quality-of-life outcomes from a phase 3, multicentre, randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol 2017;2:585-594.
149.
Kramer JR, Puenpatom A, Erickson K, Cao Y, Smith DL, El-Serag HB, et al. Effectiveness of elbasvir/grazoprevir in patients with chronic hepatitis C and chronic kidney disease: results from the Veterans Affairs system.Hepatology 2017;66:597A.
150.
Cornberg M, Negro F, Lampertico P, Turne s J, Curry M, Brown A, et al. Real-world effectiveness and safety of glecaprevir/pibrentasvir in adults with chronic hepatitis C virus infection: a meta-analysis. J Hepatol 2019;70:e113 e114.
151.
Gane E, Lawitz E, Pugatch D, Papatheodoridis G, Brau N, Brown A, et al. Glecaprevir and pibrentasvir in patients with HCV and severe renal impairment. N Engl J Med 2017;377:1448-1455.
152.
Pol S, Pockros P, Pugatch D, Brau N, Landis C, Elkhashab M, et al. Safety and efficacy of glecaprevir/pibrentasvir in adults with chronic hepatitis C virus infection genotype 1-6 and chronic kidney disease: an integrated analysis. J Hepatol 2017;66(Suppl. 1):S738.
153.
Lawitz E, Landis CS, Flamm SL, Bonacini M, Ortiz-Lasanta G, Huang J, et al. Sofosbuvir plus ribavirin and sofosbuvir plus ledipasvir in patients with genotype 1 or 3 hepatitis C virus and severe renal impairment: a multicentre, phase 2b, non-randomised, open-label study. Lancet Gastroenterol Hepatol 2020. Epub ahead of print.
154.
Borgia SM, Dearden J, Yoshida EM, Shafran SD, Brown A, Ben-Ari Z, et al. Sofosbuvir/velpatasvir for 12 weeks in hepatitis C virus-infected patients with end-stage renal disease undergoing dialysis. J Hepatol 2019;71:660-665.
155.
Cox-North P, Hawkins KL, Rossiter ST, Hawley MN, Bhattacharya R, Landis CS. Sofosbuvir-based regimens for the treatment of chronic hepatitis C in severe renal dysfunction. Hepatol Commun 2017;1:248-255.
156.
Poustchi H, et al. The combination of sofosbuvir and daclatasvir is effective and safe in treating patients with hepatitis C and severe renal impairment. J Gastroenterol Hepatol. 2020 Sep;35(9):1590-1594.
157.
Mingshu Li, Jun Chen, Zhixiong Fang, et al. Sofosbuvir-based regimen is safe and effective for hepatitis C infected patients with stage 4-5 chronic kidney disease: a systematic review and meta-analysis. Virology Journal 2019;16:34.
158.
Gane E, Pilmore H. Management of chronic viral hepatitis before and after renal transplantation. Transplantation 2002;74:427-437.
159.
Perricone G, Duvoux C, Berenguer M, Cortesi PA, Vinaixa C, Facchetti R, et al. Delisting HCV-infected liver transplant candidates who improved after viral eradication: outcome 2 years after delisting. Liver Int 2018;38:2170-2177.
160.
Pascasio JM, Vinaixa C, Ferrer MT, Colmenero J, Rubin A, Castells L, et al. Clinical outcomes of patients undergoing antiviral therapy while awaiting liver transplantation. J Hepatol 2017;67:1168-1176.
161.
El-Sherif O, Jiang ZG, Tapper EB, Huang KC, Zhong A, Osinusi A, et al. Baseline factors associated with improvements in decompensated cirrhosis after direct-acting antiviral therapy for hepatitis C virus infection. Gastroenterology 2018;154:2111-2121.
162.
Коробка В.Л., и соавт. Развитие рекомпенсации у больных HCV-ассоциированным декомпенсированны циррозом печени после терапии современными препаратами прямого противовирусного действия. Доказательная гастроэнтерология 2019;8(4-5):11-21.
163.
Сюткин В.Е., и соавт. Современные тенденции в лечении гепатита С до и после трансплантации печени. Инфекционные болезни 2020;18(2):5-13.
164.
Хубутия М.Ш., и соавт. Рекомендации по профилактике и лечению инфекций вирусами гепатита В и С у больных, находящихся в Листе ожидания трансплантации печени, и реципиентов печени. Трансплантология 2020;12(3):231-244.
165.
Cortesi PA, et al. The optimal timing of hepatitis C therapy in liver transplant-eligible patients: Cost-effectiveness analysis of new opportunities. J Viral Hepat 2018 Jul;25(7):791-801.
166.Jagpreet Chhatwal, et al. Optimal timing of hepatitis C treatment for patients on the liver transplant waiting list. Hepatology 2017 Mar;65(3):777-788.
167.
Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015;373:2618-2628.
168.
Lu M,Wu KH, Li J, Moorman AC, Spradling PR, Teshale EH, et al. Adjuvant ribavirin and longer direct-acting antiviral treatment duration improve sustained virological response among hepatitis C patients at risk of treatment failure. J Viral Hepat 2019;26:1210-1217.
169.
Poordad F, Schiff ER, Vierling JM, Landis C, Fontana RJ, Yang R, et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation recurrence. Hepatology 2016;63:1493–1505.
170.Michael Charlton, et al. Ledipasvir and sofosbuvir plus ribavirin for treatment of hcv infection in patients with advanced liver disease. Gastroenterology 2015;149(3):649-659.
171.
Chen-Hua Liu, et al. Real-world effectiveness and safety of sofosbuvir and ledipasvir with or without ribavirin for patients with hepatitis C virus genotype 1 infection in Taiwan. PLoS One, published on December 21, 2018.
172.
Charlton MR, Cheung MC, Manns MP, Sajed N, Troke P, Spellman JG, et al. Ledipasvir/sofosbuvir + ribavirin (LDV/SOF + RBV) for 12 weeks in decompensated HCV genotype 1 patients: SOLAR-1 and -2 studies compared to a real-world dataset. Hepatology 2016;64:489A-490A.
173.
Flamm SL, Everson GT, Charlton M, Denning JM, Arterburn S, Brandt- Sarif T, et al. Ledipasvir/sofosbuvir with ribavirin for the treatment of HCV in patients with decompensated cirrhosis: preliminary results of a prospective, multicenter study. Hepatology 2014;60:320A.
174.
Хубутия М.Ш., и соавт. Лечение гепатита C у реципиентов печени в Московском центре трансплантации печени в течение 10 лет. Трансплантология 2013;2:5-12.
175.
Сюткин В.Е., Е.Н. Бессонова М.Н. Терапия возвратного гепатита C после трансплантации печени препаратами прямого противовирусного действия: опыт трёх российских центров. Эпидемиология и инфекционные болезни, 2018;23(1):4-14.
176.Berenguer M, et al. Clinical benefits of antiviral therapy in patients with recurrent hepatitis C following liver transplantation. Am J Transplant 2008 Mar;8(3):679-87.
177.
Picciotto FP, Tritto G, Lanza AG, Addario L, De Luca M, Di Costanzo GG, et al. Sustained virological response to antiviral therapy reduces mortality in HCV reinfection after liver transplantation. J Hepatol 2007;46:459-465.
178.
Хубутия М.Ш., et al., Применение софосбувира для лечения возвратного гепатита С после трансплантации печени. Трансплантология, 2017;9(1):13-22.
179.
Brown R. S. Interferon-free therapy for genotype 1 hepatitis C in liver transplant recipients: Real-world experience from the hepatitis C therapeutic registry and research network. Liver Transpl. 2016;22(1):24-33.
180.
Agarwal K, Castells L, Mullhaupt B, Rosenberg WMC, McNabb B, Arterburn S, et al. Sofosbuvir/velpatasvir for 12 weeks in genotype 1-4 HCV-infected liver transplant recipients. J Hepatol 2018;69:603-607.
181.
Eisenberger U, Guberina H, Willuweit K, Bienholz A, Kribben A, Gerken G, et al. Successful treatment of chronic hepatitis C virus infection with sofosbuvir and ledipasvir in renal transplant recipients. Transplantation 2017;101:980-986.
182.
Reau N, Kwo PY, Rhee S, Brown RS, Agarwal K, Angus P, et al. MAGELLAN-2: safety and efficacy of glecaprevir/pibrentasvir in liver or renal transplant adults with chronic hepatitis C genotype 1–6 infection. J Hepatol 2017;66:90.
183.
Ian A. Rowe, et al. Hepatitis A virus vaccination in persons with hepatitis C virus infection: Consequences of Quality Measure Implementation. Hepatology 2012; 56(2):501-6.
184.Jiaye Liu, Hui Wu, Hui Chen. Immune response to hepatitis B vaccine in patients with chronic hepatitis C infection: A systematic review and meta-analysis. Hepatol Res 2018 Feb;48(2):119-126.
185.Jennifer R. Kramer, et al. Meeting vaccination quality measures for hepatitis A and B virus in patients with chronic hepatitis C infection. Hepatology 2011; 53(1):42-52.
186.
Emily Henkle, et al. Hepatitis A and B Immunity and Vaccination in Chronic Hepatitis B and C Patients in a Large United States Cohort. Clinical Infectious Diseases 2015;60(4):514-522.
187.Xiaofei Gao, et al. Prevalence and trend of hepatitis C virus infection among blood donors in Chinese mainland: a systematic review and meta-analysis. BMC Infectious Diseases 2011;11:88.
188.Pozzetto B, Memmi M, Garraud O, et al. Health care-associated hepatitis C virus infection. World J Gastroenterol. 2014; 20(46):17265-17278.
189.
Thursz M, Fontanet A. HCV transmission in industrialized countries and resource-constrained areas. Gastroenterol. Hepatol.2014;11:28–35.
190.Alastair Heffernan, et al. Scaling up prevention and treatment towards the elimination of hepatitis C: a global mathematical model. Lancet. 2019 Mar 30;393(10178):1319-1329.
191.
Conte D, Fraquelli M, Prati D, Colucci A, Minola E. Prevalence and clinical course of chronic hepatitis C virus (HCV) infection and rate of HCV vertical transmission in a cohort of 15,250 pregnant women. Hepatology. 2000;31(3):751-755.
192.
Gervais A, Bacq Y, Bernuau J, Martinot M, Auperin A, Boyer N, et al. Decrease in serum ALT and increase in serum HCV RNA during pregnancy in women with chronic hepatitis C. J Hepatol. 2000;32(2):293-299.
193
Jhaveri R, Hashem M, El-Kamary SS, Saleh D"aA, Sharaf SA, El-Mougy F, et al. Hepatitis C virus (HCV) vertical transmission in 12-month-old infants born to HCV-infected women and assessment of maternal risk factors. Open Forum Infect Dis. 2015;2(2):89.
194.
Shebl FM, El-Kamary SS, Saleh D"aA, et al. Prospective cohort study of mother-to-infant infection and clearance of hepatitis C in rural Egyptian villages. J Med Virol. 2009;81(6):1024-1031.
195.
Puljic A, Salati J, Doss A, Caughey AB. Outcomes of pregnancies complicated by liver cirrhosis, portal hypertension, or esophageal varices. J Matern Fetal Neonatal Med. 2016;29(3):506-509.
196.
Tan J, Surti B, Saab S. Pregnancy and cirrhosis. Liver Transpl. 2008;14(8):1081-1091.
197.Rosalia Ragusa, et al. Hepatitis C Virus Infection in Children and Pregnant Women: An Updated Review of the Literature on Screening and Treatments. AJP Rep. 2020 Jan; 10(1): 121-127.
198.
Санитарно-эпидемиологические правила СП 3.1.3112-13 "Профилактика вирусного гепатита С" (утв. постановлением Главного государственного санитарного врача РФ от 22 октября 2013 г. N 58).
199.
Chappell CA, Krans EE, Bunge K, et al. A phase 1 study of ledipasvir/sofosbuvir in pregnant women with hepatitis C virus [abstract 87]. Conference on Retroviruses and Opportunistic Infections. Seattle, WA; 2019.
200.
Yattoo GN. Treatment of chronic hepatitis C with ledipasvir/sofosbuvir combination during pregnancy [Abstract]. Hepatol Int. 2018;12(2):292-293.
201.
Susan M. Sinclair, et al. The Ribavirin Pregnancy Registry: An Interim Analysis of Potential Teratogenicity at the Mid-Point of Enrollment. Drug Saf 2017;40:1205–1218.
202.Anna Maria Spera, Tarek Kamal Eldin,Grazia Tosone, Raffaele Orlando. Antiviral therapy for hepatitis C: has anything changed for pregnant/lactating women? World J Hepatol. 2016;8(12): 557–565.
203.
Centers for Disease Control and Prevention (CDC). Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. MMWR Recomm Rep. 1998;47(RR-19):1-39.
204.
Resti M, Azzari C, Mannelli F, Moriondo M, Novembre E, de Martino M, et al. Mother to child transmission of hepatitis C virus: prospective study of risk factors and timing of infection in children born to women seronegative for HIV-1. Tuscany study group on hepatitis C virus infection. BMJ. 1998;317(7156):437-441.
205.Gregory J Dore, et al. Simplified monitoring for hepatitis C virus treatment with glecaprevir plus pibrentasvir, a randomised non-inferiority trial. J Hepatol 2020 Mar;72(3):431-440.
206.JS Davis, et al. Minimal Compared With Standard Monitoring During Sofosbuvir-Based Hepatitis C Treatment: A Randomized Controlled Trial. Open Forum Infect Dis. 2020 Feb; 7(2): ofaa022.
207.
Chandana Papudesu, et al. Elbasvir/grazoprevir for treatment of chronic hepatitis C virus infection. Hepatol Int DOI 10.1007/s12072-016-9761-2.
208.
Ossama Ashraf Ahmed, et al. Sofosbuvir Plus Daclatasvir in Treatment of Chronic Hepatitis C Genotype 4 Infection in a Cohort of Egyptian Patients: An Experiment the Size of Egyptian Village. Hindawi International Journal of Hepatology Volume 2018, Article ID 9616234, 5 pages.
209.
Гусев Д.А., Климова Е.А., Знойко О.О. и соавт. Эффективность и безопасность 8-недельной терапии хронического гепатита С комбинацией препаратов, включающей ингибитор протеазы нарлапревир. Инфекционные болезни: новости, мнения, обучение 2020;9(3):41-48.
210.
Raffaella Lionetti, et al. Daclatasvir, sofosbuvir with or without ribavirin for 24 weeks in hepatitis C genotype 3 cirrhosis: A real-life study. Annals of Hepatology 18 (2019) 434-438.
211.
H. Omar, et al. Generic daclatasvir plus sofosbuvir, with or without ribavirin, in treatment of chronic hepatitis C: real-world results from 18 378 patients in Egypt. Aliment Pharmacol Ther. 2017;1-11.
212.
Gane EJ, et al. Sofosbuvir-velpatasvir with ribavirin for 24 weeks in hepatitis C virus patients previously treated with a direct-acting antiviral regimen. Hepatology. 2017 Oct;66(4):1083-1089.
213.
Afdhal N, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection.N Engl J Med 2014 May 15;370(20):1889-98.
214.
Gane E, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. Gastroenterology 2015;149:1454-64.
215.
Buggisch P, et al. Real-world effectiveness and safety of sofosbuvir/velpatasvir and ledipasvir/sofosbuvir hepatitis C treatment in a single centre in Germany. PLoS One 2019;14:e0214795.
216.
Shiha G, et al. Ledipasvir/sofosbuvir with or without ribavirin for 8 or 12 weeks for the treatment of HCV genotype 4 infection: results from a randomised phase III study in Egypt. Gut 2019;68:721-8.
217.
Abergel A, et al. Ledipasvir plus sofosbuvir for 12 weeks in patients with hepatitis C genotype 4 infection. Hepatology 2016;64:1049-56.
218.
Bourgeois S, et al. Prescription and efficacy of daclatasvir and sofosbuvir ± ribavirin for hepatitis C infection, including patient-reported outcomes, in routine practice in three European countries: The CMPASS-EU cohort study. COGENT MEDICINE 2020;7(1).
219
Sulkowski MS, et al. Daclatasvir plus Sofosbuvir for Previously Treated or Untreated Chronic HCV Infection. N Engl J Med 2014 Jan 16;370(3):211-21.
220.
Pol S, et al. Safety and efficacy of daclatasvir-sofosbuvir in HCV genotype 1-mono-infected patients. J Hepatol 2017 Jan;66(1):39-47.
221.
Chung-Feng Huang, et al. An open-label, randomized, active control trial of 8 versus 12 weeks of elbasvir/grazoprevir for treatment-naïve chronic hepatitis C genotype 1b patients with mild fibrosis (EGALITE): Impact of baseline viral loads and NS5A resistance-associated substitution. J Infect Dis 2019 Jul 19;220(4):557-566.
222.
Tarik Asselah, et al. Efficacy and safety of elbasvir/grazoprevir for 8 or 12 weeks for hepatitis C virus genotype 4 infection: a randomized study. Liver Int 2020 May;40(5):1042-1051.
223.
Tarik Asselah, et al. Efficacy of Elbasvir and Grazoprevir in Participants with Hepatitis C Virus Genotype 4 Infection: A Pooled Analysis. Liver Int 2018 Sep;38(9):1583-1591.
224.
Eric Lawitz, et al. Short-duration Treatment With Elbasvir/Grazoprevir and Sofosbuvir for Hepatitis C: A Randomized Trial. Hepatology 2017 Feb;65(2):439-450.
225.
Armand Abergel, et al. Ledipasvir Plus Sofosbuvir for 12 Weeks in Patients With Hepatitis C Genotype 4 Infection. Hepatology 2016 Oct;64(4):1049-56.
226.
Allison M. Bell, et al. Elbasvir/Grazoprevir: A Review of the Latest Agent in the Fight against Hepatitis C Int J Hepatol. 2016;2016:3852126.
227.
Tania M Welzel, et al. Daclatasvir plus sofosbuvir, with or without ribavirin, achieved high sustained virological response rates in patients with HCV infection and advanced liver disease in a real-world cohort. Gut. 2016 Nov;65(11):1861-1870.
228.Gregory J Dore, et al. Simplified monitoring for hepatitis C virus treatment with glecaprevir plus pibrentasvir, a randomised non-inferiority trial. J Hepatol. 2020 Mar;72(3):431-440.
229.
Pietro Lampertico, et al. Real-World Clinical Practice Use of 8-Week Glecaprevir/Pibrentasvir in Treatment-Naı¨ve Patients with Compensated Cirrhosis. Adv Ther. 2020 Sep;37(9):4033-4042.
230.
Saifu H. N., et al. Evaluation of human immunodeficiency virus and hepatitis C telemedicine clinics Am J Manag Care. 2012 Apr;18(4):207-12.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Ивашкин Владимир Трофимович – д.м.н., профессор, академик РАН, Президент Российской гастроэнтерологической ассоциации и Российского общества по изучению печени, заведующий кафедрой пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), заслуженный врач РФ, заслуженный деятель науки РФ.
Ющук Николай Дмитриевич – д.м.н., профессор, академик РАН, Президент ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, заведующий кафедрой инфекционных болезней и эпидемиологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, заслуженный деятель науки РФ.
Богомолов Павел Олегович – к.м.н., руководитель отделения гепатологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского.
Волчкова Елена Васильевна – д.м.н., профессор, заведующая кафедрой инфекционных болезней Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
Дмитриев Александр Сергеевич – к.м.н., руководитель Центра эпидемически значимых инфекционных болезней ФГБУ "НМИЦ ФПИ" Минздрава России, врач-инфекционист.
Жаркова Мария Сергеевна – к.м.н., заведующая отделением гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
Жданов Константин Валерьевич –д.м.н., профессор, член-корр. РАН, начальник кафедры инфекционных болезней (с курсом медицинской паразитологии и тропических заболеваний) ФГКВОУ ВПО «ВМА им. С. М. Кирова» Минобороны России.
Знойко Ольга Олеговна – д.м.н., профессор кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России.
Климова Елена Анатольевна – д.м.н., профессор кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России.
Козлов Константин Вадимович – д.м.н., доцент кафедры инфекционных болезней (с курсом медицинской паразитологии и тропических заболеваний) ФГКВОУ ВПО «ВМА им. С. М. Кирова» Минобороны России.
Кравченко Ирина Эдуардовна – д.м.н. доцент, профессор кафедры инфекционных болезней ФГБОУ ВО Казанский ГМУ Минздрава России.
Маевская Марина Викторовна – д.м.н., профессор ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), консультант ЛДО3 УКБ 2.
Малинникова Елена Юрьевна – д.м.н., доцент, заведующая кафедрой вирусологии ФГБОУ ДПО РМАНПО Минздрава России.
Мамонова Нина Алексеевна – научный сотрудник лаборатории генетических технологий и трансляционных исследований ФГБУ «НМИЦ ФПИ» Минздрава России.
Масленников Роман Вячеславович – к.м.н., ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
Михайлов Михаил Иванович – д.м.н., профессор, член-корреспондент РАН, заведующий лабораторией вирусных гепатитов ФГБНУ НИИВС им. И.И. Мечникова.
Новак Ксения Егоровна – к.м.н., доцент кафедры инфекционных болезней взрослых и эпидемиологии ФГБОУ ВО СПбГПМУ Минздрава России.
Никитин Игорь Геннадиевич – д.м.н., профессор, заведующий кафедрой госпитальной терапии №2 лечебного факультета ФГАУ ВО «Российский национальный исследовательский университет им. Н.И. Пирогова» Минздрава России, директор ФГАУ НМИЦ «Лечебно-реабилитационный центр» Минздрава России.
Сюткин Владимир Евгеньевич – д.м.н., ведущий научный сотрудник отделения трансплантации печени ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ», профессор кафедры хирургии с курсами онкохирургии, эндоскопии, хирургической патологии, клинической трансплантологии и органного донорства ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России.
Тихонов Игорь Николаевич – ассистент кафедры пропедевтики, гастроэнтерологии и гепатологии ИКМ Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), врач-гастроэнтеролог отделения гепатологии УКБ 2.
Чуланов Владимир Петрович – д.м.н., профессор, главный внештатный специалист по инфекционным болезням Минздрава России, заместитель директора по научной работе и инновационному развитию ФГБУ «НМИЦ ФПИ» Минздрава России.
Шептулин Аркадий Александрович – д.м.н., профессор кафедры пропедевтики внутренних болезней гастроэнтерологии и гепатологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
Широкова Елена Николаевна – д.м.н., профессор кафедры пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
Эсауленко Елена Владимировна – д.м.н., профессор, заведующая кафедрой инфекционных болезней взрослых и эпидемиологии ФГБОУ ВО СПбГПМУ Минздрава России.
Приложение А2. Методология разработки клинических рекомендаций
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе ХВГС, а также ознакомить их с применяющимся в настоящее время алгоритмами ее диагностики и лечения.
Целевая аудитория данных клинических рекомендации:
1. Врачи-инфекционисты;
2.
Врачи-гастроэнтерологи;
3.
Врачи общей практики (семейные врачи);
4.
Врачи-терапевты.
Табл. П1.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Не сравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Табл. П2.
Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств (УДД)
| УДД | Расшифровка |
| 1. | Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2. | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3. | Не рандомизированные сравнительные исследования, в том числе когортные исследования |
| 4. | Не сравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
| 5. | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение эксперта |
Табл. П3.
Уровни убедительности рекомендаций (УУР) с указанием использованной классификации уровней убедительности рекомендаций
| УУР | Расшифровка |
| А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений и/или замечаний к ранее утверждённым клиническим рекомендациям, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Министерства здравоохранения и социального развития Российской Федерации от 31 января 2012 г. № 69н "Об утверждении Порядка оказания медицинской помощи взрослым больным при инфекционных заболеваниях";
2.
Приказ Министерства здравоохранения и социального развития Российской Федерации от 02.06.2010 № 415н “Об утверждении Порядка оказания медицинской помощи населению при заболеваниях гастроэнтерологического профиля”;
3.
Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. N 203н "Об утверждении критериев оценки качества медицинской помощи»;
4.
Приказ Минздрава России от 07.11.2012 N 685н "Об утверждении стандарта специализированной медицинской помощи при хроническом вирусном гепатите C".
Схемы противовирусной терапии хронического вирусного гепатита С с учетом генотипа, опыта предшествующей терапии, наличия цирроза печени
(названия лекарственных средств указаны в алфавитном порядке)
| Пациентам, инфицированным ВГС ГТ 1 |
| Схема 1 Велпатасвир + софосбувир** ВЕЛ+СОФ** 1 таб. (100/400 мг) 1 р/д. 12 недель – для пациентов без ЦП или с компенсированным ЦП, в том числе ранее получавших лечение ПегИФН** + РБВ** ± СОФ** и/или препаратами, ингибирующими NS3/4А, и пациентов с рецидивом ХГС после трансплантации печени и солидных органов. 24 недели – с добавлением РБВ** 1000 или 1200 мг при весе <75 кг или ≥75 кг соответственно для пациентов без ЦП или с компенсированным ЦП печени, ранее получавшим лечение режимом, включающим препараты, ингибирующие NS5A, в том числе с рецидивом ХГС после трансплантации печени и солидных органов.
Схема 2
Схема 3
Схема 4
Схема 5
Схема 6
Схема 7
Схема 8 |
| Пациентам, инфицированным ВГС ГТ 2 |
| Схема 1 Велпатасвир + софосбувир** ВЕЛ+СОФ** 1 таб. (100/400 мг) 1 р/д. 12 недель – для пациентов без ЦП или с компенсированным ЦП, в том числе ранее получавших лечение ПегИФН** + РБВ** ± СОФ** и/или препаратами, ингибирующими NS3/4А, и пациентов с рецидивом ХГС после трансплантации печени и солидных органов. 24 недели – с добавлением РБВ** 1000 или 1200 мг при весе <75 кг или ≥75 кг соответственно для пациентов без ЦП или с компенсированным ЦП печени, ранее получавшим лечение режимом, включающим препараты, ингибирующие NS5A, в том числе с рецидивом ХГС после трансплантации печени и солидных органов.
Схема 2
Схема 3 |
| Пациентам, инфицированным ВГС ГТ 3 |
| Схема 1 Велпатасвир + софосбувир** ВЕЛ+СОФ** 1 таб. (100/400 мг) 1 р/д. 12 недель – для пациентов без ЦП, в том числе ранее получавших лечение ПегИФН** + РБВ** ± СОФ** и/или препаратами, ингибирующими NS3/4А, и пациентов с рецидивом ХГС после трансплантации печени и солидных органов; 24 недели – с добавлением РБВ** 1000 или 1200 мг при весе <75 кг или ≥75 кг соответственно для пациентов без ЦП или с компенсированным ЦП печени, ранее получавшим лечение режимом, включающим препараты, ингибирующие NS5A, в том числе с рецидивом ХГС после трансплантации печени и солидных органов.
Схема 2
Схема 3
Схема 4
Схема 5 |
| Пациентам, инфицированным ВГС ГТ 4 |
| Схема 1 Велпатасвир + софосбувир** ВЕЛ+СОФ** 1 таб. (100/400 мг) 1 р/д. 12 недель – для пациентов без ЦП или с компенсированным ЦП, в том числе ранее получавших лечение ПегИФН** + РБВ** ± СОФ** и/или препаратами, ингибирующими NS3/4А, и пациентов с рецидивом ХГС после трансплантации печени и солидных органов; 24 недели – с добавлением РБВ** 1000 или 1200 мг при весе <75 кг или ≥75 кг соответственно для пациентов без ЦП или с компенсированным ЦП печени, ранее получавшим лечение режимом, включающим препараты, ингибирующие NS5A, в том числе с рецидивом ХГС после трансплантации печени и солидных органов.
Схема 2
Схема 3
Схема 4
Схема 5 |
| Пациентам с декомпенсированным ЦП |
| Схема 1 (все ГТ) Велпатасвир + софосбувир** + рибавирин** 12 недель ВЕЛ+СОФ** 1 таб. (100/400 мг) 1 р/д + РБВ** 1000 или 1200 мг при весе <75 кг или ≥75 кг соответственно. Для пациентов с декомпенсированным ЦП (класс В или класс С), в том числе у пациентов с предшествующей неудачей ПегИФН** + РБВ** ± СОФ** и/или препаратами, ингибирующими NS3/4А, и пациентов с рецидивом ХГС после пересадки печени и солидных органов. Для пациентов с ЦП класса С по классификации Child-Pugh до трансплантации следует начинать с начальной дозы РБВ** 600 мг, которую можно титровать до максимума в 1000/1200 мг (1000 мг для пациентов весом <75 кг и 1200 мг для пациентов весом ≥75 кг) при хорошей переносимости. Для пациентов с опытом лечения препаратами, ингибирующими NS5A, длительность лечения следует увеличить до 24 недель.
Схема 2 (для ГТ 1,2,3,4)
Схема 3 (для ГТ 1,4-6) |
Приложение Б. Алгоритмы действий врача
Диагностика, лечение ХВГС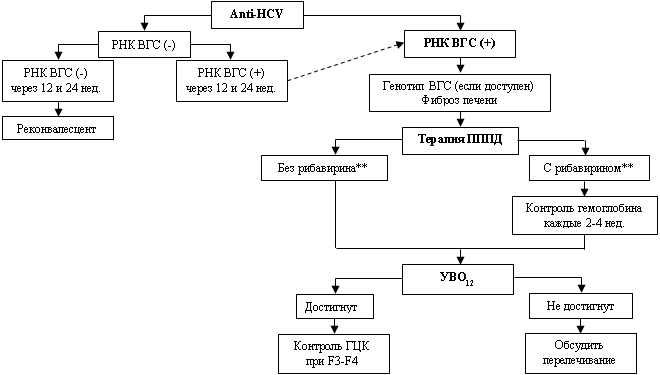
Приложение В. Информация для пациента
Уважаемый пациент! У Вас гепатит С. Современными лекарствами возможно полностью излечиться от данного заболевания. Это позволит не допустить развитие таких осложнений, как цирроз и рак печени. Обычно болезнь протекает без симптомов и выявляется при случайном обследовании. Однако это не значит, что ее не следует лечить. Объем терапии определит Ваш лечащий врач. Он же определит перечень необходимых исследований и их периодичность. Вам не следует самостоятельно отменять или заменять препараты, даже если Вы чувствуете себя лучше или считаете себя здоровым человеком. По всем появляющимся вопросам обращайтесь к лечащему врачу.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Оценка степени тяжести цирроза печени по шкале Child-Pugh
Название на русском языке: Оценка степени тяжести цирроза печени по шкале Child-Pugh
Источник: Durand F., Valla D. Assessment of the prognosis of cirrhosis: Child–Pugh versus MELD //Journal of hepatology. – 2005. – Т. 42. – №. 1. – С. S100-S107.
Тип: шкала оценки
Назначение: оценка степени тяжести цирроза печени
Содержание:
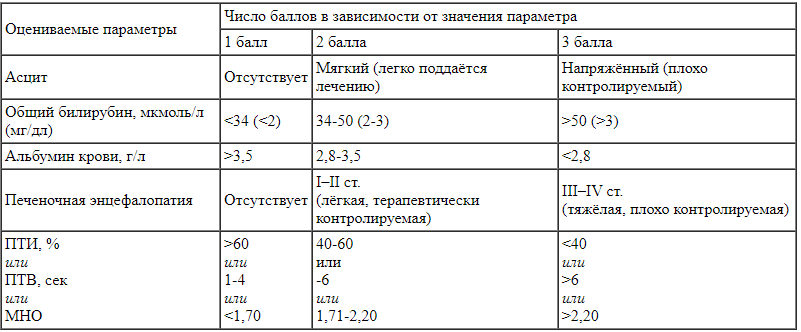
Ключ (интерпретация):
Баллы выставляются в зависимости от значения каждого из параметров от 1 до 3, после чего суммируются. Оценка выживаемости больных ЦП в зависимости от полученных баллов:
| Класс по Child-Pugh | Баллы | Годичная выживаемость, % | Двухлетняя выживаемость, % |
| A | 5-6 | 100 | 85 |
| B | 7-9 | 81 | 57 |
| C | 10-15 | 45 | 35 |
