Современный взгляд на патогенетическую терапию атопического дерматита
Статьи Опубликовано в журнале:Вестник дерматологии и венерологии. 4, 2006. Ю.К. Скрипкин, А.С. Дворников, Л.С. Круглова, П.А. Скрипкина
Modern approach to pathogenetic therapy of atopic dermatitis
Yu.K. Skripkin, A.S. Dvornikov, L.S. Kruglova, P.A. Skripkina
Центральный научно-исследовательский кожно-венерологический институт Росздрава, Москва
Алгоритм лечения - кестин и фуцикорт (фуцидин Г) - является методом выбора для лечения больных атопическим дерматитом со средней и легкой степенью тяжести кожного процесса; эффективность данного метода 87,5%. Антигистаминный препарат второй генерации кестин - уникальный, высокоэффективный препарат, безопасный даже в дозе 20 мг/сут, хорошо переносится, обладает высокой комплаентностью. Адекватное, контролируемое назначение наружных средств, содержащих кортикостероиды и антибактериальные вещества (фуцикорт, фуцидин Г), является патогенетически обоснованным и соответствует принципу лечить быстро, эффективно, комфортно.
Ключевые слова: атопический дерматит (АтД), кестин (эбастин), фуцидин Г, фуцикорт.
Therapy with Kestine and Fucicort (Fucidin H) is the method of choice for the treatment of mild and moderate atopic dermatitis. Its efficiency amounts to 87.5%. Kestine is an unique, highly efficient and safe, antihistaminic agent of the second generation. It is safe and well tolerated by the patients even at a daily dose of 20 mg. It is concluded that the controlled application of topical drugs containing corticosteroids and antibiotics, such as Fucicort (Ficidin H), is pathogenetically justified and meets the requirements of safe, effective and comfortable treatment.
Key words: atopic dermatitis (AtD), Kestine (ebastine), Fucidin H, Fucicort.
В последнее десятилетие проблема патогенетического лечения атопического дерматита (АтД) не только не утрачивает своей актуальности, но и приобретает все большую значимость в связи с неуклонным ростом заболеваемости АтД, учащением торпидных к традиционным методам лечения, часто рецидивирующих форм, приводящих к значительному снижению качества жизни больных, их социальной дезадаптации. По данным разных авторов, от 5 до 20% населения страдает этим заболеванием, а в экологически неблагоприятных регионах этот показатель даже более высокий [1].
Для АтД характерны многообразие клинических форм поражения кожи, возрастные особенности локализации и морфологии очагов воспаления, стадийное течение, а также развитие патологических изменений в различных системах организма. Согласно современным представлениям, в основе АтД лежат генетически детерминированные иммунные нарушения, при которых наблюдается дисбаланс дифференцировки на уровне Т-клеточных субпопуляций. Показано, что на ранних стадиях формирования очага воспаления при АтД имеет место экспансия Th2 с их характерным цитокиновым профилем, в то время как позже доминируют Th1. Оба эти клона стимулируются IgE-несущими и антигенраспознающими дендрическими клетками, что, как полагают, приводит к сложному цитокиномедиаторному воздействию, вызывающему воспаление и зуд [2].
Современные терапевтические возможности при АтД либо имеют патогенетическую направленность, либо носят симптоматический характер. Прежде всего на практике лечение направлено на устранение или ослабление зуда, купирование воспалительной реакции в коже и по возможности длительное поддержание полученного терапевтического эффекта [2]. На сегодняшний день предложено немало средств и методик лечения этого дерматоза. Но ведущее место в комплексном лечении АтД по-прежнему занимают антигистаминные препараты всех поколений. К сожалению, большинство этих препаратов, и прежде всего антигистаминные средства первой генерации, вызывают ряд нежелательных побочных эффектов, которые ограничивают их применение. Хорошо изучены седативный эффект, нарушения когнитивных и психомоторных функций центральной нервной системы. Низкая селективность, связывание М-холинорецепторов проявляются сухостью слизистых оболочек полости рта и кожи, повышением частоты сердечных сокращений при снижении артериального давления, головокружением и головной болью, повышением внутриглазного давления, задержкой мочеиспускания и запорами [3, 4]. Другими негативными свойствами антигистаминных препаратов первого поколения являются постепенное снижение терапевтической эффективности препаратов (тахифилаксия), а также их кратковременное действие (необходимость 3-4-кратного приема в течение суток).
Этим объясняется повышенный интерес к антигистаминным препаратам нового (второго) поколения. Отличительными свойствами препаратов второй генерации являются высокое сродство к H1-рецепторам, что обеспечивает избирательность их действия; отсутствие связывания с холино- и адренорецепторами, что в результате приводит к уменьшению побочных эффектов; прочность связывания с H1-рецепторами, а это в свою очередь обеспечивает значительную продолжительность терапевтического действия [3].
В настоящее время к антигистаминным препаратам предъявляются достаточно строгие требования:- высокоселективная блокирующая H1-гистаминовая активность;
- высокая клиническая эффективность при различных аллергических заболеваниях;
- быстрое всасывание и начало действия;
- высокая биодоступность;
- длительный период полувыведения;
- высокая безопасность;
- возможность использования в сочетании с другими группами медикаментов.
Всем вышеперечисленным требованиям отвечает антигистаминный препарат нового поколения - эбастин (группа оксипиперидинов). На отечественном и зарубежном фармацевтических рынках эбастин представлен единственным, не имеющим генериков, препаратом - кестином. Молекула эбастина имеет уникальное строение, что обусловливает ее высокую селективность и прочность соединения с гистаминовыми H1-рецепторами, а также способность связываться с субвариантами H1-рецепторов, недоступными для других H1-блокаторов (рис. 1).
Рис. 1. Кестин - уникальная формула.
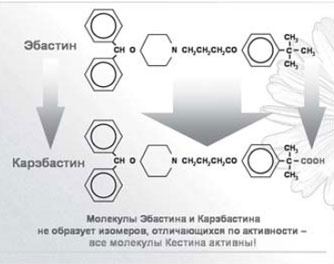
Эбастин не проникает через гематоэнцефалический барьер, являясь одним из самых неседативных препаратов нового поколения, это позволяет пациентам вести активный образ жизни, управлять автомобилем, выполнять требующие повышенного внимания действия.
Особенностью фармакокинетики эбастина является то, что он очень быстро метаболизируется в активный метаболит - карэбастин. Действие препарата начинается уже через 1-1,5 ч после однократного приема в дозе 10 мг, а через 4 ч достигается пик концентрации в плазме крови (80-100 нг/мл). В отличие от других ингибиторов гистаминовых рецепторов, оказывающих быстрое действие, антигистаминный эффект кестина стабильно сохраняется: 1 сут - после однократного приема и в течение 3 сут - после 5-дневного курсового лечения [5] (рис. 2).
Рис. 2. Кестин - самое длительное действие [7].
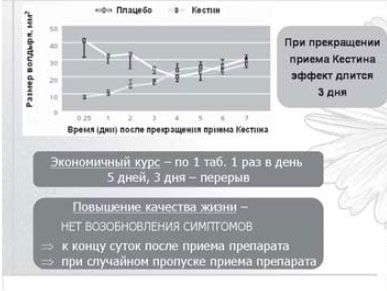
Кестин обладает высокой биодоступностью. Абсорбция препарата из желудочно-кишечного тракта не зависит от приема пищи. Карэбастин активно связывается с белками плазмы и имеет высокий объем распределения. Основной путь экскреции - почки (более 60%). Конечный период полувыведения - 15-19 ч. Величина максимальной концентрации в плазме крови возрастает в зависимости от принятой дозы эбастина, но время достижения максимальной концентрации и конечный период полувыведения остаются стабильными при использовании 10-30 мг. Кестин - единственный антигистаминный препарат второй генерации, разрешенный (вследствие его безопасности, в том числе по отношению к сердечно-сосудистой системе) к применению в двойной дозировке - 20 мг. Конечный полупериод выведения сопоставим у молодых и пожилых лиц, что позволяет назначать данный препарат всем пациентам без коррекции дозы в зависимости от возраста [3]. Одним из преимуществ препарата является то, что функции печени и почек оказывают минимальное влияние на фармакокинетику эбастина, позволяя назначать его больным с сопутствующей соматической патологией.
Помимо антигистаминного действия, эбастин обладает выраженным противовоспалительным свойством, которое заключается в способности подавлять высвобождение брадикинина, ряда интерлейкинов, простагландина D2 и лейкотриенов (LTC4 и LTD4), фактора некроза опухоли, повышающих сосудистую проницаемость и имеющих большое значение в реализации реакций гиперчувствительности немедленного типа [6- 8]. Среди других важных свойств кестина - его способность угнетать хемотаксис эозинофилов и нейтрофилов и ингибировать реакции, индуцированные нейропептидами [9]. Таким образом, кестин подавляет не только раннюю, но и позднюю фазу аллергического ответа: угнетая активность различных клеток, вовлекаемых в аллергическую реакцию, тем самым снижает образование и секрецию медиаторов аллергии [3]. Важно отметить, что данное свойство препарата проявляется в концентрации, сопоставимой со средней терапевтической дозой. Таким образом, кестин является препаратом выбора при лечении АтД (рис. 3).
Рис. 3. Кестин - оптимальное лечение АтД.
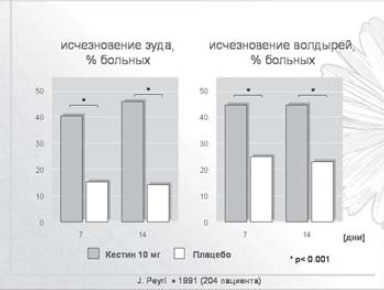
В России кестин разрешен к применению с 6 лет: детям с 6 до 11 лет его назначают в дозе 5 мг/сут, предпочтительно в форме сиропа, взрослым - 10-20 мг/сут.
Hе менее важным элементом в комплексной терапии АтД является наружное лечение. Цели наружной терапии: купирование кожных проявлений аллергии в острой (гиперемия, отек, экссудация) и хронической (лихенификация, ксероз) стадиях заболевания; уменьшение или устранение субъективных ощущений (зуд, боль, жжение). Традиционно для достижения этих целей применяются топические стероиды, эпителизирующие, увлажняющие и смягчающие средства, антибактериальные и противозудные мази, макролактамы. Hаружное лечение проводят с учетом возраста больного, клинической формы и стадии заболевания, распространенности и тяжести кожного процесса, а также эффективности и переносимости предшествующих методов лечения [10].
Hа сегодняшний день рациональное и своевременное применение кортикостероидных наружных средств для лечения АтД патогенетически обосновано и соответствует принципу "лечить быстро, эффективно и комфортно". Адекватное назначение гормональных препаратов существенно повышает эффективность терапии, зачастую являясь как бы "переломным" моментом в купировании кожных проявлений аллергии, благоприятно сказывается на качестве жизни больных [11]. Наружное применение кортикостероидов основано на их противовоспалительном, иммуносупрессивном, антиаллергическом, противозудном действии, которое обусловлено фармакологическими эффектами.
В последние годы особое внимание исследователей обращено на патогенетическое значение микробной флоры кожи у больных АтД. Зарубежные исследователи обнаружили Staphylococcus aureus у 93% больных АтД на пораженной коже и у 76% пациентов на коже, свободной от высыпаний [12]. Hесомненно этиологическое значение бактериальной флоры и в развитии инфекционных осложнений при АтД.
Таким образом, препараты, в состав которых входят кортикостероид и антибактериальное вещество, являются неотъемлемой составляющей алгоритма лечения АтД. Линия комбинированных наружных средств - фуцидин Г, фуцикорт содержит фузидовую кислоту и глюкокортикостероид, что позволяет воздействовать на порочный круг при АтД (рис. 4).
Рис. 4. Фуцикорт (фуиидин Г) - двойной удар по АтД.
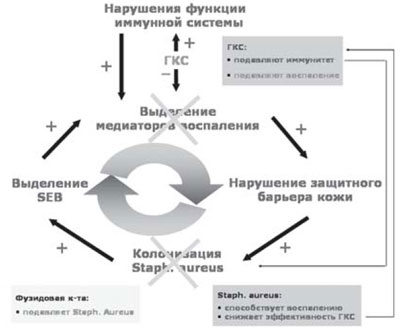
Фузидовая кислота (группа фузидинов) - антибиотик, обладающий мощной активностью против стафилококков, включая Staphylococcus aureus, Staphylococcus epidermidis и метициллинрезистентные штаммы, стрептококков и других патогенных микроорганизмов. Фуцидин действует как ингибитор синтеза белка в бактериальной клетке. Лечебная эффективность местного применения фузидовой кислоты обусловлена уникальной способностью глубоко проникать в кожу и накапливаться в дозировке, в разы превышающей минимальную терапевтическую (рис. 5).
Рис. 5. Фуцидин - самое глубокое проникновение в кожу.
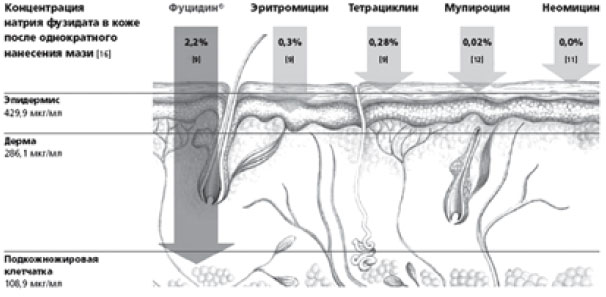
Перекрестной резистентности так же, как и перекрестной чувствительности, к фуцидину нет, так как фузидовая кислота единственный антибиотик в своей группе. Крем Фуцидин Г содержит мягкий кортикостероид - гидрокортизона ацетат и предпочтительно применяется при легкой степени поражения. В состав крема Фуцикорт входит мощный гормон - бетаметазон, что позволяет назначать его при выраженном воспалении.
Под нашим наблюдением находились 112 больных АтД: 42 (37,5%) женщины и 70 (62,5%) мужчин (преобладание за счет лиц призывного возраста). Средний возраст пациентов составил 17,1±0,63 года. У большинства больных АтД имел классическую форму и отвечал основным критериям классификации Rajka. Ведущие признаки встречались у всех пациентов, вспомогательные клинические признаки регистрировались с большой частотой в различных комбинациях. В качестве лечения больные получали кестин в дозе 10-20 мг/сут на протяжении 7-14 дней и наружные средства фуцикорт или фуцидин Г (в зависимости от тяжести кожного процесса) 1-2 раза в сутки в течение 5-10 дней, затем через день еще 10 сут.
Эффективность данного алгоритма лечения оценивалась по четырем параметрам: SCORAD (стандартная шкала тяжести и распространенности кожного процесса [13], ДИШС (дерматологический индекс шкалы симптомов), вариант калькулятора Пруриндекс (индекс зуда), ДИКЖ (дерматологический индекс качества жизни). Показатель SCORAD у 41,1% больных был в среднем 42,2±2,1 балла (p<0,05), что соответствует средней тяжести заболевания, у 48,9% - 18,8±1,3 балла (p<0,01), что соответствует легкой степени. ДИШС индексировался по 9 основным клиническим проявлениям заболевания: эритема, отек, мокнутье, лихенификация, папулы, сухость, шелушение, трещины, зуд, оцениваемым по 4-балльной шкале и рассчитывался как сумма всех индексов [2]. До лечения ДИШС составил 20,3±1,4 балла (p<0,02) по группе пациентов в целом. Интенсивность зуда оценивалась больным только 1 раз в сутки (для удобства пациентов) по 6-балльной системе: 0 -зуда нет, 1 - слабый, 2 - заметный, 3 - выраженный, 4 - сильный, 5 - очень сильный. До лечения вариант калькулятора Пруриндекс составил 4,1±0,4 балла (p<0,01). Четвертым параметром оценки эффективности стала русифицированная версия индекса Finlay - DLQI, позволяющая оценивать качество жизни больных, а следовательно, и эффективность терапии на данный момент. ДИКЖ у всех больных был значительно снижен и в среднем составил 19,4±2,3 балла (p<0,01).
Клиническая ремиссия констатировалась при снижении индексов SCORAD и ДИШС на 95% и более, значительное улучшение - 75-95%, улучшение 50- 75%, незначительное улучшение - 25-50%. В результате лечения общий клинический эффект в виде клинической ремиссии и значительного улучшения наблюдался у 87,5% (98) пациентов, улучшение констатировано у 12,5% (14), отсутствие эффекта не наблюдалось ни в одном клиническом случае (рис. 6).
Рис. 6. Динамика SCORAD и ДИШС в процессе лечения.
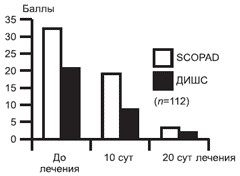
Мы согласны с мнением Н.Г. Кочергина [2], что индекс ДИШС является более объективным и чувствительным методом оценки динамики клинических кожных симптомов, чем SCORAD, поскольку не учитывает степень распространенности процесса.
Кожный зуд - является ведущим симптомом АтД. Как было отмечено выше, до лечения все больные предъявляли жалобы на сильно или умеренно выраженный зуд. Динамика варианта Пруриндекса в процессе лечения представлена на рис. 7.
Рис. 7. Изменение варианта Пруриндекса в процессе терапии (n=112).
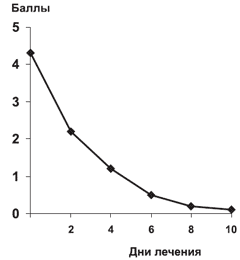
Уже к концу 1-х суток лечения большинство пациентов отмечали снижение интенсивности или полное исчезновение зуда. На 7-й день лишь у 8 (7,2%) пациентов (p<0,01) сохранялся незначительный зуд, им была продолжена терапия кестином 20 мг до 14 дней.
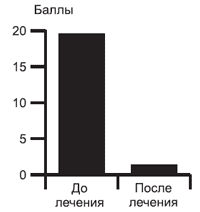
Показатель ДИКЖ в результате лечения снизился на 92,1% и составил 1,4±0,3 балла (рис. 8).
Рис. 8. Динамика ДИКЖ в процессе терапии (n=112).
Следует отметить, что ни у одного из 112 наблюдавшихся нами больных не было выявлено никаких побочных эффектов на фоне применения кестина в дозе 10-20 мг/сут в сочетании с наружным лечением фуцикортом (фуцидином Г). Все больные отмечали хорошую переносимость лечения. Схема кестин + фуцикорт (фуцидин Г) обладает высокой комплаентностью. Эффективность данного алгоритма оценивается нами как очень высокая (87,5%), и эта схема может быть рекомендована для широкого применения в лечении больных атопическим дерматитом. ЛИТЕРАТУРА
1. Хаитов P.M., Кубанова А.А. Атопический дерматит: рекомендации для практических врачей. М 2002;5-99.
2. Кочергин Н.Г. Атопический дерматит: современные аспекты патогенеза и терапии. Рус мед журн 2004;12:18:1076-1081.
3. Курбачева О.М., Гущин И.С. Применение кестина в лечении аллергического ринита круглогодичного течения у взрослых и детей. Рос аллергол журн 2004;4:75-78.
4. Сидоренко И.В., Захаржевская Т.В., Караулов А.В. Антигистаминные препараты в лечении крапивницы. Лечащий врач 2004;5:31-33.
5. Новикова В.И., Сергеев Ю.В., Новикова Н.Д. Клиническая эффективность кестина при лечении аллергических заболеваний. Иммунол аллергол инфектол 2001;3:58-60.
6. Compbel A. et al. Overview of allergic mechanisms. Ebastine has more than an antihistamines effect. Drags 1996;52:Suppl 11:15- 19.
7. Frossard N., Vita-Durand D, Mounedjl N. et al. Duration of antihistaminic effect following discontinuation of ebastine. Allergy 2001;56:553-557.
8. Roberts D.J. A preclinical overview of ebastine. Drugs 1996;52:Suppl 11:8-14.
9. Львов А. Кестин в терапии зудящихдерматозов. Врач 2004;9:55-56.
10. Хаитов P.M., Кубанова А.А. Атопический дерматит: наружная терапия. Болезни кожи 2004;6:3:167-173.
11. Короткий Н.Г. Атопический дерматит у детей. Руководство для врачей 2003;163-193.
12. Abeck D, Mempel M. Staphylococcus aureus colonization in atopic dermatitis and its therapeutic implications. Br J Dermatol 1999;139:13-16.
13. European Task Force on Atopic Dermatitis. Severity scoring of atopic dermatitis: the SCORAD index. Dermatology 1993;186:23-31.
