Влияние фактора ангиогенеза на морфофункциональное состояние миокарда у крыс при экспериментальном инфаркте миокарда
СтатьиОпубликовано в журнале:
"Российский кардиологический журнал"
»» N 2 2008
1 Сисакян А.С., 2 Оганян В.А., 2 Семерджян A.Б., 1 Петросян М.В., 2 Сисакян С.А., 3 Гуревич М.А.
Ереванский государственный медицинский университет – кафедра пропедевтики внутренних болезней1;
кафедра медицинской биологии и генетики2, Ереван;
Московский областной клинический НИИ им. А. Владимирского3, Москва Резюме
В эксперименте на белых крысах показано, что при внутривенном введении VEGF-164 перед окклюзией левой коронарной артерии на 76-й день отмечалось развитие поврежденного очага миокарда. В перинекротической зоне, а также в дистальных отделах миокарда наблюдалось более плотное расположение каппиляров и увеличение их обменной поверхности по сравнению с контрольными животными, перенесшими только окклюзию коронарной артерии.
Таким образом, препарат VEGF-164 стимулирует ангиогенез миокарда, что может снизить повреждающее воздействие ишемии и этим ограничить некротический очаг и последующую структурную реорганизацию миокарда.
Ключевые слова: экспериментальный инфаркт миокарда, терапия VEGF-164, крысы.
В настоящее время терапевтические возможности лечения ИБС включают влияние на клиническую симптоматику заболевания и снижение риска развития инфаркта миокарда, сердечной смерти путем снижения дисбаланса между потребностью миокарда в кислороде и доставкой его, профилактики прогрессирования заболевания, восстановления коронарного кровотока путем ангиопластики коронарных артерий или реваскуляризацией миокарда. Несмотря на достигнутые успехи в лечении ИБС, уровень смертности от данного заболевания остается высоким, что требует разработки новых подходов в терапии ИБС. Генная терапия, в частности, с применением ангиогенных факторов роста является потенциально новым методом лечения сердечно-сосудистых заболеваний. За последние годы были проведены многочисленные экспериментальные исследования по изучению факторов ангиогенеза и первые клинические исследования у больных с ИБС и периферическими заболеваниями сосудов [3;5]. Ангиогенез представляет собой сложный многоступенчатый процесс образования новых сосудов путем отпочковывания или с помощью трещин (splitting) из уже существующих [2;4]. Ангиогенез состоит из нескольких последовательных этапов: 1) вазодилатации, 2) миграции с адгезией и пролиферацией эндотелиальных клеток и 3) собственно формирования сосудистой стенки новой трехслойной сосудистой трубки, которая развивается по мере восстановления циркуляции [4]. Для образования сосудов более крупных, чем капилляры, необходима миграция гладкомышечных клеток, а также их адгезия к вновь образованному матриксу новых сосудов. В эксперименте модификацией этих стадий можно стимулировать и подавлять ангиогенез. Среди ряда факторов, участвующих в регуляции ангиогенеза, наиболее важным является сосудистый эндотелиальный фактор роста СЭФР (Vascular endothelial growth factor – VEGF) и его гомологи [4]. VEGF, являясь основным индуктором ангиогенеза, представляет собой гликопротеин, увеличивающий сосудистую проницаемость, селективно оказывающий митогенный эффект на эндотелиоциты, он продуцируется самими эндотелиальными клетками в условиях гипоксии [1;3]. Уровень экспрессии VEGF прогрессивно уменьшается после рождения и минимален в большинстве тканей взрослых, за исключением мест активного ангиогенеза – таких, как яичники, матка, кожа (рост волос). Высокий уровень VEGF в легких у взрослых может быть связан с эндотелиальными фенестрациями [3]. Однако экспрессия VEGF может реактивироваться при определенных условиях – таких, как наличие ишемии миокарда, сетчатки, воспалительного процесса, опухоли [1;9;10;12].
Капиллярная сеть миокарда играет важную роль в транспорте кислорода и питательных веществ к кардиомиоцитам. Повышенная капиллярная плотность в миокарде обеспечивает более высокую активность миокардаильного кровотока, перфузии и метаболизма миокарда в условиях ишемии. Изменение плотности и обменной поверхности капиллярной системы микроциркулярного русла может быть индуцировано процессом ангиогенеза.
Целью настоящего исследования явилось изучение влияния VEGF-164 на рост и развитие, а также состояние гемомикроциркуляции поврежденного миокарда, вызванного окклюзией передней нисходящей ветви коронарной артерии в периинфарктной и отдаленной от инфарктного очага зонах миокарда в эксперименте.
Материал и методы
Эксперименты поставлены на 22-х белых беспородных крысах самцах массой 200–250 гр. Первую группу животных составили 6 интактных крыс, вторую группу (n=8) – контрольные подопытные животные, которым производили окклюзию передненисходящей коронарной артерии. Третьей группе подопытных животных (n=8) предварительно внутривенно вводили препарат VEGF-164 в дозе 0,3 мкг/кг и производили окклюзию коронарной артерии.
Препарат VEGF, представляющий из себя полипептид, состоящий из 164 аминокислот, вводили в дозе 0,3 мг/кг после растворения в 1 мл буферного раствора и центрифугирования в течение 5 мин. Препарат вводили интрамиокардиально.
Экспериментальный некроз миокарда воспроизводился путем окклюзии левой передней нисходящей коронарной артерии (ЛКА) при левой стернотомии под нембуталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких. Перед проведением анестезии животным проведена инъекция атропином 0,04 м2/кг с целью предотвращения отека слизистой при интубации трахеи. Декапитацию производили на 7-й день после окклюзии в условиях нембуталовой анестезии.
Для изучения морфологического состояния миокарда использовался общепринятый метод окраски гематоксилин-эозином.
Гемомикроциркуляторное русло изучалось на микроскопических препаратах миокарда, обработанных модифицированным методом Гомори по С.А.Сисакяну [7]. С помощью окуляр-микрометра измерялся средний диаметр капилляров (d), рассчитывались плотность (общая длина – L), обменная поверхность капилляров (ОПК) и емкость капиллярного русла (ЕКР) на 1 мм3 миокардиальной ткани.
Статистическая обработка данных проводилась по t-критерию Стьюдента.
Результаты
Полученные нами данные показали, что на 7-й день после окклюзии в очаге некроза обнаруживались значительное количество некротических элементов и единичные фрагменты капилляров, тогда как после введения VEGF сосудистая реакция была более выражена.
При исследовании микроциркуляторного русла миокарда у интактных животных были выявлены параллельно расположенные и равномерно наполненные капилляры, а также поперечная исчерченность кардиомиоцитов (рис. 1).

Рис. 1. Миокард интактных животных. Параллельно расположенные капилляры и поперечная исчерченность мышечных волокон. 7 x 40.
У контрольных животных было характерно наличие многочисленных светлых полей, лишенных сосудистых элементов. В соседних с некрозом участках миокарда выявлялись густо расположенные и неравномерно заполненные капилляры. Одновременно с этим стенки капилляров окрашивались более интенсивно, многие из них извитые, с неравномерными контурами. Во многих полях зрения полностью отсутствовала поперечная исчерченность мышечных волокон (рис. 2). В миокарде животных, получивших VEGF обнаруживалось более плотное расположение капилляров, анастомирующих друг с другом и образующих своеобразную капиллярную сеть в участках, непосредственно прилегающих к некрозу (рис. 3). В более отдаленных от некроза участках капилляры располагались параллельно друг к другу, имея правильный ход с ровными контурами.
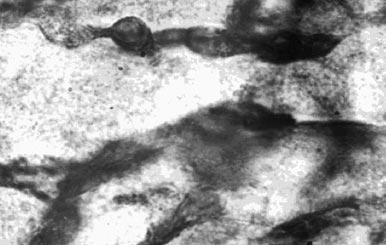
Рис. 2. Окклюзия левой коронарной артерии. Паранекротическая зона. Контуры капилляров неровные, окраска стенок неравномерная, капилляры образуют микроаневризматические расширения. 10 x 40
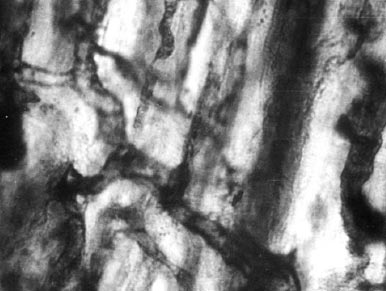
Рис. 3. Сформировавшаяся капиллярная сеть в участках миокарда, прилегающего к некрозу на 7-й день после окклюзии коронарной артерии. 10 x 40.
При морфометрической оценке капиллярной системы перинекротической зоны средний диаметр капилляров почти не отличался от такового у контрольных животных в пределах достоверности (3,3 %, р>0,1).Отмечалось увеличение плотности функционирующих капилляров (14,7 %, р<0,05) и ОПК (12,1 %, р<0,05) в этих участках (табл.1). В более отдаленных отделах миокарда капилляры располагались параллельно друг к другу, их средний диаметр и количество функционирующих капилляров в пределах достоверности не отличались от таковых в перинекротической зоне.
Таблица 1
Морфометрические изменения микроциркуляторного русла миокарда в перинекротической зоне при окклюзии ЛКА и применении VEG
| Параметры МЦР миокарда | Интактные животные | Окклюзия ЛКА | VEGF+окклюзия |
|---|---|---|---|
| d (мкм) | 6,48 ± 0,2 | 6,7 ± 0,19 | 6,9 ± 1,2 |
| L (мм) | 2035 ± 85 | 2300 ± 87,4* | 3060 ± 75,6# |
| OPK (мм2) | 42,64 ± 1,1 | 48,53 ± 3,2* | 64,76 ± 5,3# |
В группе животных, получивших предварительную инъекцию VEGF-164, отмечалось более плотное расположение капилляров как в перинекротической зоне (увеличение на 24,8 %, р<0,01), так и в отдаленных от него участках. Морфометрические измерения показали отсутствие изменения среднего диаметра капилляров от таковых у контрольных крыс (2,8 %, р>0,1), однако при этом число функционирующих капилляров достигало достоверно больших значений как в перинекротической зоне (24,8 %, р<0,01), так и отдаленных от него участках. Именно благодаря увеличению количества функционирующих капилляров наблюдалось значительное увеличение ОПК (25,1 %, р<0,01).
Обсуждение
Одним из перспективных направлений в экспериментальной кардиологии является лечение ишемии миокарда путем неоваскуляризации сердца с помощью так называемых “ангиогенов”, медиаторов индуцирующих образование сосудов. Миокардиальный ангиогенез имеет место в организме и может быть стимулирован при острой ишемии, ишемическом прекондиционировании [1;6]. При этом процесс индукции ангиогенеза сопровождается активацией ряда факторов транскрипции – Staf 3; SP-1 Pax-5 [4]. Ряд исследований показал, что коллатеральная сосудистая система защищает ишемизированный миокард при острой коронарной окклюзии.
В настоящее время имеется много нерешенных вопросов относительно методов введения VEGF с целью терапевтического ангиогенеза. Результаты проведенных исследований при применении факторов ангиогенеза противоречивы. В исследовании FIRST отмечалось повышение толерантности к физической нагрузке при интракоронарном введении белка основного фактора роста фибробластов (b-FGF) у больных старше 65 лет с выраженной стенокардией. В рандомизированном исследовании REVASC при сравнении 2-х групп больных с тяжелой стенокардией введение гена VEGF-121 в составе аденовируса в стенку ЛЖ после миниторанотомии наблюдалось улучшение данных тредмил-теста (увеличение времени до появления болей) и до возникновения депрессии сегмента ST более 1 мм) было отмечено через 26 недель [8]. Внутривенное введение или введение в “дистальный артериальный кровоток” ангиогенных факторов роста может послужить причиной системных реакций, например, роста сосудов в невыявленных опухолях, гипотензии [2;3]. В связи с этим представляет интерес влияние интрамиокардиальной инъекции VEGF во избежание ряда системных нежелательных побочных эффектов. Учитывая вышеизложенное, мы в наших экспериментах апробировали именно данный метод введения VEGF.
Капиллярная сеть играет ключевую роль в транспорте кислорода энергетических субстратов и кардиомиоцитах. Повышенная капиллярная плотность в миокарде, наблюдаемая при ишемии, указывает на физиологическую значимость гипоксииндуцированного увеличения уровня эндотелиальных митогенов и их рецепторов [2;10]. В частности, уже через 24 ч. после наложения лигатуры на левую коронарную артерию в экспериментальных условиях на моделях животных наблюдалось достоверное увеличение уровня VEGF [12]. Известно, что активация эндогенной экспрессии VEGF является ранним ответом на миокардиальную ишемию. Этот ответ, осуществляемый на молекулярном уровне, является одним из первых адаптационных механизмов миокарда на ишемию [1;3;13].
На модели экспериментального некроза и терапии фактором ангиогенеза VEGF нами установлено, что терапия названным фактором активирует процесс ангиогенеза как в перинекротической зоне, так и в отдаленных от некроза зонах путем повышения количества функционирующих капилляров и обменной поверхности капиллярного русла. Выраженность сосудистой реакции на 7-й день эксперимента, плотное расположение капилляров и наличие множества анастомозов указывает на активацию коллатерального кровообращения в перинекротической зоне у крыс контрольной группы. Указанные изменения являются адаптивно-приспособительным механизмом при острой ишемии миокарда и описаны в многочисленных экспериментальных исследованиях по моделированию инфаркта миокарда и у больных ОИМ. Одним из возможных механизмов данных изменений является активация эндогенного ангиогенеза в сердце с участием ряда факторов роста. Предварительное введение VEGF, в отличие от контрольных животных, приводило к увеличению плотности сосудистой системы не только в перинекротической зоне, но и в отдаленных от неё участках.
Литература
- Bollano E, Tian F, Shao R. Hypoxia –induced myocardial angiogenesis preserves myocardial function after infarction in mouse//Eur. J. Echocardiography, vol 6, suppl Dec 2005 S 34; 279.
- Dishart K.L., Work L.M., Denby L. et al. Gene therapy for cardiovascular disease// J. Biomed Biotechnol. 2003;2:138–148.
- Fam N.P., Verma S., Kutryk M. et al. Clinician guide to angiogenesis // Circulation 2003; 108: 2613–2618.
- Fukuda S. Angiogenic signal triggered by ischemic stress induced myocardial repair in rat during chronic infarction // J. Mol. Cell Cardiology. 2004 Apr 36(4): 547–59.
- Kleiman N.S., Califf R.M. Results from late-breaking clinical trials sessions at ACCIS 2000 and ACC 2000. American College oCardiology // J. Am. Coll. Cardiol. 2000; 36:310–325.
- Sasaki H., Fukada S. Otani H. et al. Hypoxic preconditioning triggers myocardial angiogenesis: a novel approach to enhance contractile functional reserve in rat with myocardial infarction // J. Mol. Cell. Cardiol. 2002; Mar; 34(3), 335–48.
- Sisakyan S.A. Investigations of capillary network in the myocardium, skeletal muscles and other organs by modified Gomori’s method for determination of acid phosphatase activity //Cor. Vasa. – 1977. – Vol. 19. – N 4–5. – P. 363–369.
- Stewart D.J., A phase 2, randomized, multicenter, 26-week study to assess the efficacy and safety of BIOBYPASS (AdGV –VEG121.10) delivered through minimally invasive surgery vesus maximum medical treatment in patients with severe angina, advanced coronary artery disease, and no options for revascularization //Circulation 2002; 106:2986-a: Abstract.
- Symes JF, Losordo DW, Vale PR. Gene therapy with VEGF for inoperable coronary artery disease. Ann Thorac. Surg. 1999; 68; 830–6.
- Voisine P., Bianchi C., Ruel M. Inhibition of tha cardiac angiogenic response to exogeneos vascular endothelial growth factor // Surgery 2004; 136:2:407–415.
- Yin R., Feng J, Chen D. Serum levels of VEGF in patients with angina pectoris and acute myocardial infarction // Chin Med. Sci 2000 Dec; 15 (4) 205–9.
- Yin R., Feng J. Dynamic changes of serum VEGF levels in a rat myocardial infarction model // Chin. Med. Sci 2000 Sep. 15 (3); 154–6.
- Zheng N, Brown MD, Brack TA, et al. Bradycardia – induced coronary angiogenesis is dependent on VEGF// Circ. Res. 1999; 85; 192–8.
Abstract
In laboratory white rats, intravenous VEGF-164 injection and left coronary artery occlusion resulted in myocardial infarction development by Day 7. In perinecrotic zone and distal areas, the increase in capillary density and exchange surface area was observed, comparing to control animals with coronary occlusion only.
Therefore, VEGF-164 agent stimulated myocardial angiogenesis, with potential anti6ischemic effect, decreased necrosis area, and reduced myocardial structure reorganization.
Keywords: Experimental myocardial infarction, VEGF-164 therapy, rats.
