Глутамин у плода и у находящихся в критическом состоянии новорожденных с очень низким весом при рождении: метаболизм и механизм действия
СтатьиОпубликовано в журнале:
Journal of Nutrition (Журнал питания) »» 2001; 131 (Supplement): 2585-2589
Материалы Международного симпозиума по глутамину, 2-3 октября 2000 г., Сонеста Бич, Бермуды
Джозеф Ней
Отдел педиатрии и неонатологии университета Флориды, Гейнсвилль, США
Резюме.
Глутамин является самой распространенной аминокислотой. Исследования показывают, что и глутамин, и глутамат играют важную роль в метаболических процессах в плоде и плаценте. После рождения поступление глутамина в плод через плаценту внезапно прекращается, а возможности синтеза эндогенного глутамина у ребенка могут быть недостаточны, особенно в случае недоношенности. Поэтому в первые 3-4 месяца жизни ребенок зависит от экзогенного поступления глутамина для обеспечения реакций на действие окружающей среды и роста организма. Результаты исследований добавления глутамина в схемы питания детей с очень низким весом при рождении и взрослых, находящихся в критическом состоянии, позволяют предположить возможность благоприятного действия, особенно снижения частоты внутрибольничных инфекций. В настоящее время проводятся два крупномасштабных многоцентровых исследования, которые спланированы для изучения возможных благоприятных эффектов глутамина у детей с очень низким весом при рождении. В этих исследованиях не изучается механизм действия глутамина. В данном обзоре выдвигается гипотеза о том, что азот аминогруппы глутамина может использоваться для синтеза нуклеотидов и глюкозаминов в тонком кишечнике, и о том, что этот процесс может участвовать в поддержании целостности слизистой оболочки кишечника, таким образом предотвращая проникновение бактерий через стенку кишечника и/или последующую воспалительную реакцию, которая может привести к развитию полиорганной недостаточности.
Значение глутамина для поддержания оптимального роста клеток in vitro известно с 1950-х г.г., когда Eagle (1955) опубликовал свою основополагающую статью в журнале Science. Его работа показала, что для роста клеток in vitro глутамин необходим больше, чем любая другая аминокислота. После этого во многочисленных исследованиях было установлено значение глутамина для целого ряда метаболических процессов во всем организме, и было выдвинуто предположение о возможном благоприятном действии добавления глутамина в схемы питания.
Целью данного обзора является представление основ биохимических и метаболических взаимодействий глутамина, обсуждение роли глутамина в физиологии плода, представление некоторых ключевых аспектов добавления глутамина в схемы питания детей с очень низким весом при рождении, а также обсуждение возможных механизмов действия глутамина с использованием эпителия кишечника в качестве модели.
Обзор метаболизма глутамина
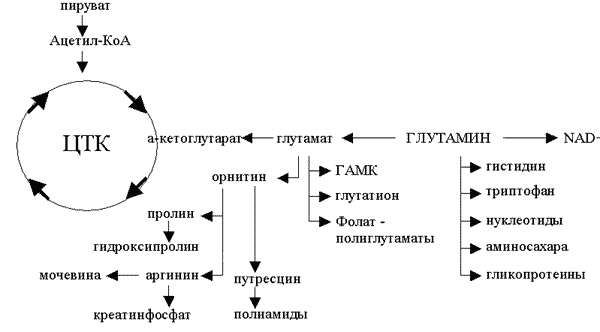
Представление списка метаболических процессов, в которых участвует глутамин, можно начать с изучения связи этой аминокислоты и ее метаболитов с циклом трикарбоновых кислот (ЦТК) (рис.1). Глутамин метаболизируется до глутамата, который легко превращается в a-кетоглутарат - неотъемлемый компонент ЦТК. Этот путь метаболизма имеет большое значение для получения энергии. Как видно из рис.1, глутамин имеет несколько важных метаболитов. Деаминирование глутамина глутаминазой приводит к образованию глутамата - предшественника g-аминомасляной кислоты, являющейся тормозным нейромедиатором. При циклизации глутамина образуется пролин - важный аминокислотный компонент коллагена (компонента соединительной ткани). Процессы деаминирования и трансаминирования глутамата участвуют в переносе аммиака между тканями. Перенос азота аминогруппы глутамина аминотрансферазой также участвует в процессе биосинтеза пуринов и пиримидинов. Аминогруппа глутамина играет важную роль в синтезе гексозаминов - веществ, жизненно необходимых для поддержания целостности и функции слизистых оболочек.
Из глутамата, цистеина и глицина синтезируется антиоксидант глутатион, защищающий ткани от повреждения свободными радикалами. Глутамат также является компонентом полиглутаматов фолиевой кислоты - ко-фактора многих ферментативных процессов.
РИСУНОК 1.
Распространенность глутамина: показаны многочисленные пути метаболизма глутамина
Глутамин у плода
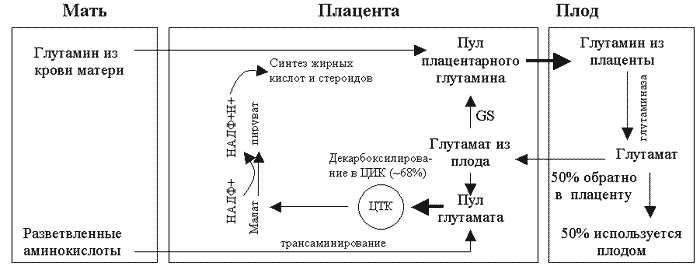
Многое из того, что известно о метаболизме аминокислот у плода, обнаружено в исследованиях на беременных овцах. Примерно 25 лет назад основополагающую работу провел Lemons с соавт (1976). По их данным, поступление глутамата в плод через пуповину отсутствовало; наоборот, суммарный перенос глутамата был направлен из плода в плаценту, что свидетельствует об образовании глутамата в тканях плода. При этом из всех аминокислот именно глутамин поступал от матери в плод через плаценту в наибольших количествах. Несколько последующих исследований, проведенных в лабораториях д-ра Джакомо Мешия и Фреда Батталья (Battaglia, 2000) в университете Колорадо, подтверждают существование глутамин-глутаматного обмена, изображенного на рисунке 2.
В этом механизме обмена суммарный перенос глутамина в целом направлен из крови матери в плод, и он усиливается синтезом глутамина в плаценте. За синтез глутамина в плаценте отвечает фермент глутамин-синтетаза, которая иммуногистохимически обнаружена главным образом в цитотрофобластах и, в меньшей степени, в мезенхимальных клетках (DeMarco et al., 1997). Глутамин, синтезируемый в плаценте, добавляется к глутамину, поступающему в плаценту из крови матери, и направляется в плод, где захватывается печенью плода. По оценке Battaglia (2000), у 130-суточного плода овцы глутамин плаценты обуславливает ~19% общего поступления азота в плод. Кроме того, было показано, что печень плода является основным местом захвата глутамина и синтеза глутамата у плода, и именно печень определяет объем выведения глутамата из плода в плаценту (Battaglia, 2000). В более поздних работах обнаружено, что значительная часть глутамата плаценты образуется путем трансаминирования разветвленных аминокислот до соответствующих кето-кислот (Chung et al., 1998). Таким образом, содержание глутамата в плаценте определяется как его поступлением из крови плода, так и синтезом на месте путем трансаминирования разветвленных аминокислот. Значительная доля глутамина, не метаболизированного в печени плода до глутамата и возвращенного в плаценту, захватывается тканями плода и используется для роста. Активный синтез глутамата в печени плода сходен с активным синтезом глюкозы в печени после рождения. Однако в период беременности никакого существенного синтеза глюкозы в печени плода и выхода глюкозы из печени плода не наблюдается (Hay et al., 1984).
Рисунок 2.
Плацентарный глутамин-глутаматный обмен: показан перенос глутамина и глутамата между кровью матери, плацентой и плодом (Адаптировано из Battaglia, 2000).
Является ли этот глутамин-глутаматный обмен просто интересным физиологическим механизмом, или он может быть связан с какими-то патологическими процессами? Недавно проведенные исследования показали, что артериовенозная разница концентрации глутамата увеличивается за неделю до родов, и то же самое происходит после введения дексаметазона (Barbera et al., 1997). Через 25 часов после введения дексаметазона выход глутамата из печени плода уменьшается на 25% по сравнению с этим показателем до введения препарата, и это приводит к значительному снижению концентрации глутамата в крови плода и уменьшению захвата глутамата плода в плаценте. В то же время наблюдается падение выхода прогестерона из матки на 60%. Эффект ослабления выхода прогестерона из матки при введении дексаметазона был обнаружен еще в конце 1960-х - начале 1970-х г.г (Liggins, 1969, Liggins et al., 1972), но сейчас установлена связь этого эффекта с глутамин-глутаматным обменом. Вероятный механизм этого эффекта описан в работе Klimek et al. (1993), в которой выявлена связь между восстановлением митохондриального НАДФ+ и окислением малата в клетках плаценты и концентрацией глутамата в среде инкубации. Снижение концентрации глутамата в плаценте приводит к ослаблению образования НАДФ-Н, необходимого для синтеза стероидов. Таким образом, события, ведущие к началу родов, связаны с глубокими изменениями метаболизма глутамина и глутамата в плаценте и печени плода, которые могут сопровождаться нарушением биосинтеза прогестерона, и, таким образом, нарушение этих процессов может играть определенную роль в запуске процесса родов.
Глутамин как пищевая добавка
Традиционно, глутамин по ряду причин не добавляют в питательные смеси. Глутамин считается заменимой аминокислотой, поскольку организм способен синтезировать эту аминокислоту с помощью глутамин-синтетазы. Глутамин имеет короткое время полужизни в водных растворах, и высказывались опасения о возможной токсичности продукта его расщепления - пироглутамата. При нормальном питании и отсутствии стрессов здоровым людям, по-видимому, не требуется дополнительного приема глутамина. Ниже рассматривается вопрос о том, относится ли это утверждение также к больным людям и к лицам, испытывающим сильный стресс и не получающим нормального питания.
Результаты нескольких исследований на животных (Fox et al., 1998; Klimberg et al., 1990; O’Dwyer et al., 1989; Suzuki et al., 1993; Van der Hulst et al., 1993; Yoshida et al., 1993) позволяют предположить возможность того, что добавление глутамина в пищу может оказывать благоприятное действие у больных, находящихся в критическом состоянии, включая новорожденных с очень низким весом при рождении. Резкое прекращение дополнительного применения глутамина у сильно недоношенных детей, испытывающих сильный стресс и растущих очень быстро, оказалось потенциально опасным. Смеси для тотального парентерального питания таких детей не содержат глутамина, а перорального питания они часто не получают неделями. В начале 1990-х г.г. мы выдвинули гипотезу о том, что добавление глутамина в пищу детей с очень низким весом при рождении может снижать их внутрибольничную заболеваемость сепсисом. В предварительном слепом рандомизированном исследовании, в котором участвовали 68 детей с низким весом при рождении, получавших глутамин или плацебо в течение 1 месяца жизни, бактериологически подтвержденный сепсис выявлялся у 30% детей контрольной группы и у 11% детей, получавших глутамин (Neu et al., 1997). Помимо снижения частоты сепсиса, у детей также наблюдалось снижение количества HLA-DR+-лимфоцитов и CD16+-Т-лимфоцитов, что согласуется с ослаблением стимуляции иммунной системы вследствие затруднения проникновения бактерий и их антигенов через слизистые оболочки. Измерение концентраций аминокислот в плазме крови детей контрольной группы выявило значительное повышение уровня большинства аминокислот в первые 2 недели жизни, а у детей, получавших глутамин, это повышение для некоторых аминокислот было менее выраженным, особенно для аминокислот, участвующих в синтезе глюкозы (аланин, глицин, серин, треонин)(Roig et al., 1996). Анализ стоимости лечения показал значительную экономию при дополнительном введении детям глутамина (Dallas et al., 1998). В другом исследовании парентерального применения глутамина (Lacey et al., 1996) обнаружено уменьшение срока пребывания на искусственной вентиляции легких при применении глутамина у детей с весом при рождении <800 г.
Также было проведено несколько исследований применения глутамина у взрослых больных, находящихся в критическом состоянии. Ziegler et al. (1992) показали снижение внутрибольничной заболеваемости сепсисом, улучшение баланса азота и уменьшение стоимости лечения (McBurney et al., 1994) больных, подвергавшихся пересадке костного мозга. Griffiths et al. (1977) выявили снижение смертности и больничных затрат на лечение больных, находящихся в критическом состоянии и получающих тотальное парентеральное питание с добавкой глутамина. В другом исследовании, проведенном в той же клинике с применением пероральной добавки глутамина (Jones et al., 1999), тоже показано снижение стоимости пребывания больных в клинике. Интересное исследование с участием взрослых больных с травмами (Houdijk et al., 1998) продемонстрировало уменьшение частоты пневмонии и сепсиса при пероральном применении глутамина. Одновременно со снижением частоты инфекций наблюдалось ослабление цитокиновой реакции на травму. Авторы полагают, что ослабление цитокиновой реакции обусловлено затруднением проникновения бактерий через слизистые оболочки, что было предположено и нами в исследовании с участием детей с очень низким весом при рождении.
Благоприятные эффекты применения глутамина, обнаруженные в этих предварительных исследованиях с участием детей и взрослых, послужили основанием для проведения двух крупномасштабных многоцентровых исследований с участием детей с низким весом при рождении. Организация Neonatal Network при Национальном институте здоровья США проводит исследование эффектов внутривенного введения глутамина, а организация Рediatrix Neonatal Group проводит аналогичное исследование с пероральным применением препарата. На момент написания данной статьи для участия в этих исследованиях отобрано около 1000 детей. После завершения этих исследований станет гораздо больше известно об эффективности и безопасности применения глутамина тем и другим способом. Могут быть получены данные о сравнительной эффективности двух путей введения глутамина у новорожденных с очень низким весом при рождении. Хотя в этих исследованиях могут быть получены очень интересные результаты, маловероятно, что они дадут какую-либо информацию о механизмах действия глутамина, понимание которых имеет критическое значение для наиболее эффективного использования этой аминокислоты и ее производных.
Механизмы действия глутамина
Некоторые фундаментальные аспекты метаболизма глутамина рассматриваются авторами других статей данного сборника. Для краткости мы здесь сконцентрируем внимание на использовании азота аминогруппы глутамина как субстрата для синтеза нуклеотидов и глюкозаминов.
Следует помнить, что между глутамином и глутаматом имеются существенные отличия, которые могут обуславливать значительное различие активности этих веществ как питательных веществ и сигнальных молекул. Это отличие связано главным образом с наличием аминогруппы у глутамина. Азот этой аминогруппы исключительно важен для синтеза пуринов и пиримидинов (рис.3). Глутамин и нуклеозиды, по-видимому, синергически влияют на пролиферацию и дифференцировку клеток эпителия кишечника. He et al. (1994) в культурах двух типов клеток эпителия кишечника (IEC-6 и Caco-2) показали замедление роста клеток при недостатке глутамина. Этот эффект в обоих типах клеток устранялся добавлением нуклеозидов. Добавление нуклеозидов в культуральную среду, бедную глутамином, также предотвращало снижение концентрации АТФ. Авторы сделали вывод, что применение нуклеозидов может усиливать скорость пролиферации и дифференцировки клеток кишечника, а также снижать потребность клеток в глутамине при их росте и развитии. Эти исследования подтверждают сильную связь между эффектами глутамина и нуклеозидов в эпителии кишечника.
РИСУНОК 3.
Азот пурина и пиримидина, происходящий из азота аминогруппы глутамина
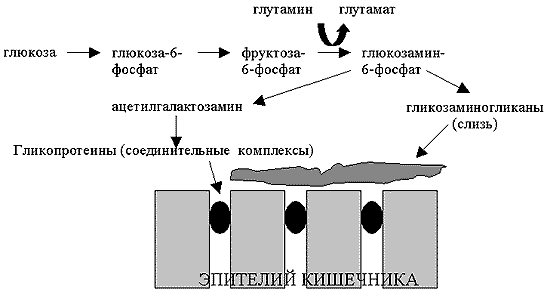
Азот аминогруппы глутамина также имеет большое значение для синтеза гексозаминов, которые, в свою очередь, выступают в качестве структурных элементов для синтеза других макромолекул (рис.4). Биосинтез глюкозамин-6-фосфата (предшественника всех гексозаминов) требует переноса азота аминогруппы глутамина на фруктозу-6-фосфат. Гексозамины как компоненты гликопротеинов и аминосахаров очень важны для поддержания всасывающей (за счет гликозилирования мембранных расщепляющих гидролаз) и барьерной функций кишечника (за счет поверхностного муцина и гликопротеинов, формирующих плотные межклеточные контакты). Рыхлая гликокаликсная оболочка ворсинок, образованная семейством гликопротеинов и протеогликанов (в которых основным углеводным компонентом являются гексозамины), защищает эпителиальные клетки кишечника от самопереваривания ферментами, находящимися в просвете кишечника, и может защищать организм от проникновения бактерий из кишечника. Возможность нарушения состава матрикса слизистой оболочки кишечника при нарушении метаболизма глутамина подтверждается исследованиями на крысах, получавших тотальное парентеральное питание с добавкой дипептида глутамина или без него (Khan et al., 1999). У крыс, получавших глутамин, матрикс слизистой оболочки был значительно более толстым и оптически более плотным. Одновременно у этих крыс отмечено снижение проницаемости стенки тонкого кишечника, которую измеряли по всасыванию декстрана, меченного флуоресцеин-изотиоцианатом.
Рисунок 4.
Гексозамин и его метаболиты, синтезируемые из глутамина
Исследования на культуре эпителиальных клеток тонкого кишечника Сасо-2 (Weiss et al., 1999) показали, что торможение активности эндогенной глутамин-синтетазы метионин-сульфоксимином приводит нарушению целостности межклеточных соединений, которую регистрировали по электрическому сопротивлению ткани и методом электронной микроскопии. Предварительные исследования также свидетельствуют о том, что отсутствие глутамина в пище крысят увеличивает частоту проникновения бактерий через слизистую оболочку, и этот эффект усиливается при торможении активности глутамин-синтетазы кишечника путем перорального введения метионин-сульфоксимина (Neu et al., 2000).
Хотя результаты большинства исследований указывают на то, что вызываемая глутамином пролиферация и защита клеток эпителия кишечника обусловлены действием аминокислоты как питательного вещества, результаты некоторых исследований позволяют предположить, что эти эффекты по крайней мере частично опосредованы через внутриклеточные сигнальные пути, связанные с киназами митоген-активируемого белка. Rhoads et al. (1977) показали достоверный синергизм действия эпидермального фактора роста и глутамина по показателю активации киназ митоген-активируемого белка.
Глутамин и цитокиновая реакция
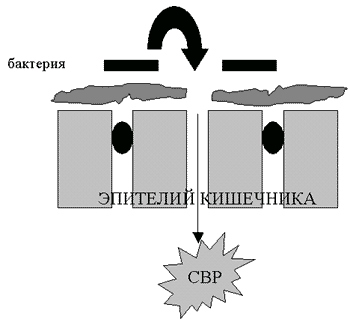
Результаты предварительных клинических исследований позволяют предположить, что в дополнение к профилактике внутрибольничных инфекций, пероральное применение глутамина может изменять течение воспалительной реакции (Houdijk et al., 1998). Если это подтвердится, то мы получим важное средство снижения заболеваемости детей с низким весом при рождении. Кишечник является самым большим органом иммунной системы и основным органом, с которого могут начинаться системные воспалительные реакции. За последние несколько лет стало все более очевидно, что цитокиновая реакция как часть неконтролируемой системной воспалительной реакции играет значительную роль в развитии преждевременных родов, хронических заболеваний легких, церебрального паралича, некротизирующего энтероколита и сепсиса. Интересной новой областью исследований будет изучение того, могут ли иммуномодулирующие питательные вещества типа глутамина ослаблять системную воспалительную реакцию по механизму, предполагаемая схема которого изображена на рис.5.
Глутамин, глутамат и их метаболиты играют ключевую роль в многочисленных клеточных процессах. Обозначение этих веществ как условно незаменимых принижает их значимость для быстрорастущих и пролиферирующих клеток, в частности, для эпителия кишечника. Быстро растущий плод и недоношенные дети, по-видимому, тоже зависят от достаточного поступления глутамина и его метаболитов для обеспечения роста и нормальных физиологических функций, в частности, для поддержания целостности слизистых оболочек и иммунных реакций. Проводимые в настоящее время исследования, предназначенные для оценки эффектов применения глутамина, должны сочетаться с исследованиями механизмов действия глутамина как питательного вещества и сигнальной молекулы. Исследования глутамин-глутаматного обмена между кровью матери, плацентой и плодом могут привести к улучшению понимания процессов, ответственных за развитие преждевременных родов. Дополнительные исследования влияния глутамина на воспалительные реакции плода и на системную воспалительную реакцию детей и взрослых могут дать ключевую информацию для модификации этой реакции и, таким образом, для снижения заболеваемости с помощью питательных веществ.
Рисунок 5.
Повреждение слизистого барьера кишечника и развитие системной воспалительной реакции (СВР): гипотеза вызываемой глутамином защиты кишечного барьера