Применение лорноксикама для обезболивания в раннем послеоперационном периоде
Статьи| Предупреждение! Препарат рецептурного отпуска! Использовать только после назначения врача! |
Авторы: Никода В.В., Маячкин Р.Б., Бондаренко А.В., Михайлов Ю.Е., Аносова Н.П.
Издание: Российский научный центр хирургии РАМН, Москва
Цель работы
Одним из основных принципов интенсивной терапии послеоперационного периода является обеспечение адекватного обезболивания. Несмотря на широкий выбор медикаментозного и немедикаментозного обезболивания, 33-75% пациентов жалуются на среднюю и сильную боль, что подтверждает актуальность данной проблемы в медицине [2]. Для обезболивания в послеоперационном периоде основной группой лекарственных средств остаются опиоидные анальгетики. Наш опыт показывает, что после обширных внутриполостных хирургических вмешательств для достижения адекватного обезболивания у каждого третьего больного требуется введение опиоидов в дозах, превышающих стандартно рекомендуемые [1]. В то же время тактика увеличения дозы опиоидных анальгетиков приводит к росту частоты побочных реакций: выраженной седации, угнетению дыхания, тошноте, рвоте, парезу желудочно-кишечного тракта, дисфункции желче- и мочевыводящих путей. Желая снизить частоту возникновения побочных эффектов при назначении опиоидов, врач ограничивает суточную дозу препарата, что является одной из основных причин неадекватного обезболивания. Двойственность положения заставляет клиницистов дополнительно применять препараты других лекарственных групп, способных потенцировать обезболивающий эффект опиоидов. Важным аспектом при этом является возможность снижения дозы опиоидов.
У больных в послеоперационном периоде патогенетически обоснованным является применение группы нестероидных противовоспалительных средств (НПВС). За последние 2 десятилетия были созданы новые представители этой группы, которые выделяются анальгетической активностью, позволяющей применять их наравне с опиоидными анальгетиками при острой боли (послеоперационная боль, ожоги, травма, почечная колика и т. д.), возможностью парентерального введения. На наш взгляд, при отсутствии противопоказаний следует рассматривать НПВС в качестве базисных анальгетиков для послеоперационного обезболивания.
Одним из новых представителей группы НПВС является лорноксикам (ксефокам), который относится к группе оксикамов с короткой продолжительностью действия. Подобно другим НПВС, лорноксикам обладает обезболивающей и противовоспалительной активностью, неселективно ингибируя активность циклооксигеназы [6, 8].
Хотя в зарубежной литературе уже накоплен определенный опыт применения лорноксикама после ортопедических, гинекологических и стоматологических операций [4, 5, 9], в то же время анализ его использования после обширных полостных операций представлен незначительным количеством работ.
Целью данной работы явилась оценка эффективности и безопасности обезболивания лорноксикамом при различных методах и дозах его применения у пациентов после обширных хирургических вмешательств.
Материал и методы
В раннем послеоперационном периоде лорноксикам (ксефокам) применяли у 64 пациентов (36 мужчин и 28 женщин) в возрасте от 18 лет до 81 года (средний возраст 53 ± 17 лет). Контрольную группу составили 55 пациентов (26 мужчин и 28 женщин) в возрасте от 17 до 79 лет (средний возраст 51 ± 15 лет), в качестве анальгетика у которых использовали промедол. Больные основной и контрольной групп не различались по характеру выполненных им операций. Лорноксикам или промедол вводили после операций на легких и органах грудной полости 14 и 11 пациентам, на органах брюшной полости 46 и 43 пациентам, на магистральных сосудах и конечностях 4 и 1 пациенту соответственно. Между группами отсутствовали различия по частоте и характеру имевшихся у пациентов сопутствующих заболеваний. У 38 больных, получающих лорноксикам, и 37 больных контрольной группы выявлены следующие заболевания: ИБС, постинфарктный и атеросклеротический кардиосклероз у 16 и 17 пациентов соответственно, гипертоническая болезнь у 18 и 10, хронический бронхит у 4 и 9, ожирение у 2 и 3, хроническая венозная недостаточность у 3 и 4 пациентов, сахарный диабет типа 2 у 3 пациентов в каждой группе. Два и более сопутствующих заболевания имели место у 22 пациентов в основной и 20 пациентов контрольной группы.
В зависимости от схемы обезболивания пациенты, получающие лорноксикам, были распределены на 3 группы.
17 пациентам 1-й группы лорноксикам назначали по стандартной схеме - обезболивание по показаниям в разовой дозе 8 мг, вводимой внутривенно (в случае удаления внутривенного катетера переходили на внутримышечное введение препарата). Максимальная суточная доза у больных этой группы не превышала 16 мг. Длительность обезболивающей терапии лорноксикамом в указанной суточной дозе и при наличии болевого синдрома средней и сильной интенсивности составила 3-6 сут. При необходимости обезболивания после введения суточной дозы лорноксикама или его неэффективности дополнительно вводили опиоидный анальгетик промедол подкожно.
13 пациентам 2-й группы проводили контролируемое пациентом обезболивание (КПО) с использованием промедола на фоне планового назначения лорноксикама в дозе до 16 мг/сут. Для проведения КПО использовали следующие режимы введения промедола: в зависимости от выраженности исходного болевого синдрома начальная доза составляла 0-6 мг, болюсная доза - 3 мг, локаут-интервал - 10 мин. Максимальная 4-часовая доза препарата составляла 25-40 мг.
3-ю группу составили 34 больных, у которых применяли постоянную внутривенную инфузию лорноксикама со скоростью введения препарата 1 мг/ч. При выраженном болевом синдроме у пациентов в возрасте до 65 лет постоянная инфузия лорноксикама начиналась с болюсного введения препарата в дозе 8 мг. У 19 пациентов старше 65 лет постоянную инфузию лорноксикама применяли без болюсного введения. Таким образом, по данной схеме назначения препарата пациенты получали в течение 1-х суток 24 или 32 мг лорноксикама. в течение 2-х суток 24 мг. При недостаточной эффективности обезболивания вводили промедод в разовой дозе 20 мг подкожно.
Противопоказанием (критерии исключения из исследования) к назначению НПВС являлись повышенная чувствительность и аллергические реакции на любой представитель группы НПВС, геморрагические диатезы, кровотечение в послеоперационном периоде, язва желудка или двенадцатиперстной кишки, умеренные и тяжелые нарушения функции печени, почек, свертывающей системы крови, выраженная гиповолемия, предполагаемое или подтвержденное острое нарушение мозгового кровообращения, беременность, детский возраст.
Пациентам контрольной группы назначали промедол по стандартной схеме - обезболивание по показаниям в разовой дозе 20 мг, вводимой подкожно (n = 20), или использовали метод КПО с внутривенным введением анальгетика (n=31) с помощью прикроватного шприцевого перфузора "Graseby" 3300 РСА Pump.
У всех больных контролировались показатели системной гемодинамики (АД, ЧСС), при необходимости проходилась пульсоксиметрия с использованием монитора "Hewlett Packard".
Для изучения влияния лорноксикама на показатели гемостаза, функцию почек и печени определяли следующие показатели: концентрацию гемоглобина, количество эритроцитов, тромбоцитов, активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс (ПИ), время Р + К, креатинин и мочевину крови, ACT, АЛТ. Эти показатели определяли в 1-й день после операции до начала проведения терапии лорноксикамом, после первых суток, а также в день окончания терапии.
Интенсивность болевого синдрома оценивали до начала проведения обезболивания, затем в течение 4-6 ч после введения лорноксикама или промедола и далее ежедневно не реже 1 раза в сутки в течение всего периода обезболивания. Интенсивность болевого синдрома регистрировали по 10-балльной визуально-аналоговой шкале (от состояния, когда пациент не ощущает болей - 0 баллов, до очень сильных болей - 10 баллов). Обезболивающий эффект в динамике оценивали следующим образом: 0 баллов - без эффекта, 1 балл - незначительный (неудовлетворительный), 2 балла - средний (удовлетворительный), 3 балла - значительный (хороший), 4 балла - полное обезболивание (отличный эффект). В случае отсутствия обезболивания либо при неудовлетворительной степени снижения боли действие препарата считалось неадекватным. Интенсивность боли оценивали не только в покое, но и при активизации (кашель, дыхательная гимнастика и т. д.) больных. В случаях, когда лорноксикам применяли в виде однократной инъекции 8 мг, определялась продолжительность обезболивающего действия препарата. При проведении обезболивания учитывалась суточная доза анальгетиков и потребность в дополнительном обезболивании.
В течение всего времени проведения терапии лорноксикамом и промедолом регистрировались все нежелательные явления, отмеченные пациентами и врачом.
Для анализа количественных данных использовали критерий Стьюдента, однофакторный дисперсионный анализ и критерий Стьюдента с поправкой Бонферрони (при множественных сравнениях), для анализа степени снижения боли - критерии Манна-Уитни, Крускала-Уоллиса и Дайна (при множественных сравнениях), для анализа побочных эффектов - критерий χ 2 и точный критерий Фишера. Средние величины указаны как среднее ± стандартное отклонение.
Результаты исследований и их обсуждение
Оценка эффективности. В 1-й группе пациентов средняя интенсивность болевого синдрома к моменту начала обезболивания составила 3,7 ± 2 балла по 10-балльной визуально-аналоговой шкале (ВАШ) в покое и 7,3 ± 1,5 балла при движении. В целом по группе адекватное обезболивание после первой инъекции лорноксикама было достигнуто у 15 (88%) больных, при этом хороший анальгетический эффект наблюдался у 7 (41%) больных, удовлетворительный - у 8 (47%). Снижение интенсивности боли на 50% за 6-часовой период наблюдения после однократного внутривенного введения лорноксикама в дозе 8 мг отмечено у 7 (41%) пациентов. Динамика интенсивности болевого синдрома после первой инъекции лорноксикама отражена на рис. 1.
Рис. 1. Динамика интенсивности боли (в баллах) в покое и при движении после первой инъекции лорноксикама (8 мг внутривенно).
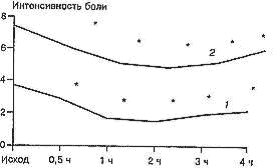
Достоверное снижение интенсивности боли отмечалось к 30-й минуте и сохранялось в течение 4-часового периода наблюдения. Максимальный обезболивающий эффект (снижение боли до 1,4 ± 1 балл в покое и до 5 ± 1,6 балла при движениях) отмечен нами ко 2-му часу. Продолжительность действия составила от 2 до 12 ч (в среднем по группе 4,8 ± 2,3 ч). В контрольной группе промедол продемонстрировал сходную аналитическую эффективность: адекватное обезболивание после одной подкожной инъекции промедола было достигнуто у 21 (87%) больного, при этом хороший анальгетический эффект наблюдался у 7 (29%) больных, удовлетворительный - у 14 (58%). Снижение болевого синдрома на 50% в течение 6-часового периода наблюдения после однократного введения дозы 20 мг было у 10 (42%) больных. Промедол характеризовался более ранним началом действия - снижение интенсивности боли отмечено уже к 15-й минуте, а максимальный анальгетический эффект наблюдался в интервале от 1 до 1,5 ч. Однако общая продолжительность действия промедола не отличалась от таковой лорноксикама и составила в среднем по группе 4,3 ± 1,7 ч.
Сравнение болеутоляющего действия лорноксикама и промедола в зависимости от метода обезболивания представлено в табл. 1. Нами выявлено, что лучшие результаты обезболивания наблюдались в группах, где использовалось КПО промедолом и в группе постоянной внутривенной инфузии лорноксикама. При этом в течение 1-х суток обезболивания постоянная внутривенная инфузия лорноксикама в дозе 25 ± 4,5 мг в сутки была эффективней ( p меньше 0,05) промедола, назначавшегося по показаниям. В течение 2-х суток анальгетическая эффективность внутривенной инфузии лорноксикама в дозе 22 ± 3,5 мг в сутки превышали токовую промедола, назначаемого по показаниям, и лорноксикама, назначаемого по 8 мг 2 раза в сутки (средняя суточная доза составила 15,5 ± 2 мг).
Таблица 1. Эффективность обезболивания (в %) лорноксикамом и промедолом в зависимости от метода назначения анальгетиков
| Оценка обезболивания | Лорноксикам, 16 мг + промедол п/п | Лорноксикам, 16 мг + КПО промедолом | Лорноксикам, 24 мг инфузия + промедол п/п | Промедол п/п | Промедол КПО | 24 ч | 48 ч | 24 ч | 48 ч | 24 ч | 48 ч | 24 ч | 48 ч | 24 ч | 48 ч |
| Отличная | - | - | - | - | 3 | - | - | - | 3 | 5 |
| Хорошая | 35 | 47 | 54 | 92 | 46 | 82 | 25 | 50 | 74 | 74 |
| Удовлетворительная | 53 | 29,5 | 46 | 8 | 48 | 18 | 58 | 37 | 20 | 16 |
| Неудовлетворительная | 12 | 23,5 | - | - | 3 | - | 17 | 13 | 3 | 5 |
Проведенный анализ не выявил существенных различий в исходной интенсивности боли между группами. В течение первых суток обезболивания интенсивность боли при движении в группах, где проводилось КПО промедолом, в среднем на 1,2 балла была ниже (р меньше 0,05), чем в группе с внутривенной инфузией лорноксикама. В дальнейшем не выявлено различий этого показателя между группами.
Суточные дозы лорноксикама и потребность в дополнительном назначении промедола представлены в табл. 2. Применение лорноксикама в 1-е сутки после операции приводило к отчетливому снижению потребности в промедоле. Так, у 34 пациентов, которым проводилась внутривенная инфузия лорноксикама, потребность во введении промедола в 1-е сутки отмечена нами у 22 (65%) больных. Среди пациентов, которым требовалось дополнительно введение анальгетиков, суточная доза промедола в этих случаях составила 48 мг, что почти в 2 раза меньше суточной дозы промедола в контрольной группе. Данное опиоидсберегающее действие лорноксикама наблюдалось и в случае, когда проводилось КПО промедолом. Дозы промедола при проведении КПО (с плановым назначением лорноксикама 16 мг/сут и в контрольной группе) в различные сроки проведения обезболивания представлены на рис. 2.
Рис. 2. Потребление промедола (в мг/сут) при проведении КПО в контрольной группе (монотерапия промедолом) и в группе с базисным назначением лорноксикама (16 мг/сут).
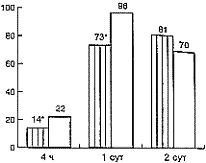
Таблица 2. Потребность в обезболивании промедолом в зависимости от суточной дозы лорноксикама
| Анальгетик | 1, 2-я группа - лорноксикам 16 мг/сут | 3-я группа - лорноксикам 24 мг/сут, в/в инфузия | Контрольная промедол п/п | 1 сут | 2 сут | 1 сут | 2 сут | 1 сут | 2 сут |
| Лорноксикам, мг/сут | 16 ± 2 | 16 ± 2 | 25 ± 5 | 22 ± 4 | - | - |
| Потребность в промедоле, % | 82 | 76 | 65* | 78 | 100 | 100 |
| Промедол, мг/сут | 48 ± 20* | 46 ± 27 | 48 ± 27* | 39 ± 23v | 91 ± 26 | 48 ± 19 |
Значительное снижение средней суточной дозы промедола в контрольной группе в течение 2-х суток проведения обезболивания обусловлено исключением из исследования пациентов, у которых возникли нежелательные явления, связанные с введением больших доз опиоидов. Так, 25% пациентов, получающих обезболивание промедолом (20 мг подкожно по показаниям) в течение 2 сут, потребовалось дополнительное назначение анальгетиков (баралгин, трамал, бупренорфин).
Дискуссионным является вопрос об эффективности различных суточных доз лорноксикама. Так, в исследовании S. Е. Norholt и соавт. [7] проанализирована эффективность применения таблетированной формы лорноксикама о дозах 4, 8, 16 и 32 мг в стоматологической хирургии. Авторами выявлено, что повышение дозы лорноксикама более 16 мг не приводило к усилению анальгетического эффекта у данной группы пациентов. Принимая во внимание, что биологическая доступность при пероральном, внутримышечном и внутривенном введении практически равна 100% [3], и данные, полученные в нашем исследовании, мы считаем, что доза 24 мг в сутки является оптимальной для обезболивания после обширных хирургических вмешательств.
Оценка переносимости препарата и нежелательные явления. Важной проблемой обезболивания НПВС является изучение безопасности их применения. У пациентов пожилого возраста назначение НПВС сопряжено с повышенным риском развития нежелательных явлений. В этой связи контроль показателей функции почек, гемостаза, состояния желудочно-кишечного тракта должен осуществляться особенно тщательно. В табл. 3 представлена динамика лабораторных показателей, характеризующих функцию почек, печени, состояние системы гемостаза у 19 больных пожилого возраста (средний возраст 73 ± 4 года), которым в течение 2 сут после операции проводилась постоянная внутривенная инфузия лорноксикама со скоростью 0,7-1 мг/ч. Как видно из табл. 3, не выявлено клинически значимых изменений исследуемых показателей. Повышение концентрации мочевины в крови к 3-м послеоперационным суткам в среднем на 13 ± 4,6 мг% не сопровождалось повышением концентрации креатинина. Следует добавить, что данное, по-видимому, обусловлено повышенным катаболизмом, характерным для раннего послеоперационного периода. Одним из важных дискуссионных вопросов применения представителей группы НПВС у больных после хирургических вмешательств является их влияние на гемостаз. Некоторые исследователи считают, что увеличение времени кровотечения, связанное с периоперационным назначением НПВС, не является клинически значимой проблемой [4]. Выраженность влияния лорноксикама на свертывающую систему крови сходна с другими представителями группы НПВС, но в отличие от аспирина лорноксикам обратимо ингибирует циклооксигеназу тромбоцитов. В нашем исследовании из показателей, характеризующих гемостаз, увеличивалась концентрация фибриногена. Наблюдаемое снижение содержания эритроцитов в среднем на 11 и 16% по окончании 1-х и 2-х суток терапии лорноксикамом соответственно по сравнению с исходными значениями и содержания тромбоцитов в среднем на 11 % после 1-х суток не требовало проведения заместительной или гемостатической терапии. Лорноксикам хорошо переносился больными. Анальгетик не оказывал влияния на АД, ЧСС, SpO 2 , ЧД. В целом по группе, где в качестве базисного анальгетика применяли лорноксикам, нежелательные эффекты отмечены у 3 (5%) пациентов. Среди них у 2 (3%) больных встречалась повышенная потливость, у 1 пациентки в течение 3 и 4 сут терапии лорноксикамом (8 мг внутримышечно 2 раза в день) через 20 мин после инъекции появлялось чувство жара и сильное головокружение, в связи с чем она отказалась от дальнейшей терапии лорноксикамом. Частота развития нежелательных эффектов в контрольных группах (промедол по показаниям и КПО промедолом) и в группах, где в качестве базисного анальгетика применялся лорноксикам, представлена на рис. 3. При монотерапии промедолом частым нежелательным эффектом в 1-е сутки являлся умеренный или сильный седативный эффект у 33 и 16% больных соответственно при назначении промедола по показаниям и проведения КПО промедолом. Другие нежелательные эффекты, имевшие место у этих пациентов, - задержка мочи у 8 и 3% больных, тошнота, рвота у 4 и 6,5% больных, головокружение у 4 и 6,5% больных соответственно. У 1 больного 79 лет, которому была выполнена экстирпация пищевода с одномоментной пластикой желудочной трубкой на 36-м часу проведения КПО промедолом, отмечены выраженный снотворный эффект и брадипноэ (4-6 дыханий в минуту), потребовавшие введения налоксона.
Таблица 3. Динамика лабораторных показателей у пациентов пожилого возраста при обезболивании лорноксикамом (n = 19)
| Показатель | 1-е п/о сутки | 2-е п/о сутки | 3-и п/о сутки | Норма |
| Мочевина, мг% | 27 ± 7 | 29 ± 7 | 40 ± 15* | 20-40 |
| Kpeaтинин, мг% | 0,8 ± 0,3 | 0,9 ± 0,3 | 1,1 ± 0,6 | 0,5-1,6 |
| ACT, ед/л | 33 ± 20 | 32 ± 16 | 24 ± 7* | 5-40 |
| АЛТ, ед/л | 20 ± 15 | 19 ± 16 | 14 ± 5 | 5-40 |
| АЧТВ, с | 35 ± 4 | 34 ± 5 | 36 ± 5 | 30-40 |
| ПТИ, % | 84 ± 5 | 81 ± 7 | 80 ± 10 | 80-110 |
| Р + К, с | 651 ± 98 | 765 ± 260 | 698 ± 123 | 660-780 |
| Фибриноген, мг% | 526 ± 150 | 601 ± 119* | 634 ± 101* | 280-350 |
| Эритроциты, 10 12/л | 4,4 ± 0,6 | 3,9 ± 0,5* | 3,7 ± 0,6* | 3,9-5,0 |
| Тромбоциты, 10 9/л | 257 ± 105 | 228 ± 93* | 249 ± 74 | 180-320 |
Рис. 3. Частота развития нежелательных эффектов.

Выводы
Список литературы
1. Лебедева Р. Н., Никода В. В. Фармакотерапия острой боли. - М., 1998. - С. 183.
2. Ферранте Ф. М., ВейдБонкор Т. Р. Послеоперационная боль. - М., 1998. - С. 3.
3. Dittrich P., Randhofer - Welte S., Mayerhofer S. et al. // Eur. J. Pharmacol. - 1990. - Vol. 183. - P. 2265.
4. Hitchcock М., Ogg T. W., Camu F. // Pain Management. - 1994. - P. 10.
5. Ilias W., Jansen М. // Br. J. Clin. Pract. - 1996. - Vol. 50. -P. 197-202.
6. McCormac К. // Drugs. - 1994. - Vol. 47, Suppl. 5. - P. 28-45.
7. Norholl S. E., Sindel-Pedersen S., Bugge C. et al. // J. Clin. Pharmacol. - 1995. - Vol. 35, - P. 606-614.
8. Pruss T. P., Stroissnig Н., Randhofer-Welte S. et al. // Postgrad. Med. J. - 1990, - Vol. 66, Suppl. 4, - P. 18-21.
9. Rosenow D. E., van Krieken I., Slolke D. et al. // Clin. Drug Invest. - 1996. - Vol. 11. - P. 11-19.
