 invar.ru
invar.ru

Cредство для естественного восстановления менструального цикла без гормонов
В его состав входит уникальная комбинация мио-инозитола, D-хиро-инозитола, марганца и фолиевой кислоты.
далее...
Инозитолы в регуляции менструального цикла девочек-подростков с дисфункцией яичников
СтатьиУварова Е.В.1,2, Турчинец А.И.1, Кумыкова З.Х.1, Хащенко Е.П.1, Мамедова Ф.Ш.1, Иванец Т.Ю.1
1 Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, 117997, г. Москва, Российская Федерация
2 Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет имени И.М. Сеченова Минздрава России (Сеченовский Университет), 127994, г. Москва, Российская Федерация
Введение. В последние годы появляется все больше исследований, оценивающих эффективность применения инозитолов при овариальной дисфункции и гиперандрогении яичникового генеза. Получены результаты многочисленных исследований по оценке эффективности различных соотношений миоинозитола и D-хироинозитола (МИ/ДХИ) у женщин с синдромом поликистозных яичников и в циклах экстракорпорального оплодотворения, однако работ, посвященных изучению результатов применения инозитолов у подростков, - единицы.
Цель - оценить влияние комбинации МИ/ДХИ в соотношении 5:1 на менструальный цикл, клинические и лабораторные показатели гиперандрогении яичникового генеза у девочек пубертатного возраста с дисфункцией яичников.
Материал и методы. В исследование включены 68 девочек, наблюдавшихся во 2-м гинекологическом отделении ФГБУ НМИЦ им. В.И. Кулакова Минздрава России с января 2019 г. по сентябрь 2022 г., в возрасте от 13 до 17 лет включительно, c нарушением менструального цикла по типу олигоменореи или аменореи. Всем пациенткам с целью регуляции менструального цикла был назначен Дикироген® (комбинация мио- и D-хироинозитола в соотношении 5:1, марганца и фолиевой кислоты) по 1 саше 1 раз в день в течение 4 мес. Эффективность оценивали с учетом установки регулярного ритма менструаций в пределах от 21 до 40 дней с индивидуальной вариабельностью в пределах 1-й недели.
Результаты и обсуждение. За период наблюдения менструации были у 88% пациенток, из них у 64% цикл стал регулярным. Среди девочек с клиническими проявлениями андрогенной дерматопатии через 4 мес регулярного приема комбинации МИ/ДХИ в соотношении 5:1 65% отметили косметические улучшения. На фоне терапии средний объем яичников пациенток достоверно уменьшился в 1,3 раза, у 35% девочек, по данным ультразвукового исследования, определялись желтые тела, функциональные образования небольших размеров или фолликулы диаметром более 10 мм. Уровни общего тестостерона и андростендиона значимо снизились в 1,5 раза, однако показатели глобулина, связывающего половые гормоны, и индекса свободных андрогенов достоверно не изменились. После окончания терапии у девочек отмечено уменьшение уровня антимюллерова гормона в 1,3 раза при увеличении секреции эстрадиола в 1,5 раза.
Заключение. Комбинация МИ/ДХИ в соотношении 5:1 эффективно уменьшает клинические и лабораторные проявления гиперандрогении и регулирует ритм менструаций у девочек с дисфункцией яичников в пубертатном периоде.
Ключевые слова: миоинозитол, D-хироинозитол; нарушения менструального цикла; гиперандрогения; дисфункция яичников
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Концепция и дизайн исследования - Уварова Е.В., Кумыкова З.Х., Хащенко Е.П.; сбор и обработка материала - Кумыкова З.Х., Хащенко Е.П., Мамедова Ф.Ш., Иванец Т.Ю.; анализ данных - Турчинец А.И.; написание текста - Турчинец А.И., Кумыкова З.Х.; редактирование - Уварова Е.В., Кумыкова З.Х.
Для цитирования: Уварова Е.В., Турчинец А.И., Кумыкова З.Х., Хащенко Е.П., Мамедова Ф.Ш., Иванец Т.Ю. Инозитолы в регуляции менструального цикла девочек-подростков с дисфункцией яичников // Репродуктивное здоровье детей и подростков. 2023. Т. 19, № 1. С. 26-35.
Effects of inositols in menstrual cycle regulation in adolescent girls with ovarian dysfunction
Uvarova E.V.1,2, Turchinets A.I.1, Kumykova Z.Kh.1, Khashchenko E.P.1, Mamedova F.Sh.1, Ivanets T.Yu.1
1 National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, 117997, Moscow, Russian Federation
2 I .M. Sechenov First Moscow State Medical University of Ministry of Health of the Russian Federation (Sechenov University), 127994, Moscow, Russian Federation
Introduction. There have been a lot of studies evaluating the efficiency of inositols in the treatment of ovarian dysfunction and ovarian hyperan-drogenism in recent years. The results of numerous studies on the selection of an efficient ratio of myoinositol and D-chiroinositol (MI/DCI) have been obtained to achieve a therapeutic effect in women with polycystic ovary syndrome and in in vitro fertilisation cycles, however, there are few studies of inositol treatment in adolescents.
Aim. To evaluate the effect of 5:1 MI/DCI therapy on the menstrual cycle, clinical and laboratory parameters of ovarian hyperandrogenism in adolescents with ovarian dysfunction.
Material and methods. The study included 68 girls from 13 to 17 years inclusive, with oligomenorrhea or amenorrhea, who was observed in the 2nd gynecological department of the National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov (Moscow, Russia) from January 2019 to September 2022. In order to regulate the menstrual cycle, all patients were prescribed Dikirogen® (myo- and D-chiroinositol in ratio 5:1 with manganese and folic asid) 1 sachet 1 time a day for 4 months. Therapy was considered effective if a regular menstrual cycle (ranging from 21 to 40 days with individual variability within one week) was established.
Results and discussion. During the observation period 88% of patients had menstruation and 64% of them had a regular cycle. After 4 months of regular use of 5:1 MI/DCI, 65% girls with clinical manifestations of androgenetic dermatopathy noted cosmetic improvements. The average volume of the ovaries of the patients significantly decreased by 1.3 times during therapy, and 35% of the girls had corpus luteum in ovary, small functional cysts or follicles with a diameter more than 10 mm. The levels of total testosterone and androstenedione significantly decreased by 1.5 times, but the sex hormone-binding globulin, and free androgen index values did not change significantly. After the end of therapy, the girls showed a decreased level of anti-Mullerian hormone by 1.3 times with an increase in the secretion of estradiol by 1.5 times.
Conclusion. 5:1 MI/DCI is efficient in a reducing of clinical and laboratory manifestations of hyperandrogenism and successfully regulates the rhythm of menstruation in girls with ovarian dysfunction during puberty.
Keywords: myoinositol, D-chiroinositol; menstrual disorders; hyperandrogenism; ovarian dysfunction
Funding. The study had no sponsor support.
Conflict of interest. The authors declare no conflict of interest.
Authors’ contribution. The concept and design of the study - Uvarova E.V., Kumykova Z.H., Khashchenko E.P; collection and processing of the material - Kumykova Z.H., Khashchenko E.P., Mammadova F.Sh., Ivanets T.Y.; data analysis - Turchinets A.I.; writing of the text - Turchinets A.I., Kumykova Z.H.; editing - Uvarova E.V., Kumykova Z.H.
For citation: Uvarova E.V., Turchinets A.I., Kumykova Z.Kh., Khashchenko E.P., Mamedova F.Sh., Ivanets T.Y. Effects of inositols in menstrual cycle regulation in adolescent girls with ovarian dysfunction. Reproduktivnoe zdorov’e detey i podrostkov [Pediatric and Adolescent Reproductive Health]. 2023; 19 (1): 26-35.
Проблеме коррекции гиперандрогении яичникового генеза посвящено множество исследований. В настоящее время первой линией терапии андроген-зависимых дерматопатий при синдроме поликистозных яичников (СПЯ) является применение комбинированных оральных контрацептивов (КОК) с антиандрогенным эффектом [1, 2]. Однако, в отличие от большинства женщин репродуктивного возраста, заинтересованных в контрацепции, девочки пубертатного возраста реже являются сексуально активными, в связи с чем применение КОК у этой подгруппы пациенток в большинстве случаев будет off-label.
В последние годы появляется все больше исследований, оценивающих эффективность применения инозитолов при овариальной дисфункции и гиперандрогении яичникового генеза. Инозитолы представляют собой группу сахарных спиртов разных стереоизомерных форм, среди которых миоинозитол (МИ) является наиболее распространенной формой у людей [3, 4]. Эпимераза NAD/NADH, инсулинозависимый фермент, превращает МИ в D-хироинозитол (ДХИ), причем скорость конверсии зависит от специфических потребностей различных тканей в этих двух молекулах, например в яичнике соотношение МИ/ДХИ 100:1 [3, 4]. Являясь структурной основой для вторичных мессенджеров, в том числе в передаче сигналов фолликулостимулирующего гормона (ФСГ), инозитолы играют значимую роль в синтезе стероидных гормонов, созревании ооцитов, скорости оплодотворения и качестве эмбрионов у женщин с и без СПЯ в программах экстракорпорального оплодотворения (ЭКО), а также оказывают благоприятное влияние на восстановление чувствительности к инсулину [3, 6, 7].
Было показано, что фолликулы, содержащие ооциты высокого качества, имеют более высокие концентрации МИ в фолликулярной жидкости, что позволяет предположить связь уровня МИ с процессами роста фолликулов и развития ооцитов [7, 8]. В исследовании М. Tabatabaie и соавт. (2022) у пациенток, получавших МИ, отметилось значительное снижение экспрессии ферментов StAR и CYP11A, инициирующих процесс стероидогенеза из холестерина, а также нормализация уровня CYP19A1, участвующего в превращении андрогена в эстрадиол [9]. Описано модулирование МИ активности переносчиков глюкозы и ее утилизации, в то время как ДХИ контролирует синтез гликогена и регулирует индуцированный инсулином синтез андрогенов [4, 10]. На основании этого наблюдения было высказано предположение, что пациенты с СПЯ и гиперинсулинемией могут иметь ускоренную эпимеризацию МИ в ДХИ, что приводит к избыточному синтезу ДХИ и, следовательно, к дефициту МИ в яичниках [11, 12]. Впоследствии эта теория была подтверждена в работе R. Isabella, Е. Raffone (2012), доказывающей, что качество ооцитов и функция яичников постепенно снижаются при увеличении дозировки ДХИ (свыше 600 мг/сут) [13].
До сих пор проводятся многочисленные исследования по подбору соотношения МИ/ДХИ для достижения эффекта у женщин с СПЯ и в циклах ЭКО, однако работ, посвященных изучению результатов применения инозитолов у подростков, - единицы [14-17].
В данном исследовании мы решили изучить динамику менструального цикла и гормонально-сонографических характеристик овариальной функции у девочек-подростков, получающих комбинацию инозитолов (МИ/ДХИ) в соотношении 5:1 для коррекции яичниковой дисфункции.
Цель - оценить влияние комбинации МИ/ДХИ в соотношении 5:1 на менструальный цикл, клинические и лабораторные показатели гиперандрогении яичникового генеза у девочек пубертатного возраста с дисфункцией яичников.
Материал и методы
В исследование были включены 68 девочек, наблюдавшихся во 2-м гинекологическом отделении ФГБУ НМИЦ им. В.И. Кулакова Минздрава России с января 2019 г. по сентябрь 2022 г., в возрасте от 13 до 17 лет включительно с диагнозами, классифицируемыми в МКБ-10 как N91.0 (первичная аменорея), N91.1 (вторичная аменорея), N91.3 (первичная олигоменорея), N91.4 (вторичная олигоменорея), E28.2 (синдром поликистоза яичников), E28.8 (другие виды дисфункции яичников) и E28.9 (дисфункция яичников неуточненная). Критериями исключения были лабораторно-инструментальные признаки гипогонадизма, аномалии половых хромосом, врожденные пороки развития половых органов, прием препаратов, содержащих половые стероидные гормоны, в течение 3 мес до начала исследования, наличие тяжелой соматической патологии, инсулинорезистентности, операций на придатках матки в анамнезе, отказ от участия в исследовании.
Всем пациенткам в целях регуляции менструального цикла был назначен Дикироген® (МИ 1000 мг, ДХИ 200 мг, фолиевая кислота 200 мкг, марганец 5 мг) по 1 саше 1 раз в день в течение 4 мес. Длительность наблюдения пациенток в среднем составила 127,4 дня. Пациенткам с отсутствием менструаций более 6 мес, а также с первичной аменореей (в возрасте старше 15 лет или через 3 года с момента телархе) после исключения клинико-диагностических маркеров гипогонадизма проводили стандартную пробу с гестагеном. При положительной пробе пациентку включали в исследование с первого дня закономерной менструальноподобной реакции (ЗМПР).
Эффективность оценивали с учетом установления регулярного ритма менструаций в пределах от 21 до 40 дней с индивидуальной вариабельностью в пределах 1 нед.
Дополнительно проводили оценку клинических данных, динамики изменений антропометрических (индекс массы тела -ИМТ), лабораторных [общий тестостерон, глобулин, связывающий половые гормоны (ГСПГ), антимюллеров гормон (АМГ), андростендион, эстрадиол] и инструментальных [объем яичников, по данным ультразвукового исследования (УЗИ) органов малого таза] показателей. Для расчета индекса свободных андрогенов (ИСА) использовали формулу:
ИСА = общий тестостерон (нмоль/л)/ ГСПГ(нмоль/л) х 100.
Чтобы оценить гликемический статус изучали уровень глюкозы и инсулина натощак, рассчитывали индекс HOMA, по показаниям проводили пероральный глюкозотолерантный тест. УЗИ органов малого таза выполняли на 5-7-й день менструального цикла по стандартной методике на ультразвуковом сканере ESAOTE MyLab™Class C с использованием абдоминального конвексного датчика частотой 3,5 МГц. Исследование гормонального статуса проводилось на 2-5-й день менструального цикла в соответствии со стандартами для каждого показателя в клинико-диагностических лабораториях 3-го уровня.
Для статистического анализа результатов использовали программы Excel и Prism Version 9.4.1. При проверке статистических гипотез применялся уровень значимости а=0,05 (для парных тестов). Для оценки значимости непараметрических показателей использовался парный критерий Вилкоксона.
За период наблюдения 9 девушек выбыли из исследования ввиду неявки на повторный прием, таким образом, исследование завершили 59 пациенток.
Результаты и обсуждение
Средний возраст пациенток составил 15,83±1,12 года при среднем возрасте менархе 12,74±1,45 года. Все пациентки предъявляли жалобы на редкие менструации или их отсутствие в течение 4-9 мес. У 3 (5,08%) девочек отмечалась первичная и у 8 (13,56%) - вторичная аменорея. Результаты пробы с гестагенами у всех 11 девочек с аменореей положительные. Первичная олигоменорея с ритмом менструаций через 40-60 дней наблюдалась у 4 пациенток (6,78%), в то время как у 18 (30,51%) девочек с момента менархе было менее 6 менструаций в год. Вторичная олигоменорея с промежутками между менструациями в 40-60 и 60-180 дней встречалась у 5 (8,47%) и 21 (35,59%) пациенток соответственно (рис. 1А).
При контрольном осмотре 38 (64,41%) пациенток отметили регулярные менструации через 21-40 дней, у 14 (23,73%) из них за 4 мес наблюдения была 1 или 2 менструации, в то время как лишь у 6 (10,17%) девочек со вторичной и 1 (1,69%) с первичной аменореей менструаций за период наблюдения не было (см. рис. 1Б).
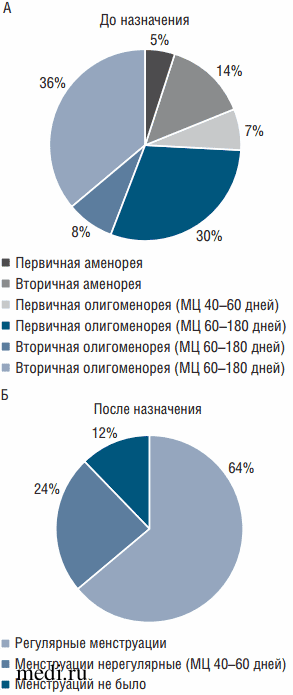 Рис. 1. Характеристика менструального цикла (МЦ) пациенток: А - до назначения комбинации миоинозитола и D-хироинозитола 5:1; Б -после назначения комбинации миоинозитола и D-хироинозитола 5:1
Рис. 1. Характеристика менструального цикла (МЦ) пациенток: А - до назначения комбинации миоинозитола и D-хироинозитола 5:1; Б -после назначения комбинации миоинозитола и D-хироинозитола 5:1
Клинические признаки гиперандрогении до начала наблюдения выявлялись у 37 (62,7%) пациенток: распространенные элементы акне и постакне на коже лица (91,9%), плеч (43,2%), спины (56,7%) и груди (48,6%), гипертрихоз по женскому типу (40,5%), гирсутизм (18,9%). При динамическом наблюдении значимое улучшение состояния кожи и снижение активности роста волос по мужскому типу на 3-м месяце наблюдения отметили 11 (29,73%), а на 4-м месяце - еще 14 (37,84%) девочек из 37 соответственно.
Средний ИМТ за период наблюдения не изменился и составил 22,22±4,07 и 22,28±3,94 кг/м2 соответственно (см. таблицу). Среди исследуемых пациенток избыточная масса тела (25 ≥ИМТ <30) была у 11 (18,96%), ожирение I степени (30 ≥ИМТ <35) - у 1 (1,724%), ожирение II степени (35 ≥ИМТ <40) - у 1 (1,724%), дефицит массы тела (ИМТ <18,50) - у 8 (13,79%) девочек.
Из 59 пациенток, пришедших на контрольный осмотр, 10 девушек не предоставили данные лабораторных и инструментальных исследований для сравнения показателей, в связи с чем статистический анализ уровня гормонов и объема яичников проводился у 49 пациенток.
В соответствии с эхографическими критериями клинических рекомендаций Минздрава России 2021 г. 14 (23,73%) из исследуемых девочек имели СПЯ [1]. При сравнении ультразвуковых показателей до и по завершении наблюдения выявлено статистически значимое уменьшение объема яичников у пациенток на фоне приема комбинации МИ/ДХИ в соотношении 5:1 на 22,57% (см. таблицу). Средний объем яичников до приема комбинации МИ/ДХИ в соотношении 5:1 составил 12,63±5,04 см3, а после 4-месячного курса инозитолов - 9,78±3,15 см3 (р<0,0001). К тому же у 8 (16,33%) пациенток при контрольном обследовании отмечалось наличие кисты желтого тела или функциональной кисты в стадии регресса, а у 9 (18,36%) - наличие фолликулов диаметром более 10 мм, в том числе у 3 девочек с формирующимся СПЯ, что свидетельствует об активации роста и созревания фолликулов и наличии у части девочек овуляторных циклов. Диаграмма, иллюстрирующая парные изменения объема яичников, представлена на рис. 2.
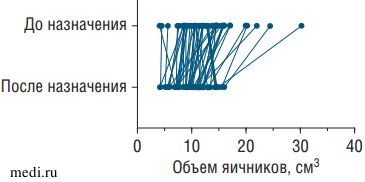 Рис. 2. Изменения объема яичников у пациенток до и после назначения комбинации миоинозитола и D-хироинозитола в соотношении 5:1 (р<0,0001)
Рис. 2. Изменения объема яичников у пациенток до и после назначения комбинации миоинозитола и D-хироинозитола в соотношении 5:1 (р<0,0001)
При изучении лабораторных показателей пациенток обратило на себя внимание значительное снижение уровней тестостерона, АМГ в крови пациенток при незначительном увеличении ГСПГ и снижении ИСА (рис. 3, А-Д).
Средний уровень тестостерона достоверно снизился на 35,85% после применения комбинации МИ/ДХИ в соотношении 5:1 и достиг верхней границы референсного значения. Учитывая незначительные скоординированные изменения ГСПГ и ИСА, можно предположить снижение активной фракции андрогенов на фоне приема инозитолов. Отсутствие достоверной динамики уровня ГСПГ у исследуемых нами пациенток соотносится с данными, полученными в метаанализе V. Unfer и соавт. (2016), где авторы не выявили значимого влияния МИ/ДХИ на глобулин, связывающий половые гормоны, при терапии длительностью до 16 нед [4]. Снижение уровня андростендиона на 28,62% по результатам наблюдения с достижением среднего значения ниже верхней границы референсного интервала соответствует уменьшению клинических признаков андрогенной дерматопатии в группе наблюдаемых пациенток и в совокупности с динамикой тестостерона подтверждает значимый антиандрогенный эффект средства Дикироген® (см. таблицу).
Статистическая оценка изменений индивидуальных значений клинико-диагностических показателей до и после применения комбинации миоинозитола и D-хироинозитола в отношении 5:1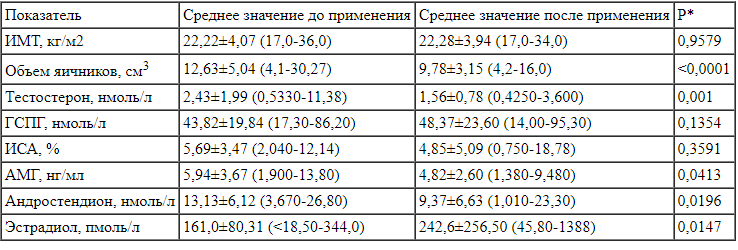 Примечание. * - значение согласно парному критерию Вилкоксона. Расшифровку аббревиатур см. в тексте.
Примечание. * - значение согласно парному критерию Вилкоксона. Расшифровку аббревиатур см. в тексте.
Поскольку в наше исследование не включались пациентки с инсулинорезистентностью как одним из факторов, стимулирующих развитие гиперандрогении, сокращение продукции общего тестостерона и андростендиона в 1,5 раза на фоне применения комбинации МИ/ДХИ в соотношении 5:1 доказывает ее эффективность в регуляции инсулинонезависимого биосинтеза андрогенов [18]. Более того, по результатам анализа рандомизированных клинических исследований 2019 г. доказана эффективность миоинозитола как в восстановлении андрогенного, так и метаболического профиля у взрослых пациенток в сравнении с применением метформина, что в совокупности с хорошей переносимостью делает его перспективным средством в терапии СПЯ [19].
Несмотря на достоверное снижение уровней АМГ на 18,8% у наблюдаемых пациенток, ни у одной девочки не было отмечено падение показателя ниже значения 1,2 нг/мл, соответствующего сниженному овариальному резерву и риску «бедного ответа» на стимуляцию яичников в программах ВРТ в соответствии с критериями POSEIDON 2016. Еще в 2012 г. Е. Carmina и соавт. определили, что высокий уровень АМГ отрицательно коррелирует с вероятностью восстановления овуляторных циклов, а его значение ≤4 нг/мл ассоциировано с нормальной овуляторной функцией [20]. К тому же уровень эстрадиола достоверно повышался, в том числе достигал нормальных значений у 3 девочек с ранее не определяемыми показателями, что характеризует положительную регуляцию функции яичников наряду со снижением АМГ (см. рис. 3, Г, Е).
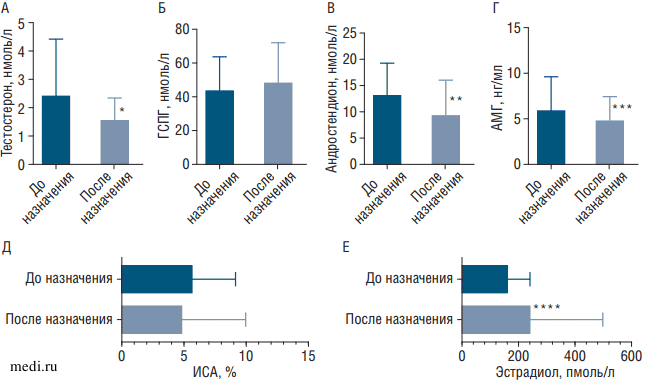 Рис. 3. Изменения средних значений лабораторных показателей до и после назначения комбинации миоинозитола и D-хироинозитола в соотношении 5:1
Рис. 3. Изменения средних значений лабораторных показателей до и после назначения комбинации миоинозитола и D-хироинозитола в соотношении 5:1
А - снижение тестостерона, * - p=0,001; Б - повышение глобулина, связывающего половые гормоны, p>0,05; В - снижение андростендиона, ** - p=0,0196; Г - снижение уровня антимюллерова гормона, *** - p=0,0413; Д - снижение индекса свободных андрогенов, p>0,05; Е - повышение эстрадиола, **** - р=0,0147. Расшифровка аббревиатур дана в тексте.
Все пациентки хорошо переносили назначенное средство, были удовлетворены формой и кратностью его приема, побочных эффектов не наблюдалось. Из 59 пациенток, находившихся под наблюдением, 14 (28,57%) девушек продолжили прием средства в течение 6-9 мес, 9 (18,37%) -в течение года, отмечая регулярный ритм менструаций и уменьшение клинических проявлений гиперандрогении.
Заключение
Таким образом, средство, содержащее МИ/ДХИ в соотношении 5:1, оказывает достоверно значимый эффект у пациенток подросткового возраста с дисфункцией яичников, оказывая регулирующее действие на ритм менструаций, клинические и лабораторные проявления гиперандрогении, уменьшая объем яичников и корректируя их гормональную функцию. Добавление комбинации МИ/ДХИ в соотношении 5:1 эффективно при дисфункции яичников в пубертатном периоде, так как инозитолы являются важной составляющей фолликулярного микроокружения, опосредуют передачу сигналов ФСГ и способствуют развитию и созреванию ооцитов.
Сведения об авторах
Уварова Елена Витальевна (Elena V. Uvarova) - член-корреспондент РАН, доктор медицинских наук, профессор, заведующий 2-м гинекологическим отделением (гинекологии детского и юношеского возраста) ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России; профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии ИПО ФГАОУ ВО ПМГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), президент Межрегиональной общественной организации «Объединение детских и подростковых гинекологов», (Москва, Российская Федерация)
Турчинец Анна Ильинична (Anna I. Turchinets) - аспирант ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (Москва, Российская Федерация)
Кумыкова Заира Хасановна (Zaira Kh. Kumykova) - кандидат медицинских наук, старший научный сотрудник 2-го гинекологического отделения (гинекологии детского и юношеского возраста) ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (Москва, Российская Федерация)
Хащенко Елена Петровна (Elena P. Khashchenko) - старший научный сотрудник 2-го гинекологического отделения (гинекологии детского и юношеского возраста) ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (Москва, Российская Федерация)
Мамедова Фатима Шапиевна (Fatima S. Mamedova) - кандидат медицинских наук, врач отделения ультразвуковой диагностики в неонатологии и педиатрии ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (Москва, Российская Федерация)
Иванец Татьяна Юрьевна (Tat’yana Y. Ivanets) - доктор медицинских наук, заведующий клинико-диагностической лабораторией ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (Москва, Российская Федерация)
Литература
1. Федеральные клинические рекомендации Синдром поликистозных яичников, 2021.
2. Хащенко Е.П., Уварова Е.В., Батырова З.К., Кумыкова З.Х., Сальникова И.А., Мамедова Ф.Ш., Киселева И.А. Возможности терапии косметологических проявлений гиперандрогении и контрацепции у молодых девушек // Репродуктивное здоровье детей и подростков. 2017. № 6. С. 84—90.
3. Аляутдина О.С., Прилуцкая В.Ю., Крылова Е.И. Применение стереоизомеров инозитола для терапии пациенток с клиническими и биохимическими признаками гиперандрогении // Архив акушерства и гинекологии им. В.Ф. Снегирева. 2021. Т. 8, № 2. С. 81-92.
4. Unfer V., Nestler J.E., Kamenov Z.A., Prapas N., Facchinetti F. Effects of Inositol(s) in women with PCOS: a systematic review of randomized controlled trials // Int. J. Endocrinol. 2016. Vol. 2016, article ID 1849162.
5. Unfer V., Carlomagno G., Papaleo E., Vailati S., Candiani M., Bail-largeon J.P. Hyperinsulinemia alters myoinositol to d-chiroinositol ratio in the follicular fluid of patients with PCOS // Reproductive Sciences. 2014. Vol. 21. P. 854-858.
6. Gupta D., Khan S., Islam M., Malik B.H., Rutkofsky I.H. MyoInositol’s role in assisted reproductive technology: evidence for improving the quality of oocytes and embryos in patients with polycystic ovary syndrome // Cureus. 2020. Vol. 12, N 5. P. e8079.
7. Russo M., Forte G., Montanino Oliva M., Lagana A.S., Unfer V. Melatonin and myo-inositol: supporting reproduction from the oocyte to birth // Int. J. Mol. Sci. 2021. Vol. 22, N 16. P. 8433.
8. Ravanos K., Monastra G., Pavlidou T., Goudakou M., Prapas N. Can high levels of D-chiro-inositol in follicular fluid exert detrimental effects on blastocyst quality? // Eur. Rev Med. Pharmacol. Sci. 2017. Vol. 21, N 23. P. 5491-5498.
9. Tabatabaie M., Amiri S., Golestan Jahromi M., Sene A.A., Zandieh Z., Mehdizadeh M., Amjadi F. The effect of Myo-Inositol supplement on molecular regulation of folliculogenesis, steroidogenesis, and assisted reproductive technique outcomes in patients with polycystic ovarian syndrome // Mol. Biol. Rep. 2022. Vol. 42, N 2. P. 875-884.
10. Bizzarri M., Fuso A., Dinicola S., Cucina A., Bevilacqua A. Pharmacodynamics and pharmacokinetics of inositol(s) in health and disease // Expert Opinion on Drug Metabolism and Toxicology. 2016. Vol. 12. P. 1181-1196.
11. Unfer V., Carlomagno G., Rizzo P., Raffone E., Roseff S. Myoinositol rather than d-chiro-inositol is able to improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial // European Review for Medical and Pharmacological Sciences. 2011. Vol. 15. P. 452-457.
12. Papaleo E., Unfer V., Baillargeon J.P., Fusi F., Occhi F., De Santis L. Myo-inositol may improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial // Fertility and Sterility. 2009. Vol. 91. P. 1750-1754.
13. Isabella R., Raffone E. Does ovary need d-chiro-inositol? // Journal of Ovarian Research. 2012. Vol. 5. P. 14.
14. Nordio M., Basciani S., Camajani E. The 40:1 myo-inositol/D-chiro-inositol plasma ratio is able to restore ovulation in PCOS patients: comparison with other ratios // Eur. Rev. Med. Pharmacol. Sci. 2019. Vol. 23, N. 12. P. 5512-5521.
15. Mendoza N., Galan M.I., Molina C., Mendoza-Tesarik R., Conde C., Mazheika M. et al. High dose of d-chiro-inositol improves oocyte quality in women with polycystic ovary syndrome undergoing ICSI: a randomized controlled trial. Gynecol. Endocrinol. 2020; 36(5): 398-401.
16. Mendoza N., Diaz-Ropero M.P., Aragon M., Maldonado V., Llaneza P., Lorente J. et al. Comparison of the effect of two combinations of myo-inositol and D-chiro-inositol in women with polycystic ovary syndrome undergoing ICSI: a randomized controlled trial // Gynecol. Endocrinol. 2019. Vol. 35, N 8. P. 695-700.
17. Хаджиева Н.Х. Альтернативное решение нормализации менструального цикла при синдроме поликистозных яичников. // Акушерство и гинекология. 2022; № 6. С. 122-128.
18. Уварова Е.В., Григоренко Ю.П. Синдром поликистозных яичников: история, этиология, патогенез, клиника (часть I) // Репродуктивное здоровье детей и подростков. 2011. № 4. С. 35-54.
19. Facchinetti F., Orru B., Grandi G., Unfer V. Short-term effects of metformin and myo-inositol in women with polycystic ovarian syndrome (PCOS): a meta-analysis of randomized clinical trials // Gynecol. Endocrinol. 2019. Vol. 35, N. 3. P. 198-206.
20. Carmina E., Campagna A.M., Mansuet P., Vitale G., Kort D., Lobo R. Does the level of serum antimullerian hormone predict ovulatory function in women with polycystic ovary syndrome with aging? // Fertil. Steril. 2012. Vol. 98, N 4. P. 1043-1046.
References
1. Clinical guidelines of Russian Federation for the assessment and management of polycystic ovary syndrome, 2021 (in Russian)
2. Khashchenko E.P., Uvarova E.V., Batyrova Z.K., Kumykova Z.Kh., Salnikova I.A., Mamedova F.Sh., Kiseleva I.A. Therapeutic possibilities of cosmetic manifestations of hyperandrogenism and contraception in young girls. Reproduktivnoye zdorov’ye detey i podrostkov [Pediatric and Adolescent Reproductive Health]. 2017; 6: 84-90.
3. Alyautdina O.S., Prilutskaya V.Y., Krylova E.I. The use of stereoisomers of inositol for the treatment of patients with clinical and biochemical signs of hyperandrogenism. Arkhiv akusherstva i ginekologii im. V.F. Snegirova [V.F. Snegirev Archives of Obstetrics and Gynecology]. 2021; 8 (2): 81-92.
4. Unfer V., Nestler J.E., Kamenov Z.A., Prapas N., Facchinetti F. Effects of Inositol(s) in women with PCOS: a systematic review of randomized controlled trials. Int J Endocrinol. 2016; 2016: 1849162.
5. Unfer V., Carlomagno G., Papaleo E., Vailati S., Candiani M., Baillargeon J.P. Hyperinsulinemia alters myoinositol to d-chiroinositol ratio in the follicular fluid of patients with PCOS. Reproductive Sciences. 2014; 21; 854-8.
6. Gupta D., Khan S., Islam M., Malik B.H., Rutkofsky I.H. MyoInositol’s role in assisted reproductive technology: evidence for improving the quality of oocytes and embryos in patients with polycystic ovary syndrome. Cureus. 2020; 12 (5): e8079.
7. Russo M., Forte G., Montanino Oliva M., Lagana A.S., Unfer V. Melatonin and myo-inositol: supporting reproduction from the oocyte to birth. Int J Mol Sci. 2021; 22 (16): 8433.
8. Ravanos K., Monastra G., Pavlidou T., Goudakou M., Prapas N. Can high levels of D-chiro-inositol in follicular fluid exert detrimental effects on blastocyst quality? Eur Rev Med Pharmacol Sci. 2017; 21 (23): 5491-8.
9. Tabatabaie M., AmiriS., Golestan JahromiM., SeneA.A.,Zandieh Z., Mehdizadeh M., Amjadi F. The effect of Myo-Inositol supplement on molecular regulation of folliculogenesis, steroidogenesis, and assisted reproductive technique outcomes in patients with polycystic ovarian syndrome. Mol Biol Rep. 2022; 49 (2): 875-84.
10. Bizzarri M., Fuso A., Dinicola S., Cucina A., Bevilacqua A. Pharmacodynamics and pharmacokinetics of inositol(s) in health and disease. Expert Opinion on Drug Metabolism and Toxicology. 2016; 12: 1181-96.
11. Unfer V., Carlomagno G., Rizzo P., Raffone E., Roseff S. Myo-inositol rather than d-chiro-inositol is able to improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial. European Review for Medical and Pharmacological Sciences. 2011; 15: 452-7.
12. Papaleo E., Unfer V., Baillargeon J.P., Fusi F., Occhi F., De Santis L. Myo-inositol may improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial. Fertility and Sterility. 2009; 91: 1750-4.
13. Isabella R., Raffone E. Does ovary need d-chiro-inositol? Journal of Ovarian Research 2012; 5; 14.
14. Nordio M., Basciani S., Camajani E. The 40:1 myo-inositol/D-chiro-inositol plasma ratio is able to restore ovulation in PCOS patients: comparison with other ratios. Eur Rev Med. Pharmacol Sci. 2019; 23 (12): 5512-21.
15. Mendoza N., Galan M.I., Molina C., Mendoza-Tesarik R., Conde C., Mazheika M., et al. High dose of d-chiro-inositol improves oocyte quality in women with polycystic ovary syndrome undergoing ICSI: a randomized controlled trial. Gynecol Endocrinol. 2020; 36 (5): 398-401.
16. Mendoza N., Diaz-Ropero M.P., Aragon M., Maldonado V., Llaneza P., Lorente J., et al. Comparison of the effect of two combinations of myo-inositol and D-chiro-inositol in women with polycystic ovary syndrome undergoing ICSI: a randomized controlled trial. Gynecol. Endocrinol. 2019; 35 (8): 695-700.
17. Khadzhieva N.Kh. An alternative solution to the normalization of the menstrual cycle in polycystic ovary syndrome. Akusherstvo i ginekologiya [Obstetrics and Gynecology]. 2022; 6: 122-8.
18. Uvarova E.V., Grigorenko Y.P. Polycystic ovary syndrome: history, etiology, pathogenesis, clinic (part I). Reproduktivnoye zdorov’ye detey i podrostkov [Pediatric and Adolescent Reproductive Health]. 2011; 4: 35-54. (in Russian)
19. Facchinetti F., Orru B., Grandi G., Unfer V. Short-term effects of metformin and myo-inositol in women with polycystic ovarian syndrome (PCOS): a meta-analysis of randomized clinical trials. Gynecol Endocrinol. 2019; 35 (3): 198-206.
20. Carmina E., Campagna A.M., Mansuet P., Vitale G., Kort D., Lobo R. Does the level of serum antimullerian hormone predict ovulatory function in women with polycystic ovary syndrome with aging? Fer-til Steril. 2012; 98: 4: 1043-6.
