 invar.ru
invar.ru

Cредство для естественного восстановления менструального цикла без гормонов
В его состав входит уникальная комбинация мио-инозитола, D-хиро-инозитола, марганца и фолиевой кислоты.
далее...
Влияние комбинации миоинозитола и D-хироинозитола в соотношении 5:1 на психоэмоциональное состояние и проявления андрогензависимой дермопатии у пациенток с синдромом поликистозных яичников.
СтатьиВ.Ю. Прилуцкая1, О.С. Аляутдина1, Н.А. Сосна2
1ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский университет), Москва, Россия;
2ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия.
Резюме
Синдром поликистозных яичников (СПКЯ) — распространенная гинекологическая патология, проявляющаяся ановуляцией и гиперандрогенией. Основными клиническими признаками гиперандрогении являются гирсутизм и акне. Комбинация миоинозитола (МИ) с D хироинозитолом (ДХИ) является перспективным методом нормализации гормонального профиля пациенток с СПКЯ и андрогензависимой дермопатии.
Цель исследования. Оценка эффективности приема комбинации МИ и ДХИ в соотношении 5:1 в коррекции андрогензависимой дермопатии — акне и гирсутизма, а также анализ изменений гормонального профиля и влияние приема комбинации МИ и ДХИ на уровень тревожности и качества жизни у пациенток с СПКЯ.
Материал и методы. В интервенционное одноцентровое проспективное исследование включено 49 пациенток с СПКЯ в возрасте 26,6±3,53 года с биохимическими и клиническими признаками гиперандрогении, в контрольную группу включено 43 здоровые женщины. В исследуемой группе пациенток с СПКЯ проводили оценку степени тяжести клинических признаков гиперандрогении — гирсутизма и акне. Всем пациенткам выполнено обследование, определены следующие гормональные параметры: содержание лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), антимюллерова гормона (АМГ), дегидроэпиандростерона сульфата (ДГЭАС), тестостерона общего (Тобщ), глобулина, связывающего половые гормоны (ГСПГ), андростендиона, рассчитаны показатели тестостерона свободного (Тсв) и индекса свободных андрогенов (ИСА). Пациентки с СПКЯ получали перорально комбинацию МИ с ДХИ в соотношении 5:1. Проводилось сравнение гормонального профиля пациенток исходно, через 3 и 6 мес приема с гормональным профилем участниц группы контроля. Исходно и через 6 мес приема определены степень тревожности по шкале Спилберга—Ханина, а также дерматологический индекс качества жизни (ДИКЖ).
Результаты. У пациенток с СПКЯ до начала приема комбинации МИ+ДХИ в соотношении 5:1 выявлено статистически значимое повышение уровней ЛГ, АМГ, ДГЭАС, Тобщ, Тсв, андростендиона при низком уровне ГСПГ (p=0,001 для всех показателей). Положительная динамика в состоянии пациенток с СПКЯ по сравнению с исходными значениями наблюдалась уже через 3 мес приема комбинации МИ+ДХИ в соотношении 5:1. Через 6 мес приема наблюдалось снижение уровня ЛГ (8,0±2,6 по сравнению с 12,5±4,5 МЕ/л, p=0,001), ДГЭАС (7,7±1,3 по сравнению с 8,3±1,3 мкмоль/л, p=0,013), Тобщ (1,8±0,4 по сравнению с 2,5±0,6 нмоль/л, p=0,001), Тсв (20,7±5,7 по сравнению с 34,1±9,7 пмоль/л, p=0,001), андростендиона (11,5±2,0 по сравнению с 13,8±2,5 нмоль/л, p=0,001), ИСА (2,8±0,9 по сравнению с 5,6±2,0, p=0,001). Изначально у всех пациенток с СПКЯ выявлено акне: у 22 (45%) легкая степень, у 19 (39%) — умеренная степень и у 8 (16%) — тяжелая степень, а также гирсутизм разной степени тяжести. Через 6 мес приема наблюдалась положительная динамика выраженности симптомов акне, а также уменьшение количества пациенток с тяжелой и умеренной степенью гирсутизма на 6 и на 8% соответственно. Оценка в баллах по шкале Ферримана—Голлвея также снизилась (8,9±3,7 по сравнению с 10,1±4,4 балла) (p=0,076). У пациенток с СПКЯ статистически значимо уменьшилась степень тревожности, на 32% увеличилось число пациенток с незначительным влиянием акне на качество жизни.
Вывод. Полученные нами результаты исследования показали, что комбинацию мио-инозитола с D-хироинозитолом в соотношении 5:1 можно рассматривать в качестве эффективного средства для коррекции биохимической и клинической гиперандрогении у пациенток с синдромом поликистозных яичников. Наблюдалось улучшение психоэмоционального состояния пациенток за счет снижения тревожности и улучшения качества жизни.
Ключевые слова: СПКЯ, синдром поликистозных яичников, миоинозитол, D-хироинозитол, гиперандрогения, андрогензависимая дермопатия, гирсутизм, акне.
Как Цитировать:
Прилуцкая В.Ю., Аляутдина О.С., Сосна Н.А. Влияние комбинации миоинозитола и D-хироинозитола в соотношении 5:1 на психоэмоциональное состояние и проявления андрогензависимой дермопатии у пациенток с синдромом поликистозных яичников.
Введение
Синдром поликистозных яичников (СПКЯ) возникает у 5—15% женщин детородного возраста [1] и характеризуется ановуляцией и гиперандрогенией. Согласно Роттердамским критериям, для установления диагноза СПКЯ необходимо присутствие как минимум двух из трех критериев: олигоовуляции или ановуляции (обычно проявляется как олигоменорея или аменорея), гиперандрогении (приводящей к гирсутизму, акне, себорее, алопеции) и поликистозной морфологии яичников [2]. Представленные признаки и симптомы неоднородны, меняются с течением времени, поэтому диагностика СПКЯ может быть затруднена. Несмотря на многолетние исследования, этиология СПКЯ не установлена. В настоящее время получены веские доказательства в пользу генетической предрасположенности к развитию СПКЯ. Генетическая детерминированность доказана в ходе исследований на девочках-близнецах, родившихся от матери с СПКЯ. Близнецы имели двойной риск возникновения СПКЯ до достижения репродуктивного возраста [3]. Согласно данным исследований, у родственников женщин с СПКЯ отмечена более высокая частота нарушений метаболизма глюкозы и развития метаболического синдрома [4]. Кроме того, на данный момент известно более 1000 специфических генов кандидатов, ответственных за вариабельные проявления СПКЯ [5]. Факторы, влияющие на развитие этого заболевания, можно разделить на пренатальные факторы, такие как программирование развития плода, и послеродовые факторы, которые связаны с нездоровым образом жизни и загрязнителями окружающей среды. Известно, что во время беременности плод особенно подвержен воздействию различных сигналов от матери. Кроме того, изменения экспрессии определенных генов могут быть связаны с повышенным риском развития метаболических и репродуктивных нарушений в постнатальной жизни [6]. Усиленное воздействие глюкокортикоидов и/или андрогенов в критические периоды эмбрионального развития может вызвать программированное развитие СПКЯ у людей и животных [3, 7]. Следует учитывать, что СПКЯ является результатом одновременных эндокринологических изменений, происходящих на уровне гипоталамо-гипофизарно-яичниковой и гипоталамо-гипофизарно-надпочечниковой осей. Эндокринный профиль пациентов с СПКЯ характеризуется повышенными концентрациями андрогенов яичникового и надпочечникового происхождения в плазме крови и, следовательно, более высокими уровнями эстрогенов (главным образом эстрона). Физиологически увеличенный уровень лютеинизирующего гормона (ЛГ) стимулирует превращение холестерина клетками теки яичников в андростендион — основной предшественник синтеза тестостерона общего (Тобщ) и эстрогена. В сетчатой зоне коры надпочечников выработка стероидных гормонов стимулируется адренокортикотропным гормоном (АКТГ) и кортикотропин-рилизинг гормоном (КРГ), которые участвуют в реакции на стресс, вследствие чего повышается синтез дегидроэпиандростерона сульфата (ДГЭАС). Увеличение импульсной активности гипоталамического гонадотропин-рилизинг-гормона (ГнРГ) приводит к повышению частоты импульсного высвобождения ЛГ, а также к нарушению соотношения ЛГ/ФСГ (фолликулостимулирующего гормона). Стимуляция клеток теки, вызванная высоким уровнем ЛГ, способствует активации биосинтеза андрогенов, а также нарушению развития фолликулов. Кроме того, ФСГ влияет на ароматизацию андрогенов и стимулирует созревание фолликулов. Андрогены яичников стимулируют рост фолликулов на предантральной и ранней антральной стадиях, в то время как их повышенная концентрация на более поздних антральных стадиях может вызвать атрезию фолликулов. Такие гормональные изменения наблюдаются совместно с увеличением уровня пролактина и инсулина и часто возникают у пациенток с СПКЯ [8]. Хорошо известно, что только около 1—2% стероидных гормонов плазмы крови не связаны с белками и, следовательно, являются биологически активными. Повышение уровня свободно циркулирующих стероидных гормонов напрямую связано со снижением синтеза глобулина, связывающего половые гормоны (ГСПГ) в печени. Этот механизм, а также индукция периферической конверсии дигидротестостерона (ДГТ) за счет увеличения активности фермента 5-альфа-редуктазы приводят к андрогензависимой дермопатии — гирсутизму, акне, алопеции [9]. Инозитолы — это группа природных полиолов (сахаров), которые содержат гидроксильные группы, присоединенные к циклогексановому кольцу, то есть относятся к классу органических соединений, известных как циклогексанолы. Существует девять стереоизомеров инозитола, в зависимости от расположения гидроксильных групп; пять из них (мио-, сцилло-, муко-, нео- и D-хироинозитол) встречаются во фруктах, злаках и орехах, в то время как другие (L-хиро-, алло-, эпи- и цисинозитол) синтезируются из мио-инозитола (МИ) в клетках. МИ уникален среди других форм инозитола благодаря единственной осевой гидроксильной группе, расположенной на втором углероде. Более того, он в основном встречается в природе, например, во всех эукариотических клетках [10]. Первым этапом биосинтеза МИ является фосфорилирование глюкозы до D-глюкозо-6-фосфата (G6P) с помощью гексокиназы. Затем G6P при участии мио-инозитол-1L-фосфатсинтазы (MIPS) преобразуется в 1-l-мио-инозитол-1-фосфат, который дефосфорилируется до свободного МИ с помощью инозитол монофосфатазы. Синтез МИ происходит в основном в почках человека, в то время как MIPS является ферментом, ограничивающим скорость этого процесса. L-хироинозитол и D-хироинозитол (ДХИ) являются продуктами эпимеризации гидроксильных групп МИ в первом и третьем углероде соответственно. Уровни стереоизомеров регулируются инсулинзависимой эпимеразой, при этом активность этого фермента резко снижается при наличии инсулинорезистентности [10].
Роль инозитолов в комплексном лечении синдрома поликистозных яичников
МИ и ДХИ, благодаря их антиандрогенному и инсулиносенсибилизирующему эффектам, улучшают метаболические и репродуктивные аспекты СПКЯ. Доказано, что МИ увеличивает поглощение глюкозы клетками и участвует в регуляции ФСГ, в то время как ДХИ имеет решающее значение для синтеза гликогена, усвоения глюкозы периферическими тканями и участвует в индуцированной инсулином избыточной продукции андрогенов в яичниках. В результате этого высокий уровень ДХИ наблюдается в тканях, хранящих гликоген, таких как жир, печень и мышцы, в то время как низкая концентрация наблюдается в энергоемких тканях, таких как мозг и сердце [11]. Следует подчеркнуть, что в этих органах уровень ДХИ всегда ниже, чем уровень МИ. Существует неразрывная связь между высоким уровнем андрогенов, ановуляцией и метаболизмом инсулина у женщин с СПКЯ. Чрезмерная концентрация инсулина и инсулинорезистентность стимулируют секрецию андрогенов яичниками и надпочечниками, подавляя синтез ГСПГ в печени. Следствием этих гормональных изменений могут быть преждевременная атрезия фолликулов, хроническая ановуляция и дисбаланс гонадотропинов, который проявляется повышением уровня ЛГ и снижением уровня ФСГ, а также соотношением ЛГ/ФСГ выше 2,5. Кроме того, синтез андрогенов в яичниках при СПКЯ, индуцируемый инсулином, по-видимому, стимулирует чувствительность гранулезных клеток к ЛГ, а также увеличивает экспрессию гена, кодирующего андрогенообразующий фермент цитохром P450c17a [12]. Многочисленные исследования доказали эффективность применения инозитолов при лечении андрогензависимой дермопатии и для снижения уровня андрогенов. Снижение уровня свободного тестостерона (Тсв) наблюдалось после применения МИ, ДХИ или их совместного применения, что приводило к положительным изменениям в менструальном цикле и фертильности. В исследовании, проведенном P. Regidor и соавт., продемонстрировано у пациенток с СПКЯ снижение уровня Тобщ с 96,6 до 43,3 нг/мл и увеличение уровня прогестерона с 2,1 до 12,3 нг/мл, после приема МИ 4 г/сут с фолиевой кислотой 400 мкг/сут [13]. Аналогичные результаты наблюдались в двойном слепом плацебоконтролируемом исследовании D. Costantino и соавт. Уровень Тобщ снизился с 99,5±7 до 34,8±4,3 нг/дл (p=0,003) и Тсв — с 0,85±0,1 до 0,24±0,33 нг/дл (p=0,01), также происходило статистически значимое улучшение показателей артериального давления, глюкозы и инсулина по результатам глюкозотолерантного теста. Овуляция восстановилась у 70% пациенток в течение 16 нед [14].Г.Е. Чернуха и соавт. оценивали эндокриннометаболические параметры 140 пациенток с СПКЯ при получении МИ 4 г/сут в течение 6 мес. В исследовании происходило снижение уровня Тсв на 29%, Тобщ — на 18%, андростендиона — на 15% (p<0,001). У каждой третьей пациентки наблюдалось восстановление регулярности менструального цикла [15]. Высокий биосинтез андрогенов при СПКЯ может быть результатом как резистентности к инсулину, так и снижения соотношения МИ/ДХИ. В связи с этим проведено достаточное количество исследований для изучения комбинаций мио- и D-хироинозитола в коррекции симптомов СПКЯ. В исследованиях, проведенных M. Januszewski и соавт., показано значительное снижение Тсв, ФСГ и ЛГ, а также увеличение уровня ГСПГ в плазме крови после приема МИ и ДХИ в соотношении 10:1. Эти гормональные изменения ассоциированы со статистически значимым улучшением состояния кожи в течение 3 мес [16]. В другом исследовании E. Benelli и соавт. использовали МИ+ДХИ в соотношении 40:1. Наблюдалось улучшение эндокринного профиля у женщин с СПКЯ и ожирением, снижение концентрации Тсв с 0,76±0,20 до 0,62±0,15 нг/дл (p<0,05) [17]. M. Nordio и соавт. проводили сравнение эффективности МИ у 24 пациенток с СПКЯ и МИ+ДХИ в соотношении 40:1 у 26 пациенток в течение 6 мес. У пациенток второй группы наблюдалось более существенное снижение уровня Тобщ с 40,1±9,5 до 32,7±10 нг/мл и увеличение уровня ГСПГ. У пациенток обеих групп статистически значимо увеличилось количество овуляторных циклов по сравнению с исходными данными [18]. M. Zacche и соавт. также отметили положительный эффект применения МИ 4 г/сут в течение 6 мес у 50 пациенток. На фоне приема МИ обнаружено снижение уровня ЛГ в плазме крови (14,1±5,7 по сравнению с 8,4±2,2 мМЕ/мл, p<0,005), Тобщ (92±38 по сравнению с 64±31 нг/дл; p<0,001) и Тсв (1,2±0,2 по сравнению с 0,7±0,3 нг/дл, p<0,001), а также базального уровня инсулина. Через 6 мес снизилась степень гирсутизма по шкале Ферримана—Голлвея (ФГ) с 11,4±3,2 до 8,1±2,6 (p<0,003) по сравнению с исходными значениями [19]. В исследовании A. Ozay и соавт. сравнивали результаты терапии комбинированным оральным контрацептивом (КОК) (этинилэстрадиол 35 мкг + ципротерон 2 мг) и приема МИ 2 г/сут. У пациенток 2-й группы происходило статистически значимое снижение Тобщ (0,80±0,47 и 0,54±0,22 нг/дл до и после применения соответственно, p<0,001), ДГЭАС (318,29±178,02 и 284,16±136,73 мкг/дл до и после применения соответственно, p=0,043), в то время как у пациенток 1-й группы улучшения по данным показателям не было [20]. M. Ranwa и соавт. исследовали влияние МИ 2 г/сут в течение 12 нед на проявления андрогензависимой дермопатии. Обнаружено уменьшение жирности кожи у 34,4% и акне у 33,3% пациенток, однако статистически значимые различия в степени гирсутизма до и после курса приема не наблюдались [21]. Комбинация МИ + ДХИ 1200 мг с антиоксидантами (ликопином, N-ацетилцистеином) и витамином D в течение 12 нед приводила к статистически значимому снижению индекса массы тела у пациенток с избыточным весом и СПКЯ, а также наблюдалось восстановление регулярности менструального цикла в 69% случаев. Положительные изменения происходили при оценке акне на лице с использованием глобальной шкалы тяжести акне (с 21,74±2,47 до 11,69±1,61 (p<0,001). Наблюдалось уменьшение гирсутизма с 2,57±0,17 до 2,12±0,16 (p<0,001) по шкале ФГ [22]. Аналогично снижение степени тяжести акне по шкале Кука (Cook’s scale) с 4,34±0,33 до 1,3±0,17 происходило в исследовании A. Ramanan и соавт. (2020) при приеме комбинации МИ 2 г, фолиевой кислоты (ФК) 1 мг и витамина D 1000 МЕ/сут в течение 6 мес. Психологическая оценка пациентов в связи с наличием акне проводилась по шкале Ликерта. Пациентки после лечения отмечали большую уверенность в себе, а также облегчение социального взаимодействия с другими людьми [23]. M. Pezza и соавт. (2017) провели сравнительное описательное исследование 50 пациенток с СПКЯ, принимавших МИ 4 г/сут в течение 6 мес. Происходило значительное уменьшение степени акне, особенно количества папуло-пустулезных элементов [24]. В исследовании Т.А. Обоскаловой и соавт. (2020) показано снижение частоты выявления акне с 96,2 до 58,6% (p<0,05) и себореи с 34,6 до 5,8% (p<0,05) у 104 пациенток, принимавших комбинацию МИ 2г + ДХИ 400 мг в соотношении 5:1 + ФК 400 мкг + марганец 10 мг/сут в течение 6 мес. Кроме того, происходило снижение Тобщ до 1,27 нмоль/л, индекса свободных андрогенов (ИСА) на 4,12%, а также восстановление регулярности менструального цикла у 76,9% пациенток с СПКЯ (p<0,05) [25]. Цель исследования — оценка эффективности приема комбинации МИ и ДХИ в соотношении 5:1 в коррекции андрогензависимой дермопатии — акне и гирсутизма, а также анализ изменений гормонального профиля и влияние комбинации МИ и ДХИ на уровень тревожности и качества жизни у пациенток с СПКЯ.
Материал и методы
Интервенционное одноцентровое проспективное исследование проведено на базе кафедры акушерства и гинекологии №1 ФГАОУ ВО «Первого МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский университет) с сентября 2020 по февраль 2021 г. В исследование включено 49 молодых пациенток (средний возраст 26,6±3,53 года) с СПКЯ. Диагноз СПКЯ устанавливали в соответствии с российскими клиническими рекомендациями «Синдром поликистоза яичников», 2016 г. [26]. Другие состояния, вызывающие нарушения овуляции или избыток андрогенов, такие как гиперпролактинемия, гипотиреоз, врожденная дисфункция коры надпочечников и синдром Кушинга, исключены после гормонального обследования. Критериями исключения являлись прием гормональных препаратов/блокаторов андрогеновых рецепторов в течение последних 3 мес до включения в исследование, патология, при которой требуется систематический прием лекарственных препаратов и/или хирургическое вмешательство, онкологические заболевания. В контрольную группу включено 43 здоровые женщины сопоставимого возраста с регулярным менструальным циклом и не имеющих какой-либо патологии (гинекологической, эндокринной, соматической). Каждой женщине с СПКЯ в исследуемой группе проводили оценку степени тяжести клинических признаков гиперандрогении (гирсутизм и/или акне). Степень тяжести акне определяли согласно классификации G. Plewig, M. Kligman. На основании количества поражений на лице/груди/спине определяли легкую, умеренную и тяжелую степень тяжести акне. Тяжесть гирсутизма определена по модифицированной шкале ФГ, которая количественно оценивает распространенность терминальных волос в девяти андрогензависимых зонах по 5-балльной шкале. Степень гирсутизма оценивали следующим образом: легкая (9—10 баллов), умеренная (11—14 баллов) и тяжелая (15—36 баллов). У всех пациенток исследованы уровни ЛГ, ФСГ, антимюллерова гормона (АМГ), ДГЭАС, Тобщ, ГСПГ, андростендион, рассчитаны показатели Тсв и ИСА. После получения информированного добровольного согласия пациентки с СПКЯ получали перорально комбинацию МИ с ДХИ в соотношении 5:1 (Дикироген, производство Nutrilinea S.r.l., Италия для PIZETA PHARMA S.p.A., Италия, номер свидетельства о государственной регистрации RU.77.99.88.00 3.R.003252.09.19). Дикироген — биологически активная добавка к пище, содержащая 1000 мг МИ и 200 мг ДХИ, а также 200 мкг фолиевой кислоты и 5 мг марганца в форме органической соли — марганца пидолата, которые являются синергистами инозитолов. Прием средства Дикироген начинали с любого дня цикла, по 1 саше 2 раза в день после приема пищи, предварительно разбавляя его содержимое в 1/2 стакана воды, на протяжении 6 мес. Проводили оценку гормонального профиля пациенток с СПКЯ через 3 и 6 мес приема средства Дикироген. Клиническую оценку проявлений андрогензависимой дермопатии осуществляли исходно и через 6 мес. Исходно и через 6 мес приема средства Дикироген определяли степень тревожности по шкале Спилберга—Ханина, а также дерматологический индекс качества жизни (ДИКЖ). Статистическая обработка данных проведена в программах Excel и Statistica 13. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD). Сравнение связанных групп для выявления различий между переменными в исходном состоянии и через 3 и 6 мес наблюдения проводили с использованием парного t-критерия Стьюдента. Значение p<0,05 считали статистически значимым.
Результаты
В исследовании приняли участие 49 пациенток с СПКЯ: фенотип A установлен у 26 (53%) пациенток, фенотип B (сочетание гиперандрогении с олиго/ановуляцией) — у 13 (27%) и фенотип C (сочетание гиперандрогении с поликистозной морфологией яичников по данным ультразвукового исследования) — у 10 (20%). Значительные изменения наблюдались в гормональном профиле пациенток с СПКЯ. Проводилось сравнение гормональных показателей у пациенток с СПКЯ и здоровых женщин, что позволило выявить более высокий уровень следующих гормонов:
— ЛГ (8,0±2,6 по сравнению с 12,5±4,5 МЕ/л, p=0,001);
— АМГ (8,3±2,9 по сравнению с 4,1±1,6 нг/мл, p=0,001);
— ДГЭАС (8,3±1,3 по сравнению с 7,0±1,5 мкмоль/л, p=0,001);
— Тобщ (2,5±0,6 по сравнению с 1,6±0,4 нмоль/л, p=0,001);
— Тсв (34,1±9,7 по сравнению с 16,5±5,0 пмоль/л, p=0,001), который рассчитан по формуле Андерсона (Тсв (пмоль/л)=Тобщ (нмоль/л)×(2,28—1,38×LOG (ГСПГ (нмоль/л)/10)×10;
— андростендиона (13,8±2,5 по сравнению с 8,6±1,7 нмоль/л, p=0,001).
У женщин с СПКЯ наблюдался статистически значимо меньший уровень ГСПГ (47,7±12,2 по сравнению с 84,2±14,5 нмоль/л, p=0,001), что обусловливало более высокий ИСА (5,6±2,0 по сравнению с 2,0±0,7, p=0,001). Расчет произведен по формуле ИСА=Тобщ/ГСПГ×100.
Положительная динамика в гормональном профиле пациенток с СПКЯ наблюдалась уже через 3 месяца (таблица 1). Отмечено снижение уровня ЛГ (12,5±4,5 по сравнению с 10,1±3,3 МЕ/л, p=0,001), Тобщ (2,5±0,6 по сравнению с 2,1±0,5 нмоль/л, p<0,001), андростендиона (13,8±2,5 по сравнению с 12,7±2,1 нмоль/л, p=0,01), повышение уровня ГСПГ (47,7±12,2 по сравнению с 56,7±11,6 нмоль/л, p<0,001). Через 6 мес у пациенток с СПКЯ значительно снизились показатели по сравнению с исходными значениями:
— ЛГ (8,0±2,6 по сравнению с 5,1±1,0 МЕ/л, p=0,001);
— ДГЭАС (7,7±1,3 по сравнению с 8,3±1,3 мкмоль/л, p=0,013);
— Тобщ (1,8±0,4 по сравнению с 2,5±0,6 нмоль/л, p=0,001);
— Тсв (20,7±5,7 по сравнению с 34,1±9,7 пмоль/л, p=0,001);
— ИСА (2,8±0,9 по сравнению с 5,6±2,0, p=0,001);
— андростендиона (11,5±2,0 по сравнению с 13,8±2,5 нмоль/л, p=0,001).
Однако гормональные показатели у пациенток с СПКЯ через 6 мес приема средства Дикироген остались статистически значимо выше по сравнению с показателями у здоровых женщин контрольной группы.
Таблица 1.
Гормональный профиль пациенток с СПКЯ исходно, через 3 и 6 месяцев наблюдения, а также контрольной группы женщин.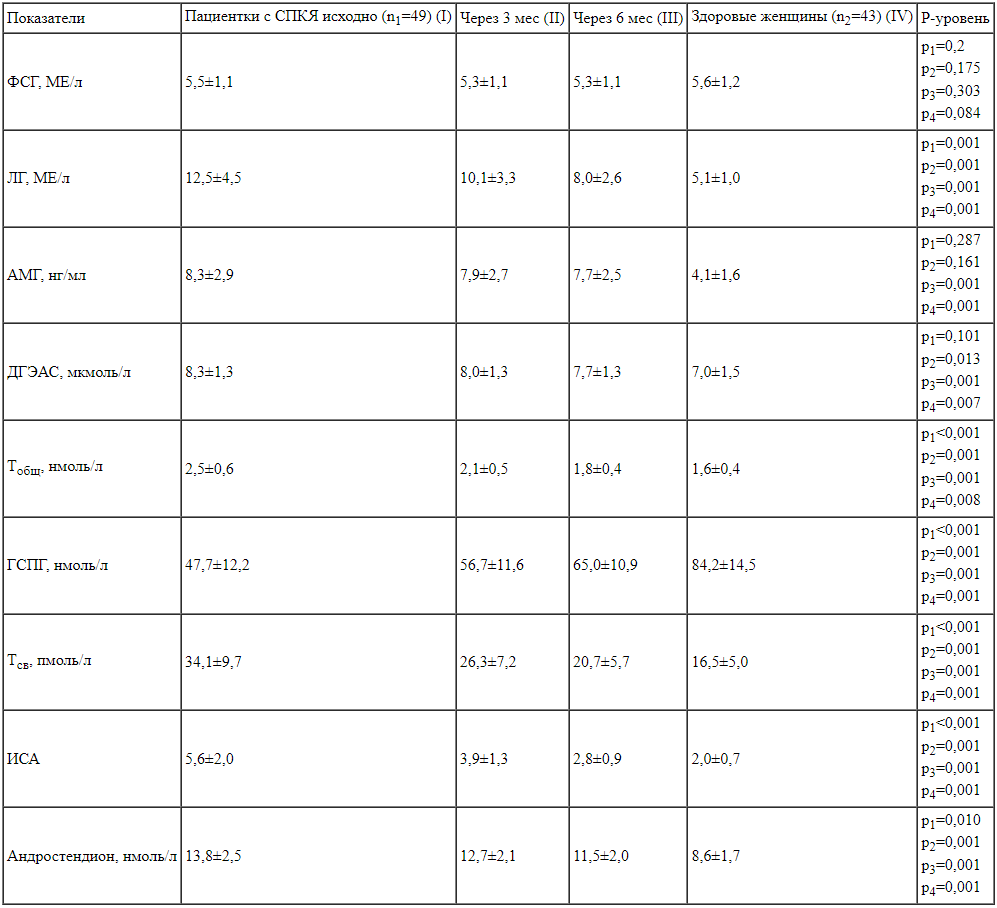 р1 – определение достоверных различий между группами I и II.
р1 – определение достоверных различий между группами I и II.
р2 – определение достоверных различий между группами I и III.
р3 – определение достоверных различий между группами I и IV.
р4 – определение достоверных различий между группами III и IV.
Изначально у всех пациенток установлено акне — у 22 (45%) легкой степени, у 19 (39%) умеренной степени и у 8 (16%) тяжелой степени. Через 6 мес комбинированного приема МИ+ДХИ в соотношении 5:1 наблюдалась положительная динамика в отношении акне (таблица 2, рис.1).
Таблица 2.
Число пациенток с акне до и после приема МИ+ДХИ в соотношении 5:1 с учетом степени тяжести.
| Степень акне | Исходно | Через 6 мес |
| Легкая | 22 (45%) | 19 (39%) |
| Умеренная | 19 (39%) | 12 (25%) |
| Тяжелая | 8 (16%) | 2 (4%) |
| Нет акне | 0 | 16 (32%) |
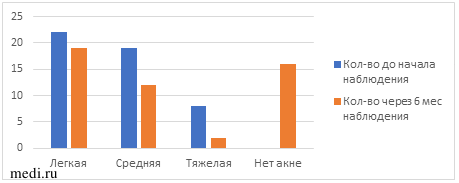 Рис. 1 Динамика выраженности акне в ходе наблюдения.
Рис. 1 Динамика выраженности акне в ходе наблюдения.
У всех пациенток с СПКЯ проводилось исследование степени выраженности гирсутизма исходно и через 6 мес наблюдения (таблица 3, рис. 2). В динамике наблюдалось уменьшение количества пациенток с тяжелой и умеренной степенью гирсутизма на 6 и на 8% соответственно. Общее количество баллов по шкале ФГ также снизилось (8,9±3,7 по сравнению с 10,1±4,4), но показатель статистически незначимый.
Таблица 3.
Число пациенток с гирсутизмом до и после приема МИ+ДХИ в соотношении 5:1 с учетом степени тяжести.
| Степень гирсутизма | Исходно | Через 6 мес | р-value |
| Легкая | 9 (18%) | 9 (18%) | |
| Умеренная | 14 (29%) | 10 (21%) | |
| Тяжелая | 7 (14%) | 4 (8%) | |
| Нет гирсутизма | 19 (39%) | 26 (53%) | |
| Балл по шкале ФГ | 10,1±4,4 | 8,9±3,7 | р=0,076 |
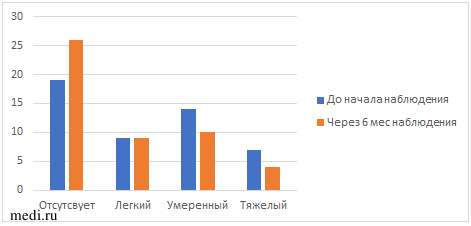 Рис. 2 Динамика выраженности гирсутизма в ходе наблюдения
Рис. 2 Динамика выраженности гирсутизма в ходе наблюдения
Также проводилась оценка дерматологического индекса качества жизни (ДИКЖ) исходно и через 6 мес наблюдения (таблица 4, рис. 3). Данный показатель применяется для оценки степени негативного воздействия дерматологического заболевания (в данном случае акне) на разные аспекты жизни пациента, характеризующие качество его жизни в целом. Индекс ДИКЖ может использоваться как критерий оценки эффективности лечения дерматологического заболевания. Через 6 мес приема комбинации МИ и ДХИ в соотношении 5:1 на 32% увеличилось число пациенток с незначительным влиянием акне на качество жизни, также уменьшилось количество пациенток с умеренным и сильным влиянием акне на качество жизни на 16 и 8% соответственно.
Таблица 4.
ДИКЖ пациенток до и после приема МИ+ДХИ в соотношении 5:1.
| Влияние на качество жизни | Исходно | Через 6 мес | р-value |
| Незначительное | 17 (35%) | 33 (67%) | |
| Умеренное | 21 (43%) | 13 (27%) | |
| Сильное | 7 (14%) | 3 (6%) | |
| Чрезвычайно сильное | 4 (8%) | 0 | |
| Индекс ДИКЖ | 8,9±5,9 | 5,5±3,5 | р=0,001 |
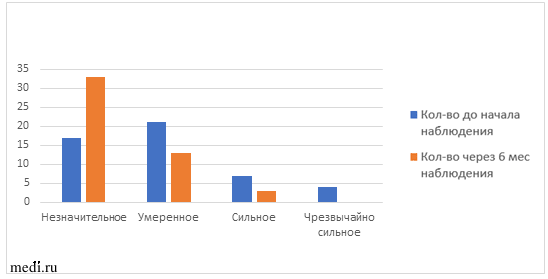 Рис 3. Динамика влияния акне на качество жизни в ходе наблюдения
Рис 3. Динамика влияния акне на качество жизни в ходе наблюдения
Степень тревожности пациенток с СПКЯ и андрогензависимой дермопатией определяли по шкале Спилберга—Ханина (таблица 5, рис. 4). Исходно высокая степень тревожности наблюдалась у 11 (22%) пациенток, умеренная — у 24 (49%). Через 6 мес наблюдения отмечена положительная динамика — высокая степень тревожности сохранилась у 4 (8%) пациенток с СПКЯ, умеренная степень — у 15 (31%). Увеличилось количество пациенток с низкой степенью тревожности — 30 (61%).
Таблица 5.
Степень тревожности пациенток до и после приема МИ+ДХИ в соотношении 5:1 по шкале Спилберга-Ханина.
| Степень тревожности | Исходно | Через 6 мес терапии | р-value |
| Низкая | 14 (29%) | 30 (61%) | |
| Умеренная | 24 (49%) | 15 (31%) | |
| Высокая | 11 (22%) | 4 (8%) | |
| Баллы по шкале Спилберга-Ханина | 36,2±10,4 | 29,5±8,9 | р=0,001 |
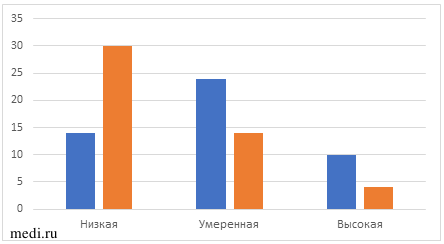 Рис. 4 Динамика степени тревожности в ходе наблюдения
Рис. 4 Динамика степени тревожности в ходе наблюдения
Обсуждение
Пациентки с СПКЯ имеют хроническую олиго/ановуляцию и избыточный синтез андрогенов, которые приводят к различным проявлениям андрогензависимой дермопатии. Выраженность клинических проявлений гиперандрогении зависит не только от степени повышения андрогенов, но и от индивидуальной чувствительности рецепторов сальных желез и волосяных фолликулов к андрогенам. В нашем исследовании все пациентки изначально имели биохимическую гиперандрогению и акне, а также в 81% случаев — гирсутизм. Золотым стандартом антиандрогенной терапии является применение КОК с антиандрогенным эффектом. Такая терапия помогает снизить степень выраженности клинических признаков гиперандрогении, а также приводит к регуляции менструального цикла и профилактике гиперплазии эндометрия [27]. Однако гормональная терапия имеет ряд ограничений. К общим побочным эффектам КОК относятся снижение либидо, головная боль, изменение массы тела, эмоциональная лабильность и депрессия, напряжение в молочных железах (мастодиния), изменение толерантности к глюкозе, варикозное расширение вен нижних конечностей, нарушения менструального цикла по типу прорывных кровотечений, а также межменструальных кровянистых выделений. К тяжелым осложнениям приема КОК относят высокий риск развития тромбозов и тромбоэмболий (тромбоз глубоких вен, тромбоэмболия легочной артерии). Риск возникновения тромбозов очень мал, однако он гораздо выше при наличии даже одного дополнительного фактора риска — курения, ожирения, гипертонии, что часто наблюдается у пациенток с СПКЯ. Негативный прошлый опыт пациенток применения КОК также ограничивает их назначение. Планирование беременности является ограничением к приему КОК. В связи с этим возникает вопрос о назначении альтернативных негормональных средств, которые не обладают побочными эффектами КОК, и их можно применять во время планирования беременности. Рекомендации по применению комбинации миоинозитола + D-хироинозитола в соотношении 5:1 отмечены в клиническом протоколе МАРС 2020 г. по прегравидарной подготовке [28]. Положительные аспекты приема инозитолов отмечены в Международном руководстве по диагностике и ведению пациенток с СПКЯ 2018 г. [29].
В проведенном исследовании наблюдались значительные гормональные изменения, а именно снижение уровней андрогенов, уже через 3 мес приема средства Дикироген. Через 6 мес изменения стали более выраженными, однако отличались от гормонального профиля контрольной группы здоровых участниц. Скорее всего, для достижения гормональных изменений, приближенных к показателям у женщин контрольной группы, необходим более длительный период приема инозитолов и наблюдения. Клинические проявления гиперандрогении, такие как акне и гирсутизм, значительно уменьшились через 6 мес применения средства Дикироген.
У каждой третьей пациентки наблюдалась полная ремиссия акне, также снизилось количество пациенток с умеренной и тяжелой степенью гирсутизма. Не достигнуты статистически значимые различия по шкале ФГ, что опять же ограничено длительностью исследования. Андрогензависимая дермопатия чрезвычайно влияет на качество жизни пациенток с СПКЯ и уровень их тревожности. Влияние акне на качество жизни оценивали с помощью опросника ДИКЖ (Дерматологический индекс качества жизни; Dermatological Life Quality Index — DLQI). Вопросы опросника в соответствии с параметрами качества жизни объединены в 6 блоков: в частности, вопросы 1 и 2 (максимальное значение 6 баллов) характеризовали симптомы и ощущения, 3 и 4 (максимальное значение 6 баллов) — ежедневную деятельность, 5 и 6 (максимальное значение 6 баллов) — отдых, 7 (3 балла) — работу и/или учебу, 8 и 9 (максимальное значение 6 баллов) —межличностные отношения и 10 (3 балла) — лечение. По результатам опроса выяснилось, что 70% пациенток с акне испытывают эстетический дискомфорт, чувство утраты внешней привлекательности, что приводит к снижению качества их жизни. Через 6 мес приема инозитолов вдвое снизилось количество пациенток, у которых дерматологические проявления отражаются на качестве жизни, что является хорошим стабильным результатом.
Доказано, что у пациенток с СПКЯ гораздо чаще встречаются депрессивные и тревожные расстройства. СПКЯ следует рассматривать не только как хроническое эндокринное расстройство, но и как гетерогенное состояние с метаболическими, репродуктивными и психическими проявлениями. В метаанализе распространенности тревожности среди пациенток с СПКЯ продемонстрировано наличие симптомов генерализованной тревоги у 20,4% пациенток по сравнению с 3,9% пациенток группы контроля [30]. Данные показатели свидетельствуют о необходимости включения оценки тревоги в скрининг при обследовании пациенток с СПКЯ. Степень тревожности в нашем исследовании оценена по шкале Спилберга—Ханина, которая является надежным и информативным способом диагностики. Тест определяет уровень тревожности на основании шкалы самооценки. Согласно данным исследования, 71% пациенток с СПКЯ исходно испытывали умеренную или высокую степень тревожности, такие показатели связаны с высокой распространенностью андрогензависимой дермопатии среди испытуемых. Через 6 мес приема средства Дикироген только 39% пациенток предъявляли жалобы на тревожность.
Вывод
Полученные нами результаты интервенционного проспективного исследования показали, что комбинацию миоинозитола и D-хироинозитола в соотношении 5:1 можно рассматривать в качестве средства, компоненты которого способствуют уменьшению выраженности акне и гирсутизма, а также снижению уровня тревожности, что суммарно приводит к положительному влиянию на качество жизни пациенток с синдромом поликистозных яичников.
Участие авторов:
Концепция и дизайн исследования — Аляутдина О.С., Прилуцкая В.Ю.
Сбор и обработка материала — Прилуцкая В.Ю., Сосна Н.А.
Статистический анализ данных — Прилуцкая В.Ю.
Написание текста — Прилуцкая В.Ю., Сосна Н.А.
Редактирование — Аляутдина О. С., Прилуцкая В.Ю.
Литература
1. Bozdag G, Mumusoglu S, Zengin D, Karabulut E, Yildiz BO. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Human Reproduction. 2016; 31(12):2841-2855.
2. Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and longterm health risks related to polycystic ovary syndrome. Fertility and Sterility. 2004;81(1):19-25.
3. Vink JM, Sadrzadeh S, Lambalk CB, Boomsma DI. Heritability of polycystic ovary syndrome in a Dutch twin-family study. The Journal of Clinical Endocrinology and Metabolism. 2006;91(6):2100-2104.
4. Yildiz BO, Yarali H, Oguz H, Bayraktar M. Glucose intolerance, insulin resistance, and hyperandrogenemia in first degree relatives of women with polycystic ovary syndrome. The Journal of Clinical Endocrinology and Metabolism. 2003;88(5):2031-2036.
5. Mohamed-Hussein ZA, Harun S. Construction of a polycystic ovarian syndrome (PCOS) pathway based on the interactions of PCOSrelated proteins retrieved from bibliomic data. Theoretical Biology and Medical Modelling. 2009;6:18.
6. Fornes R, Maliqueo M, Hu M, Hadi L, Jimenez-Andrade JM, Ebefors K, Nyström J, Labrie F, Jansson T, Benrick A, Stener-Victorin E. The effect of androgen excess on maternal metabolism, placental function and fetal growth in obese dams. Scientific Reports. 2017;7(1):8066.
7. Jahromi MS, Tehrani FR, Noroozzadeh M, Zarkesh M, Ghasemi A, Zadeh-Vakili A. Elevated expression of steroidogenesis pathway genes; CYP17, GATA6 and StAR in prenatally androgenized rats. Gene. 2016;593(1):167-171.
8. Rosenfield RL, Ehrmann DA. The Pathogenesis of Polycystic Ovary Syndrome (PCOS): The Hypothesis of PCOS as Functional Ovarian Hyperandrogenism Revisited. Endocrine Reviews. 2016;37(5):467-520.
9. Genazzani AD. Inositol as putative integrative treatment for PCOS. Reproductive Biomedicine Online. 2016;33(6):770-780.
10. Larner J. D-chiro-inositol — its functional role in insulin action and its deficit in insulin resistance. International Journal of Experimental Diabetes Research. 2002;3(1):47-60.
11. Bevilacqua A, Carlomagno G, Gerli S, Montanino Oliva M, Devroey P, Lanzone A, Soulange C, Facchinetti F, Carlo Di Renzo G, Bizzarri M, Hod M, Cavalli P, D’Anna R, Benvenga S, Chiu TT, Kamenov ZA. Results from the International Consensus Confe rence on myo-inositol and D-chiro-inositol in Obstetrics and Gynecology — assisted reproduction technology. Gynecological Endocrinology. 2015;31(6):441-446.
12. Nelson VL, Qin KN, Rosenfield RL, Wood JR, Penning TM, Legro RS, Strauss JF 3rd, McAllister JM. The biochemical basis for increased testosterone production in theca cells propagated from patients with polycystic ovary syndrome. The Journal of Clinical Endocrinology and Metabolism. 2001;86(12):5925-5933.
13. Regidor PA, Schindler AE, Lesoine B, Druckman R. Management of women with PCOS using myo-inositol and folic acid. New clinical data and review of the literature. Hormone Molecular Biology and Clinical Investigation. 2018;34(2):/j/hmbci.2018.34.issue-2/hmbci-2017-0067/hmbci-2017-0067.xml
