 invar.ru
invar.ru

Cредство для естественного восстановления менструального цикла без гормонов
В его состав входит уникальная комбинация мио-инозитола, D-хиро-инозитола, марганца и фолиевой кислоты.
далее...
Сравнение эффективности применения инозитолов и комбинированных оральных контрацептивов для коррекции метаболических, эндокринных и клинических параметров пациенток с синдромом поликистозных яичников
СтатьиАвторы
О. С. Аляутдина1, В. Ю. Прилуцкая2
Организация
1,2Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет), Трубецкая ул., д. 8, стр. 2, Москва, 119991, Российская Федерация
Для корреспонденции
Прилуцкая Виктория Юрьевна, аспирант кафедры акушерства и гинекологии №1 Института клинической медицины ФГАОУ ВО Первого МГМУ им. И.М. Сеченова (Сеченовского университета), Трубецкая ул., д. 8, стр. 2, Москва, 119991.
Аляутдина Ольга Сергеевна, профессор кафедры акушерства и гинекологии №1 Института клинической медицины ФГАОУ ВО Первого МГМУ им. И.М. Сеченова (Сеченовского университета), Трубецкая ул., д. 8, стр. 2, Москва, 119991.
Comparison of the effectiveness of inositols and combined oral contraceptives for the correction of metabolic, endocrine and clinical parameters of patients with polycystic ovary syndrome.
Authors
Olga S. Alyautdina1, Victoriya Y. Prilutskaya2
Affiliation
1,2I.M. Sechenov First Moscow State Medical University (Sechenov University), Trubetskaya st. 8-2, Moscow, 119991, Russian Federation
Victoria Y. Prilutskaya, PhD student of the Department of obstetrics and gynecology № 1 of the I.M. Sechenov First Moscow State Medical University (Sechenov University).
Olga S. Alyautdina, professor of the Department of obstetrics and gynecology № 1 of the I.M. Sechenov First Moscow State Medical University (Sechenov University).
Резюме
Введение. Применение комбинации мио-иозитола с Д-хиро-инозитолом в соотношении 5:1 (МИ+ДХИ 5:1) представляется перспективным в целях коррекции андрогензависимой дермопатии, регуляции цикла, восстановления овуляции у пациенток, планирующих беременность, а также для улучшения эндокринно-метаболических показателей, углеводного и липидного обмена при СПКЯ.
Цель исследования. Сравнить влияние комбинированных оральных контрацептивов (КОК) и комбинации миоиозитола с Д-хироинозитолом в соотношении 5:1 (МИ+ДХИ 5:1) на эндокринные, метаболические и клинические параметры пациенток с синдромом поликистозных яичников (СПКЯ).
Методы исследования. В проспективное открытое клиническое исследование было включено 129 пациенток с СПКЯ. Пациенткам первой группы (А, n=63) был назначен прием КОК с антиандрогенной активностью, содержащих этинилэстрадиол (ЭЭ) 20 мкг + дроспиренон 3 мг, пациенткам второй группы (В, n=66) – комбинация МИ+ДХИ в соотношении 5:1 в течение 6 месяцев. Также всем пациенткам была рекомендована модификация образа жизни – физические нагрузки и диетотерапия.
Результаты. В обеих группах наблюдалось снижение уровней андрогенов в сыворотке крови. При приеме КОК происходило более выраженное уменьшение гирсутизма по шкале Ферримана-Голлвея, а также клинических проявлений акне. Прием комбинации МИ+ДХИ 5:1, марганца и фолиевой кислоты показал хорошие результаты по улучшению углеводного и липидного обмена пациенток с СПКЯ. Так, в группе В происходило значительное снижение уровней глюкозы (4,9±0,3 vs 5,2±0,5, ммоль/л, p<0,01) и инсулина натощак (12,1±5,3 vs 22,2±4,9, ммоль/л, p<0,01), индексов НОМА и CARO. При приеме КОК не наблюдалось изменений углеводного обмена, но происходило увеличение уровней холестерина (6,0±0,7 vs 5,7±0,5 ммоль/л, p<0,05), липопротеинов низкой плотности (ЛПНП) (3,9±0,4 vs 3,5±0,6 ммоль/л, p<0,05), коэффициента атерогенности (КА). Показатели липидного профиля в группе В значительно улучшились по сравнению с исходными значениями за счет снижения уровня холестерина (5,1±0,6 vs 5,6±0,6 ммоль/л, p<0,05), триглицеридов (1,5±0,4 vs 1,8±0,3 ммоль/л, p<0,05), ЛПНП (2,7±0,5 vs 3,6±0,8 ммоль/л, p<0,01). Диетотерапия и прием комбинации МИ+ДХИ 5:1 также привели к уменьшению окружности талии на 4,4 %, а также снижению ИМТ на 4,8%. В группе приема КОК, наоборот, наблюдалось увеличение окружности талии на 2,1%, а ИМТ на 4,7%, что возможно связано с увеличением аппетита. Также в группе В анализировалась регулярность менструального цикла у пациенток с СПКЯ. Через 6 месяцев наблюдения регулярный цикл наблюдался у 40% пациенток vs 11 % пациенток исходно со средней продолжительностью 33,3±9,4 дней (р<0,05).
Выводы. Модификация образа жизни с применением комбинации МИ+ДХИ в соотношении 5:1 является эффективной для коррекции эндокринного, метаболического и клинического профиля у пациенток с СПКЯ и представляется новой перспективной альтернативой КОК вне зависимости от репродуктивных планов.
Ключевые слова
СПКЯ; синдром поликистозных яичников; миоинозитол; Д-хиро-инозитол; гиперандрогения; инсулинорезистентность; гирсутизм; акне.
Введение
Синдром поликистозных яичников (СПКЯ) является одним из наиболее распространенных эндокринных расстройств у женщин репродуктивного возраста и ассоциирован со следующими признаками, составляющими Роттердамские критерии: гиперандрогенией (клинической или биохимической), хронической ановуляцией (олиго- или аменореей) и поликистозной морфологией яичников [1]. Избыточная масса тела или ожирение (в основном андроидное, присутствует у 30-70 %), повышенный уровень триглицеридов, липопротеинов низкой плотности (ЛПНП) и инсулина с сопутствующей инсулинорезистентностью (ИР) приводят к возможным долгосрочным осложнениям, таким как сахарный диабет 2 типа, дислипидемия, гипертония и атеросклероз у пациенток с СПКЯ [2,3]. Метаболический синдром, наблюдаемый при СПКЯ и являющийся главным фактором риска ССЗ, в основном опосредован увеличением общего и абдоминального жира, аномальными концентрациями глюкозы натощак и снижением чувствительности периферических тканей к инсулину, связанных с СПКЯ [4]. Снижение веса за счет сбалансированного питания и регулярной физической активности считается терапией первой линии для восстановления функции яичников и фертильности, а также для предотвращения метаболических и сосудистых осложнений, уменьшения абдоминального жира и дислипидемии [5].
К стандартам терапии при СПКЯ относится применение комбинированных оральных контрацептивов с антиандрогенным эффектом. Данные препараты снижают клинические проявления гиперандрогении, такие как акне и гирсутизм, а также профилактируют развитие гиперплазии эндометрия у пациенток с СПКЯ [6]. Этинилэстрадиол (ЭЭ) в составе КОК подавляет выработку андрогенов в яичниках и повышает уровень глобулина, связывающего половые гормоны (ГСПГ), что приводит к уменьшению уровня свободного тестостерона. Дроспиренон относится к прогестинам IV поколения и является синтетическим производным спиронолактона, обладающего антиандрогенным и антиальдостероновым действиями [7]. Ограничениями к приему КОК являются планирование беременности, а также ряд заболеваний, таких как венозный и артериальный тромбоз или тромбоэмболия в настоящее время или в анамнезе, выявленная наследственная или приобретенная предрасположенность к тромбозам, сахарный диабет с диабетической ангиопатией, неконтролируемая артериальная гипертензия, тяжелая дислипопротеинемия, острые или хронические заболевания печени, наличие опухолей печени, мигрень с очаговой неврологической симптоматикой [8,9].
Миоинозитол (МИ), представляющий собой полиол (циклогексан-1,2,3,4,5,6-гексол), синтезированный из глюкозо-6-фосфата, является наиболее распространенным из девяти встречающихся в природе стереоизомеров (сцилло-, муко-, D-хиро-, неоинозитол и др.). МИ и Д-хироинозитол (ДХИ) в наибольшем количестве присутствуют в организме человека [10]. МИ является не только предшественником ДХИ (превращения, катализируемого инсулинзависимой эпимеразой), но и предшественником ряда инозитол-фосфатов, которые действуют в зависимых от кальция внутриклеточных сигнальных путях [11]. Многочисленные исследования показали, что применение ДХИ, дефицит которого наблюдается у пациентов с сахарным диабетом 2 типа и лиц с СПКЯ, может способствовать улучшению толерантности к глюкозе и чувствительности к инсулину, снижению уровня андрогенов и восстановлению овуляции у пациенток с СПКЯ [12,13]. Также другая изоформа инозитола – МИ приводит к снижению уровня инсулина и тестостерона в крови, нормализации функции яичников, контролю метаболического синдрома [14].
Целью данного исследования являлось сравнение стандартной терапии КОК, содержащими дроспиренон и приема комбинации МИ+ДХИ в соотношении 5:1 на гормональный профиль, эндокринно-метаболические параметры и клинические проявления гиперандрогении – акне и гирсутизма у пациенток с СПКЯ в течение 6 месяцев.
Материалы и методы
Набор пациенток в интервенционное одноцентровое исследование проводился на базе кафедры акушерства и гинекологии №1 ФГАОУ ВО «Первого МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский университет) с октября 2020 года по май 2021 года. Критерием включения в исследование являлось наличие установленного диагноза СПКЯ согласно Роттердамским критериям. Пациентки со вторичными эндокринными расстройствами, такими как врожденная дисфункция коры надпочечников, синдром Кушинга, гиперпролактинемия, гипотиреоз, а также принимающие в течение последних трех месяцев перед началом исследования гормональные препараты или блокаторы андрогеновых рецепторов были исключены после полного гормонального обследования.
Ни у одного из пациентов, включенных в исследование, не было в личном анамнезе гипертонии, сахарного диабета или сердечно-сосудистых событий, или они не получали лечение оральными контрацептивами или другими лекарственными средствами в течение предыдущих 6 месяцев до начала исследования.
Исследование одобрено этическим комитетом университета и от всех пациенток было получено письменное информированное согласие.
Дизайн и протокол исследования
В проспективном открытом исследовании принимало участие 129 пациенток с СПКЯ. Пациентки группы А (n=63) в качестве терапии нерегулярного менструального цикла и андрогензависимой дермопатии принимали КОК с антиандрогенным эффектом, содержащий ЭЭ 20 мкг + дроспиренон 3 мг (Джес, Bayer AG, Германия, регистрационный номер ЛСР-008842/08). Пациентки группы В (n=66) получали перорально комбинацию МИ с ДХИ в соотношении 5:1 (Дикироген, производство Nutrilinea S.r.l., Италия для PIZETA PHARMA S.p.A., Италия, номер свидетельства о государственной регистрации RU.77.99.88.003.R.003252.09.19) по следующей схеме: по 1 саше 2 раза в день после еды. Дикироген является биологически активной добавкой к пище, содержащей 1000 мг МИ и 200 мг ДХИ, а также 200 мкг фолиевой кислоты и 5 мг марганца в форме органической соли — марганца пидолата, являющиеся синергистами инозитолов. Наблюдение в обеих группах проводилось в течение 6 месяцев. Лечение начинали с первого дня спонтанного или индуцированного микронизированным прогестероном менструального цикла после исключения беременности. Также всем пациенткам была рекомендована модификация образа жизни – физические нагрузки и диетотерапия.
Клинические и антропометрические измерения включали: индекс массы тела (ИМТ), окружность талии, липидограмма, уровень глюкозы натощак, уровень инсулина натощак, индекс HOMA-IR, индекс CARO-IR анализ уровней общего тестостерона (Тобщ), глобулина, связывающего половые гормоны (ГСПГ), андростендиона (A), дегидроэпиандростерон сульфата (ДГЭАС), лютеинизирущего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), индекса свободных андрогенов (ИСА), а также оценку гирсутизма с помощью модифицированной шкалы Ферримана–Голлвея (ФГ) и степени тяжести акне согласно классификации G. Plewig, M. Kligman. Антропометрические данные (индекс массы тела (ИМТ), окружность талии (ОТ)), показатели углеводного обмена и липидограмма были проанализированы исходно и через 6 месяцев наблюдения. Оценка гормонального профиля производилась в группе А – исходно и через 3 месяца после окончания терапии, в группе В – исходно и через 6 месяцев наблюдения. Регулярность менструального цикла оценивалась в группе В через 6 месяцев наблюдения.
Статистический анализ
Статистический анализ проводился в программах Excel и Statistica 13. Для описания количественных данных, имеющих нормальное распределение, использовалось среднее арифметическое (М) и стандартное отклонение (SD). Сравнение связанных групп для выявления различий между переменными в исходном состоянии и через 6 месяцев проводили с использованием парного t-критерия Стьюдента. Значение р<0,05 считалось статистически значимым.
Результаты и обсуждение
В исследовании принимало участие 129 пациенток с СПКЯ: фенотип А – 71 (55%), фенотип В (сочетание гиперандрогении с олиго/ановуляцией) – 33 (26%), фенотип С (сочетание гиперандрогении с поликистозной морфологией яичников по УЗИ) – 13 (10%) пациенток, фенотип Д (сочетание олиго/ановуляции с поликистозной морфологией яичников по УЗИ) – 12 (9%) (табл.1).
Таблица 1.
Распределение пациенток по фенотипам СПКЯ.
| Фенотип | Группа А (n=63) | Группа В (n=66) |
| А | 32 (51%) | 39 (59%) |
| В | 18 (28%) | 15 (23%) |
| С | 6 (10%) | 7 (11%) |
| Д | 7 (11%) | 5 (7%) |
Проводился сравнительный анализ гормонального профиля пациенток с СПКЯ исходно, через 3 месяца после окончания приема КОК и через 6 месяцев приема инозитолов (табл.2). Так, через 6 месяцев приема комбинации МИ+ДХИ в соотношении 5:1 наблюдалось значимая положительная динамика по следующим гормональным показателям:
Таблица 2.
Гормональный профиль пациенток с СПКЯ исходно, через 3 месяца после окончания приема КОК и через 6 месяцев приема инозитолов.
Кроме снижения уровня андрогенов и ЛГ наблюдалось повышение уровня ГСПГ (66,3±10,3 vs 47,2±10,6 нмоль/л, p<0,05).
В группе приема оральных контрацептивов, через 3 месяца после отмены препарата наблюдалось снижение уровня ДГЭАС (7,6±1,4 vs 8,6±1,8 мкмоль/л, p<0,01) и ИСА (3,1±1,6 vs 5,2±2,3, p<0,05) за счет увеличения уровня ГСПГ (78,8±12,4 vs 49,9±11,7 нмоль/л, p<0,01). Такие показатели, как Тобщ и андростендион вернулись к исходным значениям, которые наблюдались до начала приема КОК.
В ходе исследования был проведен комплексный анализ эндокринно-метаболических параметров пациенток с СПКЯ (табл. 3).
Таблица 3.
Эндокринно-метаболический профиль пациенток с СПКЯ исходно и через 6 месяцев после назначения КОК или комбинации МИ+ДХИ в соотношении 5:1.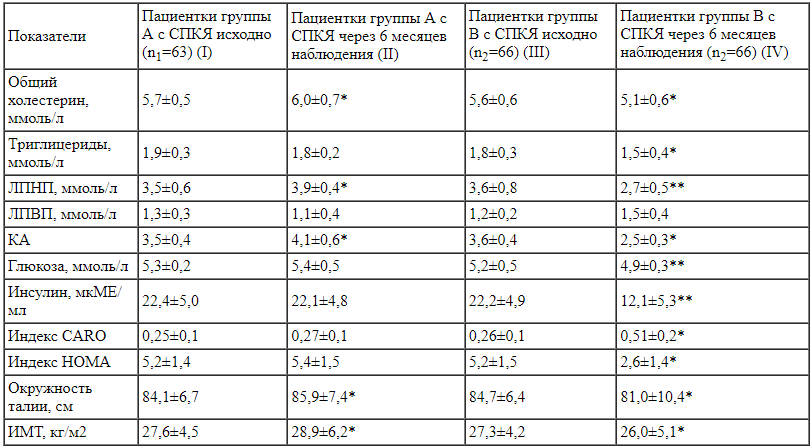
Исходные показатели в двух группах сопоставимы между собой. По результатам исследования было обнаружено, что прием комбинации МИ+ДХИ в соотношении 5:1 положительным образом влияет на липидный спектр. Происходило снижение следующих показателей:
Было выявлено повышение уровня ЛПВП (1,5±0,4 vs 1,2±0,2, ммоль/л, р>0,05), существенно снижающих риск развития атеросклероза и сердечно-сосудистых заболеваний.
В группе А через 6 месяцев лечения показатели липидного спектра ухудшились – наблюдалось увеличение уровня общего холестерина (6,0±0,7 vs 5,7±0,5 ммоль/л, p<0,05), ЛПНП (3,9±0,4 vs 3,5±0,6 ммоль/л, p<0,05), КА (4,1±0,6 vs 3,5±0,4, p<0,05), а также снижение уровня ЛПВП (1,1±0,4 vs 1,3±0,3, ммоль/л, р>0,05).
У пациенток группы В также произошла нормализация углеводного обмена. Было отмечено снижение уровня глюкозы натощак (4,9±0,3 vs 5,2±0,5, ммоль/л, p<0,01), инсулина натощак (12,1±5,3 vs 22,2±4,9, ммоль/л, p<0,01), а также индексов инсулинорезистентности – HOMA (2,6±1,4 vs 5,2±1,5, p<0,05) и CARO (0,51±0,2 vs 0,26±0,1, p<0,05). У пациенток группы А прием КОК не повлиял на углеводный обмен – показатели глюкозы и инсулина натощак сопоставимы с исходными значениями.
Диетотерапия и прием комбинации МИ+ДХИ в соотношении 5:1 также привели к значительным изменениям окружности талии и ИМТ у пациенток с СПКЯ. Наблюдалось уменьшение окружности талии на 4,4 %, а также снижение ИМТ на 4,8% (рис.1, рис.2).
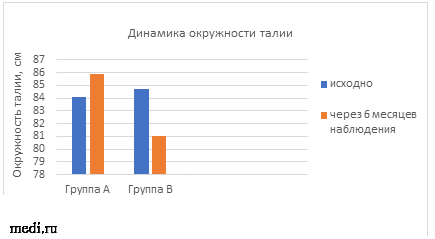 Рис.1 Динамика окружности талии в ходе наблюдения.
Рис.1 Динамика окружности талии в ходе наблюдения.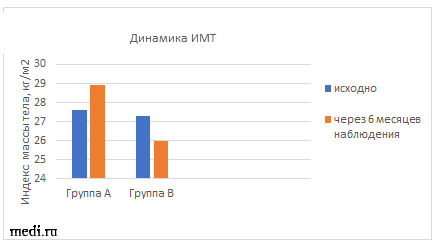 Рис.2 Динамика ИМТ в ходе наблюдения.
Рис.2 Динамика ИМТ в ходе наблюдения.
В группе А окружность талии увеличилась на 2,1%, а ИМТ на 4,7%, что возможно связано с ухудшением показателей липидограммы и отсутствием изменений в углеводном обмене. Также пациентки группы А отмечали значительное повышение аппетита на фоне приема КОК.
В группе В оценивалась регулярность менструального цикла до и после приема комбинации МИ+ДХИ в соотношении 5:1. У 89% пациенток изначально цикл был нерегулярным, средняя продолжительность менструального цикла составляла 68,5±17,1 дней. Через 6 месяцев наблюдения регулярный цикл наблюдался у 40% пациенток со средней продолжительностью 33,3±9,4 дней (р<0,05).
Изначально акне наблюдалось у 44 (70%) пациенток в группе А и у 44 (67%) пациенток в группе В. Уже через 6 месяцев наблюдения в обеих группах происходило значительное улучшение андрогензависимой дермопатии – уменьшилось число акне тяжелой степени на 8% (А) и на 4% (В), а также умеренной степени тяжести на 9% (А) и на 11% (В). Полная ремиссия в отношении акне наблюдалась у 22 (35%) пациенток в группе А и у 17 (26%) пациенток в группе В (см. таблицу 4, рис.3).
Таблица 4.
Число пациенток с акне исходно и через 6 месяцев наблюдения в обеих группах.
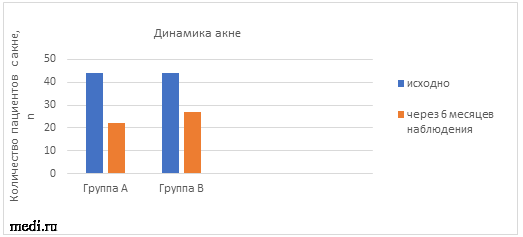 Рис.3 Динамика акне в ходе наблюдения.
Рис.3 Динамика акне в ходе наблюдения.
У всех пациенток с СПКЯ проводилась оценка степени тяжести гирсутизма исходно и через 6 месяцев наблюдения (см. таблицу 5, рис.4). В динамике наблюдалось уменьшение количества пациенток с тяжелым гирсутизмом на 7% (А) и на 3% (В), а также с умеренным гирсутизмом на 9% (А) и на 3% (В), соответственно. Более выраженное улучшение в отношении гирсутизма наблюдалось в группе А, происходило снижение общего балла по шкале ФГ (7,5±3,4 vs 10,9±4,3, р p<0,05).
Таблица 5.
Число пациенток с гирсутизмом исходно и через 6 месяцев наблюдения в обеих группах.
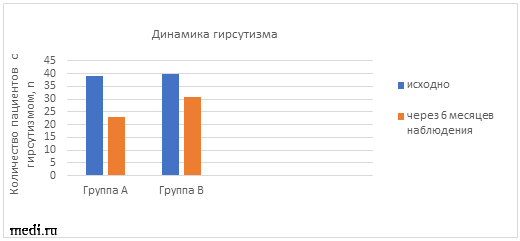 Рис.4 Динамика гирсутизма в ходе наблюдения.
Рис.4 Динамика гирсутизма в ходе наблюдения.
Заключение
Применение комбинации мио- и D-хироинозитола в соотношении 5:1 у пациенток с СПКЯ является новой перспективной альтернативой КОК вне зависимости от репродуктивных планов. В обеих группах наблюдался значимый клинический эффект в отношении выраженности акне и гирсутизма, однако в группе КОК происходило более выраженное улучшение симптомов андрогензависимой дермопатии. Изученное средство, содержащее две активные формы инозитола в соотношении 5:1 (мио-инозитол 1000 мг и D-хиро-инозитол 200 мг), марганец и фолиевую кислоту улучшало эндокринно-метаболические показатели пациенток с СПКЯ, а также способствовало снижению ИМТ и окружности талии, в то время, как прием КОК приводил к увеличению веса и окружности талии, а также ухудшению показателей липидного спектра крови. Также инозитолы способствовали восстановлению овуляции и регулярности менструального цикла в течение 6 месяцев приема. В целом, необходимы дальнейшие, более крупные исследования комбинации МИ+ДХИ в соотношении 5:1 для подтверждения полученных результатов.
В настоящее время применение инозитолов относится к числу исследовательских проектов, однако это направление представляется перспективным как в целях коррекции андрогензависимой дермопатии, регуляции цикла и восстановления овуляции у пациенток, планирующих беременность, так и для улучшения эндокринно-метаболических показателей углеводного и липидного обмена при СПКЯ.
Список литературы
1. Chang J., Azziz R., Legro R., Dewailly D., Franks S., Tarlatzis R. et al. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil. Steril. 2004; 81; 19–25.
2. Anagnostis P, Tarlatzis BC, Kauffman RP. Polycystic ovarian syndrome (PCOS): Long-term metabolic consequences. Metabolism. 2018; Sep; 86:33-43.
3. Gnanadass S., Prabhu Y., Gopalakrishnan A. Association of metabolic and inflammatory markers with polycystic ovarian syndrome (PCOS): an update. Archives of Gynecology and Obstetrics. 2021; 303:631–643.
4. Wikiera B., Zubkiewicz-Kucharska A., Nocoń-Bohusz J., Noczyńska A. Metabolic disorders in polycystic ovary syndrome. Pediatr Endocrinol Diabetes Metab. 2017; 23(4):204-208.
5. Aly JM, Decherney AH. Lifestyle Modifications in PCOS. Clin Obstet Gynecol. 2021; Mar 1;64(1):83-89.
6. Jin P, Xie Y. Treatment strategies for women with polycystic ovary syndrome. Gynecol Endocrinol. 2018; Apr 34(4):272-277.
7. Li L., Zhang R., Zeng J., Ke H., Peng X., Huang L. et al. Effectiveness and safety assessment of drospirenone/ethinyl estradiol tablet in treatment of PCOS patients: a single center, prospective, observational study. BMC Womens Health. 2020; Feb 27;20(1):39.
8. Khialani D., Rosendaal F., Vlieg AV. Hormonal contraceptives and the risk of venous thrombosis. Semin Thromb Hemost. 2020; Nov;46(8):865-871.
9. Calhoun A., Batur P. Combined hormonal contraceptives and migraine: An update on the evidence. Cleve Clin J Med. 2017; Aug 84(8):631-638.
10. Al-Suod H., Ligor M., Ratiu I., Rafin K., Górecki R., Buszewski B. A window on cyclitols: characterization and analytics of inositols. Phytochem. Lett. 2017; 20, 507–519.
11. Unfer V., Carlomagno G., Papaleo E., Vailati S., Candiani M., Baillargeon J.P. Hyperinsulinemia alters myoinositol to d-chiroinositol ratio in the follicular fluid of patients with PCOS. Reprod. Sci. 2014; 21, 854–858.
12. Kalra B., Kalra S., Sharma JB. The inositols and polycystic ovary syndrome. Indian J. Endocrinol. Metab. 2016; 20, 720–724.
13. Sortino MA., Salomone S., Carruba MO., Drago F. Polycystic ovary syndrome: insights into the therapeutic approach with inositols. Front. Pharmacol. 2017; 8, 341.
14. Zeng L., Yang K. Effectiveness of myoinositol for polycystic ovary syndrome: a systematic review and meta-analysis. Endocrinology. 2017; 59, 30–38.
Комментарии
ПРАКТИКА ПЕДИАТРА
