 invar.ru
invar.ru

Cредство для естественного восстановления менструального цикла без гормонов
В его состав входит уникальная комбинация мио-инозитола, D-хиро-инозитола, марганца и фолиевой кислоты.
далее...
Результаты применения комбинация миоинозитола и D-хироинозитола в соотношении 5:1 у женщин с синдромом поликистозных яичников
СтатьиТ.А. Обоскалова 1,2 , А.В. Воронцова 1,2, М.А. Звычайный 1,2, , К.Г. Гущина 2, М.М. Мантесян1
1ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, Екатеринбург, Россия;
2МАУЗ «Городская клиническая больница №40», Екатеринбург, Россия.
Аннотация
Нами проведено обсервационное описательное исследование оценки эффективности терапевтической модификации образа жизни с включением для нутритивной поддержки комбинации 1000 мг миоинозитола и 200 мг Д-хироинозитола (соотношение 5:1) у 104 женщин репродуктивного возраста с СПЯ (классическая фенотип и некласссические фенотипы при наличии гиперандрогении) на протяжении 6 месяцев. Выявленные изменения антропометрических параметров (снижение ИМТ на 0,89 кг/м2 (р<0,05) и ОТ на 3,0 см (р<0,05)), состояния кожных покровов (уменьшение частоты встречаемости акне с 96,2% до 58,6% (р<0,05) и себореи с 34,6% до 5,8% (р<0,05)), гормонального фона (статистически значимое изменение всех исследуемых параметров (р<0,05) - снижение общего тестостерона (до 1,27 нмоль/л) и ИСА (до 4,12%) на фоне повышения ГСПГ), углеводного обмена (нормализация толерантности к глюкозе без развития гипогликемии) и восстановление параметров менструального цикла (регулярный менструальный цикл у 76,9% (р<0,05), длительность менструального цикла 33,4 дня (р<0,05)) свидетельствуют о значительной роли первого этапа терапии пациенток с СПЯ и возможных преимуществах комбинации 1000 мг мио- и 200 мг Д-хироинозитола в качестве нутритивной поддержки.
Ключевые слова: синдром поликистозных яичников, миоинозитол, D-хироинозитол, Дикироген
Введение
Развитие синдрома поликистозных яичников (СПЯ) связано с периферической инсулинорезистентностью и гиперинсулинемией, а существующее ожирение увеличивает взаимовлияние обоих нарушений. Инсулинорезистентность при СПЯ, возникающая в 70%, может быть вторичной по отношению к постсвязывающему дефекту в сигнальных путях инсулинового рецептора, а повышенный уровень инсулина может провоцировать стимулирующее влияние ЛГ на функцию яичников. Гиперинсулинемия также может способствовать снижению синтеза глобулина, связывающего половые гормоны (ГСПГ) в печени, что, в свою очередь, повышает андрогенизацию женщины [1]
В связи с этим одним из методов коррекции углеводного обмена в соответствии с международными рекомендациями является применение метформина [2], [3]. Однако, недавно было выяснено, что комбинация инозитолов (миоинозитол (МИ) и Д-хироинозитол (ДХИ)) по сравнению с метформином показала значительно лучшие результаты в отношении снижения массы тела, частоты овуляции и наступления беременности [4].
Инозиты (инозитолы), такие как мио- (МИ) и D-хироинозитол (ДХИ), относятся к группе витаминоподобных веществ (ранее относились к витаминам группы B) и являются простыми сахарами [5]. Инозитолы содержатся в пищевых продуктах - фруктах, бобах, зерне и орехах, а также синтезируются и внутри нашего организма [6].
МИ и ДХИ работают как вторичные мессенджеры, передающие сигналы от рецепторов ФСГ, ЛГ, ГнРГ и инсулина, таким образом участвуют в регуляции синтеза и действия половых гормонов и влияния инсулина [7], [8] и, соответственно, могут быть крайне полезны у пациенток с СПЯ. Кроме того, известно, что у женщин с синдромом поликистозных яичников (СПЯ) отмечается избыточная потеря ДХИ с мочой [9], что способствует развитию инсулинорезистентности.
Последние исследования эффектов инозитола показали, что каждый из изомеров инозитола (МИ и ДХИ) отвечает за регуляцию разных аспектов углеводного обмена и поддержания гормонального баланса; поэтому, по сравнению с применением одного МИ на фоне комбинации МИ и ДХИ инозитолов женщины с СПЯ могут иметь больше преимуществ, связанных с метаболическими параметрами (снижение инсулина, холестерина и маркеров воспаления) [8], [10], [11], [12].
Дополнительным преимуществом инозитолов является их влияние на синтез грелина, что способствует в том числе и снижению аппетита [8]. Кроме того, при пероральном приеме инозитолы хорошо переносятся [3], [13].
С целью изучения влияния нутритивной коррекции на углеводный обмен, гиперандрогению и регуляцию менструального цикла у женщин с СПЯ на базе кафедры акушерства и гинекологии ФГБОУ ВО УГМУ Минздрава России и Городского эндокринологического центра МАУ ГКБ №40 г. Екатеринбурга на протяжении 2019 -2020 гг. было проведено обсервационное описательное исследование. Под наблюдением находилось 104 женщины в возрасте 19-38 лет (28,7 лет (4,61)) с диагнозом СПЯ: классический фенотип - 44 женщины (42,3%); неклассический вариант (сочетание гиперандрогении и поликистозной морфологии яичников по УЗИ) - 28 женщин (26,9%); неклассический вариант (сочетание гиперандрогении и олигоановуляции) - 32 женщины (30,8%); длительность заболевания (от момента постановки диагноза СПЯ) составила 6,4 (5,46) года. Диагноз СПЯ ставился в соответствии с российскими клиническими рекомендациями «Синдром поликистозных яичников в репродуктивном периоде (современные подходы к диагностике и лечению» (2015 г.) [14].
Критерии включения - наличие классической фенотипа, или сочетание гиперандрогении с поликистозной морфологией яичников при УЗИ, или сочетание гиперандрогении с олиго-ановуляцией; отсутствие систематического приема каких-либо препаратов; отсутствие патологии, требующей систематического приема лекарственных препаратов; отсутствие приема гормональных препаратов (гормональных контрацептивов, препаратов с антиандрогенным влиянием) в течение 3 месяцев до включения в исследование; отсутствие патологии, требующей хирургического вмешательства, отсутствие опухолевых образований.
Первичные критерии эффективности - регулярность менструального цикла, индекс массы тела (ИМТ), окружность талии (ОТ), частота встречаемости андрогенной дермопатии; вторичные критерии -уровень глюкозы в сыворотке крови, уровень общего тестостерона, глобулина, связывающего половые гормоны (ГСПГ) и индекса свободных андрогенов (ИСА).
Всем женщинам в качестве первой линии терапии СПЯ в соответствии с действующими российскими Клиническими рекомендациями была рекомендована терапевтическая модификация образа жизни - исключение вредных привычек, физические упражнения и правильное питание (на основании представленных дневников питания). В качестве нутритивной поддержки была рекомендована комбинация миоинозитола и D-хироинозитола в соотношении 5:1 (Дикироген, пр-во Pizeta Pharma, № свидетельства о гос. регистрации RU.77.99.88.003.R.003252.09.19), содержащий 1000 мг миоинозитола и 200 мг D-хироинозитола) по схеме 2 пакетика в день, предварительно разбавляя пакетик в 1/2 стакане воды на протяжении 6 месяцев. В состав Дикирогена так же входят 200 мкг фолиевой кислоты и 5 мг марганца в форме органической соли -марганца пидолата (в связи с тем, что фолиевая кислота и марганец являются синергистами инозитолов) [8]. Прием средства начинался не зависимо от дня менструального цикла.
При первичном обследовании и на протяжении приема комбинации миоинозитола и D-хироинозитола у женщины оценивались следующие параметры: масса тела, рост, ИМТ, ОТ, состояние кожных покровов (наличие андрогенной дермопатии - акне, гирсутизм, себорея волосистой части головы, андрогенная алопеция); биохимические показатели - уровень глюкозы (референсные значения для 14-60 лет - 4,1-5,9 ммоль/л), АСТ (референсные значения для людей старше 17 лет - <31 Ед/л), АЛТ (референсные значения для людей старше 17 лет - <31 Ед/л), щелочная фосфатаза (референсные значения для женщин старше 15 лет - 40-150 Ед/л) [15]; пероральный глюкозотолерантный тест с 75 г сухой глюкозы (уровень глюкозы исходно и через 2 часа после нагрузки глюкозой, в норме менее 7,8 ммоль/л) [15]; андрогенный статус - тестостерон общий (референсные значения для женщин 19-50 лет - 0,52-1,72 нмоль/л), ГСПГ (референсные значения для женщин 19-50 лет - 14,7-122,5 нмоль/л), ИСА (референсные значения для женщин в первую фазу менструального цикла - 0,8-9,3%) [15]. Исследование биохимических показателей и гормонального фона проводилось в лаборатории INVITRO. Гормональное исследование проводилась на 2-5 день естественного или индуцированного приемом прогестагена менструального цикла. Схема наблюдения представлена в Таблице 1.
Таблица 1.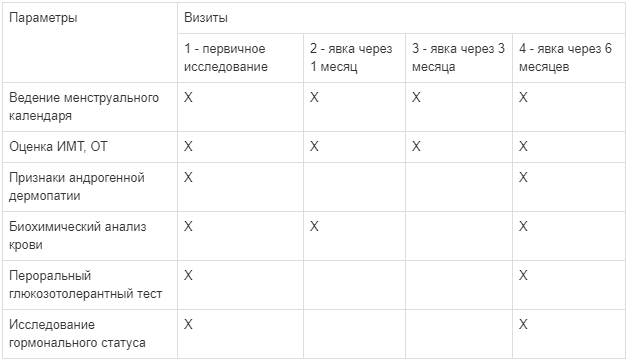 Статический анализ полученных результатов проводился в программе Статистика 13 (версия 3) на компьютере ASUS, операционная система Windows XP. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD). Сравнение связанных групп проводилось с использованием Wilcoxon Matched Pairs Test.
Статический анализ полученных результатов проводился в программе Статистика 13 (версия 3) на компьютере ASUS, операционная система Windows XP. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD). Сравнение связанных групп проводилось с использованием Wilcoxon Matched Pairs Test.
Результаты исследования и их обсуждение
Параметры исходного состояния женщин на начало исследования
При анализе антропометрических параметров установлено, что масса тела женщин в среднем составила 73,5 (±9,88) кг при минимальной массе 54 кг и максимальной массе 97 кг; ИМТ находился в пределах 20,2-35,3 кг/м2 и в среднем был 26,5 (±3,63) кг/м2; средний ОТ оказался 80,8 (±13,08) см. Избыточную массу тела имели 44,2% (46 женщин), ожирение I степени - 23,1% (24 женщины); а по результатам измерения ОТ абдоминально-висцеральное ожирение (ОТ>80 см) выявлено у 64,4% (67 женщин).
Наличие гирсутизма было обнаружено у 25% (n=26) обследованных, акне - у 96,2% (n=100), себорея волосистой части головы - у 34,6% (n=36), андрогензависимая алопеция - у 2,9% (n=3) женщин.
На момент первичного осмотра регулярный менструальный цикл был у 36,3%, а средняя длительность менструального цикла составила 52,7 (±20,85) дня.
При проведении перорального глюкозотолерантного теста (Рисунок 1) установлено, что уровень глюкозы натощак в среднем составил 4,75 (0,99) ммоль/л, при этом минимальное значение составило 3,1 ммоль/л, а максимальное - 6,1 ммоль/л. Средний уровень глюкозы через 2 часа после нагрузки 75 г глюкозы увеличился до 6,04 (±1,43) ммоль (в пределах нормы), однако максимальный уровень глюкозы оказался 9,0 ммоль/л, что свидетельствовало о наличии нарушения толерантности к глюкозе (7,8-11,1 ммоль/л) у 20 женщин (19,2%). Биохимические показатели, используемые для оценки функционального состояния печени и желчевыводящих путей (АЛТ, АСТ и щелочная фосфатаза) находились в пределах референсных значений (среднее значение, минимально и максимальное значение).
Рисунок 1. Уровень глюкозы при проведении перорального глюкозо-толерантного теста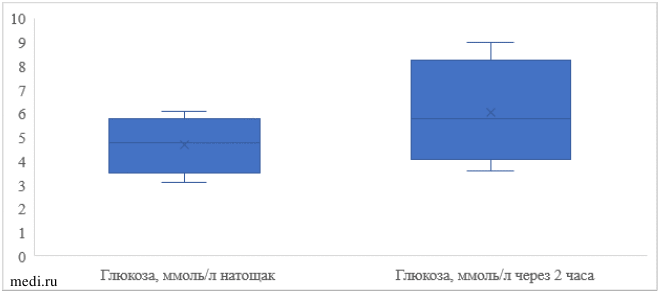
При первичном обследовании андрогенного статуса установлено, что средний уровень тестостерона был равен 3,1 (±1,00) нмоль/л, что почти в 2 раза превысило верхний уровень референсных значений. Уровень ГСПГ и ИСА в среднем составили 62,2 (±46,18) нмоль/л и 7,99 (±6,42) % соответственно (в пределах референсных значений). Однако, у 39 женщин (37,5%) ИСА был выше 9,3%, т.е., превысил максимальное допустимое значение для первой фазы менструального цикла.
Динамика изменений состояния женщин на фоне приема комбинации МИ и ДХИ в соотношении 5:1
На фоне применения комбинации МИ и ДХИ нами были выявлены изменения антропометрических данных, биохимических и гормональных показателей.
Уже на втором визите (через 1 месяц от начала наблюдения) было зафиксировано изменение ИМТ - статистически не значимое увеличение параметра на 0,18 кг/м2. Однако, на третьем визите ИМТ в среднем составил 25,66 кг/м2, что было статистически значимо ниже исходного показателя на 0,89 кг/м2 и было (р=0,0020). Снижение ИМТ сохранилось и на 4-ом визите (6-ой месяц от начала наблюдения) (Таблица 2).
Таблица 2.
Результаты сравнительного изменения ИМТ по отношению к исходному При проведении дисперсионного анализа не было выявлено корреляции между ИМТ и фенотипом СПЯ; снижение ИМТ происходило у женщин на протяжении периода наблюдения также вне зависимости от фенотипа СПЯ.
При проведении дисперсионного анализа не было выявлено корреляции между ИМТ и фенотипом СПЯ; снижение ИМТ происходило у женщин на протяжении периода наблюдения также вне зависимости от фенотипа СПЯ.
Следует отметить, что все выявленные изменения ОТ (Таблица 3) в течение нашего наблюдения были статически значимы: и увеличение ОТ через 1 месяц наблюдения, и уменьшение ОТ на 3,03 см через 3 и 6 месяцев наблюдения (с 80,8 см до 77,8 см).
Таблица 3.
Результаты сравнительного изменения ОТ по отношению к исходному В результате, избыточная масса тела через 6 месяцев наблюдения была лишь у 29,8% (31 женщина), ожирение - всего 0,9% (1 женщина); а по результатам измерения ОТ абдоминально-висцеральное ожирение (ОТ>80 см) выявлено только у 8,7% (9 женщин).
В результате, избыточная масса тела через 6 месяцев наблюдения была лишь у 29,8% (31 женщина), ожирение - всего 0,9% (1 женщина); а по результатам измерения ОТ абдоминально-висцеральное ожирение (ОТ>80 см) выявлено только у 8,7% (9 женщин).
Таким образом, у женщин, при терапевтической модификации образа жизни с использованием нутритивной поддержки в виде применения комбинации МИ и ДХИ в соотношении 5:1 отмечено статистически значимое снижение ИМТ и ОТ, что является первостепенным и крайне важным шагом в терапии женщин с СПЯ.
Как представлено на Рисунке 2, через 6 месяцев наблюдения выявлены следующие статистически значимые изменения в состоянии кожных покровов: снижение частоты встречаемости акне с 96,2% до 68,6% (р<0,05) и себореи с 34,6% до 5,8% (р<0,05).
Рисунок 2. Динамика частоты обнаружения признаков андрогензависимой дермопатии (акне и себорея) по отношению к исходному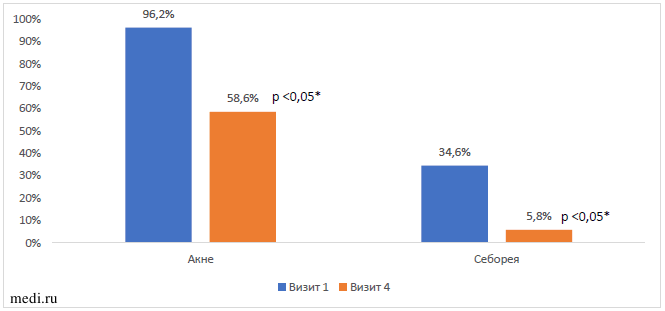 Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Таким образом, у женщин, находящихся под нашим наблюдением отмечено статически значимое улучшение состояния кожных покровов в отношении акне и себореи. Относительно гирсутизма и андрогенной алопеции статистически значимых изменений выявлено не было.
При анализе результатов оценки углеводного обмена на протяжении приема комбинации МИ и ДХИ отмечены незначительные колебания среднего уровня глюкозы натощак в пределах референсных значений (Рисунок 3). Средний уровень глюкозы через 2 часа после углеводной нагрузки снизился статистически незначимо с 6,0 до 5,8 ммоль/л, что также находилось в пределах референсных значений; однако, количество женщин, имевших нарушение толерантности к глюкозе, уменьшилось с 19,2% до 0% (р=0,0000).
Рисунок 3. Изменение параметров перорального глюкозотолерантного теста по отношению к исходному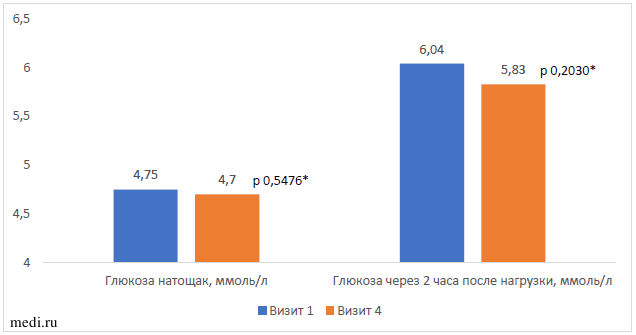 Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Таким образом, выявленная нами нормализация уровня глюкозы при наличии исходного нарушения толерантности к глюкозе и отсутствие снижения уровня глюкоза при ее исходном нормальном уровне свидетельствует о наличии благоприятного метаболического эффекта на углеводный обмен, столь значимого для пациенток с СПЯ.
В качестве оценки безопасности используемого средства оценивались в динамике уровни ферментов печени АЛТ, АСТ и ЩФ. По результатам исследования, применение МИ и ДХИ в соотношении 5:1 не оказывает отрицательного влияния на печеночные ферменты, что крайне важно у пациенток с СПЯ, особенно учитывая повышенный риск развития при данной патологии неалкогольной жировой болезни печени и желчекаменной болезни [16], [17].
Все оцениваемые нами показатели андрогенного статуса (общий тестостерон и ИСА) через 6 недель оказались статистически значимо ниже исходного уровня и находились в пределах референсных значений (Рисунок 4).
Рисунок 4. Результаты сравнительного анализа показателей андрогенного статуса у участников по отношению к исходному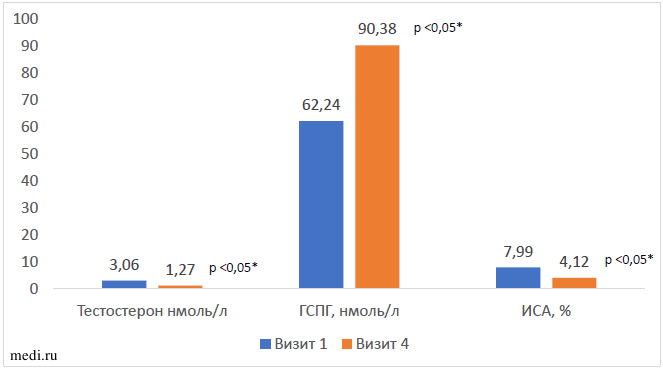 Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Снижение уровня общего тестостерона и ИСА на фоне повышения ГСПГ было обнаружено вне зависимости от фенотипа СПЯ. .
Таким образом, у женщин, находившихся под нашим наблюдением, была выявлена нормализация андрогенного статуса вне зависимости от исследуемого фенотипа СПЯ, что является преимуществом терапевтической модификации образа жизни с включением комбинации МИ и ДХИ в соотношении 5:1, позволяющим без использования гормональных препаратов снизить уровень андрогенов при СПЯ.
При оценке изменений параметров менструального цикла у обследованных нами пациенток оказалось, что через 6 месяцев наблюдения нерегулярный менструальный цикл отмечался у 23,1% (статистически значимо реже по сравнению с 63,5% при первичном обследовании; р <0,05). Более того, статистически значимое уменьшение продолжительности менструального цикла отмечено уже через месяц (Таблица 4).
Таблица 4. Результаты сравнительного анализа изменения длительности МЦ по отношению к исходному Восстановление регулярности менструального цикла происходило вне зависимости от фенотипа СПЯ (Рисунок 5).
Восстановление регулярности менструального цикла происходило вне зависимости от фенотипа СПЯ (Рисунок 5).
Рисунок 5. Динамика восстановления регулярности менструального цикла при различных фенотипах СПЯ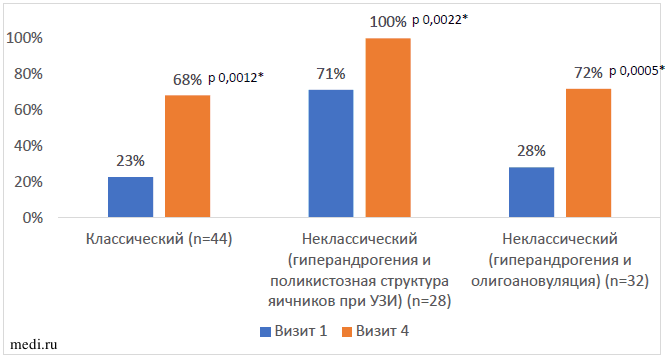 Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Примечание: * - значимость различий между первым и четвертым визитом (Wilcoxon Matched Pairs Test)
Таким образом, у женщин на фоне 6 месяцев терапевтической модификации образа жизни с применением комбинации МИ и ДХИ в соотношении 5:1 отмечено восстановление регулярности и снижение длительности менструального цикла вне зависимости от фенотипа СПЯ.
Обсуждение
Возможность применения инозитола при СПЯ была отмечена в Международном научно-обоснованном руководстве по диагностике и ведению женщин с СПЯ [3], хотя оставался открытым вопрос о проведении детальных исследований влияния различных доз и комбинаций инозитолов. Более того, за последние годы были обнаружены различия по влиянию стереоизомеров инозитола на состояние углеводного, жирового обмена и гормональный статус. Так, найдены достоверные отличия влияния МИ и ДХИ для 127 ферментов [8], что объясняет тот факт, что различные комбинации в разных соотношениях могут оказывать и различные клинические эффекты, особенно это важно при СПЯ, где необходимо восстанавливать метаболические процессы не только в яичниках, но и в периферических тканях. Например, обнаружены различия между МИ и ДХИ в активации белков-рецепторов, вовлеченных в процессы поддержания концентрации глюкозы в крови - МИ и ДХИ в одинаковой степени активировали передачу сигнала от рецептора инсулина (INSR) и рецептора пролифераторов пероксисом, но при этом были отличия в константе активации рецептора инсулиноподобного фактора роста 1 (ДХИ в 2.4 оказался более активен, чем МИ по отношению к рецептору IGF1R) [18], [19].
В последнее время было создано несколько различных комбинаций МИ и ДХИ как с дополнительными соединениями, такими как микро- и макроэлементы, витамины, так и без них; а это несколько усложняет сравнение и выбор различных комбинаций МИ и ДХИ. Так, сравнивались эффекты 2 комбинаций МИ и ДХИ у 60 женщин с СПЯ, готовящихся к проведению экстракорпорального оплодотворения - на протяжении 3 месяцев пациентки получали 1100 мг/день МИ и 300 мг/день ДХИ (комбинация в соотношении 3:1) или 1100 мг/день МИ и 28 мг/день ДХИ (комбинация в соотношении 40:1); оказалось, что показатели наступления беременности были почти в 2 раза выше в группе получавших комбинацию МИ и ДХИ 3:1 (65%; р=0,003) и число живорожденных детей также было больше в группе комбинации соотношения 3:1 (55%; р=0,002) [20].
Суммируя результаты, полученные при применении комбинации МИ и ДХИ в соотношении 5:1 в качестве нутритивной поддержки при СПЯ нами было обнаружено: позитивные изменения антропометрических параметров (снижение ИМТ на 0,89 кг/м2 (р <0,05) и ОТ на 3,0 см (р <0,05)), улучшение состояния кожных покровов (уменьшение частоты встречаемости акне с 96,2% до 58,6% (р <0,05) и себореи с 34,6% до 5,8% (р <0,05)), нормализация гормонального фона (статистически значимое изменение всех исследуемых параметров (р <0,05) - снижение общего тестостерона (до 1,27 нмоль/л) и ИСА (до 4,12%) на фоне повышения ГСПГ) и углеводного обмена (нормализация толерантности к глюкозе без развития гипогликемии), восстановление параметров менструального цикла (регулярный менструальный цикл у 76,9% (р <0,05), длительность менструального цикла 33,4 дня (р <0,05)).
Безусловно, ограничением проведенной программы является отсутствие группы сравнения, в которой предполагалось применение терапевтической модификации образа жизни без использования нутритивной поддержки, либо прием только МИ, либо плацебо. Поэтому, существует необходимость в дальнейшем проведении более детальных исследований.
Заключение
Полученные нами результаты наблюдательного исследования в отношении восстановления менструального цикла, нормализации метаболических процессов и снижения гиперандрогении согласуются с зарубежными данными [11], [12], [13], [21]. Обнаруженные нами увеличение частоты женщин с регулярным менструальным циклом, снижение частоты акне и себореи, снижение ИМТ и ОТ, нормализация углеводного обмена (снижение частоты встречаемости нарушения толерантности к глюкозе) и уменьшение уровня общего тестостерона и ИСА на фоне нутритивной поддержки комбинацией МИ и ДХИ в соотношение 5:1 при терапевтической модификации образа жизни у пациенток с СПЯ подчеркивают возможность включения данной комбинации на первом этапе ведения женщин с СПЯ.
Список литературы
1. Barber TM, McCarthy MI, Wass JA, Franks S. Obesity and polycystic ovary syndrome. Clin Endocrinol (Oxf). 2006 Aug. 65(2):137-45.
2. Otta CF, Wior M, Iraci GS, et al. Clinical, metabolic, and endocrine parameters in response to metformin and lifestyle intervention in women with polycystic ovary syndrome: a randomized, double-blind, and placebo control trial. Gynecol Endocrinol. 2010 Mar. 26(3):173-8
3. Teede HJ, Misso ML, Costello MF, Dokras A, Laven J, Moran L, et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril. 2018 Aug. 110 (3):364-379
4. Wojciechowska A, Osowski A, Jozwik M, Gorecki R, Rynkiewicz A, Wojtkiewicz J. Inositols' Importance in the Improvement of the Endocrine-Metabolic Profile in PCOS. Int J Mol Sci. 2019;20(22):5787. doi:10.3390/ijms20225787
5. Dinicola S, Minini M, Unfer V, Verna R, Cucina A, Bizzarri M. Nutritional and Acquired Deficiencies in Inositol Bioavailability. Correlations with Metabolic Disorders. Int J Mol Sci. 2017;18(10):2187. Published 2017 Oct 20. doi:10.3390/ijms18102187
6. Brown L.D., Cheung A., Harwood J.E., Battaglia F.C. Inositol and mannose utilization rates in term and late-preterm infants exceed nutritional intakes. J. Nutr. 2009;139:1648-1652
7. Larner J, Brautigan DL, Thorner MO. D-chiro-inositol glycans in insulin signaling and insulin resistance. Mol Med. 2010;16(11-12):543-552. doi:10.2119/molmed.2010.00107
8. Торшин И.Ю., Майорова Л.А., Уварова Е.В., Тапильская Н.И., Громова О.А., Хемореактомный анализ стереоизомеров инозитола: различные профили фармакологического действия миоинозитола и D-хироинозитола при нарушениях женской репродуктивной системы. Вопросы акушерства, гинекологии и перинатологии. 2020; 5 (19): . doi: 10.20953/1726-1678-2020-5
9. Baillargeon, Jean-Patrice & Diamanti-Kandarakis, Evanthia & Ostlund, Richard & Apridonidze, Teimuraz & Iuorno, Maria & Nestler, John. (2006). Altered D-Chiro-Inositol Urinary Clearance in Women With Polycystic Ovary Syndrome. Diabetes care. 29. 300-5. 10.2337/diacare.29.02.06.dc05-1070
10. Nordio M, Proietti E. The combined therapy with myo-inositol and D-chiro-inositol reduces the risk of metabolic disease in PCOS overweight patients compared to myo-inositol supplementation alone. Eur Rev Med Pharmacol Sci. 2012;16(5):575-81
11. Bizzarri M, Carlomagno G. Inositol: history of an effective therapy for Polycystic Ovary Syndrome. Eur Rev Med Pharmacol Sci. 2014 Jul;18(13):1896-903. PMID: 25010620
12. Lagana AS, Garzon S, Casarin J, Franchi M, Ghezzi F. Inositol in Polycystic Ovary Syndrome: Restoring Fertility through a Pathophysiology-Based Approach. Trends Endocrinol Metab. 2018 Nov;29(11):768-780. doi: 10.1016/j.tem.2018.09.001. Epub 2018 Sep 27. PMID: 30270194
13. Pintaudi B, Di Vieste G, Bonomo M. The Effectiveness of Myo-Inositol and D-Chiro Inositol Treatment in Type 2 Diabetes. Int J Endocrinol. 2016;2016:9132052. doi:10.1155/2016/9132052
14. Клинические рекомендации «Синдром поликистозных яичников в репродуктивном возрасте (современные подходы к диагностике и лечению)». Москва,2015. 20 с
15. Лабораторная диагностика/Под ред. Е.А.Кондрашевой, А.Ю.Островского.-4-е изд., перераб. и доп. - М.:Медиздат, 2018.-720 с., ил.
16. Chalasani N, et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases. Hepatology 2018;67(1):328-357; Sarkar M, Terrault N, Chan W, et al. Polycystic Ovary Syndrome (PCOS) Is Associated With NASH Severity and Advanced Fibrosis. Liver International. 2020;40(2):355-359
17. Успенская Ю.Б., Кузнецова И.В. Желчнокаменная болезнь как коморбидное синдрому поликистозных яичников заболевание. Consilium Medicum. 2015; 17 (6): 45-48
18. Sie KK, Li J, Ly A, Sohn KJ, Croxford R, Kim YI. Effect of maternal and postweaning folic acid supplementation on global and gene-specific DNA methylation in the liver of the rat offspring. Mol Nutr Food Res. 2013;57(4):677-685. doi:10.1002/mnfr.201200186 PMID: 23463647
19. Bian A, Ma Y, Zhou X, et al. Association between sarcopenia and levels of growth hormone and insulin-like growth factor-1 in the elderly. BMC Musculoskelet Disord. 2020;21(1):214. Published 2020 Apr 7. doi:10.1186/s12891-020-03236-y. PMID: 32264885
20. Mendoza N, Diaz-Ropero MP, Aragon M et al. Comparison of the effect of two combinations of myo-inositol and D-chiro-inositol in women with polycystic ovary syndrome undergoing ICSI: a randomized controlled trial. Gynecol Endocrinol 2019; 35 (8): 695-700. DOI: 10.1080/09513590.2019.1576620
21. La Marca A, Grisendi V, Dondi G, Sighinolfi G, Cianci A. The menstrual cycle regularization following D-chiro-inositol treatment in PCOS women: A retrospective study. Gynecol Endocrinol 2015;31:52-6
