Часто болеющие дети: проблемы патогенеза, диагностики и терапии
СтатьиРоссийский государственный медицинский университет, Москва
Г.А. Самсыгина
Термин «часто болеющие дети» появился в отечественной медицинской литературе в первой половине 80-х годов прошлого века [1]. Следует отметить, что зарубежные школы педиатрии не используют его, нет этого термина и в МКБ X пересмотра, так как это не диагноз в медицинском понимании этого слова. Часто болеющие дети (ЧБД) — это термин, обозначающий группу детей, выделяемую при диспансерном наблюдении, характеризующуюся более высоким, чем их сверстники, уровнем заболеваемости острыми респираторными инфекциями.
Тем не менее отечественная система организации медицинской помощи детям, одним из достижений которой была реальная профилактическая направленность, сочла целесообразным особо выделить эту категорию детей. Было отмечено, что среди так называемых ЧБД значительно чаще выявляются хронические заболевания носоглотки и легких, чаще встречаются и тяжелее протекают бронхиальная астма, аллергический ринит, выше частота ревматизма, гломерулонефрита и ряда других заболеваний. Было отмечено, что ЧБД в подростковом возрасте склонны к хроническим заболеваниям желудочно-кишечного тракта, сосудистым дистониям, у них легче развиваются невротические реакции, они быстрее утомляются, хуже учатся. Именно эти характеристики и побудили отечественных педиатров выделить склонных к повышенной заболеваемости респираторной вирусной инфекцией детей в особую группу наблюдения и обозначить ее как группа ЧБД.
Надо отметить, что в детском возрасте среди всех заболеваний респираторного тракта отмечается абсолютное преобладание острой инфекционной патологии. На ее долю приходится более 90% всех болезней респираторной системы [2—6]. Только в 2000 г. заболеваемость гриппом и другими острыми респираторными заболеваниями (ОРВИ) среди детей первых 3 лет жизни составила 199 850 случаев на 100 000 детского населения России [6]. Причем заболеваемость ОРВИ не только во многом определяет показатели общей заболеваемости, но оказывает существенное влияние на показатели смертности, особенно в раннем возрасте. В частности, заболеваемость ОРВИ, гриппом и пневмонией среди детей первого года жизни возросла в РФ за период с 1991 по 1997 гг. на 7%, а смертность в отдельные годы этого периода увеличилась на 9— 16% [5]. Так, в 2002 г. в Екатеринбурге зарегистрировано свыше 140 тыс. инфекционных заболеваний среди детей. Заболеваемость составила 6118 на 10 тыс. детей. В структуре инфекций ОРВИ составили 88%, при этом 11,7 тыс. детей потребовалась госпитализация. В результате фактические затраты местного здравоохранения только на госпитализацию составили около 50 млн. руб. [7].
Максимальная заболеваемость ОРВИ среди детей отмечается в возрасте от 6 мес до 6 лет и составляет от 4 до 6 заболеваний в год. Среди школьников заболеваемость снижается до 2—5 случаев в год, а среди взрослых не превышает 2—4 заболеваний на протяжении года [2, 6]. Это всеобщая закономерность, и она прослеживается у детей во всех странах мира независимо от экономического уровня их развития. Bartlett J.G. [2] в своем руководстве по респираторной патологии приводит данные Guyer B., отражающие типичную динамику уровня заболеваемости ОРВИ в детском возрасте (рис. 1). На рис. 2 приведены статистические данные МЗ РФ на 2002 г. [8], и они практически полностью совпадают.
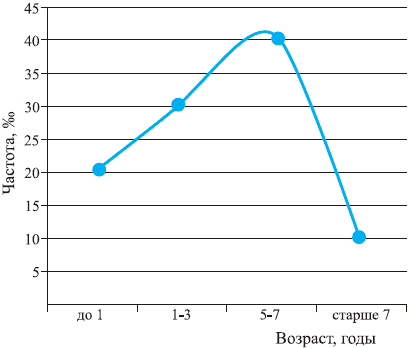
Рис. 1. Заболеваемость инфекциями респираторного тракта в детском возрасте*.
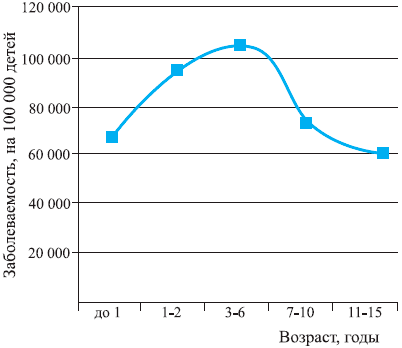
Рис. 2. Заболеваемость респираторными инфекциями детей РФ*.
Таким образом, совершенно очевидно, что ранний и дошкольный детский возраст, т.е. возраст от 6 мес до 6 лет, характеризуется повышенной чувствительностью организма ребенка к респираторной вирусной инфекции, и это не отклонение от нормы, а онтогенетическая особенность данного возрастного периода.
Естественно, напрашиваются вопросы: что же является основой столь частой заболеваемости детей первых лет жизни и имеет ли эта онтогенетическая характеристика физиологическую целесообразность?
Ответы на эти вопросы, по-видимому, лежат в плоскости процессов становления противоинфекционной защиты ребенка.
Вспомним, что первые 3—5 месяцев жизни, кстати, месяцев, являющихся периодом «физиологического гуморального иммунодефицита» человека, проходят «под прикрытием» пассивно переданных материнских антител против большинства респираторных вирусов [9, 10]. Пожалуй, только по отношению к респираторно-синтициальной (PC) инфекции напряженность пассивного иммунитета недостаточна, особенно у недоношенных новорожденных [10], что и явилось в настоящее время поводом для разработки вакцины специально для этой категории детей. Именно в связи с отсутствием частой респираторной заболеваемости в первые 6 месяцев жизни ребенка термин «часто болеющие дети» в этом возрасте практически не используется. Да и во втором полугодии жизни он используется исключительно редко.
Выделение этой группы диспансерного наблюдения реально берет свое начало на 2-м году жизни. Характерной особенностью функции иммунной системы детей 2—6 лет является высокая пролиферативная активность лимфоцитов, при этом фракция недифференцированных, «наивных» лимфоцитов у детей больше, чем у взрослых. Характерен и более высокий уровень клеточной цитотоксичности. Кроме того, именно в этом возрасте происходит переориентация иммунного ответа на инфекционные антигены с превалирования Тh2-пути ответа, свойственного плодам, новорожденным и детям первых месяцев жизни, на Тh1-ответ, типичный для инфекционного процесса у взрослых. Эти и некоторые другие возрастные особенности иммунной системы организма ребенка являются факторами, обусловливающими более высокую чувствительность организма ребенка к инфекциям и менее дифференцированный (по сравнению с взрослыми) ответ иммунной системы в целом на воздействие инфекции. С другой стороны, острые респираторные инфекции, переносимые в раннем детстве, способствуют не только формированию противовирусного иммунитета, но и поляризации иммунного реагирования организма по Тh1-пути, т.е. функциональному созреванию противоинфекционного иммунитета ребенка. Но эту ситуацию можно рассматривать как онтогенетически целесообразную и оправданную только в том случае, когда частота ОРВИ не превышает порог толерантности иммунной системы ребенка к инфекции. При ОРВИ, повторяющихся более 6—8 раз в год, адекватного восстановления функциональных характеристик иммунной системы не происходит [11, 12].
Важной стороной вопроса об особенностях иммунной системы у детей раннего и дошкольного возраста является состояние лимфоэпителиальной ткани глоточного кольца, осуществляющего местную противоинфекционную защиту респираторного тракта. Известно, что период раннего детства характеризуется интенсивным процессом развития лимфоэпителиальной глоточной системы (ЛЭГС). Обычно, начиная со 2-го полугодия жизни ребенка, постепенно формируются нёбные миндалины, причем у большинства детей миндалины появляются в последней четверти первого года жизни. Однако у части детей их можно выявить уже на 6— 7-м месяце жизни. На 2-м году начинается формирование глоточной миндалины (аденоидов), которая локализуется в так называемой «стратегической зоне» верхних дыхательных путей, там, где регистрируется наиболее интенсивное антигенное воздействие, как инфекционное, так и неинфекционное [13].
ЛЭГС обладает выраженной лимфопоэтической функцией, участвует в генерации (производстве) и «обучении» В-клонов лимфоцитов для «своего региона» — слизистой оболочки дыхательных путей, где они и осуществляют местную продукцию IgA и IgM. В нёбных и глоточной миндалинах имеются фолликулы с герминативными центрами, представляющими B-зону. Они относятся к тимус -независимым структурам миндалин. Т-лимфоциты сосредоточены в экстрафолликулярной зоне миндалин и являются тимусзависимой клеточной структурой. Эпителиоциты слизистой оболочки носоглотки и миндалин образуют петлистую сеть, где сосредотачиваются мигрирующие из общего кровотока лимфоциты — так называемый лимфоэпителиальный симбиоз.
Суть лимфоэпителиального симбиоза заключается в том, что, проходя между эпителиальными клетками, лимфоциты нарушают целостность эпителиального покрова, образуя так называемые «физиологические раны», «ходы», которые обеспечивают контакт лимфоидной ткани глотки и миндалин с внешней средой. В условиях целостности эпителиального покрова слизистой оболочки носоглотки именно эти внутриэпителиальные ходы «дозируют» поступление антигенов в ЛЭГС, обеспечивая адекватную антигенную нагрузку на лимфоидный аппарат глотки, необходимую для защиты респираторного тракта. При нарушении целостности эпителия под воздействием инфекции, особенно повторной, или под воздействием других повреждающих факторов, нарушающих ее целостность, антигенная нагрузка на ЛЭГС неизмеримо возрастает. Это может сопровождаться перенапряжением, истощением или расстройством защитных механизмов.
Функциональная активность ЛЭГС тесно коррелирует с площадью и количеством фолликулов и находится в тесной зависимости от возраста и морфологической зрелости ребенка. Так, у большинства здоровых детей максимум увеличения площади нёбных миндалин приходится на возраст 3—5 лет, а увеличение глоточной миндалины (аденоидов) — на возраст 5—7 лет. После этих «пиков» отмечается постепенная редукция лимфоэпителиальной ткани глоточного кольца, завершающаяся обычно к 18 годам (рис. 3). Возрастная эволюция ЛЭГС находится под генетическим контролем и зависит от морфотипа данного индивидуума. Давно отмечено, что крупные, рослые, склонные к избыточному весу дети, чаще светлоглазые блондины, склонны к частым «простудным» заболеваниям, гиперплазии нёбных миндалин, аденоидов и других элементов лимфоглоточного кольца. Ранее это обозначалось терминами «лимфатизм», «лимфатико-гипопластический тип аномалии конституции» .
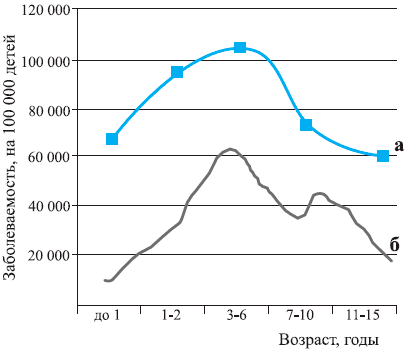
Рис. 3. Заболеваемость ОРВИ и темпы развития ткани лимфоглоточного кольца у детей.
а — заболеваемость, б — темпы развития ткани лимфоглоточного кольца.
Но наряду с генетически детерминированной склонностью к гиперплазии и замедленной редукции ЛЭГС на процессы ее эволюции немалое влияние оказывает воздействие внешних, фенотипических факторов. Таких факторов множество. Это — экологическое неблагополучие окружающей среды, проживание в сырых, плохо вентилируемых помещениях, большая скученность в помещениях, посещение детских коллективов, недостаточное и/или неправильное питание, неправильное лечение предшествующих респираторных заболеваний, злоупотребление антибактериальными препаратами, ранее перенесенные тяжелые заболевания, особенно инфекционные, глистная инвазия, повторяющиеся стрессовые воздействия и др. [14, 15, 16]. При достаточно интенсивном воздействии фенотипических факторов они способны нарушить хрупкое равновесие между нормой и патологией, и у ребенка, имеющего генетическую предрасположенность, развивается выраженная гиперплазия ЛЭГС, нарушается лимфоэпителиальный симбиоз, создаются предпосылки для неадекватной стимуляции иммунной системы, преодоления порога ее толерантности, формирования иммунной дисфункции.
Первые исследования иммунного статуса у ЧБД, основанные на изучении соотношения субпопуляций лимфоцитов в циркуляции крови, фагоцитоза и уровня факторов неспецифической защиты, не выявили существенных отклонений. Более того, те изменения, которые удалось отметить, были неспецифичны, носили разнонаправленный характер и затрагивали самые различные звенья противоинфекционной защиты. Степень выраженности их не достигала уровня, свойственного первичным и приобретенным формам иммунодефицитов [11].
Однако более поздние исследования [12] показали, что у ЧБД даже в период клинического благополучия и при отсутствии признаков ОРЗ выявляются отчетливые изменения в межклеточном взаимодействии в иммунной системе: достоверно повышено содержание провоспалительных интерлейкинов (IL2, IL4), в том числе интерлейкинов, участвующих в хронизации процессов воспаления (IL6, IL8). Это сопровождается снижением клеточной цитотоксичности, дисиммуноглобулинемией и повышением уровня клеток, экспрессирующих рецепторы, индуцирующие апоптоз. При этом индуцированная продукция провоспалительных цитокинов была недостаточной, что свидетельствует об истощении резервных возможностей иммунной системы организма ребенка. Снижение количества CD11b клеток, в состав которых входят гранулоциты, моноциты, натуральные киллеры и макрофаги, экспрессирующие молекулы межклеточной адгезии, а также уменьшение количества эндотелиальных клеток, экспрессирующих межклеточные молекулы адгезии 1-го типа и рецепторы к риновирусам, во многом объясняют повышение чувствительности детей к повторным респираторным вирусным инфекциям и склонность их к развитию бактериальных осложнений. А недостаточность резервных возможностей интерфероногенеза, особенно в плане синтеза γ-интерферона, осуществляющего мощную противовирусную защиту в организме, несмотря на нормальный уровень интерферона в сыворотке крови, объясняет сохранение вялотекущей реакции воспаления в организме ребенка даже при отсутствии клинических признаков ОРЗ [12].
Таким образом, полученные в последние годы данные свидетельствуют о том, что иммунная система ЧБД хотя и не имеет грубых первичных и приобретенных дефектов, но характеризуется крайней напряженностью процессов иммунного реагирования, нарушением межклеточной кооперации и недостаточностью резервных возможностей, что, по-видимому, является результатом длительного и массивного антигенного воздействия на организм ребенка. Безусловно, такое состояние иммунной системы является фактором высокого риска развития осложнений как местных (присоединение бактериального воспаления на различных уровнях респираторного тракта), так и общих (формирование иммунокомплексной и иной иммунной патологии). Это и обусловливает целесообразность выделения группы ЧБД в практике здравоохранения.
Критерии выделения детей в группу ЧБД сформулированы в 1986 г. В.Ю. Альбицким и А.А. Барановым [1]. Они приведены в таблице, из которой видно, что в возрасте до 1 года к группе ЧБД относят ту категорию детей, которые перенесли 4 и более эпизодов ОРЗ в год. Среди детей от 1 до 3 лет в нее включают детей, перенесших в течение года 6 и более эпизодов ОРЗ, соответственно, среди детей от 3 до 5 лет — 5 и более эпизодов, а среди детей старше 5 лет — 4 и более ОРЗ в год.
Таблица
Критерии включения детей в группу часто болеющих*
| Возраст ребенка | Частота эпизодов ОРЗ в год |
| До года | 4 и более |
| 1—3 года | 6 и более |
| 4—5 лет | 5 и более |
| Старше 5 лет | 4 и более |
Кстати, в практике зарубежных педиатров (Великобритания, США) принято считать, что обычно здоровые дети в возрасте от 1 до 3 лет переносят до 8 эпизодов ОРЗ в год. Если частота респираторных инфекций составляет 8 и более, то принято говорить о рекуррентных (повторных) респираторных инфекциях [2, 14]. Очевидно, что выделение подобной группы пациентов оправдано в глазах педиатров различных школ. С другой стороны, и подходы к оценке частоты обычной возрастной заболеваемости в детском возрасте в разных странах также сходны.
По данным различных авторов, ЧБД составляют в общей популяции детского населения в среднем от 14 до 18% , хотя некоторые авторы приводят более высокие показатели — до 40% [1, 15—18]. По данным последней всеобщей диспансеризации, в Москве группа ЧБД составила около 15% всего детского населения города. Следует отметить, что некоторые отечественные авторы рекомендуют включать в эту группу детей, у которых не только часто регистрируются респираторные инфекции, но сами заболевания протекают длительно — свыше 14 дней. Возможно, это — одна из причин более высоких показателей частоты выявления ЧБД. Насколько это правильно, судить пока трудно, так как нельзя исключить, что в основе склонности к затяжному течению респираторной инфекции лежат несколько иные механизмы. А это означает необходимость иного алгоритма диагностики и терапии.
Как уже отмечалось выше, основным критерием выделения пациентов в группу ЧБД является частота заболеваемости ОРВИ. Это, однако, не исключает проведения дополнительного обследования ребенка.
Прежде всего, ЧБД нуждаются в тщательном осмотре педиатром и обязательном осмотре ЛОР-врачом, включающем оценку состояния миндалин, аденоидов, придаточных полостей носа и барабанной перепонки, так как среди ЧБД хронические заболевания ЛОР-органов встречаются приблизительно в половине случаев (42—58%).
Обязательной практикой должно быть проведение посева со слизистой оболочки зева (с миндалин) и носа для оценки характера микробного пейзажа. Также может потребоваться исследование на атипичные возбудители (микоплазмоз, хламидиоз) методом ПЦР мазков со слизистой оболочки зева (определение титра антител к хламидиям и микоплазмам имеет только вспомогательное значение). Следует учитывать, что микробиоценоз слизистой оболочки является одним из важнейших звеньев противоинфекционной защиты и даже у здорового взрослого человека весьма зависим от воздействия окружающей среды и состояния его организма.
Основными микроорганизмами ротоглотки здорового человека являются β-гемолитические стрептококки группы А. Наряду с ними в зеве в незначительных количествах могут встречаться стафилококки, пневмококки, грамотрицательные палочки — моракселла катарралис, нетипируемая гемофильная палочка и, редко, грибы рода Candida. Основной обитатель слизистой оболочки носовых ходов — золотистый стафилококк. Но могут встречаться в небольшом проценте случаев другие условно патогенные микроорганизмы (стрептококки, грамположительные микрококки и др.).
У детей, особенно раннего возраста, биоценоз верхних дыхательных путей находится в процессе становления. Причем микробный пейзаж постепенно меняется с возрастом ребенка, приближаясь к таковому взрослого человека только к 8-летнему возрасту. Если же ребенок меняет свой образ жизни или расширяет контакты (например, меняет климатогеографическую зону проживания, начинает посещать детский сад или школу и др.), то изменение микробного пейзажа носоглотки может быть очень существенным. В это время со слизистой оболочки можно выделить такие «неожиданные» микроорганизмы, как клебсиелла, кишечная палочка, микоплазма, хламидия и др.
У ЧБД микробиоценоз носоглотки нередко существенно отличается от возрастной нормы. Во-первых, как правило, инфекции респираторного тракта у этой группы детей носят смешанный вирусно-бактериальный характер, в связи с чем им многократно в течение года назначают антибактериальные препараты. Во-вторых, среди ЧБД немало детей, страдающих хроническими заболеваниями носоглотки, — хроническим тонзиллитом, фарингитом, синуситом, аденоидитом и др., что в свою очередь влияет на микробиоценоз носо-и ротоглотки. При обследовании ЧБД можно обнаружить довольно интенсивную микробную колонизацию слизистой оболочки грибами рода Candida, стафилококками, гемофильной палочкой (в том числе гемофильной палочкой типа b), моракселлой катарралис, энтеробактериями (в том числе клебсиеллой и кишечной палочкой), микоплазмами и даже синегнойной палочкой. В носовых пазухах, лакунах нёбных и глоточной миндалин нередко обнаруживаются анаэробы. Выраженные нарушения микробиоценоза носоглотки снижают резистентность к патогенным возбудителям, поддерживают длительный воспалительный процесс, способствуют нарушению целостности эпителиального барьера и тем самым увеличивают антигенное воздействие и способствуют развитию хронической интоксикации.
Из методов дополнительного лабораторного и инструментального исследования целесообразно также сразу провести анализ периферической крови, общий анализ мочи и рентгенографию носоглотки и придаточных полостей носа в передней и боковой проекциях.
В более сложных, не поддающихся обычной терапии, случаях может потребоваться консультация клинического иммунолога и/или аллерголога, а из дополнительных методов лабораторного обследования — исследование иммунограммы, в первую очередь, состояния интерфероногенеза, фагоцитоза, гуморального иммунитета, реже клеточного иммунитета.
Медицинская помощь ЧБД складывается из трех основных направлений:
1) восстановительные или реабилитационные мероприятия, направленные на снижение антигенного воздействия, санацию местных очагов хронической инфекции и повышение резистентности организма ребенка в целом, проводятся в периоде клинического благополучия;
2) этиопатогенетическая терапия ОРЗ;
3) иммунотерапия и вакцинотерапия.
Первое направление — реабилитация, хотя и является наиболее трудоемким и длительным, но оно — основа успешного ведения таких детей. Реабилитация включает ряд общегигиенических мероприятий, которые необходимо проводить в семье. К ним относятся следующие:
1) организация рационального режима дня ребенка — полноценный, достаточный по длительности сон; исключение переутомления и перевозбуждения; обязательные и достаточные по длительности прогулки, но без переохлаждения; ограничение посещения мест большого скопления людей и др.;
2) полноценное питание, учитывающее возрастные особенности ребенка и склонность к аллергическим реакциям, разумное отношение к углеводистой пище и сладостям;
3) прием поливитаминных препаратов, соответствующих возрасту ребенка и его нагрузкам;
4) проведение, в разумных пределах, закаливающих мероприятий — обливания прохладной водой, сон на свежем воздухе, ванны, души, бальнеотерапия, общий массаж, лечебная гимнастика, тренирующие занятия физкультурой.
Медикаментозную коррекцию проводят в период клинического благополучия при обязательном участии ЛОР-врача.
Первоначально необходимо оценить объем оториноларингологической помощи. Если у ребенка имеется хроническая ЛОР-патология (хронический тонзиллит и/или аденоидит) и очаг хронической инфекции, то в период клинического благополучия показано наряду с общими оздоровительными мероприятиями проведение местного лечения, объем которого определяется педиатром и отоларингологом и зависит от характера, степени выраженности и топики поражения. Местная терапия направлена на санацию хронических очагов инфекции, восстановление целостности слизистой оболочки носоглотки, подавление хронического воспаления, что, в конечном счете, обеспечивает снижение антигенной нагрузки на иммунную систему организма ребенка. Местная терапия включает следующие мероприятия:
Местная антибактериальная терапия была предложена сравнительно недавно, но уже привлекла к себе пристальное внимание ЛОР-врачей и педиатров, так как она позволяет значительно снизить частоту использования системной антибактериальной терапии, способствует санации хронических очагов инфекции и тем самым значительно уменьшает антигенную нагрузку на ЛЭГС. Местную антибактериальную терапию проводят курсовым методом в период клинического благополучия у ЧБД с гиперплазией органов ЛЭГС, хроническим тонзиллитом, аденоидитом. Общая длительность ее составляет не менее 1 месяца. Но каждый из антибактериальных препаратов назначают на 7— 10 дней.
Препаратами местной антибактериальной терапии являются Биопарокс и Гексорал. Причем Биопарокс относится к антибиотикам растительного происхождения. Антибактериальные препараты местного действия обычно используют в виде спрея для орошения слизистой оболочки. Орошения проводят 2—4 раза в день. При этом создается достаточно высокая концентрация препарата в месте введения. Так, при использовании Биопарокса 4 раза в день в тканях носоглотки достигается концентрация растительного антибиотика фюзафюнжина от 160 до 240 мкг/л, что вполне достаточно для подавления микробного инфекционного процесса. Антимикробный спектр действия Биопарокса соответствует спектру возбудителей респираторных заболеваний (пневмококки, стрептококки, стафилококки, гемофильная палочка, моракселла катарралис, микоплазма). Кроме того, Биопарокс и Гексорал эффективны по отношению к грибам рода Candida и могут быть рекомендованы для лечения кандидозного тонзиллофарингита (кандидозной ангины). Резистентность к ним респираторных патогенов незначительна. Ограничением использования этих препаратов у детей является возраст. В частности, препараты назначают детям только старше 2 лет по 4 ингаляции (в рот— две и каждый носовой ход по одной) 3—4 раза в сутки в течение 7—10 дней.
Помимо Биопарокса и Гексорала можно использовать Фарингосепт и другие местные антисептики.
Этиопатогенетическое лечение ОРЗ у ЧБД включает противовирусную и противовоспалительную терапию.
В число противовирусных лекарственных средств входят следующие [19]:
В настоящее время известно более 10 групп препаратов, действие которых основано на подавлении репликации вирусов. Однако применение их в педиатрической практике ограничено из-за высокой токсичности, так как метаболизм размножающихся вирусов тесно связан с метаболизмом клеток организма-хозяина, и воздействие на вирус почти неизбежно оказывает влияние на клетки растущего и развивающегося организма ребенка. В результате в детском возрасте из противовирусных химиопрепаратов разрешено использование лишь единичных, и их назначение имеет строгие показания.
При гриппе применяют Римантадин (торговое название Ремантадин) и его комбинацию с альгинатом — Альгирем. Ремантадин препятствует адсорбции, проникновению вируса в клетку хозяина и «раздеванию» вируса гриппа А. Показаниями к назначению Ремантадина и Альгирема являются установленная или высоко вероятная гриппозная этиология болезни (соответствующая эпидемиологическая обстановка, тяжелая, прогрессирующая симптоматика, «запаздывание» катаральных симптомов на несколько часов — 1—2 дня) и высокий риск неблагоприятного исхода заболевания. Ремантадин назначают только детям старше 1 года внутрь из расчета 5 мг/кг массы тела в сутки (но не более 15 мг) в 2 приема в течение 5 дней [14]. Доза Альгирема в 1-й день лечения составляет 10 мг 3 раза, во 2-й и 3-й дни — 10 мг 2 раза, на 4-й день — 10 мг 1 раз в сутки.
При тяжелой (угрожающей жизни) РС-инфекции, протекающей с явлениями бронхиолита или пневмонии, используют нуклеотидный аналог гуанозина — Рибавирин. Его вводят ингаляционно (через небулайзер) в течение 18 ч в дозе до 20 мг/мл/сут (6 г препарата на 300 мл стерильной воды) на протяжении 3—7 дней.
Следует помнить, что Рибаверин и Ремантадин имеют достаточно большое число побочных эффектов, среди которых анемия, поражение печени и почек. Поэтому их назначение может быть оправдано только тяжелым течением вирусной инфекции и высоким риском неблагоприятного (летального) исхода болезни.
Из интерферонов у детей первого года, начиная с первых дней жизни, можно использовать рекомбинантный α интерферон — Виферон. Препарат продемонстрировал высокую безопасность в детском возрасте. Виферон вводят ректально, в свечах по 150 000 МЕ (Виферон 1) 2 раза в сутки в течение 3—5 дней детям до 5 лет и по 500 000 МЕ (Виферон 2) 2 раза в сутки — детям старше 5 лет. Показанием к использованию Виферона являются рино-, корона-, РС- и аденовирусные инфекции, грипп и парагрипп.
Из группы индукторов синтеза эндогенного интерферона у детей старше 6 месяцев в лечении ОРВИ может быть использован Анаферон детский (гомеопатический препарат), действие которого основано на введении сверхмалых доз антител к γ-интерферону. Анаферон назначают по 1 таблетке 3 раза в день в течение 5 дней. С 2 лет может применяться индуктор синтеза эндогенного интерферона Арбидол. Арбидол эффективен, главным образом, в отношении вирусов гриппа А и В, но показанием к его назначению являются и другие респираторные вирусные инфекции. Арбидол назначают по 0,1 г в сутки внутрь в первые 2—3 дня заболевания.
Как известно, подавляющее большинство ОРЗ имеют вирусную природу и поэтому не требуют проведения системной антибактериальной терапии. Многочисленные исследования показали, что назначение антибиотиков при респираторной вирусной инфекции не приводило к сокращению сроков лечения и числа осложнений. Показаниями к назначению системных антибиотиков являются следующие:
1) развитие бактериального осложнения ОРВИ (гнойный средний отит, гнойный синусит, ангина, ларингит с явлениями стеноза гортани II—III степени, острый гнойный трахеобронхит/бронхит, пневмония);
2) бактериальный генез ОРЗ (микоплазменная или хламидийная этиология);
3) в ряде случаев ОРЗ у ЧБД.
Как отмечалось выше, современные антибактериальные препараты для лечения респираторной инфекции принято делить на препараты местного и системного действия. При неосложненном ОРЗ у ЧБД препаратами выбора являются антибиотики местного действия, к которым относится Биопарокс. Как отмечено выше, Биопарокс обладает антимикробным спектром, достаточным для подавления патогенной микрофлоры, способной осложнить вирусную инфекцию. Наиболее оптимально действие Биопарокса при раннем его назначении — не позже 2—3-го дня болезни, т.е. в период становления бактериального процесса. По сути, в данном случае местная антибактериальная терапия играет роль превентивной терапии бактериальных осложнений ОРВИ.
Интересно, что наряду с собственно антибактериальным действием Биопарокс обладает противовоспалительным эффектом, как при вирусном, так и микробном генезе ОРЗ, т.е. обладает патогенетическим противовоспалительным действием.
Как известно, одним из самых актуальных для ОРВИ является риновирус, который может быть причиной, по крайней мере, 40% всех вирусных заболеваний респираторного тракта [10]. При риновирусной инфекции первичной областью поражения является слизистая оболочка назофарингеальной области, так как М-клетки лимфоэпителиальной зоны аденоидов содержат рецепторы межклеточных молекул адгезии 1-го типа к риновирусу. Размножение вируса сопровождается повышением продукции медиаторов воспаления — кининов (брадикинин и простагландины), интерлейкинов (IL1 и IL8) и гистамина, активирующих 1-ю фазу воспаления [2]. Как уже отмечалось, у ЧБД снижено количество CD11b клеток и эндотелиальных клеток, экспрессирующих межклеточные молекулы адгезии 1-го типа и рецепторы к риновирусам [12], что является одним из предрасполагающих факторов к повышенной чувствительности детей этой группы к заболеваемости вирусной инфекцией. Биопарокс повышает синтез молекул межклеточной адгезии 1-го типа, тем самым он способствует повышению продукции и высвобождению медиаторов воспаления активными Т-лимфоцитами и усиливает хемотаксис клеток воспаления в слизистую оболочку носоглотки, подавляя при этом образование свободных радикалов кислорода и выброс ранних интерлейкинов воспаления, что чрезвычайно важно при вирусном генезе инфекции.
Вообще, противовоспалительная терапия является важным патогенетическим направлением лечения ОРВИ. До недавнего времени это направление при лечении ОРВИ практически отсутствовало, подменяясь «домашними» средствами симптоматической терапии: тепло, обильное питье, мед, лимонный сок, сок и отвары трав, ягод и др. Не умаляя значимости средств народной медицины, хотелось бы подчеркнуть, что ее широкое применение, по сути, заполняло фармакологический пробел — отсутствие безопасных и эффективных лекарственных средств противовоспалительной терапии острого инфекционного воспаления вирусного генеза.
В то же время воспалительный процесс, по крайней мере, в острой стадии вирусной инфекции, развивается классическим образом: в ответ на вирусную агрессию происходят сосудистые изменения, связанные с вазодилатацией, увеличением проницаемости сосудов и экссудацией. Это приводит к отеку тканей, высвобождению медиаторов воспаления и изменению секреции, чаще — значительному повышению секреции слизи (гиперсекреция). В конечном итоге нарушается проходимость дыхательных путей, снижается мукоцилиарный клиренс и создаются предпосылки для развития осложнений (обструкция, отек легочной паренхимы, присоединение бактериального инфекционного процесса).
Таким образом, противовоспалительная терапия становится основным и обязательным направлением патогенетической терапии острых инфекций респираторного тракта, и особенно в детском возрасте. К сожалению, фармакологические возможности противовоспалительной терапии этого плана пока весьма ограничены. Наряду с Биопароксом, у которого противовоспалительный эффект является как бы «сопутствующим», в настоящее время появился новый противовоспалительный препарат с оригинальным механизмом действия, направленным на подавление инфекционного и неинфекционного воспаления, — фенспирида гидрохлорид (Эреспал).
Как отмечено, фенспирида гидрохлорид является оригинальным лекарственным средством, отличным как от глюкокортикостероидных, так и нестероидных противовоспалительных препаратов. Его действие основано на подавлении транспорта ионов кальция в клетки и, соответственно, подавлении активности фосфолипазы А2. Это замедляет скорость каскада метаболизма арахидоновой кислоты. В результате замедляется образование простагландинов, лейкотриенов и тромбоксанов — основных факторов, инициирующих сосудистую фазу воспаления. Снижается степень воспалительного отека тканей и секреторной активности бокаловидных клеток слизистых оболочек. Кроме того, фенспирида гидрохлорид подавляет синтез гистамина и уровень экспрессии а1-адренорецепторов, что способствует меньшей «напряженности» 2-й фазы воспаления — фазы клеточной инфильтрации. Причем фармакологической особенностью Эреспала является преимущественное воздействие его на респираторный тракт при минимальном системном эффекте. Отсутствие возрастных ограничений и высокий терапевтический эффект, достигающий, по данным многоцентровых клинических испытаний, 88—89% даже при монотерапии [20], позволяет рассматривать фенспирида гидрохлорид в качестве препарата выбора противовоспалительной терапии острых инфекций респираторного тракта у детей. Эреспал назначают в дозе 4 мг/кг массы тела в сутки в течение 7 дней.
Иммунотерапия и местная вакцинотерапия в последние годы являются довольно принятой практикой ведения ЧБД [2, 8, 11, 12, 13, 16, 17, 18, 21]. С этой целью рекомендуется назначение иммунотропных препаратов микробного происхождения или их синтетических аналогов. К ним относятся бактериальные лизаты (Бронхомунал, ИРС 19, Имудон), комбинированные иммунокорректоры, содержащие бактериальные антигены (Рибомунил, поликомпонентная вакцина ВП-4) и синтетические препараты (Ликопид).
Большинство исследователей отмечают в целом положительный эффект данной терапии, но одновременно многие отмечают кратковременность и нестабильность полученных результатов. Вероятно, одной из причин подобных эффектов является отсутствие должной подготовки пациентов к данному виду терапии. Отсутствие санации местных очагов хронического воспалительного процесса в носоглотке, сохранение дефектов целостности слизистой оболочки и лимфоэпителиального симбиоза и высокая антигенная нагрузка на ЛЭГС не позволяют в полной мере реализовать защитный эффект проводимой терапии.
ЛИТЕРАТУРА
1. Альбицкий В.Ю., Баранов А.А. Часто болеющие дети. Клинические и социальные аспекты. Пути оздоровления. — Саратов, 1986.
2. Bartlett J.G. // Management of respiratory tract infection. — 3rd ed. — Philadelphia, 2001. — P. 178—182.
3. Инфекционная заболеваемость в Российской Федерации за январь—декабрь 2001 года // Эпидемиол. инфекц. бол. — 2002. — № 3. — С. 64.
4. Учайкин В.Ф. Руководство по инфекционным заболеваниям у детей.— М., 1998.
5. Здоровье детей России / Под ред. А. А. Баранова. — М., 1999. — С. 66—68, 116—120.
6. Шаханина И.Л. // Здравоохр. — 1998. — № 9. — С. 169—172.
7. Прудков А.И., Колпащикова Г.И., Савинова Т.Л. и др. // Детские инфекции. 2003. — № 4. — С. 56—59.
8. Острые респираторные заболевания у детей: лечение и профилактика. Пособие для врачей. — М., 2002. — 70 с.
9. Стефани Д.В., Вельтищев Ю.Е. Иммунология и иммунопатология детского возраста. М., 1996. — 384 с.
10. Ритова В.В. Роль вирусов в перинатальной и постнатальной патологии человека. — М., 1976. — 256 с.
11. Тузанкина И. А. Клинико-иммунологические подходы к формированию групп часто болеющих детей и эффективность иммуномодулирующей терапии в комплексе группоспецифических реабилитационных мероприятий: Автореф. дисс... канд. мед наук. — Екатеринбург, 1992.
12. 3аплатников А.Л. Клинико-патогенетическое обоснование иммунотерапии и иммунопрофилактики вирусных и бактериальных заболеваний у детей: Автореф. дисс... докт. мед. наук. — М., 2003.
13. Богомильский М.Р., Чистякова В.Р. Детская оториноларингология. — М., 2001. — 43l с.
14. Экология и здоровье детей / Под ред. Студеникина М.Я. и Ефимовой А.А. — М., 1998. С. 247—273.
15.Чебуркин А.В., Чебуркин А. А. Причины и профилактика частых инфекций у детей раннего возраста. — М., 1994. — 34 с.
16. Bellanti J.A. // Drugs. — 1997. — Vol. 54. — Suppl. 1. — P. 501—512.
17. Коровина Н.А., Заплатников А.Л., Чебуркин А.В., Захарова И.Н. Часто и длительно болеющие дети; современные возможности иммунореабилитации. Руководство для врачей. — М., 2001.
18. 3апруднов A.M. Клинико-патогенетические аспекты заболеваний органов дыхания у часто болеющих детей. — М., 1996.
19. Рациональная антимикробная химиотерапия. / Под ред. В.П. Яковлева и С.В. Яковлева. — М., 2003. — Том 2. — 1001 с.
20. Самсыгина Г.А., Фитилев С.Б., Левин A.M. // Педиатрия. — 2002. — № 2. — С. 81—86.
21.Костиков М.П. Иммунокоррекция в педиатрии. — М., 2001. — С. 64—110.


