Фунгистатическая активность Биопарокса в клинической практике
СтатьиЕ.В. Субботина, М.И. Горбунова, А.В. Рогов
ГОУ ВПО Ставропольская государственная медицинская академия, г. Ставрополь, РФ
Микотические заболевания широко распространены в детской оториноларингологической практике. Среди возбудителей доминирующее место занимает Candida albicans. Иммунодефицитные состояния являются наиболее важными факторами в формировании микозов. Чаще других в детском возрасте встречается орофарингеальный микоз. Биопарокс (фузафунгин), кроме антибактериального и противовоспалительного, обладает выраженным антимикотическим действием. В легких случаях грибкового поражения слизистых оболочек ротоглотки показана местная терапия. Высокоэффективным препаратом выбора в отношении многих штаммов грибов Candida является Биопарокс. В тяжелых случаях орофарингеального микоза выраженный положительный клинический эффект дает сочетание в терапии Биопарокса и системных противогрибковых средств.
Ключевые слова: Биопарокс, Candida albicans, орофарингеальный микоз, иммунодефицит.
Mycotic infections are rather frequent in practice of pediatric otophinolaryngologics. Candida albicans dominates among etiological agents of mycosis. Immunodeficiency is most important factor in development of mycosis. Oropharyngeal mycosis is most frequent in pediatric practice. Bioparox (Fusafungine) has not only antibacterial and anti-inflammatory but also significant anti-fungal activity. This therapy is indicated in cases of mild oral mycosis, and Bioparox is preparation of choice for many of Candida strains. Combination of Bioparox and systemic anti-fungal antibiotics provides significant positive clinical effect in cases of severe oropharyngeal mycosis.
Key words: Bioparox, Candida albicans, оropharyngeal mycosis, immunodeficiency.
Фузафунгин (Биопарокс) - бактериостатический полипептидный антибиотик широкого спектра действия предназначен для местного применения. Основная субстанция препарата - антибиотик фузафунгин, выделяемый из мицелия гриба Fusarium lateritium WR, штамм 437. Данный штамм является стабильным штаммом с постоянными свойствами, который продуцирует фузафунгин с идеально воспроизводимым антибиотическим профилем, не претерпевающий никаких изменений с момента его открытия более 30 лет назад. Фузафунгин обладает бактериостатическим действием, противовоспалительной активностью, эффективен в отношении стрептококков группы А, пневмококков, стафилококков, некоторых штаммов нейссерий, анаэробов, микоплазм, грибов рода Candida. При ингаляции Биопарокса на слизистую оболочку доставляется ровно 125 мкг антибиотика непосредственно в очаг инфекции и воспаления. Размер частиц аэрозольного препарата составляет 0,78 микрон, благодаря чему они легко проникают в самые труднодоступные отделы дыхательных путей.
Противовоспалительное действие фузафунгина основано на его способности ингибировать продукцию различных провоспалительных медиаторов при сохранении способности макрофагов к фагоцитозу. В ряде экспериментов было доказано, что фузафунгин снижает выработку макрофагами свободных радикалов, не нарушая при этом процесс фагоцитоза [1]. Грибы рода Candida вызывают суперинфекцию у пациентов с иммунодефицитом. В опытах in vitro определяли минимальные ингибирующие концентрации фузафунгина при действии на штаммы С. albicans, выделенные со слизистой оболочки носоглотки человека. Результаты показали хорошую фунгистатическую активность фузафунгина по отношению к Candida albicans (MIC 90=16 мг/л) и подтвердили низкий риск развития вторичного кандидоза при продолжительном введении Биопарокса [2].
Заболевания, вызываемые микроскопическими грибами (микозы), представляют серьезную проблему для современной медицины и занимают одно из первых мест в инфекционной патологии, а Candida albicans входит в первую пятерку наиболее частых этиологических факторов внутрибольничных инфекций. Среди всех микотических поражений организма человека на втором месте стоит кандидоз слизистых оболочек, до 40% случаев которого составляет орофарингеальный микоз [3]. Известно, что 20% населения всего мира, т.е. каждый пятый житель, пораженны грибковой инфекцией [4].
Основной этиологический фактор орофарингеального кандидоза - Candida albicans, реже выделяют С. tropicalis, C. glabrata, C. pseudotropicalis, C. guillierimondii, C. krusei, C. lusitaniae, C. parapsilosus, C. stellatoidea. Доля Candida albicans, C. glabrata, С. tropicalis в этиологии кандидоза полости рта составляет более 80% [5]. В общей популяции частота бессимптомного носительства Candida spp. составляет от 20 до75% [6]. У здоровых взрослых людей С. albicans выделяли из полости рта в 30-45% случаев, у новорожденных - в 45%, у здоровых детей - в 45-65%, у пациентов с острой лейкемией, получающих химиотерапию, - до 95% [7].
Candida albicans входит в состав условно- или среднепатогенной микрофлоры, частота выделения которой в норме не должна превышать количество 1-4 lg КОЕ/мл. Данные микроорганизмы занимают промежуточное положение между транзиторной (высокопатогенной) и индигенной (нормальной) микрофлорой: в норме они могут присутствовать в носоглотке в количестве, недостаточном для проявления факторов патогенности, их рост предположительно сдерживается бактериальной интерференцией по отношению к транзиторной микрофлоре [8].
В последние годы появились сведения о том, что в патогенезе гипертрофии глоточной миндалины немалую роль играют анаэробы и грибы -Peptostreptococcus, Prevotella, Fusobacterium spp., Candida albicans [9]. Наиболее часто при хроническом тонзиллите высевается Candida albicans [10]. Л.Б. Дайняк с соавт. [11] при хроническом тонзиллите выявили грибковую флору как преобладающую и описали клинику грибкового поражения миндалин. Микоз миндалин может способствовать их гипертрофии [12, 13].
J.A. Alkiweicz [14] при обследовании 120 детей с гипертрофией глоточной миндалины в 39% выявил наличие грибов Candida, причем автор указал на зависимость частоты выявления грибов от степени гипертрофии миндалин. У детей с гипертрофией III степени грибковая флора определялась в 83% случаев, а II степени - в 11%. Проведенные статистические исследования показали, что сопутствующие заболевания влияют на частоту микотической инфекции.
Иммунодефицитные состояния являются одним из важных факторов, способствующих возникновению микотических инфекций. При этом инфекции, вызываемые грибами, могут выступать своеобразными «маркерами» нарушения иммунитета. Предрасположенность к микозам обусловлена чаще не физиологическими факторами (беременность, период новорожденности, стресс, травма и др.), а иммунодефицитными состояниями, которые бывают как первичными (наследственные), так и вторичными (приобретенные). К тяжелому течению микозов предрасполагают дефекты неспецифических механизмов иммунитета (особенно фагоцитоза) и нарушение тимусзависимого звена иммунной системы [7].
Среди локальных факторов риска кандидоза полости рта и глотки существенное значение имеет лечение ингаляционными кортикостероидами, которые подавляют клеточный иммунитет и фагоцитоз. Еще один локальный фактор риска - это потребление большого количества углеводов, которые способствуют росту Candida spp. и адгезии грибов на эпителиальных клетках [6]. Системными факторами риска развития кандидоза могут быть сахарный диабет, дефицит витаминов группы В, синдром Иценко-Кушинга, применение противоопухолевых препаратов и антибиотиков широкого спектра действия.
Клинические проявления микотического поражения ЛОР-органов зависят от характера локализации возбудителя - в пределах слизистой оболочки (поверхностное поражение) или инвазия в подлежащие ткани (глубокое).
Цели исследования - изучение фунгистатической активности фузафунгина (Биопарокса) у детей с фаринголарингитами грибковой и смешанной этиологии, у пациентов, перенесших аденотонзиллэктомию, и у онкогематологических больных с фарингомикозами.
Задачи настоящего исследования:
1) оценка эффективности монотерапии Биопароксом фаринголарингитов грибковой и смешанной этиологии; в послеоперационном периоде после санации хронических очагов инфекций ЛОР-органов, ассоциированных с колонизацией слизистых оболочек дрожжеподобными грибами; в комплексной терапии среднетяжелых и тяжелых форм фарингомикозов у детей с онкогематологической патологией;
2) определение сроков купирования клинических признаков в пораженных ЛОР-органах;
3) определение продолжительности элиминации патогенной микрофлоры на фоне проводимого лечения по данным лабораторных исследований.
Всего в исследовании приняли участие 135 пациентов, которые были разделены на 3 группы. 1-ю и 2-ю группы составили 95 пациентов в возрасте от 3 до 17 лет, лечившиеся в ЛОР-отделении Детской краевой клинической больницы г. Ставрополя в течение 2010 г. и первого квартала 2011 г. 1-я группа - 45 пациентов с фарингомикозами и фарингитами смешанной этиологии была отобрана среди пациентов, поступающих с острой или обострением хронической патологии полости носа и придаточных пазух, среднего уха. У 50 пациентов 2-й группы эффективность местного применения Биопарокса оценивали в послеоперационном периоде после санации очагов инфекции при хроническом тонзиллите, аденоидите. Наличие хронических очагов инфекции в данной группе было ассоциировано с колонизацией слизистых оболочек ротоглотки дрожжеподобными грибами, без выраженных клинических проявлений и жалоб со стороны пациентов. 3-ю группу составили 40 пациентов со среднетяжелыми и тяжелыми формами орофарингеального кандидоза, проходившие химиолечение в онкогематологическом отделении и получавшие системные противогрибковые препараты в комплексе с местным использованием фузафунгина.
После объективного осмотра поступивших пациентов, целенаправленного сбора данных анамнеза (указание на частое использование антибиотиков в лечении, наличие иммунной недостаточности по клеточному или смешанному типу по данным иммунологического исследования), при наличии клинических проявлений микотического поражения слизистых оболочек или подозрения на латентно протекающий процесс, у таких больных брали соскоб со слизистых оболочек ротоглотки и проводили его микроскопическое исследование. Микроскопия нативного препарата - наиболее простой и надежный способ диагностики микозов, позволяющий не только выявить наличие гриба в исследуемом материале, но и отличить сапрофитию (единичные клетки) от грибкового заболевания (множество клеток, наличие мицелия с признаками активного роста). При наличии множества клеток в нативном или окрашенном (окраска по Романовскому-Гимзе) препарате без признаков активного роста оценивали степень обсемененности слизистых оболочек. Учитывали случаи с частотой выделения Candida albicans, превышающей количество 1-4 lg КОЕ/мл (более 104 КОЕ/мл).
Пациентам 1-й группы - 45 человек с признаками фарингомикоза (микроскопически множество клеток, наличие мицелия с признаками активного роста) - мы назначали Биопарокс по 4 впрыскивания 4 р/сут в глотку в течение 7 дней. Для сравнения наблюдали 30 пациентов с фарингитами смешанной этиологии (в мазках единичные дрожжеподобные клетки и колонии), которые получали полоскания глотки фурациллином 3 р/сут и УФО глотки в течение 7 дней. Через 3 дня после завершения терапии у всех пациентов проводили контрольный соскоб со слизистых оболочек ротоглотки с последующей микроскопией при выявлении колонизации С. albicans, учитывали случаи обсемененности слизистых оболочек более допустимых значений (1-4 lg КОЕ/мл) (рис. 1).
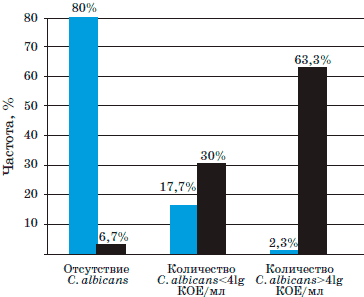
Рис. 1. Сравнение результатов лечения пациентов с фарингомикозами, получавших Биопарокс, и группы сравнения.
Здесь и на рис. 2 :
1-й столбик - лечение Биопароксом,
2-й столбик - стандартная терапия.
Таким образом, монотерапию Биопароксом следует рассматривать как высокоэффективную при лечении неосложненных форм фарингомикоза. В 80% случаев наступило выздоровление, в 17,7% флора соответствовала нормальным показателям обсемененности слизистых оболочек ротоглотки без клинических проявлений, что можно расценивать как здоровое носительство. В одном случае среднетяжелого течения фарингомикоза и наличия сопутствующей патологии у пациента потребовалось назначение противогрибковых препаратов системного действия.
У пациентов 2-й группы (50 человек), поступивших в ЛОР-отделение для оперативного лечения хронического тонзиллита, аденоидита, было выявлено наличие данной патологии, ассоциированной с грибковой колонизацией слизистых оболочек ротоглотки, проявляющейся гиперкератозом крипт миндалин, белым плотным налетом корня языка, при отсутствии жалоб и субъективных ощущений, без изменения общего состояния ребенка. Пациентам данной группы в день проведения оперативного вмешательства проводилась периоперационная антибактериальная подготовка: однократно в суточной дозировке за 30 мин до оперативного вмешательства вводили внутримышечно системный антибиотик. Через 2 ч после операции назначали Биопарокс в дозе по 4 впрыскивания 4 р/сут в течение 7 дней, кроме того, назначали анальгетики на 2 суток в послеоперационном периоде. Для сравнения наблюдали 50 детей после оперативного лечения хронического тонзиллита при стандартной послеоперационной терапии. Оценивали симптомы (боли в глотке, гипертермия более 48 ч после операции) (рис. 2) и проводили повторное микроскопическое исследование мазков из ротоглотки через неделю после оперативного вмешательства. Учитывали рост C. albicans>4 lg КОЕ/мл.
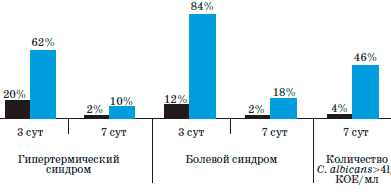
Рис. 2. Динамика клинических симптомов в послеоперационном периоде при лечении Биопароксом и у детей группы сравнения.
В результате наблюдения и послеоперационного лечения детей в группе пациентов, применявших Биопарокс, частота выявления роста С. albicans в количестве, превышающем допустимые значения (>4 lg КОЕ/мл), составила 4%, что значительно ниже показателей группы сравнения (46%), получавшей стандартную послеоперационную терапию. Кроме того, проявления гипертермического и болевого синдромов в группе сравнения на 3-й день были более выражены и на 7-й день лечения сохранялись выше аналогичных показателей по сравнению с пациентами, применявшими в послеоперационном периоде Биопарокс.
Можно сделать вывод о том, что как можно раннее использование Биопарокса в послеоперационном периоде обеспечивает гладкое его течение, значительно уменьшает проявления болевого и гипертермического синдрома. Выраженные антибактериальные, противовоспалительные, фунгистатические свойства Биопарокса позволяют его использовать после оперативных вмешательств в носоглотке в виде монотерапии. Применение Биопарокса при санации хронических очагов инфекции в отоларингологической практике дает возможность отказаться от послеоперационного курсового (7-10 дней) применения системных антибиотиков.
При наблюдении пациентов 3-й группы (40 детей) со среднетяжелыми и тяжелыми формами орофарингеального кандидоза, проходивших химиолечение в онкогематологическом отделении, 20 детям помимо назначения системных противогрибковых препаратов в терапию было добавлено местное использование фузафунгина по схеме 4 впрыскивания 4 р/сут в течение 7 дней. Другие 20 пациентов получали только системную противогрибковую терапию флуконазолом в возрастной дозировке. Эффективность лечения оценивали по времени купирования местных клинических проявлений (покраснения слизистой оболочки, исчезновения белесоватых налетов на нёбных дужках, миндалинах, мягком нёбе, беловато-серых налетов на языке), исчезновения жалоб (рис. 3).
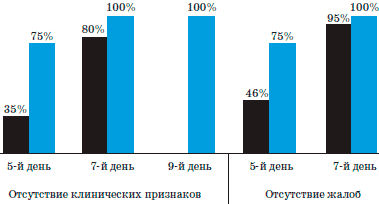
Рис. 3. Сроки купирования воспалительных изменений ротоглотки и жалоб у пациентов 3-й группы и группы сравнения.
1-й столбик - противогрибковая терапия, 2-й столбик -противогрибковая терапия+Биопарокс.
Сочетание местной и системной терапии приводило к более быстрому купированию клинических проявлений фарингомикоза у детей с онкогематологической патологией. Таким образом, у пациентов с выраженным иммунодефицитом эффективность лечения при сочетании системной противогрибковой терапии с местным использованием Биопарокса выше, чем использование только системных препаратов.
Проведенные нами клинико-лабораторные исследования показали широкую распространенность грибкового поражения ЛОР-органов в детской практике. Рост заболеваемости микозами обусловлен иммунодефицитными состояниями, приводящими к снижению антифунгальной резистентности организма. В большинстве случаев при отсутствии первичного иммунодефицитного состояния встречаются легкие формы грибкового поражения слизистых оболочек, вызванные Candida albicans. Лечение неосложненных форм фарингомикоза, благодаря антибактериальным и фунгистатическим свойствам фузафунгина, оказалось высокоэффективным (в 80% случаев наступило выздоровление). Применение Биопарокса в послеоперационном периоде при лечении хронического тонзиллита, аденоидита значительно уменьшает проявления болевого и гипертермического синдромов, позволяет снизить частоту назначения системных антибактериальных препаратов. Совместное применение Биопарокса и противогрибковых препаратов системного действия повышает эффективность лечения орофарингеальных кандидозов среднетяжелых и тяжелых форм у детей с выраженным иммунодефицитом (онкогематологическая патология). Высокая активность Биопарокса в отношении C. аlbicans и других штаммов Candida spp. позволяет рекомендовать его для широкого использования в детской оториноларингологической практике.
ЛИТЕРАТУРА
1. Лопатин А.С., ВарвянскаяА.В. Противовоспалительные свойства фузафунгина. Вестн. оториноларингологии. 2010; 2: 51-54.
2. Leclerg R, Auzou R. J. Chemotherapy, 2005; 17 (suppl. 3): 210.
3. Кунельская В.Я. Микозы в оториноларингологии. М.: Медицина, 1989.
4. Акулич И.И., Лопатин А.С. Грибковые заболевания глотки. Леч. врач; 2003; 8: 17.
5. Odds F. Candida and candidiasis. 2nd Ed. London: Baillire Tindall, 1988.
6. Akpan A, Morgan R. Oral candidiasis. Postgrad. Med. J. 2002; 78: 455-459.
7. Лопатин А.С., Овчинников А.Ю. Орофарингеальный кандидоз в практике врача-отоларинголога. Вестн. отоларингологии. 2010; 6: 26-30.
8. Карпова Е.П., Тулупов ДА. Хронический аденоидит у детей. Пособие для врачей. М.: РМАПО, 2009.
9. Brook I, Shah K. Bacteriology of adenoids and tonsils in children with recurrent adenotonsillitis. Ann. Otol. Rhinol. Laryngol. 2001; 110 (9): 844-848.
10. Jokien K, et al. Mycotic flora in tonsils and adenoids. Laryngoscope. 1976; 90 (10): 945-952.
11. Дайняк Л.Б., Кунельская В.Я., Касимов К.К. Микозы глотки. Ташкент: Медицина, 1985: 95 с.
12. Дядченко О.П. Клинико-антропометрическая характеристика и лечебная тактика при хроническом аденоидите и гипертрофии глоточной миндалины у детей: Автореф. дисс... канд. мед. наук. Киев, 1988.
13. Козлов В.С., Шиленкова В.В., Карпов ВА. Аденоиды: консервативное и хирургическое лечение. М.: Полиграфист и издатель, 2009: 172 с.
14. Alkiweicz JA. Uber candidose der Rachenmandeln bei Kinderen. Mycosen. 1975; 18 (51): 17-24.
