Применение препарата Ксефокам для профилактики послеоперационной боли
Статьи| Предупреждение! Препарат рецептурного отпуска! Использовать только после назначения врача! |
Авторы: Экстрем А.В., Попов А.С.
Издание: Волгоградская медицинская академия, кафедра анестезиологии и реаниматологии
Актуальность проблемы
Актуальность данного вопроса красноречиво обозначена в названии статьи Harmer M. (1991) "Постоперационное обезболивание - пора вытащить голову из песка", поскольку существующие методы интенсивной терапии и профилактики послеоперационной боли не отвечают современным требованиям к анестезиолого-реанимационному обеспечению хирургических вмешательств и послеоперационного периода. (Осипова Н.А., 2001; Лебедева Р.Н., Никода В.В., 1999; Овечкин А.М., и др., 2001).
Несмотря на широкий выбор методик медикаментозного и немедикаментозного обезболивания, 33-75% пациентов жалуются на среднюю и сильную боль в операционной ране сразу после пробуждения при использовании общей анестезии, несмотря на проводимую в послеоперационном периоде обезболивающую терапию (Ferrante F.M., VadeBoncouer T.R., 1998; Wolman R.L., Shapiro J.H., 1991). G. Smith (1991), автор статьи "Боль после операции" ("Pain after surgery"), опубликованной в журнале "British J. of Anaesthesia" в разделе "от редакции", раскрывая состояние проблемы обезболивания в послеоперационном периоде, указывал, что "... в большинстве клиник Великобритании послеоперационное обезболивание проводится неадекватно". Несколько раньше, Mak Jennes (1976) назвал проблему послеоперационного обезболивания "сильным дефектом, мучительным позором в здравоохранения Англии". В Германии, по мнению E. Lonen (1991), "проблема обезболивания до сих пор решалась неудовлетворительно". По данным Cohen F.L. 75 % больных в послеоперационном периоде не получают адекватного обезболивания и, соответственно, страдают от боли.
Kehlet H. (1988, 2001) приводит целый ряд причин неадекватного послеоперационного обезболивания, среди которых наиболее распространенная - применение наркотического аналгетика в недостаточной дозировке, вследствие боязни развития привыкания или других побочных эффектов (воздействий на дыхательную и сердечно-сосудистую системы).
С одной стороны, боль, являясь маркером неблагополучия в организме, сообщает о внешних или внутренних повреждающих факторах, приводя к активации стресс-реализующих и стресс-лимитирующих систем, направленных на устранение или уменьшение реализации действия болевого фактора (Меерсон Ф.З., 1988).
С другой стороны, чрезмерный защитный рефлекс сам способен приводить к регуляционной дезадаптации и при относительно продолжительном воздействии, по образному выражению Дюпюитрена, "боль, как и кровотечение, убивает человека".
Практика показывает наличие двух крайностей в неадекватном послеоперационном обезболивании:
Передозировка наркотических аналгетиков. Для интенсивной терапии послеоперационной боли в большинстве случаев традиционно используют опиоидные аналгетики (Эпштейн С.А., Николаев И.В., 1999). Однако побочные эффекты и особенности действия опиоидов, такие как: неуправляемость анальгетического эффекта, малая терапевтическая широта, частое угнетение дыхания при сохранении болевой чувствительности снижают уровень безопасности больного, особенно в первые сутки после оперативного вмешательства.
Недостаточная послеоперационная аналгезия. Приводит к развитию органных и системных нарушений в организме.
Усиливается нагрузка практически на все жизненно важные системы организма. Напряжение функций этих систем, прежде всего кровообращения и дыхания, проявляется повышением давления, тахикардией, нарушением ритма сердца, учащением дыхания и т.д. К клиническим проявлениям дискомфорта, обусловленного болью в раннем послеоперационном периоде, относятся: снижение двигательной активности, неспособность пациента откашливать мокроту и глубоко дышать, "вынужденное" положение, депрессивное состояние (Никода В.В., 2001). Известно, что после полостных операций, у пациентов с неадекватным обезболиванием в ближайшем послеоперационном периоде отмечаются нарушения функции внешнего дыхания: снижается жизненная емкость легких (ЖЕЛ) на 50-75%, функциональная остаточная емкость легких (ФОЕЛ). Spence A.A., Smith G. (1971) выявили различия вентиляционно-перфузионных отношений и альвеолярно-артериального градиента по O 2 у больных при эффективном и неэффективном обезболивании. Снижение ФОЕЛ до 60% от исходной величины увеличивает количество осложнений в системе дыхания. Кроме того, снижение ФОЕЛ до 40% от исходной величины повышает риск легочных осложнений (Никода В.В. 1999).
На системном уровне развиваются стрессорные повреждения как результат гиперактивации стресс-реализующих систем. Природа стрессорных повреждений на клеточном уровне описана достаточно полно (Меерсон Ф.З., 1984). При стрессорных ситуациях возбуждение высших вегетативных центров детерминирующих стрессорную реакцию, составляет I звено процесса и приводит к многократному увеличению действующей концентрации катехоламинов. Второе звено - активация внутриклеточной аденилатциклазы (II звено). Это влечет за собой три наиболее существенных изменения, составляющих ключевое (III) звено процесса: увеличение вхождения в клетки Ca ++; мобилизацию и уменьшение резерва гликогена; реализацию липидной триады, которая слагается из:
Липидная триада составляет основу повреждения лизосомальных мембран, в результате которого из лизосом освобождаются протеолитические ферменты (IV звено). В результате действия лизосомальных ферментов и нарушений в системе гликолиза развиваются повреждения мембран сарколеммы, саркоплазматического ретикулума, ответственных за перенос Ca ++, и возникает избыток этого катиона в саркоплазме (V звено). Это важное изменение имеет два следствия.
Одновременно, под влиянием свободно-радикальных продуктов ПОЛ, возникают разрывы в молекулах ядерной ДНК, которые в большинстве ядер устраняются посредством репарации, в немногих приводят к разрушению ДНК и гибели клеток. Клиническая симптоматика стрессорного повреждения, таким образом, носит обобщенный характер и принимает черты различной степени полиорганной недостаточности. Наконец, неэффективное обезболивание в ближайшие сутки послеоперационного периода, возможно, служит одной из причин формирования впоследствии хронической боли, которая может сохраняться у пациентов в течение длительного времени. (Никода В.В., 2001).
С профессиональной точки зрения, с учетом принципов биоэтики (Седова Н.Н, Петров В.И., 2001), неадекватная послеоперационная аналгезия является определяющей для квалификационной оценки анестезиолога.
В большинстве случаев для профилактики и интенсивной терапии послеоперационной боли в настоящее время используют опиоидные аналгетики (Эпштейн С.А., Николаев И.В., 1999). Хорошо известны побочные эффекты и особенности действия опиоидов:
Кроме того, использование традиционных схем послеоперационного обезболивания, имеющих основным компонентом препараты, воздействующие непосредственно на опиатные рецепторы, не всегда приводит на практике к достижению достоверного антиноцицептивного эффекта у больных, находящихся под остаточным действием общих анестетиков и миорелаксантов. Так, после обширных внутриполостных хирургических вмешательств для достижения адекватного обезболивания у каждого третьего больного требуется введение опиоидов в дозах, превышающих стандартно рекомендуемые (Лебедева Р.Н., Никода В.В., 1998). Это заставляют искать новые пути и методы профилактики боли (Осипова Н.А., 2001; Лебедева Р.Н., Никода В.В., 1998 - 2000).
Основные пути оптимизации послеоперационного обезболивания представляются двумя взаимообусловленными направлениями:
Профилактика послеоперационной боли обоснована физиологическими механизмами боли. Вторичность послеоперационной анальгезии по отношению к развившемуся болевому синдрому, является основным недостатком традиционных методов послеоперационного обезболивания, поскольку в основе послеоперационной боли лежат пластические изменения функциональной активности ноцицептивной системы (Осипова Н.А, Береснев В.А.,. Петрова В.В, 2001). В связи с этим, значительный интерес представляет клиническая реализация концепции предупреждающей анальгезии, сформировавшаяся на протяжении последнего десятилетия (Woolf, Chong, 1993), результатом которой является предотвращение развития послеоперационного болевого синдрома или максимальное снижение его интенсивности. Основное условие - лечебные мероприятия должны быть начаты до начала хирургического вмешательства.
Для решения этих задач в последние годы большое внимание уделяется использованию в комплексе упреждающей анальгезии нестероидных противовоспалительных средств (НПВС), которые, в отличие от опиоидов, воздействуют непосредственно на периферический химический компонент боли (Осипова Н.А., 2001). При этом не угнетается сознание, гемодинамика и функция внешнего дыхания, стабилизируются вегетативные реакции (Петров В.И., Вознесенский А.Г., 1999., Осипова Н.А., 1994-2001; Никода В.В., Лебедева Р.Н., 1996-2001; Г. Хоббс, 1998; Bugge J.F., 1995; Wielbalck C.A., 1995; и др.).
Возрождение интереса к препаратам данной группы объясняется расширением представлений о механизмах их воздействия на острую боль. Известно, что тканевая травма сопровождается высвобождением простагландинов (циклооксигеназный путь) симпатическими постганглионарными нейронами, а также субстанции Р и ряда других алгогенных пептидов окончаниями первичных афферентных нейронов. Результатом их действия является сенситизация периферических ноцицепторов со снижением болевых порогов и развитием первичной гиперальгезии в зоне повреждения (McCormack, Brune, 1991). Для развития первичной гиперальгезии необходимо, чтобы первичные импульсы из зоны травмы достигли задних рогов спинного мозга, и если гиперальгезия уже развилась, она "не нуждается в поддержке" импульсами из поврежденных тканей (Torebjork et al,1992).
Вторичная гиперальгезия, развивающаяся в интактных околораневых тканях, в свою очередь, является результатом центральной сенситизации нейронов задних рогов спинного мозга (ЗРСМ) с активацией М-метил-О-аспартат (NMDA) рецепторов ВАКергической системы, возникновением феномена "взвинчивания" активности ноцицептивных нейронов ЗРСМ и расширением рецепторных полей. (Петров В.И., с соавт., 1997., Вознесенский А.Г., 1999, Овечкин А.М., с соавт., 1999).
Клинический эффект НПВС, в первую очередь, обусловлен подавлением синтеза простагландинов путем неселективного ингибирования активности циклооксигеназы -1 и -2 (ЦОГ-1, ЦОГ-2) (Насонова В. А. и соавт., 1996; Вознесенский А.Г., 1999; Страчунский Л.С., 2000). За последние годы появились данные, в соответствии с которыми лечебный эффект НПВС обусловлен не только их обратимым ингибирующим воздействием на периферический синтез простагландинов через систему ЦОГ-1, ЦОГ-2, т. е. торможением периферической гиперальгезии (McCormack, Brune 1991), но и их опосредованным стимулирующим влиянием на продукцию эндогенных регулирующих пептидов ВАКергической системы, обладающих анальгетическим влиянием (эндорфины и энкефалины) и уменьшающих выраженность воспаления (Петров В.И., Пиотровский Л.Б., Григорьев И.А. 1997). В частности, было показано, что НПВС угнетают таламический ответ на ноцицептивную стимуляцию, препятствуют повышению концентрации простагландинов в спинномозговой жидкости в ответ на активацию NMDA-рецепторов ВАКергической системы, тормозят развитие вторичной гиперальгезии (McCormack, 1994, Овечкин А.М., с соавт., 1999, 2001). С учетом механизма действия (ингибирование химической компоненты боли, упреждающее воздействие на развитие патологической боли) назначение НПВС рекомендуется ВОЗ в качестве "первого шага" послеоперационного обезболивания (Rummans, 1994).
Однако ряд отрицательных свойств НПВС предыдущих генераций, вкючающие НПВС - гастропатии, обусловленные ингибированием ЦОГ-1, медленное развитие анальгетического эффекта, отсутствие удобной лекарственной формы для использования в критической медицине, токсичность, значительно ограничивали применение НПВС в анестезиологии и интенсивной терапии для упреждающей аналгезии (Хоббс Г., 1998). По современным представлениям (Насонов Е.Л., 1999, 2000), идеальный для критической медицины НПВС должен соответствовать следующим критериям:
В этой связи, для профилактики послеоперационной боли, представляется перспективным применение нового мощного нестероидного противовоспалительного препарата "КСЕФОКАМ" (лорноксикам). Препарат: не угнетает синтез простагландинов здоровых тканей; имеет лекарственную форму для внутривенного введения; короткий период полураспада. (Лебедева Р.Н., Никода В.В., 1998; Galbrain W.G. et al., 1990; Staunstrup H. et al., 1999).
"КСЕФОКАМ" оказывает:
При внутривенном введении препарат:
Исходя из вышесказанного, представляется перспективным изучение действия препарата "КСЕФОКАМ" в премедикации для профилактики послеоперационной боли, с учетом концепции "упреждающей анальгезии", с целью оптимизации ведения послеоперационного периода.
Цель исследования
Изучить эффективность применения препарата "КСЕФОКАМ" для профилактики боли в ближайшем послеоперационном периоде.
Материалы и методы исследования
Исследования проводились у пациенток в возрасте 45-55 лет, без сопутствующих заболеваний, оперированных в плановом порядке по поводу симптомной миомы матки в объеме ампутации матки. Выбор мотивирован желанием добиться максимальной функциональной однородности групп. Испытуемые были рандомизированы на две группы по условиям эксперимента с различиями в премедикации:
1 группа - группа контроля [37 пациенток]: традиционная схема премедикации с использованием атропина, димедрола. 2 группа - группа сравнения (группа "Ксефокам") [36 пациенток]: традиционная схема премедикации с использованием атропина, димедрола и Ксефокама.
Методика общего обезболивания в группах идентична (для исключения дополнительных факторов влияния):
Методы исследования:
- Визуально-аналоговая шкала субъективной оценки боли (ВАШ). На настоящее время это простая и легко применимая технология является фактически основой для исследования уровня боли, поскольку до сих пор не найдены точные физиологические корреляты боли.
- Визуально-аналоговая дискретная шкала утомляемости (ВАДШУ). Шкала разработана в НИИ им. Павлова (Лебедев В.П. и др. 2000) и позволяет оперативно определять психическую и физическую утомляемость, высоко коррелируя с громоздкими традиционными тестами (САН, Люшера, Спилбергера-Ханина). В итоге получается интегративный показатель, выраженный в баллах.
- Статистические показатели по данным карт стационарного больного:
Обследование пациентов с помощью ВАШ производились через сутки для исключения фактора влияния анестетиков на когнитивные функции. Уровень утомляемости измерялся ВАДШУ через 7 суток после оперативного вмешательства с целью определения уровня восстановления физических кондиций. Статистические показатели регистрировались в картах стационарных больных.
В исследовании использовался препарат "КСЕФОКАМ" производства фирмы NYKOMED. Препарат применялся внутривенно болюсно в премедикации за 10 мин до индукции в общую анестезию и начала оперативного вмешательства.
Дозирование препарата производилось по рекомендации фирмы производителя и из работ Никода В.В. (2001). Препарат назначался в дозировках 8-16-24 мг. Удельная доза препарата составила от 0,072 до 0,293 мг/кг реального веса больного. Эффективность дозировки определялась исходя из показателей ВАШ.
Результаты и обсуждение
Основные данные, полученные при исследовании, представлены в таблице.
|   | ВАШ баллы | ВПТ минуты | ДвПС ml | СДО ml | ВПС часы | К/д сутки | ВАДШУ баллы |
| Группа контроля | 4,58±2,28 | 68,75±48,7 | 4,72±0,81 | 8,86±0,69 | 83,28±28,03 | 12,8±2,05 | 5,87 |
| "Ксефокам" | 0,25±1,05* | 328±98,97* | 2,57±0,95* | 7,74±0,25* | 39,34±11,99* | 11,03±2,47* | 3,86* |
| Сила влияния фактора "Ксефокам" | 61% | 75% | 63% | 18% | 51% | 13% | 34% |
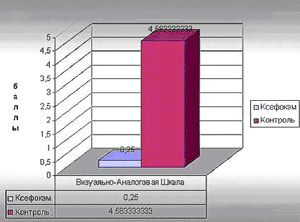
Как следует из таблицы, в контрольной группе выраженность болевого синдрома сразу после восстановления сознания, определяемого с помощью визуально-аналоговой шкалы (ВАШ), составила в среднем 4,58±2,28 балла. Причем, 83,6% больных имели по шкале ВАШ больше 3 баллов, что отражало неудовлетворительное качество послеоперационной аналгезии и требовало немедленного назначения аналгетика. Полученные данные подтверждают ранее проведенные исследования (Осипова Н.А., 2001; Лебедева Р.Н., Никода В.В., 1999, Ferrante F.M., VadeBoncouer T.R., 1998; Wolman R.L., Shapiro J.H., 1991, Smith G., 1991, MakJennes 1976, Lonen E. 1991 и др.) выраженный болевой синдром в которых определялся от 35 до 91% случаев. Из этого можно сделать простой вывод, что больные, просыпаясь, ощущают в большинстве случаев выраженную боль, вызывающую дискомфортное состояние и негативную оценку ситуации. С медицинской точки зрения подобная ситуация может вызвать ухудшение функционирования различных систем, о чём сказано выше.
В то же время выраженность болевого синдрома, сразу после восстановления сознания, определенная с помощью визуально-аналоговой шкалы (ВАШ) в группе "Ксефокама" составила в среднем 0,25±1,05 балла (P меньше 0,05), что достоверно ниже, чем в контрольной группе. Из 37 пациентов группы "Ксефокама" только 2 пациента ощущали интенсивные боли, требующие назначения аналгетика. Это составило 5,4% от общего количества пациентов. При анализе дозирования препарата выяснилось, что в данных случаях имела место неадекватность применённой дозы Ксефокама (см. ниже).
Достоверность различий между показателями ВАШ в группах подтверждена статистическими методами. Подтверждена достоверность влияния фактора "Ксефокам" дисперсионным однофакторным анализом с применением Fi-критерия (Фишера) на показатели ВАШ. Сила влияния фактора "Ксефокам", вычисленная методом Снедекора, на показатели ВАШ составила 61%. Этот показатель превышает 50% порог, выше которого сила влияния оценивается как "высокая".
Время первого требования аналгетика в контрольной группе, являющееся косвенным признаком выраженности болевого синдрома, составило 68,75±48,7 мин. У пациентов с показателями ВАШ выше 3 баллов ВПТ составило 53,79±30,55 мин. Показатели ВАШ и ВПТ в данной подгруппе имели высокую степень обратной корреляции (-0,9109). То есть, чем выраженнее был болевой синдром, тем быстрее применялся наркотический аналгетик. Сокращение времени первого требования на фоне постнаркозной депрессии, по данным анонимного опроса анестезиологов и хирургов, значительно увеличивает частоту осложнений в виде угнетения дыхания, развития вторичного сна. Причем, развитие осложнений, по данным того же анонимного опроса, не документируются в большинстве случаев.
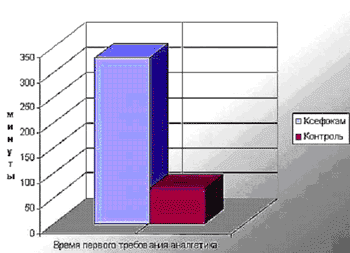
Время первого требования аналгетика в группе "Ксефокам" составило 328±98,97 мин и достоверно превысило ВПТ в контроле (P меньше 0,05). Это более чем в 5 раз превышает время первого требования в контрольной группе. Сила влияния фактора Ксефокам на данный показатель по данным однофакторного дисперсионного анализа наиболее высока (75 %). Подобное оптимизирующее действие "Ксефокама" весьма выгодно в плане безопасности больных, поскольку снижает риск сочетания остаточного постнаркозного действия и наркотических аналгетиков для послеоперационного обезболивания. Увеличение ВПТ в группе "Ксефокам" подтверждает справедливость концепции упреждающей аналгезии.
Доза опиатов, введенных в первые сутки после операции в контрольной группе, составила в среднем 4,72±0,81 мл. 2% раствора Промедола. Таким образом, в первые сутки вводилось 53% общей дозы опиатов в послеоперационном периоде, что повышает риск развития побочных эффектов и снижает уровень безопасности больных.
Доза опиатов, введенных в первые сутки после операции в группе "Ксефокам" составила 2,57±0,95 мл. 2% раствора Промедола, что достоверно меньше чем в контрольной группе (P меньше 0,05). Применением Ксефокама удалось уменьшить потребность опиатов в первые сутки на 55%. Многочисленные данные свидетельствуют о снижении дозы опиатов на 30-50% в первые сутки при использовании Ксефокама в комбинации с наркотическими аналгетиками для лечения послеоперационной боли. Таким образом, применение Ксефокама для профилактики боли в премедикации более эффективно, чем для лечения уже развившейся боли и также подтверждает правильность концепции упреждающей аналгезии.
Кроме того, количество опиатов в первые сутки в группе "Ксефокама" составило 33% от суммарной дозы опиатов в послеоперационном периоде, что достоверно меньше чем в контрольной группе (53%) (P меньше 0,05).
Сила влияния фактора "Ксефокам" по данным дисперсионного однофакторного анализа и метода Снедекора на количество опиатов в первые сутки достоверна и высока (63%).
Суммарная доза опиатов за весь послеоперационный период составила в контрольной группе 8,86±0,69 мл. 2% раствора Промедола, при длительности послеоперационного обезболивания в среднем 3 суток. В группе "Ксефокам" - 7,74±0,25 мл. 2% раствора Промедола (P меньше 0,05), что достоверно меньше, чем в контрольной группе.

Сила влияния Ксефокама на данный показатель достоверна, но весьма незначительна (18 %). С другой стороны, опиаты на 2 - 3 сутки, как правило, назначались врачами профильного отделения автоматически. Это позволяет предположить, что применение опиатов на 2 - 3 сутки превышало потребность в них.
Время нормализации моторики ЖКТ (время первого стула), отражающее восстановление адекватной вегетативной регуляции организма и уровень стресслимитации, составило в контрольной группе 83,28±28,03 часа. Отмечается корреляция с показателями ВАШ (с ростом показателей ВАШ увеличивается ВПС) и отрицательная корреляция со временем первого требования (с уменьшением ВПТ возрастает ВПС). Как правило, первый стул вызывался стимуляцией моторики ЖКТ.
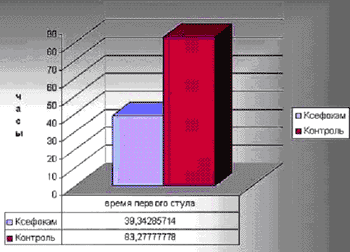
В группе "Ксефокам" время первого стула составило 39,34±11,99 часа, что достоверно меньше чем в контрольной группе (P меньше 0,05). Сила влияния Ксефокама на нормализацию моторики ЖКТ достоверно высока (51%). Также отмечается положительная корреляция ВПС с показателями ВАШ.
Важность данного показателя определяется патофизиологическими особенностями механизмов стрессорного повреждения. Первая особенность заключается во времени развития симптоматики стрессорного повреждения, поскольку симптоматика начинает манифестировать не во время оперативного вмешательства, а на 1 - 2 сутки после него. Вторая особенность - характерное место приложения стрессорного повреждения. Известно, что Ганс Селье впервые описал стрессорную реакцию как реакцию с повреждением желудочно-кишечного тракта, одним из проявлений которого является нарушение моторики ЖКТ. В настоящее время, подтверждена корреляция нарушений пассажа кишечного содержимого с развитием синдрома полиорганной недостаточности (Зильбер А.П. 1996).
Исходя из выше сказанного, ВПС является косвенным индикатором уровня стрессорного повреждения во время оперативного лечения и, соответственно, качества стрессорной защиты. Следовательно, препарат "Ксефокам" можно рассматривать не только как аналгетик, но и как препарат, обладающий выраженным стресслимитирующим и вегетостабилизирующим действием, что подтверждают данные о стимуляции эндорфинной и ВАКергической систем Ксефокамом.
Для оценки восстановления физического состояния использована шкала ВАДШУ. При этом субъективная интегративная оценка пациентами своей физической и психологической утомляемости, определявшаяся по шкале ВАДШУ на 7 сутки после оперативного вмешательства, в группе "Ксефокам" была достоверно ниже (в 1,5 раза) показателей контрольной группы. Большинство пациентов из группы Ксефокам, в отличие от пациентов контрольной группы, к 7 суткам восстанавливали физические кондиции и готовы были покинуть стационар на амбулаторное долечивание.
Продолжительность пребывания в стационаре после оперативного вмешательства в контрольной группе составило 12,8±2,05 койко-дней, в группе "Ксефокам" - 11,03±2,47 койко-дней (P меньше 0,05), что достоверно меньше, чем в контрольной группе.
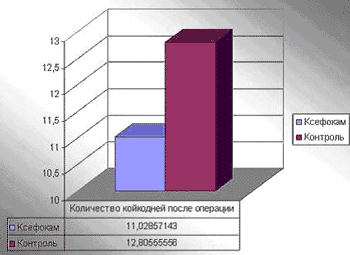
Раннее восстановление физических кондиций, функционального состояния вегетативной, антиноцицептивной систем, адекватная стресслимитация позволяли осуществлять более раннюю выписку пациентов из стационара. Однако на практике возможности более ранней выписки пациента из стационара ограничиваются необходимостью динамического наблюдения в условиях стационара (уход за раной и т.д.), что, при соответствующей организации лечебного процесса вполне осуществимо в амбулаторных условиях.
Дозирование препарата "Ксефокам". Удельная доза препарата составила от 0,072 до 0,293 мг/кг реального веса больного и эффективность дозировки определялась исходя из показателей ВАШ. Эффективные дозировки, сопровождавшиеся отсутствием болевых ощущений после пробуждения (0 баллов по ВАШ) превышали 0,08 мг/кг реального веса больного. Средняя эффективная дозировка составила 0,16-0,19 мг/кг реального веса больных. Эта дозировка принята за оптимальную и рекомендуется для применения в клинической практике.
Выводы
Рекомендуемая эффективная доза препарата "Ксефокам" для проведения профилактики боли составляет 0,2 мг/кг реального веса больного внутривенно в премедикации за 10-15 минут до индукции в наркоз. Список литературы
1. Вознесенский А. Г. Клиническая фармакология нестероидных противовоспалительных средств. Волгоград, 1999.
2. Кемпбелл С. "Анестезия, реанимация и интенсивная терапия" 2000.-264с.
3. Кемпбелл С., Верник Р. Новое в ревматологии. Боли в пояснице. //Международный журнал медицинской практики. - 2000 - N1 - с. 50 -51.
4. Кукушкин М.Л., Решетняк В.К. "Механизмы патологической боли" //РМЖ, Том 5 N 15, 1997.
5. Лебедева Р.Н., Никода В.В "Послеоперационная боль: проблема адекватной аналгезии и пути ее решения", //Анналы РНЦХ РАМН, 1999, стр. 84-90.
6. Лебедева Р.Н., Никода В.В., Маячкин Р.Б. Проблема адекватного обезболивания в послеоперационном периоде. //Анестезиология и реаниматология. - 1999. - N 5. - с. 66 - 69.
7. Лиманский Ю. П. Основные принципы функциональной организации ноцицептивных и антиноцицептивных систем мозга. //Физиол. ж., 1989, N 2, с. 110- 21.
8. Меерсон Ф.З. Адаптация, стресс и профилактика. - М: Наука, 1981. - 278с
9. Меерсон Ф.З. Стресс-лимитирующие системы организма и их роль в предупреждении ишемических повреждений сердца. //Бюл. Всесоюз. кардиол. науч. центра. - 1985. - N1. - С. 34-43.
10. Насонов Е.Л. Анальгетические эффекты нестероидных противовоспалительных препаратов при заболеваниях опорно-двигательного аппарата: баланс эффективности и безопасности //Консилиум Медикум, 2000.
11. Насонов Е.Л. Нестероидные противовоспалительные препараты. Перспективы применения в медицине. М.: Анко, 2000, 143с.
12. Насонова В.А., Клиническая оценка нестероидных противовоспалительных препаратов в конце ХХ века. //РМЖ, Том 8 N 17, 2000
13. Никода В.В. "Послеоперационная боль: применение нестероидных противовоспалительных средств". //Фармацевтический вестник. - N13 (N164).
14. Никомед Фарма. Ксефокам. Лорноксикам. Новый обезболивающий и противовоспалительный препарат. Монография по продукту. Издание компании НИКОМЕД РОССИЯ - СНГ. Июнь 1998.
15. Овечкин А. М, Гнездилов А. В, Арлазарова Н. М. и др. Предупреждающая аналгезия: реальная возможность профилактики послеоперационного болевого синдрома. //Анест. и реаниматол., - 1996, - N 4, - с. 35-39.
16. Овечкин А. М, Гнездилов А. В., Морозов Д.В. Лечение и профилактика послеоперационной боли. Мировой опыт и перспективы. М., 2000.
17. Овечкин А.М., Гнездилов А.В, Кукушкин М.Л. "Послеоперационный болевой синдром. Клиническая реализация концепции предупреждающей анальгезии". //Тезисы Российской научно-практической конференции "Патологическая боль", Новосибирск, - 1999 г.
18. Овечкин А.М., Гнездилов А.В. "Новые технологии в анестезиологии и реаниматологии". //Вестн. инт. тер; 13-8. 2000.
19. Овечкин А.М., Гнездилов А.В. Боль в Европе. Обзор материалов 2-го Конгресса Европейской ассоциации по изучению боли. //Анестезиология и реаниматология. - 1998 - N5 - с. 64 - 71.
20. Овечкин А.М., Морозов Д.В., Жарков И.П. Обезболивание и управляемая седация в послеоперационный период: реалии и возможности. //Вестник интенсивной терапии - 2001. - N4. - с. - 47-60.
21. Осипова Н. А. Антиноцицептивные компоненты общей анестезии и послеоперационной анальгезии. //Анест. и реаниматол., - 1998, - N 5, с. 11-15.
22. Осипова Н. А., Новиков Г. А., Прохоров Б. М. Адъювантные средства. Москва, Издательство "Медицина", 1998
23. Осипова Н.А, Береснев В.А., Петрова В.В.. "Мультимодальная системная фармакотерапия послеоперационного болевого синдрома". //Consilium-Medicum, - Том 3, - N 9/2001.
24. Осипова Н.А. Механизмы развития и принципы лечения острых и хронических болевых синдромов. //Материалы I съезда анестезиологов Юга России. Ростов-на-Дону, 2001.
25. Осипова Н.А., Петрова В.В., Береснев В.А., Ветшева М.С. Ненаркотические медикаментозные средства и методы послеоперационного обезболивания - М.: МЗ РФ, - 1998. - 24 с.
26. Петров В.И. Сравнительная оценка стресс-протекторного действия первых аналогов медиаторных аминокислот, обладающих ноотропной активностью. в сб. Актуальные вопросы медицины. - Волгоград, 1994. - С. 78-80.
27. Петров В.И., Пиотровский Л.Б., Григорьев И.А. Возбуждающие аминокислоты. Волгоград, 1997. -167 с.
28. Седова Н.Н., Петров В.И. "Биоэтика". Волгоград, 2001.
29. Страчунский Л.С., 2000. Нестероидные противовоспалительные средства. Минск, 2000.
30. Ферранте Ф. Майкл. Нестероидные противовоспалительные препараты. Москва, Издательство "Медицина", 1998.
31. Ферранте Ф. Майкл., Катц Натаниэль. Послеоперационная боль, М., Издательство "Медицина", 1998.
32. Хоббс Г. Парентеральные нестероидные противовспалительные препараты //Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций. Архангельск-Тромсё. 1998. с. 169-174.
33. Эпштейн С.Л., Николаев И.В. Нестероидный противовоспалительный препарат кетанов в послеоперационный период - разумная альтернатива опиоидам. //Вестник интенсивной терапии. - 1999 - N4 - с. 51-53.
34. Bonica J.J. The management of Pain. 2nd Edition. Vol.1. Philadelphia. London, 1990. -958P.
35. Bonica J.J., Foreword. In Pain Management in Emergency Medicine. Paris PM, Steward RD. (Eds). Norwalk, CT, Appeleton and Lange. 1988;12.
36. Harmer M. Postoperative pain relief - time to take our heads out of the sand? //Anaestesia.-1991/-V.46(3). - P.167-168.
37. Kehlet H. Effect of pain relief on the surgical stress response. //Reg Anesth ,21(6S): 35-37,1996
38. Kehlet Н. Postoperative pain relief. //Regional Anaesth.1994. V.19. P.369-377.
39. Kehlet Н., Dahl J.B. Postoperative pain. //World J.Surg.1993. V.17. P.215-219.
40. Lornoxicam. A novel analgetic and anti-inflammatory agent. Product monograph. Adis Int Lim.1996.
41. McCormack K, Brune K. Dissociation between the antinociceptive and antiinflammatory effects of the nonsteroidal antinfammatory drugs. //Drugs.- 1991.- V.41.- P.533-547.
42. McCormack K. Nonsteroidal antiinflammatory drugs and spinal nociceptive processing. //Pain. -1994. -V.59.- P.9-43.
43. McCormack K. Novel aspects of pain management, Opioids and beyond. J. Sawynok, A. Cowan (eds.). New York: John Wiley and Sons Inc. 1997.
44. Rummans Т. Nonopioids agents for treatment of acute and subacute pain. //Mayo Clinic Proceed. -1994.- V.69. - P.481-490.
45. Torebjork H.E., Lundberg L.E., LaMotte R.H. Central changes in processing of mechanoreceptor input in capsaicininduced sensory hyperalgesia in humans. //J.Physiol.(Lond.) - 1992.-V.448.- P.765
46. Woolf C.J. and Chong M.S. Preemptive analgesia treating postoperative pain by preventing the establishment of central sensitization. //Anesth. Analg.- 1993. - V.77.-P.18.
