Пробиотики в профилактике антибиотик-ассоциированных диарей у детей
Статьи Опубликовано в журнале:ПРАКТИЧЕСКАЯ МЕДИЦИНА. 7 (39) ноябрь 2009 г. И.Н. Захарова, Э.Б. Мумладзе, В.И. Свинцицкая, В.В. Кучерова, Ю.А. Дмитриева
Российская медицинская академия последипломного образования, г. Москва
Тушинская детская городская больница, г. Москва
Ежегодно, согласно данным ВОЗ, регистрируется 1 -1,2 млрд. заболеваний, сопровождающихся диареей, в год, а 5 000 000 случаев заканчивается летальным исходом. В России ежегодно заболевают диареей 500 000 детей (схема 1). Одной из частых причин развития диареи является применение антибиотиков (АБ), часто назначаемых в амбулаторных условиях. Для антибиотик-ассоциированной диареи (ААД), согласно определению ВОЗ, характерно учащение стула (более 3 раз в сутки), возникшее на фоне антибиотикотерапии или в течение 2 месяцев после ее окончания, сопровождающееся увеличением объема, изменением консистенции, появлением патологических примесей в виде слизи, зелени и крови. По данным различных авторов, ААД развивается у 5-30% лиц, получающих антибиотики [1]. Точных данных о частоте ААД у детей нет, поскольку чаще всего в этом случае педиатры диагностируют антибиотик-ассоциированный дисбактериоз кишечника (схема 2). ААД может иметь легкое течение, а отмена антибиотика приводит к купированию симптомов. Однако существуют тяжелые формы ААД, называемые псевдомембранозным колитом (ПМК). ПМК - острое, тяжелое заболевание толстой кишки, связанное с применением анти-биотиков и/или с хирургическим вмешательством на кишечнике, характеризующееся образованием на слизистой оболочке округлых фибринозных бляшек, сливающихся между собой, на фоне воспалительно-геморрагических изменений.
Схема 1. Этиологическая структура диарей (ВОЗ)
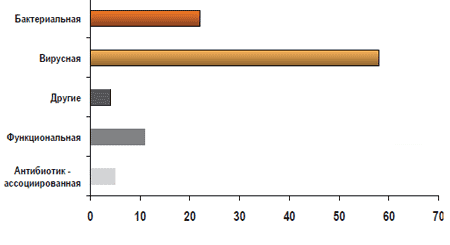
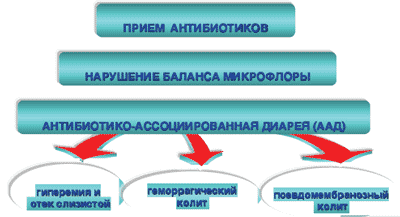
Схема 2. Антибиотико-ассоциированная диарея
Практически все антибиотики, особенно активные в отношении анаэробов, способны вызывать ААД. Риск ААД возрастает при применении клиндамицина, линкомицина, аминопенициллинов, цефалоспоринов II и III поколения. По данным L. McFarland (1993), ААД встречается в 5-10% случаев при применении ампициллина, в 10-25% - цефалоспоринов II поколения, и лишь в 2-5% случаев при использовании других антибиотиков, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин) [2].
ААД этиологически может быть связана c воздействием различных микробов: Clostridium difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureu, а также грибов рода Candida. Однако наиболее тяжелые формы ААД и псевдомембранозного колита обусловлены Clostridium difficile.
К факторам риска развития псевдомембранозного колита, обусловленного Clostridium difficile, относятся [3]:
- группа антибиотика, путь его выведения (чаще препараты, выводящиеся желчью, - цефтриаксон), длительность лечения, повторные курсы, комбинированная терапия;
- возраст больных (до 5 лет и старше 60 лет частота обнаружения Clostridium difficile увеличивается);
- длительная госпитализация больного (прямо пропорциональна частоте колонизации Clostridium difficile), пребывание в одной палате с больным, имеющим манифестную форму инфекции;
- наличие тяжелых сопутствующих заболеваний (патология ЖКТ, иммунодефицитные состояния, почечная недостаточность, онкология);
- проводимые медицинские манипуляции (операции, инвазивные процедуры).
Clostridium difficile - грамположительный анаэроб, обнаружен впервые в 1935 г. Hall и O'Tolle в кале новорожденных. В 1977 г. доказана роль Clostridium difficile в развитии ААД [4]. Известно, что токсигенные штаммы Clostridium difficile продуцируют 2 вида экзотоксина. У токсина А менее выражено цитотоксическое действие [5]. Токсин В (цитотоксин) оказывает летальное действие, значительно превосходящее действие токсина А. Так как эпителиальные клетки кишечника не содержат рецепторов к токсину В, он может действовать после повреждения эпителия токсином А или других факторов. За счет действия токсина А нарушается проницаемость эпителиального слоя, что создает условия для проникновения токсина В в слизистую оболочку. Оба токсина, обладая синергичным действием, вызывают воспалительную реакцию в слизистой толстой кишки посредством активации выработки и секреции моноцитами цитокинов с секрецией экссудата, содержащего большое количество белка, нейтрофилов, моноцитов и слущенных энтероцитов. Кроме того, токсин А увеличивает проницаемость энтероцитов для других микроорганизмов (протей, сальмонелла, эшерихии), что значительно облегчает микробную транслокацию.
В патогенезе ААД, обусловленной Clostridium difficile, имеют значение следующие механизмы развития диареи:
- секреторный (воздействие энтеротоксина и желчных кислот);
- осмотический (нарушение обмена углеводов);
- экссудативный (воспалительная экссудация в просвет кишечника).
В клинической картине ААД обращает на себя внимание появление водянистой диареи, схваткообразных болей в животе, уменьшающихся после стула, в ряде случаев - повышение температуры, лейкоцитоз в крови, появление лейкоцитов в кале. Возможно развитие эксикоза с гипопротеинемией и вторичной экссудативной энтеропатией. Может быть холероподобный вариант с летальным исходом.
Основным фактором в развитии ААД является нарушение состава микрофлоры кишечника, что приводит к снижению его колонизационной резистентности. Использование пробиотиков, колонизирующих кишечную стенку и ограничивающих избыточный рост патогенных бактерий, является одним из перспективных методов профилактики и лечения ААД, благодаря их влиянию на организм человека (схема 4).
Схема 4. Влияние пробиотиков на организм человека

Профилактический и лечебный механизм действия пробиотиков сводится к следующему:
- продукция антимикробных субстанций (бактериоцинов, лизоцима, проглютамата, пероксида) и конкурентное взаимодействие с патогенными и условно-патогенными микроорганизмами;
- синтез цитопротективных веществ (аргинин, глютамин, полиамины);
- снижение рН толстокишечного содержимого;
- стимуляция иммунного ответа (синтез sIgA, IgG, gjdsitybt синтеза цитокинов (IL-4, IL-10), усиление фагоцитоза);
- стимуляция секреции муцина;
- подавление эпителиальной адгезии и транслокации патогенов;
- стимуляция апоптоза.
Конкуренция пробиотиков за рецепторы слизистой не только уменьшает адгезию, но и рост энтеротоксичных грамотрицательных анаэробов. В настоящее время опубликованы результаты мета-анализа, основанного на 6 рандомизированных исследованиях, посвященного применению пробиотиков для профилактики и лечения диареи, вызванной антибиотиками. В мета-анализ включено 766 пациентов (376 в основной группе и 390 в контрольной группе). Большинство исследований подтвердило укорочение продолжительности диареи при применении пробиотиков примерно на 1 сутки. Наиболее эффективными оказались по мере убывания: Lactobacillus rhamnosus (LGG), Saccharomyces boulardii, B.lactis, Streptococcus thermophilus.
Целью нашей работы явилось изучение эффективности препарата "Йогулакт" для профилактики и лечения ААД у детей, получавших антибиотикотерапию. "Йогулакт" в капсулах представляет собой биологически активную добавку к пище, являющуюся дополнительным источником пробиотических микроорганизмов. К преимуществам "Йогулакта" как пробиотика относятся возможность применения у детей, начиная с 3-месячного возраста, а также удобство применения - всего один раз в день (таблица 1).
Таблица 1. Состав "Йогулакта" в капсулах (2x109 КОЕ/капсула)
| Ингредиенты | В каждой капсуле (мг) |
| Lactobacillus acidophilus | 9,00 |
| Lactobacillus rhamnosus | 5,00 |
| Культура йогурта (Streptococcus thermophilus, Lactobacillus delbrueckii (bulgaricus) | 20,00 |
Входящие в состав "Йогулакта" лактобактерии поддерживают и регулируют равновесие кишечной микрофлоры. Препарат устойчив ко многим антибиотическим средствам, поэтому с профилактической целью оправдано его применение во время антибиотикотерапии.
Оценка клинической и лабораторной эффективности "Йогулакта" проводилась по единому протоколу с информированным согласием родителей. На каждого больного была составлена индивидуальная карта. Всем детям проводилось исследование клинического анализа крови, мочи на 1 и 34 день исследования и бактериологическое исследование кала на 1, 34, 48 день исследования.
Нами обследовано 30 детей в возрасте от 3 месяцев до 8 лет, из них 9 мальчиков (30%) и 21 девочка (70%). 17 детям проведено 3-кратное микробиологическое исследование кала, 10 детям - 2-кратное исследование, 3 детям - однократное (родители отказались от повторных обследований по причине, не касающейся приема препарата). Все больные наблюдались в условиях Тушинской городской детской больницы г. Москвы. Исследование проводилось в период с апреля по декабрь 2008 г. Среди обследованных дети до года составили 46,7% (14 детей), от 1 года до 7 лет - 50% (15 детей), 3,3% (1 ребенок) составили дети старше 7 лет. В исследование вошли дети, получавшие антибиотикотерапию по поводу инфекции мочевой системы, пиелонефрита, осложненного течения ОРВИ, ОРВИ у детей с нефротической формой гломерулонефрита.
Большая часть исследуемых детей (63,3% - 19 детей) получали "Йогулакт" на фоне антибиотикотерапии во время исследования (пенициллины, цефалоспорины 1,2 поколения, макролиды). Около трети больных (36,7% - 11 детей) получали "Йогулакт" с целью профилактики ААД через 1-2 недели окончания антибиотикотерапии (таблица 2).
Таблица 2. Частота применения различных антибиотиков у исследуемых больных
| Характеристика антибиотиков | Пробиотики во время антибиотикотерапии | Пробиотики после окончания антибиотикотерапии | ||
| Абс. число | % | Абс.ч. | % | |
| Пенициллины в/м | 2 | 10,5% | - | - |
| Ко-амоксикав внутрь | 4 | 21,0% | 4 | 36,4% |
| Цефалоспорины в/м (цефазолин, цефабол, цефтриаксон) | 10 | 52,6% | 6 | 54,5% |
| Супракс внутрь | 1 | 5,3% | 1 | 9,1% |
| Макролиды | 2 | 10,5% | - | - |
| Уросептики (фурагин) | 11 | 36,7% | - | - |
До поступления в стационар дети не получали пробиотики. До начала терапии "Йогулактом", на фоне проводимой антибиотикотерапии все больные имели функциональные нарушения со стороны ЖКТ, связанные с дисбактериозом кишечника. На фоне применения "Йогулакта" уже на 4 день терапии отмечена существенная положительная динамика клинических симптомов функциональных нарушений со стороны ЖКТ, а к 19 дню лечения отмечено полное отсутствие жалоб у 100% пациентов (рисунок 4).
Анализируя характеристику стула обследованных детей до назначения "Йогулакта", нами выявлено у 3 детей (10%) наличие плотного "овечьего" стула, "замазкообразного" - у 5 больных (16,6%), кашицеобразного, непереваренного - у 10 детей (33,3%), разжиженного, с примесью слизи - у 1 ребенка (3,3%). Через месяц после начала приема "Йогулакта" у всех детей стул нормализовался, что позволяет считать "Йогулакт" высокоэффективным средством профилактики и лечения ААД у детей.
У всех пациентов до и после назначения "Йогулакта" осуществлялось бактериологическое исследование микрофлоры кишечника. Все включенные в исследование пациенты были распределены на группы в зависимости от степени тяжести дисбактериоза кишечника (таблица 3). Распределение по степеням тяжести проводилось в соответствии с классификацией, предложенной профессором К. Ладодо в 1991 г. и дополненной П. Щербаковым в 1998 г.
Таблица 3. Распределение дисбактериоза по степени тяжести
| Степень | До лечения | На 34 день исследования | На 48 день исследования | |||
| n* | % | n* | % | n* | % | |
| Общее число пациентов | 30 | 100% | 27 | 100% | 17 | 100% |
| I | - | - | - | - | - | - |
| II | 10 | 33,3 | 19 | 70,4 | 1 | 5,9 |
| III | 11 | 36,7 | - | - | - | - |
| IV | 9 | 30 | 2 | 7,4 | 2 | 11,8 |
| N показатели | - | - | 6 | 22,2 | 14 | 82,3 |
Полученные данные свидетельствуют о полной нормализации кишечной микрофлоры у 6 детей (22,2%) на 34 день исследования и у 14 детей (82,3%) на 48 день от начала терапии. Улучшение показателей микрофлоры кишечника было выявлено у 17 детей из 27 обследованных (63%) на 34 день исследования: у 7 детей (26%) отмечался переход из IV во II степень дисбактериоза, у 10 детей (37 %) - из III во II степень.
Только у 2 детей (7,4%) на 34 день и у 1 ребенка (5,8%) на 48 день исследования сохранялась II степень выраженности дисбактериоза. У 2 детей на 34 (7,4 %) и 48 (11,6 %) дни сохранялась IV степень, что, возможно, связано с присоединившейся ротавирусной инфекцией и вторичным нарушением микрофлоры кишечника.
На 34 и 48 день исследования ни у кого из обследованных больных не отмечалось возобновления клинических проявлений функциональных нарушений со стороны ЖКТ, свидетельствующих о нарушении кишечного микробиоценоза. Препарат "Йогулакт" хорошо переносился больными, побочных и нежелательных явлений при его приеме нами отмечено не было.
Таким образом, проведенные исследования позволили отметить, что "Йогулакт":
ЛИТЕРАТУРА
1. Bartlett J.G. Antibiotic-associated diarrhea. N Engl J Med 2002; 346: 334-9.
2. McFarland L.V. Diarrhea acquired in the hospital. Gastroenterol Clin North Am 1993; 22: 563-77.
3. Малов В.А. Антибиотикоассоцированные диареи. Клиническая микробиология и антимикробная химиотерапия 2002; 1(4): 27.
4. Осипенко М.Ф., Бикбулатова Е.А. Антибиотико-ассоциированная диарея. Фарматека 2007; 13: 89-90.
5. Torres J., Jennische E., Lange S. Enterotoxins from Cl.difficile; diarrhoeogenic potency and morphological effects in the rat intestine. Gut 1990; 31: 781-5.
