ROHHAD-синдром. Клиническое наблюдение
Статьи
Опубликовано в журнале:
«Практика педиатра» № 1, 2019 (февраль) , стр. 43-51
Е. В. Тозлиян, педиатр-эндокринолог, генетик, канд. мед. наук, ОСП «НИКИ педиатрии
им. акад. Ю. Е. Вельтищева» РНИМУ ФГБОУ ВО им. Н. И. Пирогова Минздрава России, Москва
Резюме: Статья посвящена актуальной проблеме современной педиатрии - редким заболеваниям у детей. Продемонстрировано собственное клиническое наблюдение ребенка с редким заболеванием, сопровождающимся быстропрогрессирующим ожирением, гиповентиляцией, гипоталамической и автономной дисфункцией (РОХХАД-синдром). Показаны основные клинические и диагностические признаки этого редкого заболевания. Подчеркивается необходимость своевременного выявления и оказания адекватной помощи больным с синдромом РОХХАД.
Ключевые слова: дети, ожирение, гиповентиляция, гипоталамическая, автономная (вегетативная) дисфункция, РОХХАД-синдром,редкие заболевания
Summary: The paper deals with the topical problem of modern pediatrics - rare diseases in children. It demonstrates the author's clinical observation of child with the rare disease characterized by rapid-onset obesity, hypoventilation, hypothalamic and autonomic disregulation (ROHHAD-syndrome). It shows the major clinical and diagnostic signs of this rare disease. It underlines the need for timely detection and adequate care to patients with ROHHAD-syndrome.
Keywords: children, obesity, hypoventilation, hypothalamic, autonomic dysregulation, ROHHAD-syndrome, rare diseases
Ожирение у детей и подростков является одной из актуальных проблем современного здравоохранения. Практически во всех регионах мира количество больных детей с ожирением неуклонно растет. Всемирная организация здравоохранения признала ожирение эпидемией XXI в. Ожирение приводит к ухудшению качества жизни, ранней потере трудоспособности и преждевременной смертности. Ожирение - не особенность конституции организма. Проблема ожирения не должна восприниматься сквозь призму предрассудков бытового мышления как результат «дурных» привычек или, наоборот, как общий признак здоровья и благополучия. Ожирение - это болезнь (рис. 1). Из-за широкой распространенности и большой социально-психологической значимости ожирение всегда было актуально для врачей. Гиппократ посвятил этой болезни специальный раздел «Как похудеть» в «Трактате о здоровом образе жизни». Ожирение как проблему, требующую комплексного подхода в лечении, трактовали классики медицины Запада (Клавдий Гален, Целий Аурелиан) и Востока (Абу Али ибн Сина -Авиценна) (рис. 2).
Ожирение может быть самостоятельным заболеванием или возникать на фоне различных патологий, и тогда речь идет о вторичном (симптоматическом) ожирении. Симптоматическое ожирение обусловлено различными причинами, как-то: генетические нарушения, опухоли головного мозга, нарушения в ЦНС, эндокринной системе, некоторые соматические заболевания, приемом лекарственных препаратов.
В связи с тем, что симптоматическое ожирение сопутствует множеству заболеваний и нередко является одним из первых их проявлений, исключительной важной проблемой для врача выступает дифференциальная диагностика заболеваний, сопровождающихся избытком массы тела.
Одним из редких генетических заболеваний у детей, сопровождающихся быстро прогрессирующим ожирением, является ROHHAD-синдром. Ввиду недостаточной его изученности возникают сложности в диагностике этого редкого заболевания. В связи с этим цель настоящей статьи:
- познакомить врачей разных специальностей с редким генетическим заболеванием на основании клинического наблюдения;
- показать сложности дифференциально-диагностического поиска;
- продемонстрировать необходимость мульти-дисциплинарного подхода к ведению больных с полиорганными нарушениями на примере синдрома ROHHAD.
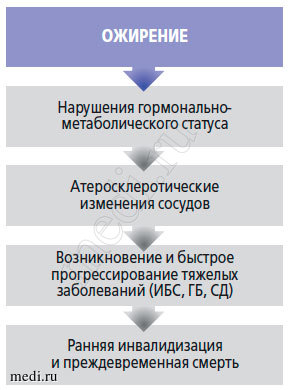
Рисунок 2. Историческая справка

РОХХАД (англ. ROHHAD) - аббревиатура, расшифровывающаяся как «быстро прогрессирующее ожирение (Rapid-onset Obesity) с гипоталамической дисрегуляцией (Hypothalamic), гиповентиляцией (Hypoventilation) и автономной (вегетативной) дисфункцией (Autonomic Disregulation)».
История изучения синдрома ROHHAD
Первое клиническое наблюдение синдрома ROHHAD (ранее известный как Late-Onset Central Hypoventilation Syndrome (LO-CHS) with Hypothalamic Dysfunction) -центральный синдром гиповентиляции с поздним дебютом и гипоталамической дисфункцией) описано в американском педиатрическом журнале за 1965 г. [1]. Таким образом, изучение синдрома ROHHAD началось с уже известного на тот момент синдрома центральной гиповентиляции (CHS) (или «синдром Ундины» - «синдром ночного апноэ»; название которого восходит к немецкой легенде о нимфе Ундине (русалке)). CHS - редкое заболевание, диагностированное в 1962 г. (Dr. Robert Mellins), проявляющееся уже на первом месяце жизни, часто в первые часы после рождения (с аутосомно-доминантным типом наследования с неполной пенетрантностью). Частота CHS - 1 случай на 50000-200000 новорожденных. На данный момент в мире страдают CHS около 1000 человек, диагноз подтвержден молекулярно-генетическим исследованием (данные, приведенные в J Nature Genetics, 2014). Число больных с синдромом ROHHAD около 75.
Симптомы мягких форм CHS могут обнаруживаться позднее (в детском или зрелом возрасте) - Late-onset CHS (LO-CHS). Форма заболевания, проявляющаяся в более позднем детском возрасте, при которой наряду с гиповентиляцией развиваются прогрессирующее ожирение, гормональные нарушения и невральные опухоли (чаще ганглионевромы) - синдром ROHHADNET (синдром ROHHAD+) (рис. 3) [2; 3].
Рисунок 3. Центральный синдром гиповентиляции (CHS; OMIM 209880) (группа заболеваний, характеризующихся нарушением автономного контроля дыхания)

Рисунок 4. Патогенетические механизмы при синдроме ROHHAD
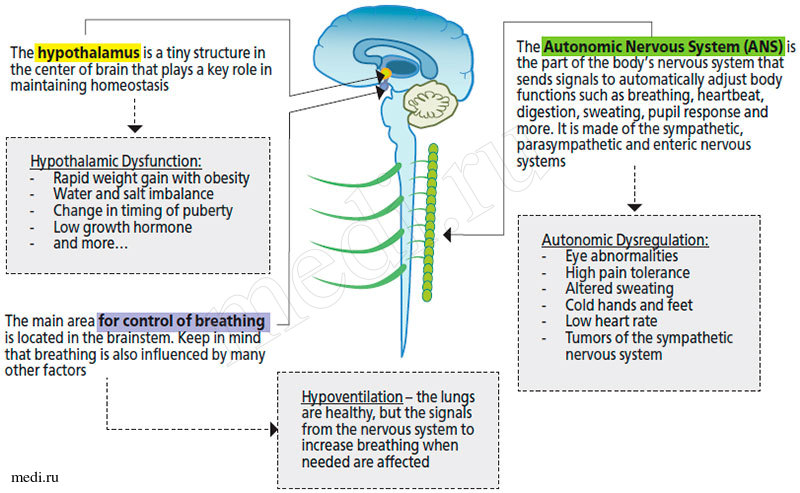
Патогенетические механизмы при синдроме ROHHAD
Этиология и патогенез синдрома врожденной центральной гиповентиляции (и различных его форм) до настоящего времени активно изучаются. CHS характеризуется нарушением автономного контроля дыхания при отсутствии нервно-мышечных, легочных, кардиологических заболеваний или поражения мозга. Нарушение автономного контроля дыхания приводит к неадекватному вентиляционному ответу на гиперкапнию и гипоксемию. Причиной гиповентиляции являются нарушения передачи импульсов, приводящих в движение диафрагму и мускулатуру грудной клетки, от головного мозга к дыхательной мускулатуре, но возможны нарушения других звеньев обратной связи дыхательной системы (поражение каротидных телец, снижении чувствительности периферических хемо-рецепторов). Основной причиной клинических проявлений при синдроме ROHHAD является поражение центральных структур (рис. 4) [4]. Гипоталамус играет ключевую роль в поддержании гомеостаза. Здесь имеются вегетативные нервные центры, задающие термостатную, массостатную, осмостатную установочную точку, а также баростатические и другие центры поддержания балансовых констант организма. Физиологически это выражается в регуляции теплоотдачи и теплопродукции, аппетита и насыщения, жажды и диуреза, индукции противоположных изменений кровяного давления, балансирования анаболизма и катаболизма. Гипоталамическая дисфункция проявляется прогрессирующим ожирением, водно-электролитными нарушениями, гормональными нарушениями (снижение выработки половых гормонов, гормона роста, гормонов щитовидной железы и т. д.). Быстропрогрессирующее ожирение при ROHHAD-синдроме объясняется нарушением функции интегративных центров гипоталамуса (вентромедиальных ядер, аркуатных, дорсомедиальных, паравентрикулярных ядер), участвующих в регуляции аппетита, и как следствие развивается повышенный аппетит (вплоть до полифагии) и ожирение. Дисфункция стволовых структур мозга (именно ствол мозга ответственен за все жизненно важные функции организма) проявляется кардиореспираторными кризами, нарушениями болевой и температурной чувствительности, нарушениями глотания, речи, дисфункцией пищеварения и т. д. Автономная (вегетативная) дисрегуляция входит в симптомокомплекс синдрома ROHHAD и проявляется глазными нарушениями, нарушениями болевой и температурной чувствительности, сосудистыми нарушениями, нарушениями функции мочевого пузыря и перистальтики кишечника, опухолями симпатической нервной системы.
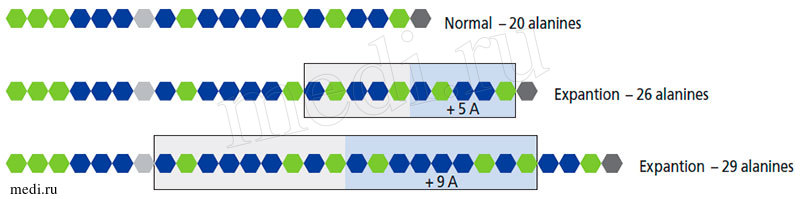
Рисунок 5. Различия между нормальным и мутированным геном PHOX2B при CHS
Молекулярно-генетические основы изучения синдрома ROHHAD
В последние годы активно изучаются молекулярно-генетические механизмы синдрома CHS и различных его форм. Было доказано, что при синдроме центральной гиповентиляции имеется мутация в гене PHOX2B (Pair-like homeobox 2b; 4p12) - a neurogenesis regulator, отвечающего за развитие, дифференцировку и миграцию нервных клеток на ранних этапах эмбрионального развития [5; 8]. В большинстве случаев эта мутация является de novo. Реже причиной заболевания являются точковые мутации в гене PHOX2B. Мутация в гене PHOX2B связана с экспансией тринуклеотидных GCG-повторов и увеличением количества аланинов более 25 аминокислот (полиаланиновая экспансия) - феномен экспансии нуклеотидных повторов, впервые описанный V. Verkerk и соавт. в 1991 г. при синдроме Мартина-Белл. У здоровых людей не обнаруживается эта особенность, поэтому PHOX2B является геном, определяющим это заболевание. Число повторов прямо пропорционально тяжести заболевания (рис. 5, 6). Около 92% мутаций в гене PHOX2B связаны с полиаланиновой экспансией; в 8% случаев - другие типы нарушений нуклеотидной последовательности (миссенс-, нонсенс- или мутации со сдвигом рамки считывания). Тип мутации влияет на проявление симптомов заболевания, так что можно делать выводы в отношении:
- риска возникновения опухолей нервных клеток, как например, нейробластомы или ганглионевромы;
- риска возникновения болезни Гиршпрунга;
- степени тяжести гиповентиляции и необходимости в 24-часовой искусственной вентиляции легких;
- риска нарушений сердечного ритма как возможной причины внезапной смерти.
Рисунок 6. Сиквенс GCN-повторов, кодирующих полиаланиновый тракт, в экзоне 3 гена PHOX2B
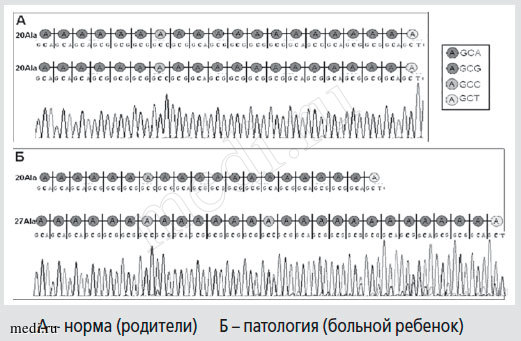
График 1. Частота встречаемости клинических проявлений при синдроме ROHHAD (по данным наиболее крупных исследований IZE-Ludow D., 2007, n = 15, и Bougneres P., 2008, n = 6)

Очень редко - мутации в генах, участвующих в дифференцировке и миграции нервных клеток на этапе эмбриогенеза: RET (Rearranged during transfection; хромосома 10q11.21): исследования показывают, что у 1 из 19 больных обнаружили миссенс-мутацию экзона 12 протоонкогена RET; BDNF (Brain-derived neurotrophic factor; хромосома 11p): исследование различных вариаций гена мозгового нейротрофического фактора (BDNF) показало, что у 1 из 19 больных с синдромом врожденной центральной гиповентиляции имеются мутации указанного гена; в гене глиотического нейротрофического фактора GDNF (Glial-derived neurotrophic factor; хромосома 5p12-13.1). У пациентов с синдромом ROHHAD ген PHOX2B не имеет отклонений. При ROHHAD-синдроме анализировались следующие гены, белковые продукты которых играют ключевую роль в эмбриональном развитии гипоталамуса и вегетативной нервной системы: 5-hydroxytryptamine receptor 1A (HTR1A) - 1А рецептор 5-гидрокситриптамина; pituitary adenylate cyclase activating polypeptide (PACAP) genes - полипептид, активирующий аденилатциклазу гипофиза; orthopedia (OTP) - показана экспрессия данного гена в широком спектре опухолей почти всех локализаций [6].
Клиническая характеристика синдрома ROHHAD
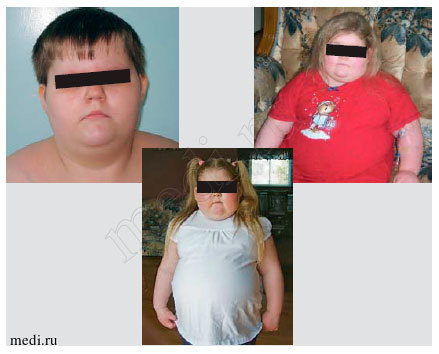
Отличительной характеристикой синдрома РОХХАД является нормальное развитие детей до 2-4 лет. Манифестация первых симптомов дебютирует с быстропрогрессирующего ожирения. С этого же возраста отмечается снижение темпов роста. В течение короткого периода времени большинство детей с РОХХАД-синдромом имеют морбидное ожирение, отмечаются первые респираторные нарушения в виде апноэ. Фенотип детей имеет особенности: лунообразное лицо с большими щеками, короткая толстая шея (фото 1). У большинства описанных больных выявлен дефицит гормона роста, вторичный гипотиреоз, гипогонадотропный гипогонадизм при отсутствии данных за объемное образование головного мозга. Характерным лабораторным признаком является постоянная умеренная гиперпролактинемия.
Фото 1. Фенотипы детей с ROHHAD-syndrome
Симптомы вегетативной дисрегуляции встречаются практически у всех больных в виде гипо- и гипертермии, зрачковой дисфункции, страбизма, нарушения моторики ЖКТ (запоры или хроническая диарея).
Характерны водно-электролитные нарушения у пациентов с синдромом РОХХАД в виде гипер- и гипонатриемии с недостаточным объемом суточной мочи и нормальным уровнем осмоляльности крови и мочи, что обусловлено нарушением гипоталамической регуляции водного обмена.
Кардиореспираторные кризы (кратковременные эпизоды остановки дыхания и сердечной деятельности) встречаются более чем у половины пациентов с этим синдромом. Имеет место альвеолярная гиповентиляция различной степени тяжести. Некоторым пациентам требуется искусственная вентиляция легких. Но, несмотря на своевременность реанимационных мероприятий, кардиореспираторные кризы в некоторых случаях могут привести к летальному исходу.
У больных с синдромом ROHHAD встречаются расстройства аутистического спектра, поведенческие нарушения, умственная отсталость различной степени выраженности, судорожные пароксизмы.
Частота встречаемости клинических проявлений при синдроме ROHHAD представлена данными наиболее крупных исследований (Ize-Ludow D., 2007, Bougneres P., 2008) (график 1) [4; 7].
Дифференциальная диагностика должна проводиться с наследственными синдромами, сопровождающимися ожирением (Прадера-Вилли, Лоуренса-Муна, Барде-Бидля, Коэна и др.), а также с симптоматическим ожирением при опухолях головного мозга, надпочечников.
Методы диагностики синдрома гиповентиляции при синдроме ROHHAD
Полисомнография - самый эффективный метод исследования, так как с его помощью можно получить всю информацию для оценки дыхания во время сна (представляет собой синхронную запись различных физиологических параметров во время сна) [9]. Суточная (дневная) гиповентиляция диагностируется путем измерения уровней показателей SpO2 и CO2 в течение дня. Показатель SpO2 ниже 95% и показатель CO2 выше 50 мм рт. ст. (6,7 кПа) свидетельствуют о гиповентиляции в состоянии бодрствования.
Лечение. Лечение при синдроме ROHHAD симптоматическое. При диагностировании гиповентиляции пациенты не могут самостоятельно дышать во время сна, а иногда и в состоянии бодрствования, поэтому больные нуждаются в искусственном аппаратном дыхании. Существует несколько возможностей искусственной вентиляции легких (ИВЛ). В зависимости от возраста пациента, тяжести заболевания и опыта обслуживающего медицинского центра для каждого пациента и его близких должен быть подобран оптимальный вид искусственной вентиляции легких. Пациенты с синдромом ROHHAD должны регулярно обследоваться на наличие подобных опухолей для проведения лечения на ранней стадии образования опухоли. Пациенты с эндокринными нарушениями (вторичный гипотиреоз, гипогонадизм, дефицит гормона роста, гиперпролактинемия) получают гормональную терапию.
Перспективы. Дальнейшее изучение молекулярно-генетических основ и патогенетических механизмов этого редкого заболевания помогут в разработке эффективных методов лечения с целью улучшения качества жизни пациентов с ROHHAD-синдромом. Молекулярно-генетические исследования помогут в определении прогноза у больного ребенка и медико-генетическом консультировании семьи.
Рисунок 7. Мультидисциплинарный подход
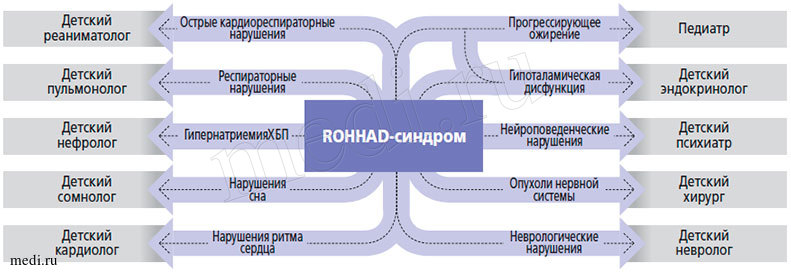
Учитывая полиорганность поражения при синдроме ROHHAD, отсутствие на данный момент эффективных методов лечения этих больных, все действия направлены на успешную реабилитацию этих пациентов. Эффективность реабилитации зависит от правильной координации действий врачей различных специальностей. Мультидисциплинарный подход является «золотым стандартом» и современной моделью помощи пациентам с синдромом ROHHAD (рис. 7).
Клиническое наблюдение
Девочка Р., 10 лет поступила в НИКИ педиатрии с диагнозом: Ожирение. Гипоплазия почек. ВСД.
Жалобы при поступлении на избыточные прибавки в весе (с 4 лет), обильное потоотделение, быструю утомляемость, постоянный субфебрилитет, холодные конечности.
Анамнез семейный: родители русские, не состоящие в кровном родстве и не имеющие профессиональных вредностей. По линии отца у родственников мочекаменная болезнь, желчекаменная болезнь.
Анамнез жизни: перинатальный анамнез не отягощен. Беременность 1, роды 1. Беременность протекала без особенностей. Роды на 41-й неделе, вес при рождении - 3150 г, рост 51 см. Раннее психомоторное и речевое развитие по возрасту. Перенесенные заболевания: ветряная оспа в 5 лет, ОРВИ редко. В возрасте 10 лет холецистэктомия.
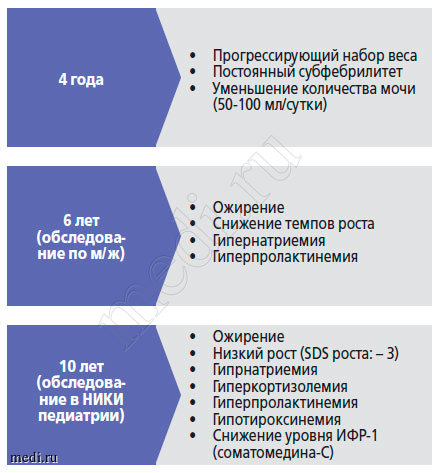
Анамнез заболевания: до 4 лет росла и развивалась согласно возрасту. В 4 года, после перенесенной пневмонии, у ребенка длительно сохранялся субфебирилитет, уменьшилось количество мочи до 50-100 мл/ сут и начался прогрессивный набор веса. Впервые обследована по м/ж в возрасте 7 лет, выявлена гипернатриемия, гиперпролактинемия и гипоплазия почек. Получала лечение: курантил, эссенциале. C 7 лет отмечается снижение темпов роста. В возрасте 10 лет выявлен калькулезный холецистит (у отца и родственников со стороны отца МКБ и ЖКБ), проведено оперативное лечение (холецистэктомия). В возрасте 10 лет ребенок направлен в Москву, в НИКИ педиатрии с целью уточнения диагноза (рис. 8).
Рисунок 8. Возрастная динамика симптомов у ребенка Р.
Общее состояние средней тяжести. Кожные покровы: повышенной влажности. Видимые слизистые: розовые, влажные, чистые. Дужки зева не гиперемированы. Подкожная жировая клетчатка: развита избыточно, распределена преимущественно по абдоминальному типу. Лимфатические узлы: безболезненные. Щитовидная железа: не увеличена. Клинически эутиреоз. Сердечно-сосудистая система: АД справа 85/60 мм рт. ст., частота пульса 79 в мин, область сердца не изменена, сердечные тоны ритмичные, ясные, шумы не выслушиваются, границы сердца не расширены. Дыхание везикулярное, проводится во все отделы, хрипов нет, перкуссия легких - звук ясный легочный, ЧДД - 16 в мин. Язык чистый влажный, живот мягкий, безболезненный при пальпации во всех отделах, печень не увеличена, селезенка не пальпируется, стул регулярный. Мочевыделительная система: мочеиспускание свободное, безболезненное, симптом поколачивания - отрицательный с обеих сторон. Половые органы: половое развитие Tanner 1. Нервная система и органы чувств: сознание ясное. Правильно ориентирована во времени, пространстве и собственной личности. Сон не нарушен. Зрачки OS = OD, реакция на свет содружественная. Сухожильные рефлексы живые, симметричные. Патологические рефлексы не выявлены. Очаговой неврологической и менингеальной симптоматики не выявлено. Патологии со стороны костно-суставной и мышечной системы нет.
Данные объективного исследования:
SDS роста - 2,44, ИМТ - 22,5 кг/м2, SDS ИМТ - 1,34.
Рисунок 9. Диагностические тесты

Рисунок 10. Диагностические тесты

Рисунок 11. Диагностические тесты

Рисунок 12. Диагностические тесты

Данные лабораторных и функциональных исследований (рис. 9-12):
Клинический анализ крови и мочи - норма.
Гликемический профиль норма.
Биохимический анализ крови - калий 4,5 ммоль/л (норма 3,5-5,1), натрий 156 ммоль/л (норма 136-145), хлориды 119 ммоль/л (норма 98-107), остальные показатели в пределах нормы.
Гормональный профиль: гиперпролактинемия 47 нг/ мл при норме до 9,6, свТ4 = 0,88, повышение ТТГ = 7,25 Ед/л (норма 0,4-4,0), повышение АРП до 50 нг/мл/ч при нормальных показателях АД, снижение инсулино-подобного фактора роста-1 (ИФР1) 30 нг/мл (53-332). Кортизол крови утром 690,5 нмоль/л (норма 77-630).
Суточный анализ мочи на кортизол - 64,41 (норма 60-413).
Суточный анализ мочи на метанефрины, нормета-нефрины - норма.
Анализ мочи по Зимницкому:
Удельная плотность 1000-1015;
Дневной диурез - 345 мл, ночной - 660 мл.
ЭКГ:
Заключение: ритм синусовый с ЧСС 75-60 в мин.
Синдром укороченного Р-Q.
Горизонтальное положение электрической оси сердца.
Изменения миокарда в области верхушки, боковой и нижней стенок левого желудочка могут быть вследствие снижения коронарного кровоснабжения.
Изменение предсердного компонента.
Метаболические изменения миокарда.
УЗИ надпочечников:
Надпочечники: не увеличены, объемных образований не выявлено.
Рентгенологическое исследование:
Протокол исследования: На рентгенограмме кистей «костный возраст» = 7 лет (ПВ 10 лет).
По результатам пробы с дексаметазоном исключен гиперкортизолизм.
МРТ головного мозга: патологии не выявлено.
УЗИ внутренних органов: реактивные изменения сосудов, протоков печени. Невыраженные диффузные изменения паренхимы печени. Диффузные изменения поджелудочной железы. Недостаточно четкая дифференцировка паренхимы почек.
Консультация специалиста по расстройствам сна (сомнолог).
Проведена ночная пульсоксиметрия, данных за гиповентиляцию в ночное время не получено.
Рисунок 13. Диагноз, лечение, эффективность терапии у ребенка Р.

Учитывая фенотип ребенка, данные анамнеза, результаты дополнительных исследований ребенку поставлен диагноз (рис. 13):
СТГ-дефицит, вторичный гипотиреоз, гиперпролактинемия, ожирение, гипернатриемия, нарушение терморегуляции. Совокупность данных компонентов соответствует синдрому ROHHAD.
На фоне терапии гормоном роста отмечается хороший ростовой эффект, осложнений терапии не выявлено, целесообразно продолжить терапию.
По вторичному гипотиреозу девочка компенсирована на фоне приема 25 мкг левотироксина.
По данным ночной пульсоксиметрии данных за гиповентиляцию не получено.
Данных за объемные образования надпочечников в настоящий момент также не получено.
В анализах крови отмечалась гипернатриемия до 156 ммоль/л. Назначением принудительного выпаивания и гипотиозида удалось скорректировать уровень натриемии до 146 ммоль/л. На фоне приема гипотиазида отмечается уменьшение потливости. В целом на фоне терапии отмечаются улучшение самочувствия, удовлетворительная динамика темпов роста, уменьшение вегетативных проявлений, снижение темпов набора веса.
Таким образом, приведенный клинический случай демонстрирует совокупность симптомов и диагностических признаков синдрома ROHHAD. Различная во времени манифестация симптомов при синдроме ROHHAD может приводить к диагностическим ошибкам. Своевременная диагностика особенно важна, так как позволяет найти оптимальный подход к лечению, профилактике возможных осложнений (вплоть до летальных исходов). Дальнейшие изучения патогенетических и молекулярно-генетических механизмов этого редкого заболевания помогут разработать новые эффективные методы терапии, которые будут способствовать повышению качества жизни больных с синдромом ROHHAD. Это диктует необходимость врачам различных специальностей четко ориентироваться в потоке наследственной обусловленной редкой патологии.
ЛИТЕРАТУРА
- Fishman L.S. at al. Primary alveolar hypoventilation syndrome (Ondine's Curse) // Amer J Dis Child. 1965. № 110(8). P. 155.
- Gothi D., Joshi J.M. Late onset hypoventilation syndrome: is there a spectrum of idiopathic hypoventilation syndromes? // Indian J Chest Dis Allied Sci. 2005. № 47. P. 293-297.
- Katz E.S., McGrath S., Marcus C.L. Late-onsetcentral hypoventilation with hypothalamic dysfunction: a distinct clinical syndrome // Pediatr Pulmonol. 2000. № 29. P. 62-68.
- Bougneres P. et al. Endocrine manifestations of the rapid-onset obesity with hypoventilation, hypothalamic, autonomic dysregulation and neural tumor syndrome in childhood // J. Clin. Endocrinol. Metab. 2008. № 93(10). P. 3971-3980.
- Amiel J. et al. Polyalanine expansion and frameshift mutations of the paired-like homeobox gene PHOX2B in congenital central hypoventilation syndrome // Nat Genet. 2003. № 33. P. 459-461.
- Rand C.M. et al. Rapid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation: analysis of hypothalamic and autonomic candidate genes // Pediatr Res. 2011. № 70 (4). P. 375-378.
- Ize-Ludlow D. et al. Rapid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation presenting in childhood // J. Pediatrics. 2007. 120 (1). P. 179-188.
- Назаренко Л.П., Назаренко М.С., Герасименко Н.Ю. Синдром врожденной центральной гиповентиляции: описание случая с молекулярно-генетической верификацией // Медицинская генетика. 2012. № 1. С. 47-50.
- Прохорова А.Д., Блохин Б.М., Полуэктов М.Г. Синдром обструктивного апноэ сна и ожирение у детей: точки соприкосновения // Практика педиатра. 2017. Сентябрь-октябрь. С. 7-12.
Комментарии
ПРАКТИКА ПЕДИАТРА

