Значение хронодиагностики и хронотерапии для оптимизации лечения детей с заболеваниями сердечно-сосудистой системы
СтатьиОпубликовано в журнале:
Практика педиатра, сентябрь-октябрь, 2017
Е.В. Неудахин, Заслуженный врач РФ, д.м.н., профессор, главный научный сотрудник ГБУЗ «НПЦ специализированной медицинской помощи детям им. В.Ф. Войно-Ясенецкого ДЗМ», г. Москва
Ключевые слова: дети, альтернативное взаимодействие, биоритмы, хронотерапия, артериальная гипертензия, сердечная недостаточность, L-карнитин, Элькар®
Keywords: children, alternative interaction, biorhythms, chronotherapy, arterial hypertension, cardiac decompensation, L-carnitine, Elkar®
В статье очень кратко изложены общие представления о биоритмах организма. Особое внимание уделено осцилляторам биоритмов, их иерархической структуре, альтернативному взаимодействию реакций организма, обеспечивающих и поддерживающих их. Обоснована необходимость учета биоритмов при разработке методов лечения заболеваний. Представлены данные литературы о хронотерапии артериальной гипертензии и некоторых других сердечно-сосудистых заболеваний у детей. Подчеркивается, что назначение лекарственных препаратов с учетом циркадианной чувствительности организма к ним способствует повышению эффективности лечения при значительно меньших курсовых дозах.
Учение о биоритмах имеет тысячелетнюю историю. Еще в трудах Гиппократа, а затем Авиценны сообщалось о сезонной цикличности человеческих заболеваний. Древнекитайские целители отмечали различную зависимую от времени суток чувствительность органов человеческого тела к воздействию иглоукалывания. Постепенное накопление фактического материала, последующие целенаправленные исследования в области биологических ритмов привели к необходимости использования полученных знаний в практическом здравоохранении.
Биологические ритмы, подчиняясь общим законам природы, в том числе закону цикличности, возникли при зарождении жизни на Земле. Под влиянием постоянно повторяющихся факторов внешней среды, инициирующих экзогенные ритмы, в процессе эволюции в живых системах сформировались структурно-функциональные организации, ответственные за эндогенные биоритмы. Последние в результате естественного отбора закрепились в геноме. Благодаря биоритмам осуществляется внутреннее движение, развитие организма, его устойчивость к воздействию факторов окружающей среды. Это осуществляется за счет ритмического чередования альтернативных процессов (анаболизма и катаболизма, возбуждения и торможения, множества других). В основе развития организма, становления его адаптационных механизмов, обеспечивающих синхронизацию физиологических функций с разнообразными изменениями окружающей среды, лежит закон единства и борьбы противоположностей, который, по моему мнению, правильнее называть законом альтернативного взаимодействия. Взаимодействие альтернативных процессов, взаимопроникающих друг в друга, осуществляется по принципу «обратных связей», по образцу «качелей», что является внутренним источником биоритмов. Таким образом, биологический ритм – это интегральное самоподдерживающееся и самовоспроизводящееся свойство живой природы, отражающее альтернативное взаимодействие качественно различных процессов организма и обеспечивающее его биологические функции и биологические реакции.
Эволюция развития живых систем свидетельствует о том, что первоначально сформировались молекулярно-генетические и клеточные биоритмы – «базовые» по своей сущности. В дальнейшем, в ходе эволюционного развития, усложнения живых организмов стали формироваться «надстроечные» биоритмы. Последние связаны с поэтапным включением регуляторных систем: цитокиновой, иммунной, эндокринной, вегетативной, центральной нервной, «обслуживающих» базовые системы (рисунок).
Уровни регуляции адаптивных процессов с позиции их альтернативного взаимодействия*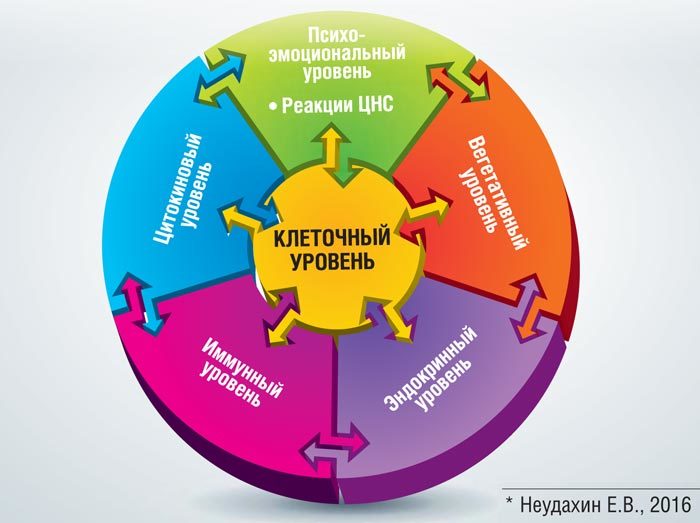
Данные М.Н. Кондрашовой и соавт. [1], наши данные [2] свидетельствуют о том, что ферментный статус лейкоцитов, характеризующий энергетический обмен в клетках, отражает состояние ВНС, гормонально-метаболические изменения, тоническое состояние сосудов, структуру и функцию миокарда. Следовательно, важнейшую роль в развитии патологических состояний играют нарушения клеточных структур (мембран, митохондрий и др.), которые являются триггерами нарушений эволюционно более молодых «надстроечных» систем: гормональной, вегетативной и др. Доказано, что клеточные мембраны являются пейсмекерами (осцилляторами), генерирующими циркадные ритмы во взаимодействии с другими, многочисленными осцилляторами, представляющими организм как мультиосцилляторную систему [3–6].
Высокий уровень адаптации различных систем достигается лишь в условиях их циклической деятельности. Именно от характера циклических процессов зависит адаптоспособность той или иной системы организма. Циклические процессы являются основой гомеостаза живых систем. С их помощью осуществляется координация физиологических функций организма с ритмами окружающей среды [7, 8].
Исследование биоритмов позволяет оценивать реактивность, функциональное состояние и адаптогенность организма. При всех патологических состояниях в организме возникает нарушение временной организации физиологических функций (десинхроноз), глубина которых коррелирует с тяжестью заболевания [9]. В связи с этим возникает необходимость применения лекарственных препаратов с учетом ритма чувствительности организма к их воздействию, так как было установлено, что одинаковые дозы препаратов, вводимые в разное время суток, вызывают разные по силе, а иногда и по качеству эффекты [10–12]. Хронофармакотерапевтический подход отражает наиболее перспективный принцип индивидуальной, эффективной и безопасной терапии больного [13].
В организме человека наиболее заметной в плане ритмической активности является сердечно-сосудистая система. Функциональная (в том числе ритмическая) деятельность ее может контролироваться большим количеством разнообразных, доступных методов исследования. Следует отметить, что с позиции интегральной медицины ритмическая активность сердечно-сосудистой системы индуцируется ритмической активностью всех органов и систем организма, получающих, в свою очередь, ритмические сигналы от сердечно-сосудистой системы. Ритмическая деятельность сердечнососудистой системы наиболее ярко проявляется ритмами изменений ЧСС и АД.
Сердечно-сосудистая система оперативно реагирует на любые воздействия факторов внешней среды и любые отклонения внутренней среды, благодаря чему своевременно обеспечиваются функциональные потребности организма. Оперативность сердечно-сосудистой системы обусловлена совершенными механизмами ее регуляции и высокой организацией ее структурных элементов. В связи с этим сердечно-сосудистая система обладает большими адаптационно-компенсаторными возможностями.
Сердечная деятельность подчинена удовлетворению потребностей организма. В зависимости от них сердце способно нагнетать в аорту от 4–6 л крови (в покое) до 30–35 л (при значительной физической нагрузке), т. е. сердечно-сосудистая система принимает самое активное участие в обеспечении процессов адаптации организма, в его непрерывном приспособлении к постоянно меняющейся окружающей среде.
В деятельности сердечно-сосудистой системы наиболее отчетливо выражены суточные (циркадианные) ритмы, которые столь же фундаментальны, как и генетический код [14–15]. Эндогенный по своей природе (наследственный, сформировавшийся в результате естественного отбора) суточный ритм постоянно испытывает корригирующее влияние факторов внешней среды. В связи с этим сердечный ритм изменяется под влиянием таких факторов, как «сон – бодрствование», «покой – физическая нагрузка» и т. д.
Необходимо отметить, что в эмбриональном периоде желудочки сердца формируются раньше, чем предсердия. Такой порядок развития отделов сердца закономерен с общебиологической точки зрения. Сначала созревают отделы с автономным (более древним) уровнем регуляции, а затем – отделы, связанные с центральным уровнем регуляции, реагирующем на действия факторов внешней среды. При формировании желудочков появляются редкие и нерегулярные их сокращения. По мере созревания предсердий и синусового узла «водителем» сердечных сокращений становятся импульсы, генерируемые в правом предсердии, а затем в синусовом узле. При этом сердце начинает сокращаться более часто и более регулярно.
Нервные и гуморальные механизмы регуляции возникают уже в эмбриональном периоде. Нервные структуры формируют проводящую систему сердца. На 16-й день внутриутробного развития обнаруживаются нервные волокна, подходящие к синусовому узлу. Очень рано образуются холино- и адренорецепторы, причем первые раньше вторых. Однако в пренатальном периоде ведущую роль играет гуморальная регуляция сердечной деятельности. Так, установлено, что развитие чувствительности сердца к ацетилхолину предшествует появлению парасимпатической иннервации.
К моменту рождения в организме нормально развивающегося плода формируются собственные суточные ритмы, согласованные с суточными ритмами физиологических процессов материнского организма [16]. У новорожденных суточные ритмы сердечной деятельности определяются уже с первых дней жизни [17]. Поэтому можно думать о врожденном характере данных циклических процессов.
При исследовании сердечного ритма в течение суток установлено, что наиболее низкая частота сердечных сокращений у доношенных новорожденных детей отмечается во время сна (в период от 1 до 4 ч). В этот период у новорожденных увеличивается длительность интервалов РQ, QRS, уменьшается высота зубца Р [18]. У недоношенных новорожденных отсутствуют суточные ритмы изменений частоты сердечных сокращений. Это связано с недостаточным развитием у них многих вегетативных функций [16]. У недоношенных детей имеется тенденция к формированию не суточных (24 ч), а полусуточных (12 ч) ритмов основных жизненно важных функций организма [16]. По данным других авторов [19], суточные ритмы у недоношенных детей выявляются с первых дней их жизни.
Г.В. Яцык и Е.В. Сюткина [19] в результате оценки биоритмов гемодинамики у 208 недоношенных детей установили, что с увеличением гестационного и постнатального возрастов увеличиваются среднесуточные значения систолического артериального давления (САД), диастолического артериального давления (ДАД) и среднего артериального давления (АДср). Особенно заметным это было на второй неделе жизни. У недоношенных детей с перинатальной энцефалопатией такой закономерности не отмечается. Наиболее информативной для оценки степени зрелости ребенка к моменту рождения оказалась амплитуда суточного ритма показателей АД. Так, у детей с гестационным возрастом 37 недель величина амплитуд ДАД и АДср достоверно выше, чем у детей с гестационным возрастом 35 недель. При увеличении постнатального возраста у относительно здоровых недоношенных детей и здоровых доношенных новорожденных акрофаза показателей АД смещается на вторую половину дня. Это указывает на созревание циркадианной системы, так как подобный характер изменений акрофазы суточного ритма АД наблюдается у здоровых взрослых людей. Амплитуда суточного ритма частоты сердечных сокращений (ЧСС) также увеличивалась при нарастании гестационного и постнатального возрастов. Акрофаза суточного ритма ЧСС имеет тенденцию к смещению к полудню, приближаясь к акрофазе ЧСС у здоровых взрослых людей (14–16 ч). У недоношенных детей со среднетяжелой и тяжелой степенями перинатальной энцефалопатии отмечается задержка созревания суточного ритма показателей гемодинамики. Кроме того, авторами установлено, что у недоношенных детей недельный и полунедельный ритмы проявляются раньше, чем суточный. Они коррелируют с геомагнитной активностью.
Для детей грудного и раннего возраста типична лабильность пульса и АД, что обусловлено недостаточной устойчивостью механизмов нейрогуморальной регуляции. Суточный ритм ЧСС отчетливым становится к 4-й неделе после рождения, но лишь с двух лет преобладает ритм, характерный для взрослых. У детей преддошкольного, дошкольного и школьного возрастов максимальная частота ЧСС наблюдается в дневные (11–12) и вечерние (18) часы, минимальная – в ночное время (24–03 ч). С суточным ритмом ЧСС коррелирует суточный ритм САД и ДАД, максимальные значения которых определяются в первую половину дня (8–12 ч), минимальные – ночью (24–08 ч). Это связано с тем, что в первую половину дня отмечается высокая активность симпатического отдела вегетативной нервной системы, максимальная продукция стрессреализующих гормонов: адреналина и кортизола. В это же время наблюдается выраженный суточный ритм образования ренина и ангиотензина-2. К концу дня и ночью симпатоадреналовая активность снижается [20].
У здоровых детей 7–14 лет в ночные часы, по сравнению с дневными, достоверно увеличиваются такие параметры ЭКГ, как длительность интервалов РQ, QT, RR, зубца T, сегмента ST1, а также систолический показатель. Эти изменения можно связать с влиянием парасимпатического отдела вегетативной нервной системы. У детей, больных ревматизмом, суточный ритм показателей ЭКГ извращается. Во-первых, продолжительность указанных выше компонентов ЭКГ в любое время суток больше, чем у здоровых детей; во-вторых, она не уменьшается в дневные часы, а наоборот, увеличивается. Следовательно, сердце у больных детей «отдыхает» меньше, чем у здоровых [21].
Любое заболевание сердечно-сосудистой системы начинается с развития десинхроноза. Поэтому при лечении сердечно-сосудистых заболеваний должен учитываться характер изменений биологических ритмов основных функций организма.
У большинства детей с первичной артериальной гипертензией (ПАГ) наиболее высокое АД отмечается в период с 12 до 18 ч. С нарастанием тяжести артериальной гипертензии (АГ) увеличивается сдвиг акрофазы к ночному времени [22]. Традиционно считается, что в основе патогенеза ПАГ лежит повышение активности симпатической нервной системы и ренин-альдостеронового аппарата. По нашим данным [23], важную роль в патогенезе ПАГ у детей (особенно с ожирением) играют еще и метаболические расстройства. В такой ситуации, сопровождающейся развитием окислительного стресса, нарушением окислительного фосфорилирования и энергетического дисбаланса, резко повышается активность симпатоадреналовой системы. Возникающая при этом дестабилизация клеточных мембран (пейсмекеров биоритмов) обуславливает развитие десинхроноза. При дестабилизации клеточных мембран организм «в интересах клеток» отказывается от «чрезмерных услуг» центрального контура регуляции (симпатоадреналовой системы) и переходит на более экономный, автономный, энергосберегающий путь обмена веществ, что достигается за счет усиления вагоинсулярного и ренин-ангиотензин-альдостеронового аппаратов, более активных в вечерние часы.
С позиции описанных представлений о патогенезе ПАГ понятной становится причина смещения акрофазы АД на вечерние часы. При исследовании суточного ритма АД у новорожденных в раннем и позднем неонатальном периодах [24–25] было установлено, что у доношенных новорожденных максимальное значение АД отмечается в 7–8 и 19–20 ч, минимальное – в 2 ч ночи. Во время сна АД адекватно снижается. У недоношенных с низкой массой тела максимальные показатели АД определяются в 12–14 ч, минимальные – в 5 ч утра и в 17 ч вечера, у недоношенных с очень низкой массой тела максимальные значения АД наблюдаются в 10 ч утра и в 22 ч вечера, минимальные в 5 ч утра и 17 ч вечера. Кроме того, у недоношенных новорожденных и маловесных к сроку гестации детей обнаружены более низкие средние значения АД, недостаточное их снижение во время сна (non-dippers), частые периоды развития артериальной гипотензии. У доношенных новорожденных, крупных к сроку гестации, во многих случаях во время сна отмечается недостаточное снижение как САД, так и ДАД, а примерно в 1/3 случаев зафиксировано его повышение, что, безусловно, является показанием для углубленного обследования этих детей и повышенного к ним внимания.
Суточный ритм ЧСС с понижением во время сна приобретает вид, характерный для взрослых, с двухлетнего возраста. Это связано с тем, что при переходе ребенка в вертикальное положение из-за активации фазнотитанического режима функционирование скелетной мускулатуры усиливает парасимпатическое влияние, в результате чего уменьшается ЧСС. Подобный характер изменений ЧСС указывает на снижение активности эрготропных реакций и усиление – трофотропных, более экономных в энергетическом плане. Если же у ребенка отмечается более высокая ЧСС (тахикардический вариант ритма сердца), то это свидетельствует о снижении уровня его здоровья [26].
Имеющиеся в литературе сведения о характере биоритмов показателей сердечно-сосудистой системы при АГ, а также сведения о зависимости чувствительности рецепторов к действию гипотензивных препаратов от временных характеристик являются основанием для применения указанных препаратов с учетом их хронофармакодинамики.
При назначении гипотензивных препаратов рекомендуется использовать превентивную схему хронотерапии (прием препарата за 1,5–2 ч до акрофазы АД или минутного объема кровообращения). Эта схема, разработанная Р.М. Заславской [27], применялась при лечении АГ такими гипотензивными препаратами, как клофелин (гемитон), анаприлин (обзидан), допегит. Под влиянием хронотерапии указанными препаратами наступал выраженный стойкий гипотензивный эффект, преимущественно за счет периферической вазодилатации; отмечалась нормализация хроноструктуры суточных ритмов и показателей гемодинамики. Такая же схема использовалась Л.В. Лукотиной и соавт. [28]. Они назначали при лабильной артериальной гипертензии анаприлин, а при стабильной – коринфар. Стабилизация АД при хронотерапии наступала на 6–9 дней раньше, чем при традиционной терапии (по 1 табл. 3 раза в день). Много лет спустя Р.М. Заславская и соавторы [29] использовали этот метод при лечении пациентов с АГ капотеном в амбулаторных условиях, подтвердив высокую эффективность метода. По сравнению с общепринятым лечением, они получили хороший результат при существенно более низкой курсовой дозе. Л.И. Ольбинская и Б.А. Хапаев [30] доказали, что гипотензивные препараты короткого действия лучше применять за 1,5–2 ч до акрофазы АД, а пролонгированные – за 4–8 часов. Если ночью АД высокое, то следует использовать пролонгированные препараты, если низкое, то препараты короткого действия в 1-ю половину дня.
В литературе неоднократно отмечалось, что применение пролонгированных ИАПФ у пациентов с АГ, как правило, приводит к снижению АД, к нормализации его циркадианного ритма (к переходу non-dippers в разряд dippers). При этом препарат назначается один раз в день. Так, применение рамиприла вечером (в 21 ч) оказывает более выраженное снижение САД и ДАД ночью, а при назначении его утром лучше контролируются утренние и дневные подъемы АД [31–32].
В последние годы наблюдается заметное нарастание количества детей, особенно подростков, с абдоминальным ожирением, которое является одним из проявлений метаболического синдрома (МС).
Лечение АГ у детей с МС имеет свои особенности. В связи с тем, что бета-адреноблокаторы (БАБ) отрицательно влияют на липидный обмен и усиливают инсулинорезистентность, их применение для лечения АГ у этих детей не показано. Не рекомендуется применение короткодействующих антагонистов кальция (АК), а также тиазидных диуретиков. Последние часто приводят к развитию осложнений и побочных эффектов в виде гипокалиемии, гиперурикемии, гиперлипидемии, гипергликемии. Из диуретических препаратов при необходимости можно использовать индапамид (арифон), который является метаболически нейтральным.
В настоящее время для лечения АГ у детей и подростков с МС наиболее широко используются ИАПФ (в основном 2-го и 3-го класса). Однако при назначении препаратов 2-го класса (эналаприл, фозиноприл) необходимо помнить о том, что они активируются в печени и накапливаются в жировой ткани. ИАПФ 3-го класса (лизиноприл и др.) не откладываются в жировой ткани и не требуют активации в печени, в связи с чем их применение при АГ у детей с МС наиболее оправдано. При вечернем назначении ИАПФ происходит более глубокое снижение АД в ночное время [33]. По данным Н.В. Шипицыной [34], лизиноприл в дозе 5–10 мг/сут. при типах АД «dippers» и «over-dippers» следует назначать в 8–10 ч утра, а при типах АД «nondippers « и «night-peakers» – в 20–22 ч.
При лечении АГ у детей и подростков с МС оправдано назначение пролонгированных дигидропиридиновых АК (амлодипин, фелодипин). Применение АК обеспечивает адекватный суточный контроль АД. У пациентов с профилем АД по типу «dippers» амлодипин и пролонгированный нифедипин не нарушают суточный профиль АД, независимо от того, в какое время суток (утром или вечером) вводился препарат. Однако у пациентов с десинхронозом по типу «non-dippers» эти препараты способствуют нормализации суточного профиля АД [33]. По данным Е.Ю. Федоровой[35], при введении пролонгированного изоптина утром достоверно снижается ДАД, вечером – САД.
В результате анализа доступной литературы можно прийти к обобщающим выводам о времени назначения антигипертензивных препаратов с учетом суточного ритма их наиболее эффективного действия: в вечернее время лучше применять ИАПФ, АК, БРА (блокаторы рецепторов ангиотензина), в утреннее – БАБ. При гиперкинетическом типе кровообращения предпочтение следует отдавать бетаадреноблокаторам, при гипокинетическом – ИАПФ. При гиперсимпатикотоническом типе вегетативного обеспечения АД, выраженном повышении среднедневного САД наиболее целесообразно назначать амлодипин в утренние часы.
При исследовании хроноэффективности сердечных гликозидов у больных с сердечной недостаточностью было установлено, что максимальный терапевтический эффект достигается при назначении строфантина утром, коргликона – днем, дигоксина – вечером [27]. В связи с наличием при хронической сердечной недостаточности более неблагоприятных сдвигов показателей гемодинамики во второй половине дня В.Л. Назифуллин и соавт. [36] предлагают применять инотропные препараты и периферические вазодилататоры преимущественно в вечерние часы.
По данным экспериментальных работ [37], хроночувствительность строфантина и дигоксина в ночное время оказалась в несколько раз выше, чем днем. Это следует учитывать при выборе доз названных препаратов. Кроме того, установлено, что под влиянием индерала аритмия значительно быстрее купируется в дневные часы, чем в ночные.
При многих патологических состояниях, в том числе при АГ сердечной недостаточности, возникают нарушения окислительного фосфорилирования с развитием энергетической недостаточности, с дестабилизацией клеточных мембран (пейсмекеров циркадных ритмов). Все это является патогенетическим основанием для применения в таких случаях препаратов L-карнитина. Последний играет важную роль в обеспечении энергетического потенциала клеток, в образовании нейромедиаторов (АТФ, ацетилхолина), в коррекции вегетативных и гормонально-метаболических сдвигов, в нормализации биоритмов. В связи с этим, по нашему мнению, при лечении таких состояний показано назначение препаратов L-карнитина. При их использовании необходимо учитывать, что в утренние часы они усиливают энерготропные процессы в организме, а в вечерние – трофотропные. Кроме того, нами установлено, что у детей как избыточное, так и недостаточное питание – это проявления хронического стресса, играющего важную роль патогенезе заболеваний. В связи с этим лекарственный препарат на основе L-карнитина Элькар®, разработанный отечественной компанией ПИК-ФАРМА и выпускаемый в виде 30% раствора левокарнитина (300 мг/мл) для приема внутрь, мы применяем с учетом суточного ритма в дозе 30–50 мг/кг в сутки. Детям с ожирением препарат назначается только утром, детям с недостаточной массой тела – в полдень и вечером курсами по 6 недель с 3-месячным перерывом.
В заключение с сожалением приходится констатировать, что хронотерапия сердечнососудистых заболеваний еще не нашла широкого применения в медицине, особенно в педиатрии. Между тем, именно она позволяет в максимальной степени индивидуализировать лечение каждого больного, повысить его эффективность и безопасность.
Основная цель этой статьи – привлечь внимание к проблемам хронодиагностики и хронотерапии заболеваний у детей. При этом хочется пожелать всем, у кого есть или появляется возможность заниматься разработкой данных проблем, воспользоваться этим, так как за хрономедициной и ее указанными разделами – будущее. Это было пожеланием наших великих Учителей В.А. Таболина и Ю.Е. Вельтищева.
Список литературы
- Кондрашова М.Н., Хундерякова Н.В., Захарченко М.В., Захарченко А.В. Индивидуальная характеристика человека по паттерну (узору) цитобиологических показателей взаимодействия янтарной кислоты с митохондриями // Материалы Симпозиума «Регуляторы энергетического обмена» / Под ред. В.А. Хазанова. Томск, 2007. С. 8–16.
- Неудахин Е.В., Морено И.Г. Углубление представлений о некоторых механизмах формирования хронического стресса // Вопросы практической педиатрии. 2016. № 11 (5). С. 28–37.
- Piggins H.D., Loudon A. Circadian biology: clocks within clocks // Curr. Biol. 2005; 15 (12): 455–457.
- Фролов В.А. и др. Общая патологическая физиология. М.: Высшее образование и наука, 2009. 508 с.
- Иванов В.П., Иванова Н.В., Полоников А.В. Медицинская экология. СПб.: СпецЛит, 2012. 320 с.
- Агумова Л.П. Хронобиология: Учебное пособие. Томск, 2013. 259 с.
- Баевский Р.М. Временная организация функций и адаптационно-приспособительная диагностика организма // Теоретические и прикладные аспекты анализа временной организации биосистем. М., 1976. С. 88–111.
- Оранский И.Е. Природные лечебные факторы и биологические ритмы М., 1988. 288 с.
- Воложин А.И., Субботин Ю.К. Синхронизация биоритмов // Болезнь и здоровье: две стороны приспособления. М.: Медицина, 1998. С. 327–331.
- Halberg F. Chronobiology // Annual review of physiology. 1969; 31: 675–725.
- Reinberg A. Clinical chronopharmacology. An experimental basis for chronotherapy Biol. Rhytms and med. cellular. London,1983; 4: 211–264.
- Таболин В.А., Лебедев В.П. Хронобиологический подход к выбору лекарств при заболеваниях у детей // Труды II Российского национального конгресса. М., 1996. 94–107.
- Валиев О.М., Исмаилов Ш.И. Циркадный ритм артериального давления у гипертензивных больных и хронофармакотерапия бета-адреноблокаторами III Всесоюзная конференция по хронобиологии и хрономедицине. М.; Ташкент, 1990. C. 74.
- Алякринский Б.С., Степанова С.И. По закону ритма. М.: Наука, 1985; 176 с.
- Агаджанян Н.А., Шабатура Н.Н. Биоритмы, спорт, здоровье. М.: Физкультура и спорт, 1989. 208 с.
- Окунева Г.Н., Власов Ю.А., Шевелева Л.Т. Суточные ритмы газообмена и кровообращения человека. Новосибирск: Наука, 1987. 277 с.
- Евсюкова И.И., Савич А.А., Сысуев В.М. Динамика ритма сердечных сокращений у здоровых детей в первые дни жизни // Вопр. охраны материнства и детства. 1980. № 25 (4). С. 11–14.
- Бирюкович А.А. Становление суточного ритма деятельности сердца у новорожденных (электрокардиографическое исследование) // Педиатрия. 1970. № 6. С. 33–37.
- Яцык Г.В., Сюткина Е.В. Неонатальная хронобиология. М.: Информзнание, 1999. 68 с.
- Таболин В.А. и др. Проблемы биологических ритмов детского организма. Суточные ритмы физиологических процессов организма. М., 1972. С. 71–73.
- Чимаров В.М., Виноградов А.Ф. Суточный ритм показателей электрокардиограммы у детей в норме и при патологии. Наследственные и приобретенные нарушения обмена веществ у детей // Труды ин-та. Т. ХL1. Серия «Педиатрия». Вып. 13. М., 1977. С. 82–86.
- Асланян Н.Л., Мадоян С.Х. Ритмологические особенности артериального давления, частоты сердечных сокращений и температуры тела у больных гипертонической болезнью // Проблемы хронобиологии. 1991. № 1–2. С. 57–71.
- Морено И.Г., Неудахин Е.В., Иванова С.В., Гурьева Е.Н. Роль вегетативных и гормонально-метаболических расстройств в развитии первичной артериальной гипертензии у детей и подростков с ожирением // Педиатрия им. Г.Н. Сперанского. 2016. № 95 (3). С. 31–38.
- Сафанеева Т.А. Суточный ритм артериального давления у новорожденных в раннем неонатальном периоде: Автореф. дис. … канд. мед. наук. Волгорад, 2007. 25 с.
- Лавренюк И.И. Оптимизация диагностики нарушений гемодинамики у новорожденных в позднем неонатальном периоде: Автореф. дис. … канд. мед. наук. Волгоград, 2015. 24 с.
- Иванова О.В. Дизритмии у детей (распространенность, клинико-функциональная и метаболическая характеристика, особенности мониторинга): Автореф. дис. … д-ра мед. наук. М., 2008. 38 с.
- Заславская Р.М. Хронодиагностика и хронотерапия заболеваний сердечно-сосудистой системы. М.: Медицина, 1991. 320 с.
- Лукутина Л.В., Иванов А.В., Трифонова О.Ю. Хронотерапия артериальных гипертоний // Тез. докл. 3 Всесоюзной конф. по хронобиологии и хрономедицине. М.;Ташкент, 1990. С. 208.
- Заславская Р.М., Васькова Л.Б., Болсуновская Ю.Р. Хронофармакология и хрономедицина как новый методологический подход к оптимизации лечения // Пространство и время. 2012. № 1. С. 195–198.
- Ольбинская Л.И., Хапаев Б.А. Роль суточного мониторирования артериального давления в диагностике и лечении кардиологических заболеваний // Хронобиология и хрономедицина / Под ред. Ф.И. Комарова, С.И. Рапопорта. М.: Триада Х, 2000. С. 211–229.
- Горбунов В.М. и др. Влияние утреннего и вечернего назначения рамиприла на суточный профиль артериального давления у больных артериальной гипертонией // Рациональная фармакотерапия в кардиологии. 2009. № 1. С. 28–32.
- Горбунов В.М. и др. Влияние хронотерапии различными антигипертензивными препаратами на суточный профиль артериального давления // Рациональная фармакотерапия в кардиологии. 2011. № 7 (1). С. 6–18.
- Леммер Б. Хронофармакология – влияние циркадных ритмов на лекарственную терапию сердечно-сосудистых заболеваний // Хронобиология и хрономедицина: Руководство / Под ред. С.И. Рапопорта, В.А. Фролова, Л.Г. Хетагуровой. М.: ООО «Медицинское информационное агентство», 2012. С. 462–480.
- Шипицина Н.В. Хронотипы суточных ритмов артериального давления и методы хронотерапии артериальной гипертонии ингибитором АПФ в условиях заполярной вахты: Автореф. дис. … канд. мед. наук. Тюмень, 2013. 24 с.
- Федорова Е.Ю. Фармакодинамическое и фармакокинетическое обоснование хронотерапии артериальной гипертензии: Автореф. дис. … канд. мед. наук. М., 2010. 22 с.
- Назифуллин В.Л., Давлетшин Р.А., Диденко Р.Г. Циркадный ритм показателей гемодинамики у больных хронической недостаточностью кровообращения // Проблемы хронобиологии, хронопатологии, хронофармакологии и хрономедицины: Тез. докл. Т. 2. Уфа, 1985. С. 115–116.
- Асланян Н.Л. Основные направления хронобиологических и хрономедицинских исследований // Проблемы хронобиологии. 1990. № 1–2. С. 38–49.

