Интерпретация биохимического анализа крови при патологии печени. Синдром цитолиза. Часть 1.
СтатьиОпубликовано в журнале:
"Практика педиатра" июнь, 2017г.
М. Г. Ипатова1, 2 к.м.н., Ю. Г. Мухина1 д.м.н. профессор, П. В. Шумилов1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова
МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты
В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме.
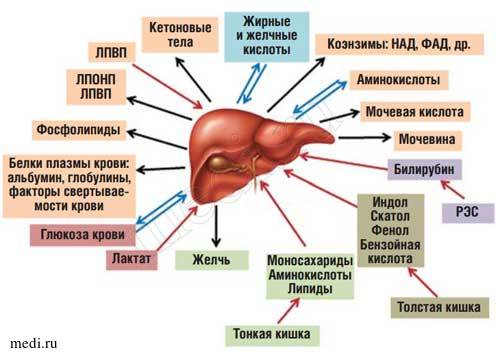
Рис. 1. Роль печени в обмене веществ.
Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид.
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно.
Таблица 2. Причины повышения уровня аминотрансфераз
|
Печеночные причины |
Внепеченочные причины |
|
•Вирусные гепатиты (В, С, ЦМВ и др.) •Хронические инфекции и паразитарные •Неалкогольный стеатогепатит •Аутоиммунные заболевания печени •Злоупотребление алкоголем •Прием лекарственных препаратов •Метаболические заболевания печени •врожденные и приобретенные дефекты •Цирроз печени •Опухоли печени |
•Патология сердца (острый инфаркт •Повышенная физическая нагрузка •Наследственные нарушения мышечного •Приобретенные мышечные заболевания •Травма и некроз мышц •Целиакия •Гипертиреоз •Тяжелые ожоги •Гемолиз эритроцитов •Нарушение кислотно-щелочного равновесия •Сепсис |
Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
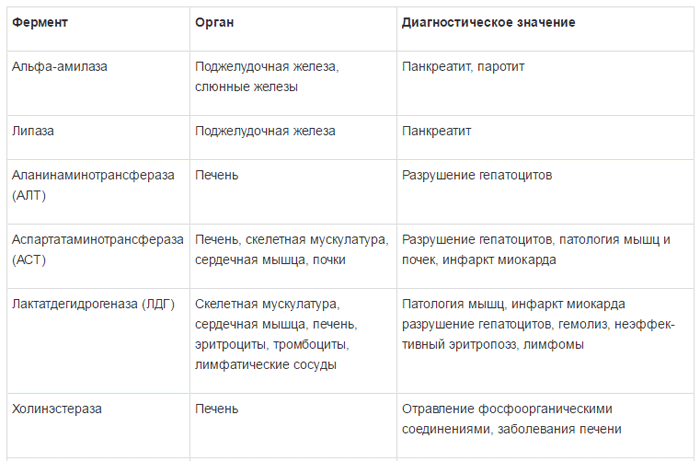
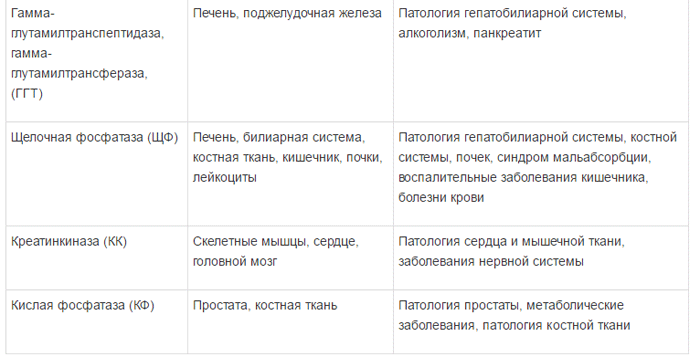
Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4].
Ферменты в зависимости от их локализации можно разделить на несколько групп:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам,
купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) органеллоспецифические ферменты, являются маркерами определенных органелл
гепатоцита: митохондриальные (глутаматде-гидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фос фатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5].
Исходя из выше изложенного, следует, что в большинстве случаев отклонения активности сывороточных ферментов от «нормы» неспецифичны и могут быть вызваны различными причинами. Поэтому нужно с большой осторожностью относиться к интерпретации этих отклонений, сопоставляя их с клинической картиной заболевания и данными других лабораторных и инструментальных методов исследования [5, 6].
В связи с использованием в клинических лабораториях разных методов исследования ферментов и единиц измерения их активности целесообразно каждый раз, получив результаты анализа, уточнить, каким методом и в каких единицах была измерена активность фермента, и сопоставить полученное значение с «нормой», принятой в данной лаборатории.
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок.
В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологии печени в биохимическом анализе крови выделяют 4 синдрома:
• Синдром цитолиза
• Синдром холестаза
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром.
В данной статье мы подробно разберем по
казатели, характерные для синдрома цитолиза.
Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7].
Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2).
Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики.
Таким образом:
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0).
3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания
скелетных мышц (преимущественно увеличение изофермента ЛДГ1, ЛДГ2, ЛДГ3).
4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (пневмония и др.)
7. Инфаркт почки.
8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином).
Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10]
|
Препараты |
Синдром цитолиза |
|
Липоевая кислота |
± |
|
ЭФЛ |
+ |
|
Препараты животного происхождения |
+ |
|
Силимарин |
+ |
|
L-орнитин L-аспартат |
± |
|
Адеметионин |
+ |
|
УДХК (Урсодезоксихолевая кислота) |
+ |
Примечание: (+) – положительный терапевтический эффект; (±) – относительный терапевтический эффект;
Повышенную активность ЛДГ в физиологических условиях наблюдают у беременных, новорожденных, после гемотрансфузии, у лиц после интенсивных физических нагрузок.
ГЛУТАМАТДЕГИДРОГЕНАЗА
Референтные величины активности ГлДГ в сыворотке крови – менее 4 МЕ/л.
Глутаматдегидрогеназа (ГлДГ) – митохондриальный фермент, который катализирует превращение глутамата в альфа-кетоглутаровую кислоту. Фермент содержится в нервных клетках, миокарде, скелетных мышцах, но наибольшее его количество находится в клетках печени – гепатоцитах.
Повышенный уровень ГлДГ в сыворотке крови указывает на повреждение печени. Поскольку фермент является митохондриальным, то степень повышения его активности отражает глубину и тяжесть патологического процесса.
При вирусном гепатите активность ГлДГ повышается в крови в первые сутки желтушного периода. Степень ее повышения зависит от тяжести вирусного гепатита, особенно высокие значения выявляют при развитии печеночной недостаточности.
Высокую активность ГлДГ отмечают у больных первичным и метастатическим раком печени. При обострении хронического персистирующего гепатита повышение активности ГлДГ либо отсутствует, либо бывает незначительным. При циррозе печени в стадии декомпенсации подъем активности ГлДГ бывает значительным, причем высокая активность фермента рассматривается как неблагоприятный признак.
Алкогольная интоксикация также сопровождается значительным увеличением активности ГлДГ в сыворотке крови.
Для установления этиологии повышения уровня трансаминаз рекомендуется проведение дополнительных лабораторных проб (маркеры холестаза, вирусных гепатитов, аутоиммунных заболеваний, липидограм-ма крови, определение уровня альфа1-антитрипсина, церулоплазмина, ферритина, и др.), и инструментальных методов обследования (ультразвуковое исследование, компьютерная и магнитно-резонансная томография брюшной полости, пункционная биопсия печени с последующим гистологическим исследованием биоптата).
Длительное повышенное разрушение гепатоцитов, сопровождающееся воспалительной реакцией и цитолизом, в конечном итоге ведет к развитию фиброза и цирроза.
Лечение заболеваний печени должно быть комплексным и включать этиотропную терапию (после постановки диагноза) и патогенетическую терапию (с момента выявления цитолиза).
С целью повышения устойчивости печени к патологическим воздействиям, используются препараты, относящиеся к группе гепато-протекторов.
Гепатопротективные препараты, применяемые при синдроме цитолиза представлены в таблице 3.
МЕХАНИЗМЫ ДЕЙСТВИЯ ГЕПАТОПРОТЕКТИВНЫХ ПРЕПАРАТОВ ПРИ СИНДРОМЕ ЦИТОЛИЗА
Эссенциальные фосфолипиды (ЭФЛ)
представляют собой очищенную смесь полиненасыщенных фосфолипидов (преимущественно – фосфатидилхолина), которые получают из бобов сои. ЭФЛ соответствуют по своей химической структуре эндогенным фосфолипидам. ЭФЛ восстанавливает дефицит пула фосфолипидов в организме, которые идут в качестве строительного материала для клеточных мембран, поддерживая их текучесть, а также являются мишенью для продуктов перекисного окисления липидов, уменьшая проявления окислительного стресса [10, 11].
Побочное действие: Желудочный дискомфорт, диарея, аллергические реакции.
Противопоказания: повышенная чувствительность к фосфатидилхолину или другим вспомогательным ингредиентам препарата; детский возраст до 3 лет.
Силимарин – общее название химически связанных изомеров флавонолигнана из плодов расторопши. Основными биофлавонои-дами в силимарине являются: силибинин, силидианин, силикристин, изосилибинин, среди которых силибинин обладает наибольшей биологической активностью [12].
Силимарин нейтрализует свободные радикалы в печени, препятствует разрушению клеточных структур. Специфически стимулирует РНК-полимеразу и активирует синтез структурных и функциональных белков и фосфолипидов в поврежденных гепатоцитах. Стабилизирует клеточные мембраны, ускоряет регенерацию клеток печени. Силимарин является специфическим антидотом при отравлении бледной поганкой (препятствует проникновению в клетку ядов бледной поганки: фаллоидина и аманитина).
Побочное действие: Послабляющее действие.
Противопоказания: повышенная чувствительность к компонентам препарата.
Адеметионин – активный серосодержащий метаболит метионина, природный антиоксидант и антидепрессант, образующийся в печени из метионина и аденозина в количестве до 8 г/сут. и присутствующий во всех тканях и жидкостях организма, но больше всего в местах его образования и потребления: в печени и головном мозге [10].
Адеметионин играет центральную роль в промежуточном метаболизме и уступает только АТФ по универсальности в отношении участия в разнообразных биохимических реакциях. Молекула S-аденозил-L-метионина донирует метильную группу в реакциях метилирования фосфолипидов клеточных мембран белков, гормонов, нейромедиаторов и др. (трансметилирование). Является предшественником физиологических тиоловых соединений – цистеина, таурина, глютатиона (обеспечивает окислительно-восстановительный механизм клеточной детоксикации), КоА и др. в реакциях транссульфатирования. После декарбоксилирования участвует в процессах аминопропилирования как предшественник полиаминов – путресцина (стимулятор регенерации клеток и пролиферации гепатоцитов), спермидина и спермина, входящих в структуру рибосом [10, 13]. Показана эффективность при гепато-патиях, обусловленных приемом гепатотоксичных лекарственных препаратов (парацетамол, цитостатические препараты и др.) [14, 15].
Побочные действия: гастралгия; диспепсия; изжога; бессонница, аллергические реакции.
Противопоказания: повышенная чувствительность к компонентам препарата; генетические нарушения, влияющие на метиониновый цикл и/или вызывающие гомоцистинурию и/или гипергомоцистеинемию (дефицит цистатионин бета-синтазы, нарушение метаболизма витамина В12); I и II триместр беременности; период лактации (грудного вскармливания); возраст до 18 лет из-за отсутствия исследований по эффективности и безопасности.
В случае клинической необходимости назначения адеметионина в детской практике вопрос решается через консилиум или при разрешении локального этического комитета при информированном согласии родителей. Наши клинические наблюдения за детьми показали положительный эффект от применения аде-метионина в виде снижения ЩФ, ГГТ, нормализации АЛТ и АСТ. Ни у одного из наблюдаемых нами пациентов не было отмечено каких-либо побочных эффектов. Детям до 10 кг назначается 50–100 мг/сут, от 10 до 20 кг – 100– 200 мг/сут, выше 20 кг – 200–400 мг/сут [16].
Урсодезоксихолевая кислота (УДХК) – нетоксичная, третичная, гидрофильная желчная кислота.
Мембраностабилизирующий эффект УДХК обусловлен способностью препарата модулировать структуру и состав богатых фосфоли-пидами смешанных мицелл в желчи. Конъюгаты УДХК защищают холангиоциты от повреждающего влияния ЖК путем стимуляции базолатеральной секреции и снижения холангиоцеллюлярной концентрации гидрофобных ЖК. На фоне приема препарата уменьшается энтерогепатическая циркуляция гидрофобных желчных кислот, предупреждается их токсический эффект на мембраны гепатоцитов и эпителий желчных протоков.
УДХК посредством активации рецепторов эпидермального фактора роста (epidermal growth receptor) и MARK (mitogen-activated proteinkinases) вызывает в гепатоцитах сигналы, направленные на выживание клетки, обусловливая, таким образом, антиапоптический эффект.
Терапия УДХК снижает риск развития онкологических процессов, в частности гепатоцеллюлярной карциномы (ГЦК) и при хроническом вирусном гепатите С у пациентов, не ответивших на противовирусную терапию. Также она оказывает иммуномодулирующее действие, влияет на иммунологические реакции в печени: уменьшает экспрессию некоторых антигенов на мембране гепатоцитов, влияет на количество Т-лимфоцитов, образование интерлейкина-2, уменьшает количество эозинофилов. УДХК показано при лечении аутоиммунных заболеваний печени [17, 18].
При синдроме цитолиза тяжелой степени наиболее выраженный положительный эффект наблюдается при одновременном назначении адеметионина (парентерально) с УДХК.
Список литературы:
1. Подымова С. Д. Внутрипеченочный хо-лестаз: патогенез и лечение с современных позиций / Consillium Medicum, приложение № 2 (гастроэнтерология). 2004. С. 3-6.
2. Биологическая химия: Учебник. Березов Т. Т., Коровкин Б. Ф..- 3-е изд., перераб. и доп.- М.: Медицина, 1998.- 704 с.
3. Пропедевтика внутренних болезней, часть 3: Лабораторные и инструментальные методы исследования в клинике внутрен них болезней. / Шапошник И. И., Комар С. И., Котлярова В. Н., Катукова В. Е., Исупов Е.Б., Максимов С. В., Рытвинская Н. П., Экто- ваЛ. А., Потапова Н.П. Медицинский Вестник.-2008.-№5.-160 с.
4. Биохимические основы патологических процессов: Учеб. Пособие/Под ред. Е. С. Северина. - М.: Медицина, 2000. - 304 с.
5. Клиническая лабораторная диагностика: Национальное руководство: в 2 т. - Том 1./ под ред. Долгова В. В., Меньшикова В. В. - М.: Геотар-Медиа, 2012. - 928 с.
6. Клиническая оценка результатов лабораторных исследований. / Назаренко Г. И., Кишкун А. А. - М.: Медицина, 2000. - 544 с.
7. Клиническая лабораторная диагностика: учебное пособие. / А. А. Кишкун. - М.: ГЭ-ОТАР-Медиа, 2013. - 976 с.
8. Клинико-лабораторная диагностика заболеваний печени / Камышников В. С. .– М.: МЕДпресс-информ, 2013 г., 96 стр.: ил.
9. Drug-induced liver disease / Ed by N. Ka-plowitz, L. D. De Leve. 2nd ed. N. Y.: Informa Healthcare USA, 2007.,– 808 с.
10. Губергриц Н. Б. Гепатопротекторы: от теории к практике / Н. Б. Губергриц, Г. М. Лукашевич, П. Г. Фоменко. – М. : 4ТЕ Арт, 2012. – 52 с.
11. Гундерманн К.-Й. Новейшие данные о механизмах действия и клинической эффективности эссенциальных фосфолипидов / К.-Й. Гундерманн // Клинические перспективы га-строэнтерол., гепатол. – 2002. – № 2. – С. 21–24.
12. Гепатопротекторы-антиоксиданты в терапии больных с хроническими диффузными заболеваниями печени / И. И. Дегтярева, И. Н. Скрыпник, А. В. Невойт [и др.] // Новые мед. технологии. – 2002. – № 6. – С. 18–23.
13. S-Adenosyl-L-Methionine prevents intra-cellular glutathione depletion by GSH-depleting
drugs in rat and human hepatocytes / R. Jo-ver, X. Ponsoda, R. Fabra [et al.] // Drug Invest. – 1992. – Vol. 4, Suppl. 4. – P. 46–53.
14. Bray G. P. S-adenosylmethionine protects
against acetaminophen hepatotoxicity in two
mouse models / G. P. Bray, G. M. Tredger, R. Wil
liams // Hepatology. – 1992. – Vol. 15. – P. 297–
301.
15. Intracellular glutathione in human he-
patocytes incubated with S-adenosyl-Lmethi-
onine and GSH-depleting drugs / X. Ponsoda, R.
Jover, M. J. Gomez-Lechon [et al.] // Toxicology. –
1990. – Vol. 70. – P. 293–302.
16. Ипатова М. Г., Куцев С. И., Шумилов П. В., и др. Краткие рекомендации по ведению больных с синдромом Швахмана-Даймонда. Педиатрия. Журнал имени Г. Н. Сперанского. 2016;95(6):181–186.
17. Кучерявый Ю. А., Морозов С. В.. Гепа-топротекторы: рациональные аспекты применения: учеб. пособие для врачей – М. : Форте Принт, 2012. – 36 с.
18. Paumgartner G., Beuers U. Ursodeoxy-cholic acid in cholestatic liver disease: mechanisms of action and therapeutic use revisited [review] // Hepatology. 2002. 36 (3). Р. 525–531.

