Клинический случай фуросемид-ассоциированной нефропатии у ребенка с расстройством пищевого поведения
СтатьиО.Б. Кольбе1, канд. мед. наук, Г.Б. Бекмурзаева2, 3, канд. мед. наук, Е.В. Внукова1, С.Г. Семин1, канд. мед. наук, Е.В.Тамбиева2, канд. мед. наук
1 ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
2 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
3 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
Резюме. Большинство детей и подростков с расстройством пищевого поведения (РПП) длительное время скрывают от семьи и врачей свою проблему. При этом они нуждаются не только в наблюдении психиатра, но и участии других специалистов, в связи с развитием широкого спектра соматических осложнений.
Одним из проявлений РПП является длительный самостоятельный прием слабительных средств и диуретиков. Неосведомленность врачей о приеме пациентом лекарств приводит к тому, что клинические проявления осложнений злоупотребления препаратами интерпретируются как самостоятельные диагнозы и проводится безуспешное лечение.
Одной из главных проблем приема диуретиков является развитие фуросемид-ассоциированной нефропатии, последствия которой требуют комплексной терапии.
В статье приводится описание клинического случая фуросемид-ассоциированной нефропатии как одного из клинических осложнений неконтролируемого приема мочегонных препаратов у пациентов с расстройством пищевого поведения.
Ключевые слова: дети, лекарственная нефропатия, фуросемид, расстройство пищевого поведения
Summary. Most children and adolescents with eating disorders (ED) hide their problem from family and doctors for a long time. At the same time, they need not only the supervision of a psychiatrist, but also the participation of other specialists, due to the development of a wide range of somatic complications.
One of the manifestations of eating disorder is long-term self-administration of laxatives and diuretics. The lack of awareness of doctors about the patient’s medication intake leads to the fact that clinical manifestations of complications of drug abuse are interpreted as independent diagnoses and unsuccessful treatment is carried out.
One of the main problems of taking diuretics is the development of furosemide-associated nephropathy, the consequences of which require complex therapy.
The article describes a clinical case of furosemide-associated nephropathy, as one of the clinical complications of uncontrolled use of diuretics in patients with an eating disorder.
Keywords: children, drug-induced nephropathy, furosemide, eating disorder
Для цитирования: Клинический случай фуросемид-ассоциированной нефропатии у ребенка с расстройством пищевого поведения / О.Б. Кольбе [и др.] // Практика педиатра. 2024. № 2. С. 37-41.
For citation: A clinical case of furosemide-associated nephropathy in a child with an eating disorder / O.B. Kolbe [et al.] // Pediatrician’s practice. 2024;(2):37-41. (in Russ.)
Введение
Почки являются очень важным и в то же время хрупким органом человека. Они выполняют большое количество функций: гомеостатическую, метаболическую, эндокринную. Любой препарат при неправильном приеме является потенциально нефротоксичным [1]. Предпосылки к этому:
- интенсивное кровоснабжение почек, и как результат более длительный контакт препарата и структур почки;
- участие ферментных систем клеток канальцев в метаболизме препаратов;
- участие в процессе элиминации лекарства путем клубочковой фильтрации и канальцевой экскреции. Факторы риска развития лекарственной нефропатии:
Таблица 1.
Вопросы скрининговой шкалы SCOFF
| 1. Вызываете ли вы у себя рвоту, потому что чувствуете дискомфорт от переедания? |
| 2. Тревожит ли вас потеря контроля над своим питанием? |
| 3. Потеряли ли вы более 6 кг в течение последних 3 месяцев? |
| 4. Считаете ли вы себя полным, даже когда окружающие говорят вам обратное? |
| 5. Можете ли вы сказать, что еда занимает доминирующее положение в вашей жизни? |
- возраст пациента (дети, особенно младшего возраста, пожилые люди);
- наличие хронических заболеваний (особенно влияющих на функции почек и печени);
- психические нарушения, в том числе расстройство пищевого поведения (самостоятельный, бесконтрольный прием лекарств);
- использование больших дозировок и/или длительный прием одного препарата;
- полипрагмазия (одновременный прием большого количества лекарственных средств, часто неконтролируемый).
Чаще всего поражение почек возникает при самостоятельном приеме лекарственных средств без назначения врача. Лекарственные средства могут повреждать почки различным образом: прямое и непрямое токсическое воздействие, иммунологическое поражение. А также на различных уровнях: повреждение клубочков, канальцев, закупорка канальцев [2].
В результате поражения почечной ткани может развиться один из вариантов лекарственной нефропатии:
- острое почечное повреждение,
- хроническая болезнь почек,
- тубулоинтерстициальный нефрит,
- острый канальцевый некроз,
- тубулопатии,
- гломерулонефрит.
Вариант развития нефропатии зависит от препарата, но иногда сложно предположить заранее, каким именно будет поражение у конкретного пациента при приеме определенного препарата.
Одно из заболеваний, которое повышает риск развития лекарственной нефропатии, - расстройство пищевого поведения. Расстройство пищевого поведения (РПП) - психическое расстройство, характеризующееся нарушением поведения в отношения питания или контроля веса. К РПП относятся нервная анорексия, нервная булимия, компульсивное переедание, расстройство избегающего или ограничительного потребления пищи и другие расстройства (психогенная рвота, поедание несъедобного, синдром ночного питания и т. д.) [3]. По последним данным, 22% детей и подростков в мире страдают от различных типов расстройства [4]. Заболевание приводит к соматическим осложнениям всех органов и систем, а также нарушению социальной адаптации. В связи с этим пациент должен наблюдаться не только психиатром, но и врачами других специальностей [5]. Отягощающим фактором для выявления таких пациентов является то, что они скрывают от окружающих наличие РПП, приемы снижения веса проводят тайно и в поле зрения медицинских сотрудников попадают редко и в тяжелом состоянии. С пациентами, у которых подозревается РПП, очень важно выстраивать доверительные отношения, для того чтобы оказать им полноценную помощь. В 2000 г. коллективом ученых под руководством J.F. Morgan была разработана скрининговая шкала SCOFF (табл. 1), которая помогает с высокой точностью выявить наличие РПП у пациента [6]. При наличии двух и более положительных ответов на предлагаемые вопросы, пациента необходимо направить на консультацию к специалисту по РПП.
Кроме нарушения питания, для достижения цели больные используют дополнительные меры: самоиндуцированная рвота, повышенные физические нагрузки, прием лекарственных средств. Чаще всего пациенты прибегают к использованию петлевых и тиазидных диуретиков, слабительных препаратов. Целями применения мочегонных препаратов являются быстрое снижение массы тела и противоотечный эффект [7, 8].
Фуросемид блокирует Na+, K+, Cl- каналы, в связи с чем нарушается реабсорбция натрия, увеличивается выделение осмотически связанной воды. Одновременно с этим увеличивается секреция калия, кальция и магния. В результате увеличивается диурез, уменьшаются отеки. Однако вследствие повышенных потерь натрия активируется ренин-ангиотензин-альдостероновая система, увеличивается реабсорбция натрия, задерживается вода в организме, снижается диурез, нарастают отеки. Для дальнейшего получения эффекта от препарата пациенту необходим прием препарата в повышенной дозировке. Таким образом, образуется порочный круг (рис. 1), приводящий к фуросемид-ассоциированой нефропатии. Осложнения РПП в виде гипопротеинемии, электролитных нарушений и хроническая регидратация утяжеляют и ускоряют течение нефропатии [8].
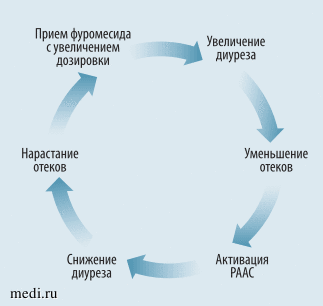 Рис. 1. «Порочный круг» приема фуросемида Составлено автором
Рис. 1. «Порочный круг» приема фуросемида Составлено автором
При обследовании пациента могут быть зарегистрированы клинические изменения в различных комбинациях между собой [9, 10]. Далее в виде схемы мы представили взаимосвязь биохимических изменений и клинических проявлений фуросемид-ассоциированной нефропатии (рис. 2).
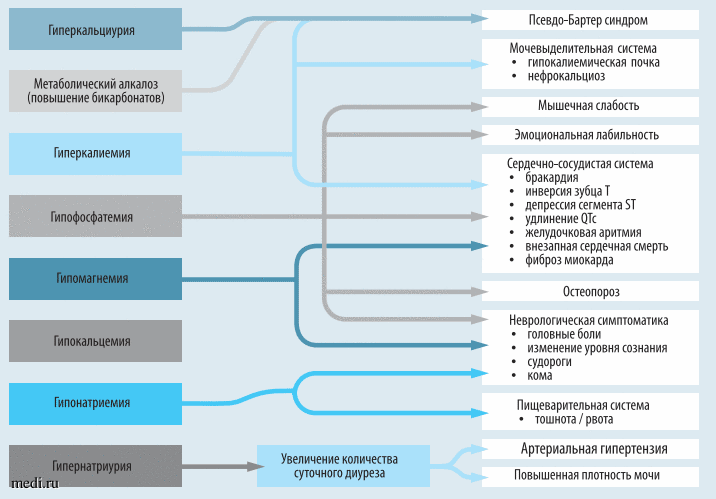 Рис 2. Взаимосвязь биохимических изменений и клинических проявлений фуросемид-ассоциированной нефропатии Составлено автором
Рис 2. Взаимосвязь биохимических изменений и клинических проявлений фуросемид-ассоциированной нефропатии Составлено автором
Для оказания помощи пациенту с развившейся фуросемид-ассоциированной нефропатией необходим комплексный подход. При начале терапии нельзя единовременно резко снижать или полностью отменять фуросемид, важно соблюдать постепенное уменьшение дозировки. Также на весь период снижения дозировки мочегонного препарата до полной его отмены необходимо назначение спиронолактона для подавления активности РААС. Для нормализации электролитного состава назначаются пероральные формы солей, при развитии тяжелых дефицитов (гипокалиемия <2,5 ммоль/л, гипонатриемия <120 ммоль/л, гипомагниемия <1,25 мг/дл) и развернутой клинической картины нефропатии проводится внутривенная инфузионная терапия [9].
Клиническое наблюдение
Девочка У, 15 лет, 2006 года рождения. Планово госпитализирована в нефрологическое отделение ДГКБ им. З.А. Башляевой в июле 2022 г. по направлению участкового педиатра.
Анамнез жизни. Ребенок от I беременности, протекавшей физиологически. Роды I на 39-40-й неделе, самостоятельные. Ребенок закричал сразу, оценка по шкале Апгар 8/9 баллов. Масса тела при рождении 3550 г, длина 50 см. Росла и развивалась по возрасту. Перенесенные заболевания: ветряная оспа (в 4 года), ОРВИ. Наследственный анамнез: со слов матери, не отягощен, заболеваний мочевыделительной системы у родственников нет.
Анамнез заболевания: в ноябре 2021 г. самостоятельно начала прием фуросемида в дозировке 80 мг в сутки с целью снижения веса и устранения отеков. В феврале 2022 г. у девочки появились жалобы на головные боли, головокружение, тошноту, слабость, эпизоды ощущения сердцебиения. В связи с вышеописанными жалобами обратилась к педиатру и неврологу, о факте приема фуросемида врачам не сообщила. При амбулаторном обследовании установлен диагноз вегетативно-сосудистой дистонии (ВСД). В марте 2022 г. - эпизод потери сознания, в связи с чем бригадой СМП доставлена в Морозовскую ДГКБ с диагнозом ВСД, от госпитализации родители ребенка отказались. Из-за сохраняющихся жалоб по назначению участкового педиатра в апреле 2022 г. проведен биохимический анализ крови: калий 2,9 ммоль/л, натрий 138,6 ммоль/л, мочевина 4,8 ммоль/л, креатинин 86 мкмоль/л, холестерин 6,21 ммоль/л. Дополнительное обследование и лечение не проводилось. В мае 2022 г. девочка обратилась к детскому гинекологу в связи с отсутствием менструаций с июня 2021 г., сообщила врачу о соблюдении строгой диеты. Гинекологом рекомендована витаминотерапия и расширение рациона питания. В июне 2022 г. девочка сама пробовала прекратить прием фуросемида, но в связи с появлением на третьи сутки параорбитальной отечности и отечности голеней возобновила прием препарата. Повторно обследована амбулаторно в июне 2022 г. При биохимическом исследовании крови: общий белок 71 г/л, мочевина 4,7 ммоль/л, креатинин 71,3 мкмоль/л, калий 3,34 ммоль/л, натрий 144,2 ммоль/л, хлор 97 ммоль/л, рСКФ по формуле Шварца 80,9 мл/мин. В общем анализе мочи: плотность 1005, остальные показатели в пределах нормы. При ультразвуковом исследовании (УЗИ) почек патологии не выявлено. Консультирована нефрологом. На приеме сообщила врачу, что самостоятельно принимает фуросемид 40 мг в сутки. Учитывая данные обследования и анамнеза, ребенок был записан на плановую госпитализацию через две недели в нефрологическое отделение ДГКБ им. З.А. Башляевой. Врачом рекомендовано до момента госпитализации продолжить прием фуросемида в дозировке 40 мг в сутки, дополнительно назначен калия аспарагинат + магния аспарагинат (175 + 175) по 1 таблетке в сутки.
При осмотре в отделении: рост 160 см (25-50% перцентиль), вес 52,5 кг (25-50% перцентиль), ИМТ 20,5 кг/кв.м. (50-75% перцентиль). Состояние средней тяжести. Кожные покровы бледно-розовые, чистые. Периферические лимфоузлы не увеличены. При аускультации: в легких дыхание везикулярное, хрипов нет, ЧД 18 в мин. Перкуторные границы сердца соответствуют возрасту. Тоны сердца ясные, ритмичные. АД 104/67 мм рт. ст., ЧСС 64 уд/мин. При пальпации живот мягкий, безболезненный. Печень и селезенка не увеличены. Физиологические отправления в норме. Половые органы развиты по женскому типу, соответственно возрасту. При осмотре на себя обращали внимание снижение мышечного тонуса, мышечной силы, эмоционального фона.
При обследовании: клинический анализ крови, коагулограмма без патологии. В биохимическом анализе крови отмечались гиперхолестеринемия (холестерин 6-9,4 мкмоль/л, норма <4,5 ммоль/л), гиперурикемия (мочевая кислота 442-533 мкмоль/л, норма <340 ммоль/л), гиперфосфатемия (фосфор неорганический 1,7 при норме 1-1,35 ммоль/л), гипокалиемия (2,86 ммоль/л, норма 3,5-5 ммоль/л), креатинин 62-75 мкмоль/л, дефицит витамина Д (11,40 нг/ мл), рСКФ = 94 мл/мин / 1,73 м2. При исследовании КОС: метаболический алкалоз (pH 7,468 при норме 7,35-7,45; ВЕ 5,1-5,4 ммоль/л, норма от -2,3 до 2,3). В общем анализе мочи удельный вес 1020, белок 0,025 г/л. В биохимическом анализе мочи повышена экскреция кальция - кальций-креатининовый коэффициент составил 0,86 (норма <0,6). Суточная потеря белка 0,08 г/сут, микроальбумин в моче 9,8 мг/л. Анализ мочи по Зимницкому: удельный вес 10061019, общий диурез 430 мл.
При УЗИ размеры почек в норме, диффузные изменения почек по типу медуллярного нефрокальциноза. На ЭКГ синусовая брадикардия, ЧСС 4856 уд/мин (норма 60-103).
Учитывая самостоятельный прием фуросемида в анамнезе, выявленные изменения по результатам обследования, назначена поддерживающая дозировка фуросемида 40 мг/сут, спиронолактон 75 мг/сут и калия аспарагинат + магния аспарагинат (175 + 175 мг) по 2 таблетки 3 раза в сутки под контролем электролитов крови. Несмотря на проводимую терапию в течение трех дней, отмечалось усугубление гипокалиемии до 2,7-2,6 ммоль/л. При повторном и доверительном общении с пациенткой выяснено, что последние несколько месяцев она принимала фуросемид в дозировке 400 мг в сутки. Принято решение об увеличении дозы фуросемида до 320 мг/ сут. На четвертые сутки лечения в связи с прогрессирующей гипокалиемией до 2,3 ммоль/л девочка была переведена в ОРИТ, где проводилась инфузионная терапия (декстроза, калия хлорид + кальция хлорид + магния хлорид + натрия ацетат + натрия хлорид + яблочная кислота + магния сульфат + натрия гидрокарбонат). На седьмые сутки уровень калия крови нормализовался до уровня 3,8 ммоль/л, пациентка переведена обратно в нефрологическое отделение, где продолжена терапия фуросемидом, спиронолактоном и калия аспарагинатом + магния аспарагинатом в прежнем объеме.
Пациентке установлен диагноз: фуросемид-ассоциированная нефропатия. Хроническая болезнь почки, стадия 1 (рСКФ = 94 мл/мин/1,73 м2), дефицит витамина D.
После стабилизация состояния пациентка выписана домой с рекомендациями: консультация медицинского психолога, психиатра, продолжение постепенного снижения фуросемида (по 10 мг 1 раз в 3 дня, на момент выписки дозировка составляла 300 мг/сут), прием спиронолактона 75 мг/сут на весь период приема фуросемида и калия аспарагинат + магния аспарагинат (175 + 175 мг) по 2 таблетки 3 раза в сутки, контроль уровня калия в сыворотке крови 1 раз в неделю.
В дальнейшем пациентке под контролем нефролога в поликлинике по месту жительства удалось успешно отменить фуросемид. Однако девочка вновь самостоятельно возобновила прием препарата и в настоящее время наблюдается нефрологом и психиатром.
В нефрологическом отделении в 2023 г. наблюдались еще две 16-летние девочки с диагностированной фуросемид-ассоциированной нефропатией. Обе пациентки также самостоятельно принимали фуросемид на протяжении 1 и 3-х лет соответственно, в дозах от 40 до 400 мг с целью снижения веса при объективном отсутствии избыточности питания. На фоне длительного приема фуросемида у девочек, как и в предыдущем клиническом случае, развивались отеки и уменьшался диурез, что служило поводом для увеличения дозы препарата. Кроме того, у пациенток с первых месяцев приема фуросемида отмечались жалобы на эпизоды синкопе, приступы тошноты, онемения пальцев, боли в области поясницы. При обследовании выявлены разной степени выраженности электролитные нарушения: гипокалиемия, гипомагниемия, гиперфосфатемия; глюкозурия (при отсутствии гипергликемии), умеренная протеинурия. У одной из девочек наблюдалось снижение рСКФ до 83 мл/мин/1,73 м2, у другой -метаболический алкалоз с pH 7,44-7,49. По данным УЗИ почек: выраженный медуллярный нефрокальциноз (синдром «белых пирамид»). Помимо коррекции метаболических нарушений, пациенткам была назначена и нефропротективная терапия ингибитором ангиотензинпревращающего фермента, рекомендовано наблюдение нефролога, психолога и психиатра для предотвращения прогрессирования хронической болезни почек.
Заключение
В клиническом случае представлен вариант течения фуросемид-ассоциированной нефропатии, потребовавшей перевода пациентки в ОРИТ и назначения активной инфузионной терапии в связи с развитием критической гипокалиемии.
Хотелось бы обратить внимание, что пациенты с РПП могут иметь средние показатели ИМТ, поэтому при внешнем осмотре не возникает подозрений о наличии у ребенка проблем с питанием. В случае трудностей поиска причин заболевания у пациента использование скрининговой шкалы SCOFF помогает определить наличие у пациента РПП с высокой достоверностью. Далее при доверительной беседе с лечащим врачом дети могут признаться в злоупотреблении диуретиками.
При затруднении доказательства самостоятельного приема препаратов необходимо проведение дифференциального диагноза с наследственными тубулопатиями, протекающими со схожей клинической картиной.
Литература
1. Клинические рекомендации: Тубулоинтерстициальные болезни почек. 2021. С. 58-59.
2. Громыко В.Н., Пилотович В.С. Лекарственные нефропатии // Медицинские новости. 2016. № 6 (261). С. 49-52.
3. Treasure J., Duarte T.A., Schmidt U. Eating disorders // Lancet. 2020. Vol. 395 (10227). P. 899-911.
4. Global Proportion of Disordered Eating in Children and Adolescents: A Systematic Review and Meta-analysis / J.F. Lopez-Gil [et al.] // JAMA Pediatrics. 2023. Vol. 177, No. 4. P. 363372.
5. Hornberger L.L., Lane M.A. Committee on adolescence. Identification and Management of Eating Disorders in Children and Adolescents // Pediatrics. 2021. Vol. 147, No. 1. P. e1-e23
6. Eating Disorder Screening: a Systematic Review and Meta-analysis of Diagnostic Test Characteristics of the SCOFF / A.M. Kutz [et al.] // Journal of General Internal Medicine. 2020. Vol. 35, No. 3. P. 885-893.
7. Диагностика и терапия расстройств пищевого поведения: мультидисциплинарный подход / Ю.Б. Барыльник, Н.В. Филиппова, А.А. Антонова [и др.] // Социальная и клиническая психиатрия. 2018. № 1. C. 50-57.
8. Николаев А.Ю., Захарова Е.В., Тареева А.Б. Особенности поражения почек при злоупотреблении салуретиками и неконтролируемом голодании при анорексии // Терапевтический архив. 2014. № 6. С. 84-87.
9. Puckett L. Renal and electrolyte complications in eating disorders: a comprehensive review // Journal of Eating Disorders. 2023. No. 11 (1). P. 26.
10. Hypokalemic nephropathy / H.B. Yalamanchili [et al.] // Kidney International Reports. 2018. No. 3 (6). P. 1482-1488.

