Острое повреждение почек у новорожденных различного гестационного возраста: этиология, патогенез, особенности клинико-лабораторной диагностики
СтатьиО.Л. Чугунова1, д-р мед. наук, профессор, С.В. Думова1, канд. мед. наук, доцент, А.А. Ханмагомедова1, С.И. Жогин2, П.В. Шумилов1, д-р мед. наук, профессор
1 ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, г. Москва
2 ГБУЗ «ММКЦ «Коммунарка» Департамента здравоохранения города Москвы», перинатальный центр, г. Москва
Резюме. В настоящее время на фоне снижения уровня младенческой смертности увеличивается количество диагностируемых у новорожденных детей патологических состояний со стороны многих органов и систем, в том числе и острого повреждения почек. Чаще всего это тяжелейшее состояние, увеличивающее риск неблагоприятного исхода, отмечается у глубоко недоношенных новорожденных неонатальных отделений реанимации и интенсивной терапии. В статье обобщены данные по классификации и критериям диагностики острого повреждения почек (ОПП), используемые на современном этапе, рассмотрены возможные звенья патогенеза и факторы развития хронической болезни почек у детей, перенесших острое повреждение почек в периоде неонатальной адаптации, представлены исследования, позволяющие на ранних сроках и достоверно диагностировать ОПП в неонатальный период.
Ключевые слова: острое повреждение почек, неонатальный период, глубоко недоношенные новорожденные, маркеры ОПП в моче, цистатин С, NGAL, KIМ-1, хроническая болезнь почек
Summary. At present, against the background of decreasing infant mortality rate, the number of pathologic conditions diagnosed in newborn children from many organs and systems, including acute kidney injury, is increasing. Most often this most severe condition, which increases the risk of unfavorable outcome, is noted in patients, especially deepterm newborns, of neonatal intensive care units. The article summarizes the data on the classification and diagnostic criteria of acute kidney injury used at the present stage, considers possible links of pathogenesis and factors in the development of chronic kidney disease in children who have suffered acute kidney injury in the period of neonatal adaptation, presents studies that allow early and reliable diagnosis of AKI in the neonatal period.
Keywords: acute kidney injury (AKI), neonatal period, profound premature neonates, urinary markers of AKI, cystatin C, NGAL, KIM-1, chronic kidney disease
Для цитирования: Острое повреждение почек у новорожденных различного гестационного возраста: этиология, патогенез, особенности клинико-лабораторной диагностики / О.Л. Чугунова [и др.] // Практика педиатра. 2024. № 2. С. 42-49.
For citation: Acute kidney injury in newborns of different gestational age: etiology, pathogenesis, features of clinical and laboratory diagnostics I O.L. Chugunova [et al.] // Pediatrician's practice. 2024;(2):42-49. (in Russ.)
По данным Росстата, младенческая смертность в России имеет четкую тенденцию к снижению и составляет 4,5‰. Это связано с изменением подхода к выхаживанию новорожденных, четкой маршрутизацией пациентов, развитием медицинских технологий. Одной из сложнейших проблем выхаживания является работа с глубоко недоношенными новорожденными. Летальность среди этой группы детей в 30 раз выше, чем среди доношенных. В России ежегодно рождается около 0,2% детей с экстремально низкой (ЭНМТ) и 0,8% недоношенных с низкой массой тела [1]. Ведущей причиной смертности среди новорожденных различного гестационного возраста остаются инфекционные заболевания, однако поражение других органов и систем, развитие полиорганной недостаточности влияет на прогноз выхаживаемых новорожденных в плане увеличения летальности [2]. Одним из состояний, существенно ухудшающих прогноз заболевания у новорожденного, является развитие острого повреждения почек (ОПП). Результаты исследований свидетельствуют, что на фоне ОПП увеличивается процент формирования бронхолегочной дисплазии (БЛД), усиливается риск неврологических осложнений, в первую очередь внутрижелудочковых кровоизлияний (ВЖК) нетравматического генеза, развивается артериальная гипертензия [3].
ОПП - полиэтиологический синдром, характеризующийся острым снижением гомеостатических функций почек, приводящий к накоплению продуктов азотистого обмена, нарушению водно-электролитного и кислотно-основного баланса, характеризующееся резким, на протяжении менее 48 часов, нарастанием креатинина плазмы более чем на 50% и (или) объективно отмеченной олигурией (снижение диуреза до значений менее 0,5 мл/кг/час в течение более чем 6 часов) [4]. Необходимо отметить, что, помимо диуреза и уровня сывороточного креатинина, в современной классификации KDIGO (в модификации для новорожденных М. Zappitelli и др., 2017 г.) учитываются темпы нарастания креатинина у конкретного новорожденного в течение 7 дней [5] (таблица 1).
Таблица 1.
Клинические практические рекомендации KDIGO по острому почечному повреждению в модификации для новорожденных
| Стадии | Критерии сывороточного креатинина (SCr) | Критерии объема мочи за сутки |
| 1 | Увеличение SCr на ≥0,3 мг/дл (≥26,5 мкмоль/л) в течение 48 часов или в 1,5-1,9 раза выше базального уровня в течение 7 дней | <1,0 мл/кг/ч в течение 24 часов |
| 2 | Увеличение SCr более чем в 2-2,99 раза от базального уровня | <0,5 мл/кг/ч в течение 24 часов |
| 3 | Увеличение SCr в 3 раза от базального уровня или увеличение ≥2,5 мг/дл (≥221 мкмоль/л) или начало заместительной почечной терапии (ЗПТ) | <0,3 мл/кг/ч в течение 24 часов |
До настоящего момента нет единого мнения о достоверности представленных критериев. В основном это касается уровня креатинина в сыворотке крови в первые 48 часов жизни ребенка. Многие исследователи отмечают, что в первые двое суток изменения уровня креатинина характеризуют работу плаценты матери, другие подтверждают, что показатели сывороточного креатинина достоверно отражают количество и функциональную активность нефронов и являются клинически значимыми [6]. Важным показателем является уровень диуреза и его динамика в течение суток. Исследователями установлено, что снижение диуреза у новорожденных менее 1,5-1,0 мл/кг в час были связаны с увеличением риска летального исхода [6]. Однако у новорожденных и недоношенных детей часто наблюдается неолигурическая форма ОПП [7].
Данные по частоте ОПП у новорожденных отличаются у разных авторов и составляют от 8,0 до 29,9%, а уровень смертности достигает 10,0-61,0% [7-9]. Среди пациентов отделений реанимаций и интенсивной терапии новорожденных (ОРИТН) ОПП возникает в 24-56% случаев [7, 10-14]. У глубоко недоношенных детей ОПП развивается практически в 50% случаев, что способствует повышению риска летального исхода практически в три раза [15].
Формирование нефрона начинается на 5-й неделе гестации, а завершение нефрогенеза наблюдается на сроке от 26 до 34-36 недель гестации. Количество образующихся нефронов у разных людей колеблется от 200 000 до 2-3 миллионов. Это связано с различными малоизученными факторами, в том числе гестационным возрастом и задержкой внутриутробного роста [16]. Кроме того, есть экспериментальные данные, позволяющие предположить влияние ОПП в раннем неонатальном периоде на дальнейший нефрогенез [17]. Данные микроскопии свидетельствуют о структурно-функциональных особенностях почек и количества нефронов у глубоко недоношенных детей [16]. В нефронах недоношенных детей с экстремально низкой массой тела отмечается ускоренное формирование почечных телец и канальцев гораздо больших размеров, чем у доношенных новорожденных, что может рассматриваться как развитие компенсаторной гипертрофии почек у глубоко недоношенных. При десинхронном нефроногенезе у преждевременно родившихся детей наблюдаются как морфометрические признаки нефронов, характерных для 1-12 лет, так и структуры, схожие с почечными тельцами первичной почки человека. Десинхронизация нефрогенеза может приводить к снижению функции почек [16]. Кроме диснефрогенеза, у новорожденных наблюдается становление почечного кровотока в период ранней неонатальной адаптации. В первую неделю жизни практически удваивается почечный кровоток и перфузионное давление [18]. Распределение почечного кровотока идет от более глубоких зрелых юкстагломерулярных клубочков до самых поверхностных, кортикальных. Воздействие в этот момент гипоксии, инфекционного агента, нефротоксичных препаратов может привести к тяжелому повреждению почек при развитии септических осложнений, нарушений гемодинамики, гипоксических состояний [19]. Функциональная незрелость нефрона обусловливает снижение концентрационную способность почек, что предрасполагает к потерям жидкости, электролитному дисбалансу и развитию азотемии. По причинам развития ОПП у детей неонатального периода является полиэтиологическим состоянием. Выделяют преренальные, ренальные и постренальные факторы [20, 21]. В 85% случаев диагностируется гипоперфузия почек, связанная с преренальным воздействием. Чаще всего к преренальному ОПП у новорожденных приводят инфекционно-воспалительные заболевания, артериальная гипотензия и шоковые состояния, асфиксия, гипотермия, снижение сердечного выброса, анемия и гиповолемия, использование нефротоксичных препаратов [22]. Преимущественно в неонатальный период применяют такие нефротоксичные препараты, как аминогликозиды, ванкомицин, фуросемид, нестероидные противовоспалительные средства (НПВС), хлоротиазид, спиронолактон, пиперациллин-тазобактам, ацикловир, амфотерицин B [23].
В 11-12% случаев ОПП в неонатальном периоде имеет ренальный характер, возникает при повреждении почечной паренхимы с гистологической картиной острого тубулярного или изолированного коркового некроза [24]. Одной из частых причин развития ренального повреждения является тромбоз почечных вен или артерии. Также это может быть связано с длительно действующими и некупирующимися пре- или постренальными причинами [25].
В 3% случаев ОПП у новорожденных имеет постренальный характер. В результате обструкции, обусловленной врожденными пороками развития, мицелием грибов, внешней компрессией развивается тубулярный некроз, что в результате способствует формированию ренальной формы ОПП [7, 8, 26]. Так же ОПП, возникшее в неонатальный период, можно разделить на раннюю и позднюю формы, в зависимости от времени манифестации. Ранняя форма ОПП развивается в первые 7 суток жизни и может быть вызвана перенесенной гипоксией, гиповолемией, инфекционно-воспалительным процессом, воздействием нефротоксичных препаратов, гипербилирубинемией [27]. Позднее ОПП, возникающее после 7 суток жизни, чаще всего связано с септическим процессом, энтероколитом, пороками развития органов мочевой системы, функционирующим гемодинамически значимым артериальным протоком, использованием вазопрессоров, НПВС, нефротоксичных антибиотиков, диуретиков, метилксантинов [28].
Частота развития ОПП коррелирует с гестационным возрастом. Так, по данным исследования AWAKEN (2017 г.), эпизоды ОПП отмечались у 45% недоношенных новорожденных с гестационным возрастом менее 29 недель и только у 14% недоношенных новорожденных, родившихся на сроке с 29 по 36 неделю гестации [29]. Увеличение частоты поражения почек у недоношенных и глубоко недоношенных детей связано с повышенным риском развития постгипоксических состояний, развитием дыхательных нарушений и проведения искусственной вентиляции легких (ИВЛ), инфекционных осложнений, нестабильностью гемодинамики. Функционирующий открытый артериальный проток (ОАП) также повышает риск развития ОПП. При наличии гемодинамически значимого ОАП проводится консервативное закрытие с использованием НПВС, которые также обладают и нефротоксическим действием. Однако развитие тяжелого ОПП менее вероятно при эффективном терапевтическом закрытии гемодинамически значимого ОАП [30].
Кроме того, дополнительным риском развития ОПП у недоношенных является неполный нефрогенез и небольшое количество нефронов, высокое сопротивление в почечных сосудах, низкая скорость клубочковой фильтрации, высокая активность ренина плазмы, снижение межкортикальной перфузии и недостаточная реабсорбция натрия в проксимальных канальцах [21, 30]. Ускоренное созревание почек у недоношенных новорожденных, более высокий процент морфологически аномальных клубочков и меньшее количество функциональных нефронов, является не только предрасполагающим фактором к развитию ОПП, но и способствует формированию хронической болезни почек (ХБП) в последующем [31].
Одной из самых частых причин ОПП в неонатальный период является как внутриутробная, так и постнатальная гипоксия. В зависимости от интенсивности и длительности переносимой гипоксии прогноз разный - может наблюдаться как полное восстановление почечного кровотока, так и формирование фиброза [32]. Развитие фиброза связано с течением воспалительного асептического процесса, нарушением микроциркуляции с повышением экспрессии профибротических цитокинов и фактора роста, снижением экспрессии сосудистых факторов, в том числе фактора роста эндотелия сосудов с усугублением нарушения микроциркуляции, уменьшением перитубулярных капилляров, активацией перицитов и их дифференцировкой в фибробласты. Активация фибробластов с повышением экспрессии профибротических цитокинов и снижением экспрессии сосудистых факторов приводит к развитию ХБП [26, 33]. Кроме того, гистиогенез почек наиболее зависим от длительности и тяжести переносимой гипоксии. При лечении гипоксии часто развиваются состояния, связанные с гипероксией с развитием окислительного взрыва на фоне дефицита антиоксидантных систем у новорожденных, приводящего к повреждению эпителиальных клеток канальцев, ЦНС, легких, почек и других органов и систем [34].
Важнейшим патогенетическим механизмом развития ОПП является воспалительная реакция, поэтому полиморфизм генов интерлейкина-6 (IL-6), интерлейкина-10 (IL-10), интерлейкина-18 (IL-18) и фактора некроза опухоли-альфа (TNF-a) может определить предрасположенность к развитию ОПП и прогнозировать его исход, особенности клиники и исхода у конкретного пациента, однако исследователи не пришли по этому поводу к единому мнению [35-37].
Одним из основных процессов в развитии воспаления паренхимы почек является лимфангиогенез. Васкулоэндотелиальный фактор роста тип С (vascular endothelial growth factor, VEGF-C) - регулирующий лимфангиогенез цитокин. VEGF-C действует через рецепторы VEGFR-2 (vascular endothelial growth factor receptor) и VEGFR-3 на поверхности эндотелиоцитов. Рецепторы VEGFR-3 экспрессируются преимущественно лимфатическими эндотелиоцитами, а VEGFR-2 представлены на поверхности эндотелиоцитов и лимфатических, и кровеносных сосудов [38]. Учитывая важное действие VEGF-C на лимфатические эндотелиоциты, можно предположить, что его уровень имеет важное значение для лимфоангиогенеза [39, 40].
Своевременная диагностика ОПП в период новорожденности затруднена, так как уровень креатинина, скорость клубочковой фильтрации и диурез в неонатальном периоде, особенно у недоношенных, преимущественно в первые дни жизни, не всегда достоверно отражают нарушение почечных функций. К тому же детям в критическом состоянии, при котором чаще всего развивается ОПП, проводится инфузионная терапия, что может влиять на диурез и уровень креатинина [41].
Как уже было представлено выше, у новорожденных детей различного гестационного возраста достаточно часто наблюдается неолигурическая форма ОПП [42].
В первые двое суток жизни нормальным считается диурез 0,5-2,5 мл/кг в час, после вторых суток жизни - уже 3-4 мл/кг в час [43]. Транзиторная олигурия, отмечающаяся в период ранней неонатальной адаптации, является переходным физиологическим состоянием. Патологическая олигурия у новорожденных - постоянное снижение диуреза менее 30% возрастной нормы, <0,5 мл/кг в час в первые двое суток и <1 мл/кг в час до конца первой недели жизни [44].
Скорость клубочковой фильтрации (СКФ) у детей первого года низкая как в абсолютном значении, так и с поправкой на площадь поверхности тела (миллилитров в минуту на 1,73 метра2). У глубоко недоношенных детей, родившихся ранее 28 недель гестации, СКФ составляет всего 0,7 мл/мин на кг в возрасте 1 дня и незначительно повышается в течение первых нескольких недель жизни. Уровень сывороточного креатинина, особенно в первые дни жизни, зависит не только от мышечной массы, канальцевой секреции креатинина, пола, возраста и катаболической направленности обмена, но и от уровня сывороточного креатинина матери. К тому же его повышение наблюдается при потере 25-50% почечных функций [21]. У доношенных новорожденных в норме самые высокие цифры креатинина, около 100 мкмоль/л наблюдаются в первые сутки жизни, а затем они снижаются до 2232 мкмоль/л в течение первого месяца жизни (таблица 2) [46]. Нарастание креатинина более 106 мкмоль/л до 7 дня жизни и более 88 мкмоль/л у детей старше 1 недели жизни, а главное, повышение его уровня в динамике считаются прогностически неблагоприятными признаками [45].
Таблица 2.
Нормальные показатели креатинина у детей
| Возраст | Мальчики (креатинин, мкмоль/л) | Девочки (креатинин, мкмоль/л) | ||
| Нижняя граница | Верхняя граница | Нижняя граница | Верхняя граница | |
| 0-14 дней | 27 | 81 | 27 | 81 |
| 14 дней - 1 год | 14 | 34 | 14 | 34 |
| 1-3 года | 15 | 31 | 15 | 31 |
| 3-5 лет | 23 | 37 | 23 | 37 |
| 5-7 лет | 25 | 42 | 25 | 42 |
| 7-9 лет | 30 | 48 | 30 | 48 |
| 9-10 лет | 28 | 57 | 28 | 57 |
| 11 лет | 36 | 64 | 36 | 64 |
| 12 лет | 36 | 67 | 36 | 67 |
| 13 лет | 38 | 76 | 38 | 74 |
| 14 лет | 40 | 83 | 43 | 75 |
| 15 лет | 47 | 98 | 44 | 79 |
| 16 лет | 54 | 99 | 48 | 81 |
| > 16 лет | 59 | 104 | 45 | 84 |
У недоношенных новорожденных уровень креатинина в первые трое суток жизни наблюдается на уровне 114,9-132,6 мкмоль/л (таблица 3) [44], а затем к концу второго месяца жизни нормализуется до уровня 44,2-53 мкмоль/л [47].
Таблица 3.
Уровень креатинина у недоношенных новорожденных различного гестационного возраста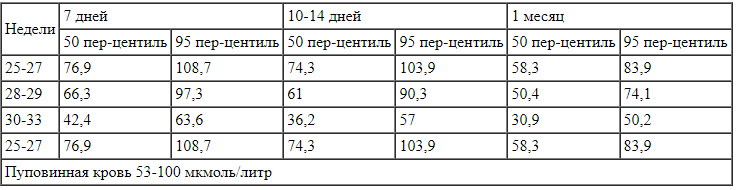 Вышеперечисленные особенности диагностики часто не позволяют своевременно диагностировать ОПП у новорожденных, что обусловливает необходимость искать и использовать более достоверные маркеры ОПП. Не всегда есть возможность частого забора крови у новорожденных детей, особенно у детей с экстремально низкой массой тела, в связи с небольшим объемом ОЦК и высоким риском ятрогенной анемизации. В связи с этим ведется активный поиск маркеров ОПП в моче.
Вышеперечисленные особенности диагностики часто не позволяют своевременно диагностировать ОПП у новорожденных, что обусловливает необходимость искать и использовать более достоверные маркеры ОПП. Не всегда есть возможность частого забора крови у новорожденных детей, особенно у детей с экстремально низкой массой тела, в связи с небольшим объемом ОЦК и высоким риском ятрогенной анемизации. В связи с этим ведется активный поиск маркеров ОПП в моче.
Маркеры повреждения почек можно условно разделить на четыре группы:
1) ферменты, высвобождаемые из поврежденных клеток канальцев, клубочков, такие как: холинэстераза, щелочная фосфатаза, гаммаглютамилтранспептидаза (ГГТ), аланинаминопептидаза, изоферменты глутатионтрансферазы, N-ацетил-бета-D-глюкозаминидаза (NAG);
2) белки с низкой молекулярной массой, фильтрующиеся через поврежденный клубочек: цистатин С, альфа-1 -микроглобулин, бета-2-микроглобулин, ретинол-связывающий белок;
3) специфические белки, продуцируемые почками в ответ на развивающееся ОПП: белок 61 богатый цистеином (cysteine-rich protein 61), липокалин-2 (NGAL), молекула поражения почек - 1 (KIM-1), цитокины и хемокины (Gro-alpha, ИЛ-18);
4) структурные и функциональные белки ренальных канальцев: F-actin, Na+ / H+ exchange isoform 3 [48].
Наиболее часто в неонатальном периоде для определения состояния почек оценивается активность ферментов мочи, уровень молекулы повреждения почек 1 (Kidney Injury Molecule-1 (KIM-1), кластерин (Clusterin)), фактор роста эндотелия (Vascular Endothelial Growth Factor (VEGF), интерлейкин-18 (IL18), бета-2-микроглобулин, Cystatin C, липокалин-2 (липокалин, ассоциированный c желатиназой нейтрофилов (Neutrophil gelatinase-associated lipocalin (NGAL)). По изменению уровня маркеров в моче или крови можно предположить этиологию патологического процесса и уровень поражения нефрона [49].
Цистатин С (CysC) является ингибитором цистеиновой протеазы. Данный белок не секретируется проксимальными канальцами и полностью метаболизируется в почках, фильтруясь клубочками и реабсорбируясь в проксимальных канальцах. Можно говорить, что повышение уровня CysC в сыворотке крови отражает изменение функции почек, а повышение его уровня в моче свидетельствует о повреждении канальцев [48].
Многие исследования доказывают, что у новорожденных сывороточный CysC является более ранним и достоверным маркером для оценки функции почек и скорости клубочковой фильтрации [48, 50].
Нейтрофильный желатиназа-ассоциированный липокалин (NGAL) стимулирует пролиферацию поврежденных клеток, обладает бактериостатической активностью. Очень важно, что экскреция NGAL в мочу происходит только при повреждении проксимальных ренальных канальцев. При развитии ОПП повышается синтез NGAL в печени, легких, нейтрофилах, макрофагах, дистальных отделах нефрона. Поэтому при развитии ОПП, связанную в первую очередь с нарушением состояния канальцев, будет отмечаться повышение уровня NGAL в моче [48, 50, 51].
Молекула повреждения почек 1 (ЮМ-1), являясь поверхностным белком из суперсемейства иммуноглобулинов (полисахаридный комплекс с иммуноглобулином), не содержится в здоровых почках. После повреждения ткани почек в клетках эпителия канальцев он начинает активно накапливаться и активно выводиться с мочой. Увеличение выделения KIM-1 с мочой более специфично для ишемического поражения почек и не зависит от других повреждающих факторов. Его высокие концентрации в моче коррелируют с неблагоприятным исходом ОПП [52, 53].
Интерлейкин-18 является провоспалительным цитокином, который вырабатывается в проксимальных канальцах трубчатым эпителием после действия факторов нефротоксичности. Определение IL-18 в моче позволяет диагностировать на самой ранней стадии почечное повреждение, вызванное ишемией или нефротоксинами. Кроме того, он является показателем тяжести ОПП и повышенного риска летального исхода.
p2-микроглобулин - белок, состоящий из 100 аминокислот из основных молекул легкой цепи главного комплекса гистосовместимости класса I, находящийся на всей поверхности всех ядросодержащих клеток, кроме эритроцитов. Он метаболизируется почками, реабсорбируется и катаболизируется в проксимальных канальцах. При неповрежденном нефроне в моче определяется в следовых количествах, и повышение его уровня указывает на повреждение канальцев [54]. У новорожденных наличие p2-микроглобулина в моче может отмечаться при незрелости канальцев.
Васкулоэндотелиальный фактор роста тип С (VEGF-C) - сосудистый факторов роста, цитокин, регулирующий лимфангиогенез в физиологических и патологических условиях. В развитии воспалительных реакций в почечной паренхиме, в том числе и реакций асептического воспаления, лимфангиогенез играет важную роль, поэтому VEGF-C можно рассматривать потенциальным ранним биомаркером ОПП [56].
Вопрос о формировании хронической болезни почек (ХБП) у новорожденных до настоящего момента остается открытым в связи с отсутствием достаточного количества масштабных исследований. Риск развития прогрессирования ХБП, вероятно, связан с сохраняющимися воспалительными реакциями с нарушением регенерации и дезадаптивной репарацией [26]. Так, при гистологических исследованиях у недоношенных новорожденных, перенесших ОПП, выявляются аномальные клубочки, которые, вероятно, могут подвергаться склерозированию на фоне уменьшения количества нефронов с развитием ХБП [57]. Работы других исследователей не подтверждают зависимость развития ХБП и перенесенной в неонатальный период ОПП [57]. Однако выявляемая митохондриальная дисфункция, метилирование ДНК (гиперметилирование RASAL 1), ацетилирование/деацетилирование гистонов (активация гистона 3) и экспрессию специфической микроРНК (миРНК-24, миРНК-494), переход в фиброзный фенотип поврежденных эндотелиальных клеток, свидетельствуют о высоком риске развития ХБП на фоне фиброза [57].
Риск ОПП у новорожденных в критическом состоянии без предшествующей почечной патологии продолжает оставаться высоким как у доношенных, так и у недоношенных детей. Наблюдения в катамнезе показали высокую частоту ХБП у детей, перенесших ОПП в периоде новорожденности. Предполагается, что в основе формирования ХБП лежит несколько механизмов: потеря нефронов и гиперфильтрация, сосудистая недостаточность и нарушение механизмов восстановления.
Другие факторы, такие как недоношенность и малый вес при рождении, являются как независимыми факторами риска ХБП, так вносят свой дополнительный вклад в ее развитие после ОПП. Рекомендуется всем детям с документированным эпизодом ОПП в периоде новорожденности длительное катамнестическое наблюдение для ранней диагностики ХБП [58].
Заключение
В настоящее время отмечается увеличение случаев диагностирования ОПП в неонатальный период. Не всегда удается своевременно и правильно определить манифестацию этого тяжелого состояния в связи со стертыми клинико-лабораторными симптомами, однако риск неблагоприятных исходов у детей при развитии ОПП возрастает в несколько раз. Являясь полиэтиологическим заболеванием, ОПП приводит к тяжелым гистологическим, структурным и метаболическим изменениям, которые, вероятно, увеличивают риск развития хронической болезни почек. Все вышеизложенное указывает на необходимость внедрения новых молекулярных методов оценки состояния почечных функций в неонатальную практику.
Литература
1. Баранов А.А., Альбицкий В.Ю., Намазова-Баранова Л.С., Терлецкая Р.Н. Состояние здоровья детей современной России. 2-е изд., доп. Москва: ПедиатрЪ, 2020. 112 с.
2. Володин Н.Н., Дегтярев Д.Н., Албегова М.Б. Неонатология: Национальное руководство: в 2 т. Том 1. Москва: ГЭОТАР-Медиа, 2023 г. 654 с.
3. Incidence, risk factors, and outcome of neonatal acute kidney injury: a prospective cohort study / M.A. Shalaby [et al.] // Pediatric Nephrology. 2018. Vol. 33, No. 9. P. 1617-1624.
4. Neonatal Kidney Collaborative (NKC). Incidence and outcomes of neonatal acute kidney injury (AWAKEN): a multicentre, мultinational, observational cohort study / J.G. Jetton [et al.] // The Lancet Child &Adolescent Health. 2017. November; 1 (3). P 184-194.
5. Developing a neonatal acute kidney injury research definition: A report from the NIDDK neonatal AKI workshop / M. Zappitelli [et al.] // Pediatric Research. Nature Publishing Group. 2017. Vol. 82, No. 4. P 569-57.
6. Creatinine filtration kinetics in critically Ill neonates / D.R. Rios [et al.] // Pediatric Research. 2021. Vol. 89, No. 4. P. 952-957.
7. Острое повреждение почек у новорожденных (проект клинических рекомендаций от 29.04.2019) / О.Л. Чугунова [и др.] // Неонатология: новости, мнения, обучение. 2019. Т. 7, № 2. С. 68-81.
8. Сафина А.И., Абдуллина Г.А., Даминова М.А. Становление функций почек у детей, родившихся преждевременно // Российский вестник перинатологии и педиатрии. 2016. Т. 61. № 5. С. 166-173.
9. Jetton J.G. Neonatal Kidney Collaborative (NKC). Incidence and outcomes of neonatal acute kidney injury (AWAKEN): a multicentre, multinational, observational cohort study // The Lancet Child & Adolescent Health. 2017. Vol. 1, No. 3. P 184-194.
10. Савенкова Н.Д. Педиатрические классификации и эпидемиология острого повреждения почек // Российский вестник перинатологии и педиатрии. 2018. Т. 63, № 5. С. 36-42.
11. Эпидемиология острого почечного повреждения у новорожденных в отделениях реанимации / Л.С. Золотарева [и др.] // Педиатрия. 2020. Т. 99, № 1. С. 58-64.
12. Acute kidney injury in children after cardiopulmonary bypass: risk factors and outcome / S. Bazaz [et al.] // Indian Pediatrics. 2015. Vol. 52, No. 3. Р 223-226.
13. Chaturvedi S., Mammen C., KH. Ng. The path to chronic kidney disease following acute kidney injury: a neonatal perspective // Pediatric Nephrology. 2017. Vol. 32, No. 2. Р. 227-241.
14. Follow-up of Acute kidney injury in Neonates during Childhood Years (FANCY): a prospective cohort study / M.W Harer [et al.] // Pediatric Nephrology. 2017. Vol. 32, No. 6. P 1067-1076.
15. Frequency of Acute Kidney Injury and Association With Mortality Among Extremely Preterm Infants / B. Khyzer [et al.] // JAMA Network Open. 2022. Vol. 5, No. 12.
16. Структурные показатели десинхронного нефроногенеза в почках детей, рожденных с экстремально низкой массой тела на сроках постконцептуального возраста / В.Л. Янин [и др.] // Медицинская наука и образование Урала. 2018. № 4. С. 67-73.
17. Advances in Neonatal Acute Kidney Injury / C. Michelle [et al.] // Pediatrics. 2021. Vol. 148, No. 5.
18. Lyndsay A., Harshman M.D., FAAP. Evaluate renal function of patients with neonatal acute kidney injury during well visits // American Academy of Pediatrics. Focus on Subspecialties. News. 2016. November 23.
19. Prognostic Value of the Baseline and Early Changes in Monocyte-to-Lymphocyte Ratio for Short-Term Mortality among Critically Ill Patients with Acute Kidney Injury / X. Luo [et al.] // Journal of Clinical Medicine. 2023. November 28. Vol. 12, No. 23. P 7353.
20. Mazaheri M., Rambod M. Risk factors analysis for acute kidney injury in the newborn infants: predictive strategies // Iran Journal Kidney Diseases. 2019. Vol. 13, No. 5. P. 310-315. PMID: 31705747.
21. Nada A., Bonachea E.M., Askenazi D.J. Acute kidney injury in the fetus and neonate // Seminars in Fetal and Neonatal Medicine. 2017. Vol. 22. P 90-97.
22. Gomella’s Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs / editor T.L. Gomella // Medical Publishing Division. 2020. 1441. P. 15.
23. Allegaert K., Simons S., Van Den Anker J. Research on medication use in the neonatal intensive care unit // Expert Review of Clinical Pharmacology. 2019. Vol. 12. P. 343-353.
24. Risk factors for and outcomes of acute kidney injury in neonates undergoing complex cardiac surgery / C.J. Morgan [et al.] // The Journal of Pediatrics. 2013. Vol. 162. P. 120-127.
25. Incidence, risk factors, and outcome of neonatal acute kidney injury: a prospective cohort study / M.A. Shalaby [et al.] // Pediatric Nephrology. 2018. Vol. 33, No. 9. P. 1617-1624.
26. Морозов С.Л., Миронова В.К., Длин В.В. Постгипоксическое поражение почек у детей раннего возраста // Практическая медицина. 2021. Т. 19, № 2.
27. Incidence and risk factors of early onset neonatal AKI / J.R. Charlton [et al.] // Clinical Journal of the American Society of Nephrology. 2019. Vol. 14. P. 184-195.
28. Neonatal Kidney Collaborative (NKC). Late onset neonatal acute kidney injury: results from the AWAKEN Study / J.R. Charlton [et al.] // Pediatric Research. 2019. Vol. 85, No. 3. P 339-348.
29. Neonatal Kidney Collaborative (NKC). Incidence and outcomes of neonatal acute kidney injury (AWAKEN): a multicentre, multinational, observational cohort study / J.C. Jetton [et al.] // The Lancet Child & Adolescent Health. 2017. Vol. 1, No. 3. P 184-194.
30. Nephrotoxic medication exposure in very low birth weight infants / E.T. Rhone, J.B. Carmody, J.R. Swanson, J.R. Charlton // Journal of Maternal-Fetal and Neonatal Medicine. 2014. Vol. 27. P 1485-1490.
31. Recognition and reporting of AKI in very low birth weight infants / J.B. Carmody, J.R. Swanson, E.T. Rhone, J.R. Charlton // Clinical Journal of the American Society of Nephrology. 2014. Vol. 9. P 2036-2043.
32. Ischemic Duration and Frequency Determines AKI-to-CKD Progression Monitored by Dynamic Changes of Tubular Biomarkers in IRI Mice / Y. Dong [et al.] // Frontiers in Physiology. 2019. Vol. 10. P 153.
33. Hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat (FG-4592) protects against cisplatin-induced acute kidney injury / Y. Yang [et al.] // Clinical Science (London). 2018. April 16. Vol. 132, No. 7. P 825-838.
34. Гипероксия, приводящая к усилению острого повреждения почек у новорожденных, вызванного общей гипоксией / Е.Ю. Плотников [и др.] // Рецепторы и внутриклеточная сигнализация: сборник статей. Т. 2. Институт биофизики клетки Российской академии наук - обособленное подразделение Федерального государственного бюджетного учреждения науки «Федеральный исследовательский центр «Пущинский научный центр биологических исследований Российской академии наук», 2019. С. 580-585.
35. Developing a neonatal acute kidney injury research definition: A report from the NIDDK neonatal AKI workshop / M. Zappitteli [et al.] II Pediatric Research. 2017. Vol. 82, No. 4. P 569-573.
36. Neonatal Acute Kidney Injury. Critical Care I I. Bhattacharjee, M.J. De Freitas, M. Mhanna, A. Abitbol II Pediatric Nephrology and Dialysis: A Practical Handbook. 2019. P 171-186.
37. Askenazi D., Picca S., Guzzo I. Neonatal Kidney Dysfunction II Pediatric Kidney Disease. Eds. D.F. Geary and F. Schaefer. Springer-Verlag Berlin Heidelberg. 2016. No. 48.
38. Rauniyar K., Jha S.K., Jeltsch M. Biology of Vascular Endothelial Growth Factor C in the Morphogenesis of Lymphatic Vessels II Frontiers in Bioengineering and Biotechnology. 2018. Vol. 67.
39. Li J., Li XL., Li CQ. Immunoregulation mechanism of VEGF signaling pathway inhibitors and its efficacy on the kidney II The American Journal of the Medical Sciences. 2023. Vol. 366, No. 6. P 404-412.
40. Formation of the glomerular microvasculature is regulated by VEGFR-3 I M.D. Donnan [et al.] II The American Journal of Physiology-Renal Physiology. 2023. January 1. Vol. 324, No. 1. F91-F105.
41. Влияние перегрузки жидкостью в послеоперационном периоде у новорожденных на развитие острого почечного повреждения и длительность пребывания в ОРИТ I Л.С. Золотарева [и др.] II Российский вестник детской хирургии, анестезиологии и реаниматологии. 2020. Т. 10, № 1. С. 51-61.
42. Relationship between acute kidney injury and brain MRI findings in asphyxiated newborns after therapeutic hypothermia I S. Sarkar [et al.] II Pediatric Research. 2014. Vol. 75, No. 3. P 431-435.
43. Acute renal failure in neonatal septicemia I G. Jagrawal, V. Arora, M. Gunawat, P. Malik II International Journal of BioMed Research. 2016. Vol. 7, No. 5. P 260-264.
44. Serum creatinine concentration in very-low-birth-weight infants from birth to 34-36 wk postmenstrual age I D.A. Bateman [et al.] II Pediatric Research. 2015. Vol. 77. P 696-702.
45. The discrepancy between serum creatinine and cystatin C can predict renal function after treatment for postrenal acute kidney injury: multicenter study and pooled data analysis I M. Matsuki [et al.] II Clinical and Experimental Nephrology. 2017. Vol. 21, No. 5. P. 852-857.
46. Guidance for clinicians managing children at risk of, or with, acute kidney injuryI Think Kidneys.
47. Glomerular filtration rate reference values in very preterm infants I R. Vieux [et al.] II Pediatrics. 2010. Vol. 125, No. 5.
48. Современные биомаркеры повреждения почек в педиатрии / Н.Н. Смирнова, О.В. Галкина, В.П. Новикова, Н.Э. Прокопьева II Нефрология. 2019. № 23 (4). С. 112-118.
49. Диагностика острого повреждения почек с позиций молекулярной медицины I О.Л. Морозова [и др.] II Педиатрия им. Г.Н. Сперанского. 2019. № 98 (5). С. 128-135.
50. Критерии ранней диагностики острого почечного повреждения у глубоко недоношенных новорожденных и возможности терапевтической коррекции I О.Л. Чугунова [и др.] II Педиатрия. 2015. № 94 (3). С. 8-12.
51. Роль биомаркеров острого повреждения почек в прогнозировании функциональных результатов хирургического лечения у больных локализованным раком почки I И.О. Дементьев [и др.] II Исследования и практика в медицине. 2021. № 8 (3). С. 97-107.
52. Kidney injury molecule 1 (KIM-1): a multifunctional glycoprotein and biological marker (review) I T.A. Karmakova [et al.] II Sovremennye tehnologii v medicine. 2021. Vol. 13, No. 3. P 64-80.
53. Blood and Urine Biomarkers Predicting Worsening Kidney Function in Patients with Type 2 Diabetes Post-Acute Coronary Syndrome: An Analysis from the EXAMINE Trial I J.P. Ferreira [et al.] IIAmerican Journal of Nephrology. 2021. Vol. 52, No. 12. P 969-976.
54. Complex reference value distributions and partitioned reference intervals across the pediatric age range for 14 specialized biochemical markers in the CALIPER cohort of healthy community children and adolescents I J. Kelly [et al.] II Clinica chimica acta. 2015. Vol. 450. P 196-202.
55. GFR estimation using в-trace protein and p2-microglobulin in CKD I L.A. Inker [et al.] II American Journal of Kidney Diseases. 2016. Vol. 67, No. 1. P. 40-48.
56. Биомаркер повреждения почек при экспериментальной интраабдоминальной гипертензии I В.В. Яковлев [и др.] II Сеченовский вестник. 2020. № 11 (3). С. 47-56.
57. Epigenetic regulation in the acute kidney injury (AKI) to chronic kidney disease transition (CKD) I R. Rodriguez-Romo, N. Berman, A. Gomez, N.A. Bobadilla II Nephrology (Carlton). 2015. Vol. 20, No. 10. P 736-743.
58. Chaturvedi S., Kar Hui Ngю, Mammen Ch. The path to chronic kidney disease following acute kidney injury: a neonatal perspective II The International Journal of Pediatric Nephrology. 2017. Vol. 32, No. 2. P 227-241.

