Ребаунд-синдром при младенческих гемангиомах
СтатьиН.П. Котлукова1,2, д-р мед. наук, профессор, Н.К. Константинова1, 2, Н.Д. Тележникова2, Т.Р. Лаврова2, канд. мед. наук, Т.С. Белышева3, д-р мед. наук, Е.Ю. Гавеля4, канд. мед. наук, С.А. Житкова1, В.Е. Меньшиков1, Е.В. Карелина1
1 ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
2 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
3 Научно-исследовательский институт детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
4 ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Резюме. Статья посвящена ребаунд-синдрому - одному из осложнений, которые могут возникнуть после завершения медикаментозной терапии младенческих гемангиом. На большом клиническом материале (654 пациента, которые прошли лечение препаратом пропранолол, в том числе пероральным раствором препарата «Гемангиол»®, в Центре компетенций по лечению младенческих гемангиом на базе отделения кардиологии Детской городской клинической больницы им. З.А. Башляевой г. Москвы, продемонстрирована низкая частота (3,6%) рецидивов. Представлена таблица с клиническими данными всех 25 пациентов с данным осложнением, проведен анализ возможных причин его возникновения, рассмотрены факторы риска и группы риска по формированию ребаунд-синдрома, различные тактики ведения пациентов и, главное, профилактические меры. В статье также описан клинический случай, который наглядно иллюстрирует изложенный теоретический материал.
Ключевые слова: младенческая (инфантильная) гемангиома, ребаунд-синдром, лечение, пропранолол, факторы риска, группы риска, Гемангиол®
Summary. The article is devoted to the analysis of rebound syndrome, one of the complications that may occur after the completion of drug therapy for infantile hemangiomas. On a large clinical material (654 patients) who were treated at the Competence Center for the Treatment of Infantile Hemangiomas on the basis of the Department of Cardiology of the Children's State Clinical Hospital named after Z.A. Bashlyaeva with propranolol, including the oral solution Hemangiol®, a low percentage (3.6%) of the formation of relapses was shown. A table with clinical data of all 25 patients is presented, followed by an analysis and discussion of possible causes, factors and risk groups for the formation of rebound syndrome, management tactics in the event of this complication and, most importantly, preventive measures for its development. The article also provides a clinical case, which is a visual addition to the material presented.
Keywords: infantile hemangioma, rebound syndrome, treatment, propranolol, risk factors, risk groups, Hemangiol®
Введение
Современная тактика ведения пациентов с младенческими (МГ), или инфантильными, гемангиомами подбирается индивидуально и, в зависимости от глубины и распространенности патологического процесса, может включать режим наблюдения, местную терапию, системную фармакотерапию, лазерное и хирургическое лечение. Первой линией системной фармакотерапии во всем мире в настоящее время является применение неселективного бета-адреноблокатора пропранолола в лекарственной форме раствора пропранолола гидрохлорида для приема внутрь. Эта форма зарегистрирована в России 10 ноября 2015 г. под торговым наименованием «Гемангиол»® («Пьер Фабр Медикамент», Франция). «Гемангиол»®, раствор для перорального применения у детей 1-го года жизни -первое и единственное официально зарегистрированным, в том числе в России, лекарственное средство, созданное для лечения МГ, требующих системной терапии [1,2].
Эффект пропранолола при лечении МГ, во-первых, основан на способности препарата вызывать периферическую вазоконстрикцию, в том числе в сосудах гемангиом, благодаря подавлению образования и высвобождения оксида азота (NO). В результате вазоконстрикции уменьшается скорость кровотока в сосудах МГ, цвет сосудистого образования меняется с насыщенного багрово-фиолетового на более бледный, изменяется его напряженность и снижается местная температура. Эти изменения появляются уже на 1-2-е сутки от начала приема препарата. Во-вторых, пропранолол ингибирует процессы ангиогенеза, снижая экспрессию VEGF (васкулоэндотелиального фактора роста) и FGF (фактора роста фибробластов). VEGF и FGF участвуют в процессе ангиогенеза. В нем также принимают участие матриксные металлопротеиназы (ММР-2 и ММР-9), уровень которых повышается в фазу пролиферации МГ. Их деятельность регулируется бета-адренорецепторами. Пропранолол ингибирует деятельность ММР-2 и ММР-9, снижая тем самым активность ангиогенеза. В-третьих, установлено, что пропранолол запускает апоптоз эндотелиальных клеток.
Несмотря на оптимистичные результаты применения пропранолола при МГ во всем мире и в России [1, 2], у некоторых пациентов после его отмены возникает так называемый ребаунд-синдром (рецидив), при котором сосудистое образование вновь начинает пролиферировать. Клинически это проявляется отрицательной динамикой в виде увеличения объема, усиления яркости, плотности сосудистого образования. Описан случай, когда после завершения лечения и развития рецидива размеры МГ стали больше, чем до старта лечения пропранололом [3].
Согласно данным литературы, рецидивы после прекращения приема препарата наблюдаются у 17-25% пациентов после 6 мес терапии, а пролонгация лечения, в частности до 12 мес, снижает их частоту до 5%. Обсуждаются возможные причины развития данного осложнения [4-10]. При этом в опубликованных сообщениях обращает на себя внимание небольшое число пролеченных пропранололом пациентов (от 12 до 44). Лишь в одной работе число пациентов составило 212, из них 13 (6%) с зарегистрированным ребаунд-синдромом, развившимся в различные сроки после завершения терапии [4]. Достаточно грозным был случай ребаунд-синдрома у пациента с подскладковой гемангиомой гортани, которая в результате рецидива после завершения терапии почти полностью закрыла дыхательные пути [8].
Цель работы - анализ ребаунд-синдрома у детей с МГ, в 2017-2023 гг. находившихся на лечении в отделении кардиологии Детской городской клинической больницы (ДГКБ) им. З.А. Башляевой Департамента здравоохранения г. Москвы (в Центре компетенций по лечению младенческих гемангиом), с выделением факторов и групп риска развития данного осложнения.
Материал и методы
В течение 7 лет в вышеуказанном центре проведено лечение 694 детей с МГ различных локализаций (без учета повторных госпитализаций, которые осуществлялись каждые 3 мес).
Из 694 детей 87% поступали впервые, 55% были в возрасте до 6 мес, когда МГ находилась в стадии пролиферации или активного роста, а 30% детей были в возрасте от 6 мес до 1 года. Этим пациентам по месту жительства был рекомендован режим наблюдения, и МГ при поступлении находились в стадии остановки роста. Оставшиеся 15% детей были старше 1 года. Они поступали, как правило, с неудачным опытом (неэффективностью) предшествующего лечения (криодеструкции, лазера, рентгенотерапии, местного лечения). У некоторых из них в анамнезе уже имел место ребаунд-синдром.
Результаты и обсуждение
Нами проведен проспективный анализ данных пациентов с МГ, которые поступили в отделение впервые, не проходили до этого никакого лечения и которым было впервые назначено лечение неселективным бета-блокатором пропранололом, включая препарат «Гемангиол»®. После предварительного обследования, динамического контроля за эффективностью и безопасностью лечения, соблюдения этапности проводимого лечения с определением индивидуальных сроков терапии и индивидуальной схемы отмены препарата было установлено, что ребаунд-синдром после завершения лечения возник у 25 детей, что составило 3,6% от общего числа пролеченных пациентов.
С учетом небольшого числа детей с ребаунд-синдромом мы сочли возможным представить в таблице результаты проведенного индивидуального анализа (который включал форму, тип и локализацию МГ, предположительную причину ребаунд-синдрома, тактику ведения, исход), а также описать клинический случай, демонстрирующий двукратный рецидив у ребенка с МГ в правой околоушно-жевательной области.
Характеристика детей с младенческими гемангиомами и ребаунд-синдромом
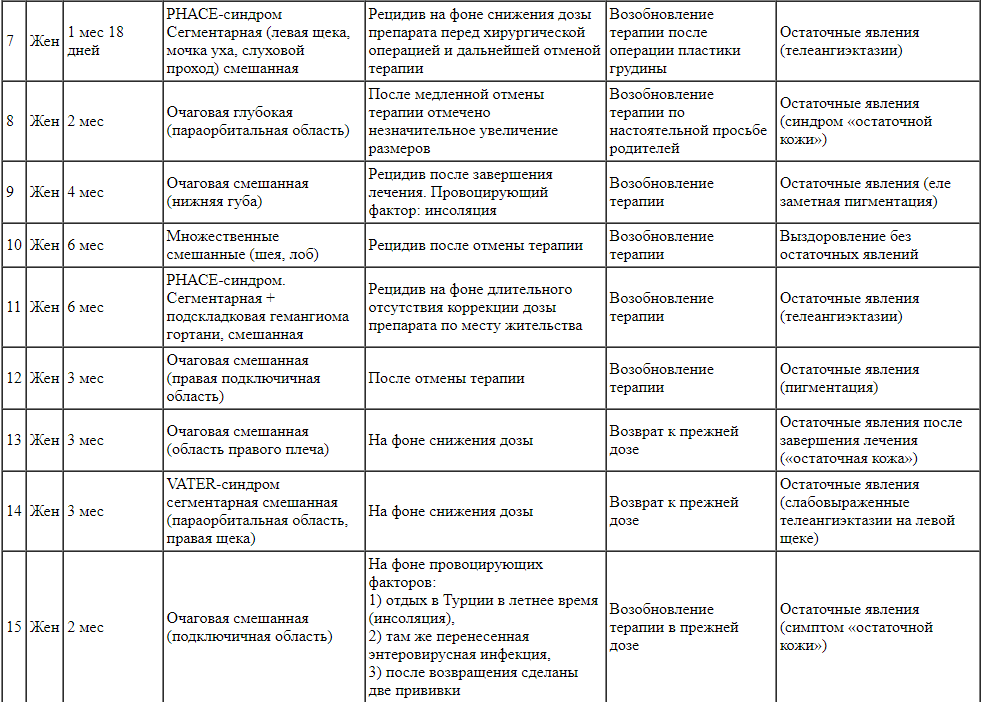
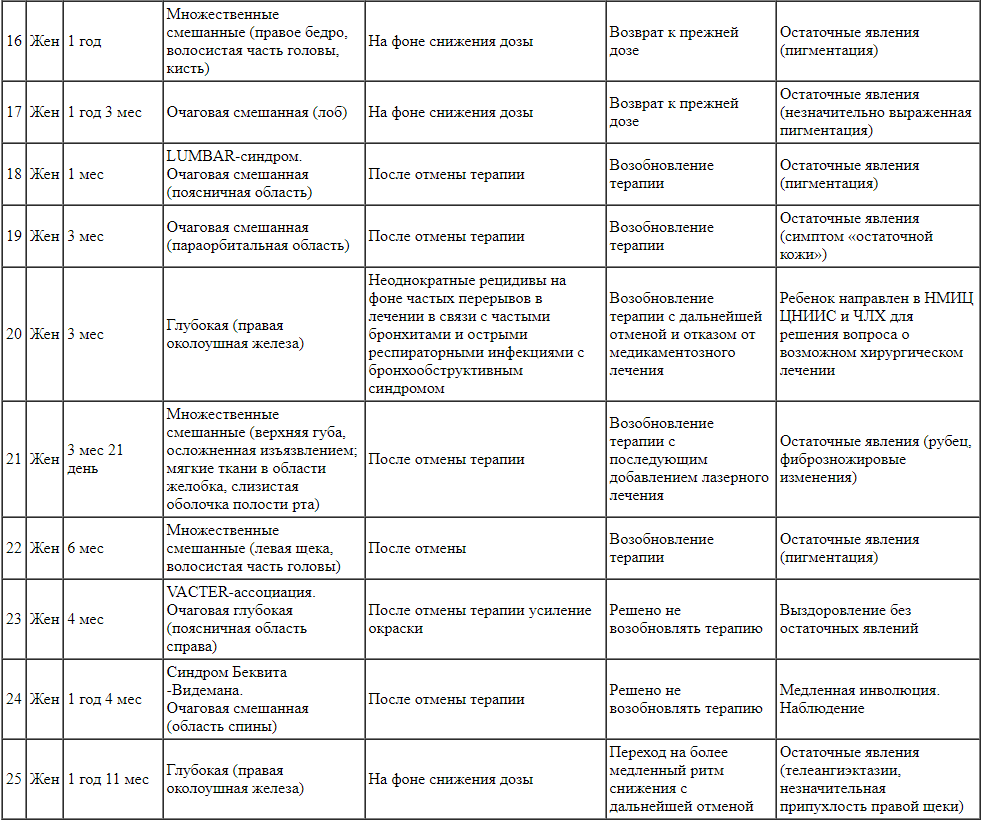 Анализируя полученную информацию, следует отметить, что 84% наблюдавшихся нами пациентов с ребаунд-синдромом - это девочки, что превышает общую особенность данной патологии с преимущественной встречаемостью у лиц женского пола в соотношении 3:1. Из 25 детей рецидив был зафиксирован лишь у 4 мальчиков. В возрасте от 1 до 6 мес, что соответствовало стадии пролиферации МГ, были 84% пациентов, но при этом в оптимальном для старта системной фармакотерапии возрасте, который составляет от 1 до 2 мес жизни, были только 6 детей.
Анализируя полученную информацию, следует отметить, что 84% наблюдавшихся нами пациентов с ребаунд-синдромом - это девочки, что превышает общую особенность данной патологии с преимущественной встречаемостью у лиц женского пола в соотношении 3:1. Из 25 детей рецидив был зафиксирован лишь у 4 мальчиков. В возрасте от 1 до 6 мес, что соответствовало стадии пролиферации МГ, были 84% пациентов, но при этом в оптимальном для старта системной фармакотерапии возрасте, который составляет от 1 до 2 мес жизни, были только 6 детей.
Анализ типа и формы МГ показал, что поверхностных гемангиом практически не было, большинство (20 человек) имели смешанный тип сосудистых образований, который сочетает в себе как наружный, так и внутренний компонент, а у 5 детей наблюдался глубокий тип гемангиом без наружного компонента. У 12 детей гемангиомы были очаговыми (одиночными), у 6 - множественными, у 4 детей они имели распространенную сегментарную форму. В 72% случаев МГ располагались в области головы, лица и шеи, а в 18% - в области туловища и конечностей. Голова, лицо и шея поражаются данной патологией чаще, чем туловище и конечности (соответственно в 60 и 40% случаев), но при ребаунд-синдроме процент поражения головы, лица и шеи оказался существенно выше. Наиболее часто ребаунд-синдром зафиксирован у пациентов с локализацией МГ в околоушно-жевательных (20%) и параорбитальных (20%) областях, включая РНАСЕ-синдром
У 1/3 пациентов с рецидивами МГ была выявлена синдромальная форма патологии (РНАСЕ-синдром, LUMBAR-синдром, VACTER-ассоциация, синдром Беквита - Видемана). В подавляющем большинстве случаев (20 детей) ребаунд-синдром был однократным. У 4 детей он повторялся дважды, а у мальчика с глубокой МГ правой околоушной железы рецидивы возникали после каждой отмены препарата, что в итоге явилось показанием к направлению пациента к челюстно-лицевым хирургам.
Анализируя сроки, возможные причины и провоцирующие факторы рецидивов МГ, следует отметить, что у 60% (15 пациентов) ребаунд-синдром развился в ближайшие 3 мес после завершения лечения, у 31,6% отрицательная динамика стала наблюдаться при попытке отмены пропранолола на фоне постепенного, медленного снижения дозы препарата. В 1 случае ухудшение наступило из-за отсутствия коррекции дозы по месту жительства, чего потребовало изменение массы тела ребенка, в другом - из-за необоснованной резкой отмены лечения хирургом через 6 мес терапии. У третьего ребенка частые острые респираторные инфекции осложнялись бронхообструктивным синдромом, что требовало отмены препарата на несколько дней и незамедлительно приводило к увеличению объема правой околоушно-жевательной области. Четвертый пациент на фоне терапии пропранололом, вопреки совету врача, находился на отдыхе в Турции с избыточной инсоляцией, где перенес энтеровирусную инфекцию, а после возвращения ему были сделаны 2 прививки. Набор вышеперечисленных провоцирующих факторов привел к резко выраженной отрицательной динамике, что было расценено как ребаунд-синдром. Следует отметить, что инсоляция как триггер была зафиксирована у 3 пациентов, прививки - также у 3 пациентов. У 1 ребенка с полной картиной процесса пролиферации МГ ребаунд-синдром развился через год после завершения лечения. Клиническая картина рецидива появилась после вакцинации против гриппа, проведенной ребенку в детском саду.
Средняя продолжительность лечения пациентов с ребаунд-синдромом составила 30,5 мес (2,5 года). Минимальный срок терапии составил 9 мес у ребенка МГ в области кончика носа, родители которого отказались от повторного назначения терапии, а максимальный срок - 51 мес у ребенка со смешанной МГ правой околоушной железы.
При появлении отрицательной динамики, риске или клинике ребаунд-синдрома решение вопроса о тактике ведения всегда было индивидуальным. Как уже было сказано выше, оно основывалось на совокупности клинико-лабораторных и инструментальных показателей, в том числе ультразвуковых (УЗИ) параметрах линейной скорости кровотока (ЛСК), а также индексе резистентности сосудов. Практически всегда после отмены системного приема пропранолола по данным УЗИ фиксировали незначительное повышение ЛСК, что было обусловлено пусть медленным и постепенным, но все-таки уходом от периферического вазоконстрикторного влияния препарата на сосудистую стенку, что не означало наличия рецидива и не служило показанием к повторному курсу лечения. В случаях ребаунд-синдрома на фоне снижения дозы препарата проводилась их коррекция, а при рецидивах, появлявшихся после завершения лечения, терапия пролонгировалась с назначением повторного курса лечения. В отдельных случаях прием пропранолола не возобновлялся (см. таблицу). Учитывалась также и кардиологическая симптоматика, в частности влияние пропранолола на сердечный ритм по данным суточного ЭКГ-мониторирования по Холтеру. В первую очередь оценивались показатели продолжительности пауз сердечного ритма.
Из 25 детей, у которых возник ребаунд-синдром, 17 (68%) терапия была возобновлена, при этом у 3 детей с двумя ребаунд-синдромами лечение возобновлялось дважды. Четырем детям, у которых отрицательная динамика была зафиксирована в процессе снижения дозы препарата, был сделан «шаг назад», т. е. осуществлен возврат к предыдущей дозе пропранолола. Одному ребенку была осуществлена коррекция темпа снижения в сторону более медленного ритма. Трем пациентам повторная терапия не назначалась: в 1 случае по желанию родителей, у 2 детей нами было принято решение воздержаться от пролонгации терапии (дети с синдромальной патологией: синдромом Беквита - Видемана и VACTER-ассоциацией) с продолжением наблюдения под динамическим контролем УЗИ-параметров. Одному ребенку терапия возобновлялась после выздоровления от острой респираторной инфекции с БОС, но в дальнейшем она была остановлена, несмотря на симптомы рецидива, по причине развития симптомов бронхообструкции, которая развивалась даже при отсутствии клиники ОРВИ. Трем детям проводилось также лазерное лечение.
Всем детям с МГ в околоушно-жевательной области и ребаунд-синдромом после завершения лечения проводилась компьютерная томография (КТ) с внутривенным болюсным контрастированием. По результатам КТ у всех 5 пациентов выявлялись множественные аномальной формы (мальформационные) извитые сосуды, окружающие, «опутывающие» околоушную железу, с наличием крупного приносящего сосуда, берущего начало от наружной сонной артерии либо ее ветвей. С этим фактом была связана очень высокая исходная ЛСК, которая в приносящем сосуде достигала 180-220 см/с и, несмотря на отчетливый положительный эффект системной фармакотерапии как клинически, так по показателям ЛСК, приводила к ребаунд-синдрому после ее завершения. Тем не менее благополучное завершение лечения было зарегистрировано у 3 детей с данной локализацией, у 1 до настоящего времени продолжается терапия в минимальной поддерживающей дозе с наблюдением за процессом медленной инволюции, а 1 ребенок (с БОС) направлен на консультацию к челюстно-лицевым хирургам для решения вопроса об оперативном лечении.
У остальных детей (80%) исходом медикаментозной терапии стало либо полное выздоровление без каких-либо остаточных изменений (2 ребенка), либо выздоровление с остаточными явлениями в виде телеангиэктазий, гиперпигментации, симптома «остаточной кожи», фиброзно-жировых изменений, создающих внешнюю припухлость, а также рубцов на месте язвенных дефектов, что создавало определенные косметические проблемы.
Как уже было сказано выше, анализ случаев ребаунд-синдрома, проведенный в большой когорте пациентов с МГ (694 ребенка), прошедших курс лечения неселективным бета-адреноблокатором пропранололом, выявил данное осложнение всего у 3,6% детей. Столь низкая частота ребаунд-синдрома была достигнута благодаря проведению динамического УЗИ гемангиом, в ходе которого оценивались размеры, толщина, количество сосудов в одном ультразвуковом срезе, а также ЛСК по артериям разного калибра (приносящий сосуд, а также интрапаренхиматозные крупные и средние артерии). Данное исследование проводилось как на фоне лечения пропранололом, так и после его окончания. На основании полученных данных формировался индивидуальный подход к продолжительности лечения, что позволило максимально снизить риск развития рецидивов.
Проведенный анализ позволил нам выявить две группы факторов риска по формированию ребаунд-синдрома при МГ: факторы риска, зависящие от самой МГ (внутренние), и факторы риска, которые могут быть отнесены к внешним.
Внутренние факторы риска ребаунд-синдрома, обусловленные особенностью МГ:
- Тип: глубокие и смешанные (комбинированные) МГ.
- Локализация: околоушно-жевательная область, ягодичная область, слизистая оболочка губ.
- Анатомия приносящей артерии (ее диаметр и скоростные характеристики крови).
- Степень исходной васкуляризации МГ.
- Синдромальная патология пациента: PHACE(S) и LUMBAR-синдромы, VATER-ассоциация и др.
- Женский пол.
Внешние факторы риска развития ребаунд-синдрома при МГ:
- Низкие дозы принимаемого препарата.
- Отсутствие или длительный промежуток в коррекции доз лекарственного препарата.
- Короткий курс лечения.
- Прекращение терапии до завершения стадии инволюции.
- Быстрая отмена препарата.
- Провоцирующие факторы (инсоляция, прививки, инфекции, травмы).
Клинический случай
Ниже представлен клинический случай двух ребаунд-синдромов у одного ребенка с наиболее агрессивной локализацией МГ (в правой околоушной области) и пролонгированным курсом лечения. Случаи ребаунд-синдромов имели место до поступления в Центр компетенций по лечению младенческих гемангиом.
Девочка 2016 года рождения впервые поступила в отделение кардиологии ДГКБ им. З.А. Башляевой (Центр компетенций по лечению младенческих гемангиом) в возрасте 1 года 10 мес.
Из анамнеза жизни известно, что ребенок от 8-й осложненной беременности, протекавшей с угрозой прерывания, токсикозом, хроническим пиелонефритом. Масса тела при рождении - 3960 г, рост - 56 см. Оценка по шкале Апгар - 8/9 баллов.
Из анамнеза заболевания известно, что в возрасте 1 мес в области правой щеки и мочки уха появилось покраснение. Хирургом поликлиники поставлен диагноз «кавернозная младенческая гемангиома». По данным УЗИ: сосудистое образование размерами 37 х 25 х 38 мм с интенсивным кровотоком. Назначена местная терапия в виде аппликаций с 0,5%-ным раствором тимолола малеата (глазные капли). В связи с отсутствием эффекта, продолженным ростом сосудистой гиперплазии девочка направлена на консультацию к челюстно-лицевому хирургу, подтвердившего диагноз смешанной младенческой гемангиомы в правой околоушно-жевательной области. Проведена первая местная инъекция преднизолона в область гемангиомы, после которой рост продолжился еще более быстрыми темпами, щека значительно увеличилась в объеме, появился язвенный дефект. В возрасте 3 мес проведена повторная местная инъекция преднизолона, после чего на фоне продолжающегося активного роста МГ начала кровоточить (рис. 1).
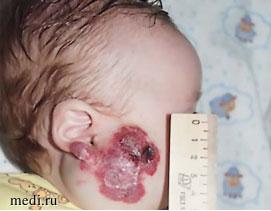 Рис. 1. Пациент 3 мес. Внешний вид смешанной младенческой гемангиомы в правой околоушно-жевательной области после второй местной инъекции преднизолона в стадии пролиферации, осложненной язвенным дефектом
Рис. 1. Пациент 3 мес. Внешний вид смешанной младенческой гемангиомы в правой околоушно-жевательной области после второй местной инъекции преднизолона в стадии пролиферации, осложненной язвенным дефектом
В возрасте 3 мес 3 нед девочка была госпитализирована в отделение челюстно-лицевой хирургии больницы Св. Владимира г. Москвы, где был начат курс лечения селективным бета-блокатором атенололом с обработкой язвенного дефекта протосаном и банеоцином. На фоне заживления язвенного дефекта размеры МГ, тем не менее, продолжали увеличиваться (по сравнению с исходными они увеличились в 2 раза (60 х 40 х 60 мм)). Через 5 мес в ходе повторной госпитализации в данный стационар ребенку была проведена КТ, по данным которой размеры сосудистого образования не уменьшились, а напротив, отмечено распространение его на окологлоточное пространство (рис. 2). Терапия атенололом была продолжена. Еще через 3 мес в больнице Св. Владимира на фоне продолжающейся терапии атенололом проведено 5 сеансов лазерного лечения, а еще через 3 мес в возрасте 1 года 2 мес проведена первая попытка отмены атенолола. На этом фоне возник первый эпизод ребаунд-синдрома (рецидива), когда щека вновь стала резко увеличиваться в объеме, что послужило причиной возобновления терапии атенололом до августа 2018 г., когда он был отменен в связи с некоторым уменьшением размеров ИГ (42 х 32 х 12 мм). Через 1 мес возник повторный эпизод ребаунд-синдрома с увеличением объема щеки, в связи с чем у лечащих врачей возникли сомнения в правильности первоначального диагноза и был поставлен диагноз «сиалоаденит неясной этиологии, возможно цитомегаловирусной природы». Девочка направлена к педиатрам для обследования с рекомендацией приема нурофена, эриуса и гомеопатического препарата лимфомиозот.
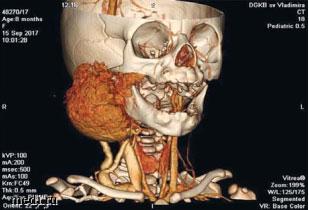 Рис. 2. Тот же пациент в возрасте 8 мес. Компьютерная томография. Младенческая гемангиома правой околоушной железы с распространением на окологлоточную область
Рис. 2. Тот же пациент в возрасте 8 мес. Компьютерная томография. Младенческая гемангиома правой околоушной железы с распространением на окологлоточную область
С 31.10.2019 (с возраста 1 года 10 мес) по 12.11.2019 ребенок впервые находился на стационарном лечении в отделении кардиологии ДГКБ им. З.А. Башляевой (Центре компетенций по лечению младенческих гемангиом).В связи с тем, что МГ, несмотря на возраст ребенка, продолжала находиться в стадии активного роста, вновь был дан старт системной фармакотерапии бета-адреноблокатором, но не атенололом, а пропранололом. Визуализировалась увеличенная в объеме правая щека цианотичной окраски, горячая и плотная, с местной температурой 38,6°С и рубцовыми изменениями (рис. 3). По данным УЗИ ЛСК была очень высокой как в питающей артерии (152 см/с), так и в крупной интрапаренхиматозной (64 см/с). Пропранолол был назначен в максимальной дозе (2,9-3,1 мг/кг/сут). В дальнейшем ребенок поступал в отделение каждые 3-4 мес для проведения комплексного обследования с целью оценки эффективности и безопасности лечения, постоянной коррекции доз пропранолола (всего 13 госпитализаций), что осуществлялось путем УЗИ гемангиомы, контроля анализов крови, ЭКГ, холтеровского мониторирования, эхокардиографии. Положительный эффект наметился уже в ходе первой госпитализации, что отчетливо наблюдалось в дальнейшем по данным клинического осмотра и результатов УЗИ с определением ЛСК по приносящим и интрапаренхиматозным сосудам гемангиомы, эти данные свидетельствовали о медленном процессе обратного развития. Постепенно объем правой щеки перестал отличаться от левой, нормализовалась местная температура, пальпаторно определялись уплотнения за счет участков фиброзно-жировой ткани. Последняя госпитализация состоялась в возрасте 6 лет 1 мес. С февраля 2022 г. (5 лет и 3 мес) было начато медленное снижение дозы препарата, которое завершилось его отменой в июле 2022 г. (5 лет 8 мес).
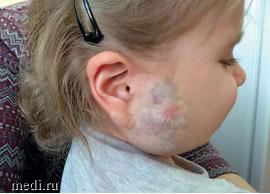 Рис. 3. Тот же пациент в возрасте 2 лет. Внешний вид после двух перенесенных ребаунд-синдромов (правая щека увеличена в объеме, визуализируются выраженные рубцовые изменения)
Рис. 3. Тот же пациент в возрасте 2 лет. Внешний вид после двух перенесенных ребаунд-синдромов (правая щека увеличена в объеме, визуализируются выраженные рубцовые изменения)
В возрасте 6 лет 1 мес спустя 5 мес после отмены пропранолола признаков ребаунд-синдрома у девочки не выявлено. Асимметрии лица нет. Визуализируются рубцы на месте бывшего язвенного дефекта и лазерного воздействия, пальпаторно сохраняются фиброзно-жировые уплотнения. Местная температура - 36,9-37,3°С. Температура с контралатеральной стороны - 36,4°С. По данным УЗИ в области правой околоушной железы и правой щеки дополнительных объемных образований не выявлено. Правая околоушная железа не увеличена в объеме, структура ее неоднородна за счет участков пониженной эхогенности и множественных мелких фиброзных включений линейной формы как резидуальных изменений. В составе железы определялись расширенные сосуды диаметром до 1,7 мм в небольшом количестве. ЛСК имела среднескоростные параметры (в наиболее крупной интрапаренхиматозной артерии - 36 см/с, в артериях среднего калибра - 24 см/с). При этом в крупной питающей артерии ЛСК была высокой и составляла 80 см/с. Индекс резистентности был сниженным (0,69). Таким образом, были получены ультразвуковые данные, свидетельствующие о выраженном, но не завершенном полностью процессе инволюции МГ в правой околоушно-жевательной области. Ребенку была проведена повторная КТ мягких тканей с внутривенным контрастированием сосудов, при которой в области правой околоушной слюнной железы определялись множественные извитые разнокалиберные сосуды, отходящие от наружной сонной артерии (сосудистая мальформация). Сама железа имела неоднородную структуру. С контралатеральной стороны железа обычных размеров и структуры (рис. 4). Показания к возобновлению терапии пропранололом отсутствовали, и девочка была выписана домой. Нежелательных кардиальных и экстракардиальных эффектов в ходе терапии бета-адреноблокаторами у ребенка не было. На рис. 5 представлена положительная динамика ЛСК по данным УЗИ гемангиомы в приносящем и крупном интрапаренхиматозном сосудах без повторных эпизодов ребаунд-синдрома на фоне лечения пропранололом в Центре компетенций по лечению младенческих гемангиом ДГКБ им. З.А. Башляевой.
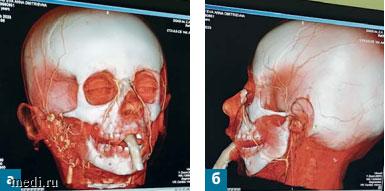 Рис. 4. Тот же пациент в возрасте 6 лет 1 мес. Компьютерная томография правой (а) и левой (б). КТ правой околоушной железы с внутривенным контрастированием сосудов спустя 5 месяцев после завершения лечения
Рис. 4. Тот же пациент в возрасте 6 лет 1 мес. Компьютерная томография правой (а) и левой (б). КТ правой околоушной железы с внутривенным контрастированием сосудов спустя 5 месяцев после завершения лечения
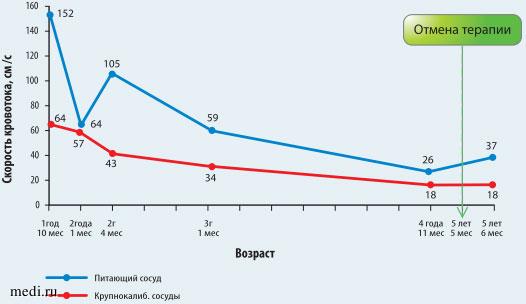 Рис. 5. Динамика линейной скорости кровотока по данным УЗИ на фоне терапии пропранололом
Рис. 5. Динамика линейной скорости кровотока по данным УЗИ на фоне терапии пропранололом
Таким образом, приведенный клинический пример демонстрирует:
а) агрессивный характер МГ с локализацией в околоушно-жевательной области, обусловленный обильной васкуляризацией (большим количеством измененных извитых сосудов, «опутывающих» околоушную железу, отходящих от наружной сонной артерии, имеющих очень высокую скорость кровотока как в приносящих артериях, так и в интрапаренхиматозных крупных и средних артериях);
б) высокий риск рецидивов (ребаунд-синдрома) при отмене терапии бета-адреноблокаторами, который обусловлен вышеперечисленными особенностями васкуляризации;
в) необходимость проведения пролонгированной системной фармакотерапии пропранололом в максимальных дозах (не менее 3 мг/кг/сут) с медленной отменой под контролем ультразвуковых параметров ЛСК и индекса резистентности сосудов МГ данной локализации;
г) нецелесообразность использования лазерной терапии в случаях смешанных МГ, имеющих не только наружный, но и внутренний компонент, который в данном случае оставил грубые рубцовые изменения;
д) бесполезность и ошибочность применения пропранолола в виде препарата тимолол для местного аппликационного лечения комбинированных (смешанных) МГ, имеющих как наружный, так и внутренний компонент, в связи с низкой степенью проникновения препарата в глубину тканей. Такая терапия приводит как к отсутствию желаемого эффекта, так и к задержке своевременного старта системной фармакотерапии на фоне активного процесса пролиферации МГ, особенно с локализацией в околоушно-жевательных областях.
Следует также отметить, что в литературе в качестве одной из причин ребаунд-синдрома обсуждается возможность более длительной фазы пролиферации (дольше 6 мес) у детей с МГ околоушных желез, а также активирующая роль в этом процессе VEFR [3].
Заключение
Таким образом, проведенный анализ результатов наблюдения большого числа пациентов с МГ, проходивших лечение в Центре компетенций по лечению младенческих гемангиом на базе отделения кардиологии ДГКБ им. З.А. Башляевой г. Москвы, позволил установить частоту и причины формирования ребаунд-синдрома, определить внутренние и внешние факторы риска его развития и предложить меры профилактики, которые заключаются в назначении адекватных доз лекарственного препарата и подборе индивидуальных сроков лечения на основании особенностей локализации и васкуляризации МГ.
Частота формирования ребаунд-синдрома при младенческих гемангиомах может быть минимизирована благодаря индивидуальному подходу к ведению пациентов из группы риска его развития. К группе риска следует отнести детей с синдромальной патологией, детей, имеющих глубокие или смешанные МГ с локализацией в параорбитальной области, слизистой оболочке губ, в околоушно-жевательных областях, где сосудистое образование питается большим количеством более мелких разветвленных артерий, отходящих от самой наружной сонной артерии или ее наиболее крупных ветвей. Индивидуальный подход заключается в раннем старте медикаментозной терапии (начало стадии пролиферации), назначении максимально допустимых доз пропранолола, своевременной коррекции доз, объективном динамическом ультразвуковом контроле, определяющем сроки лечения, а также постепенном снижении дозы пропранолола с рекомендацией «шага назад» с возвратом к предыдущей дозе с пролонгацией на 2 нед при появлении первых признаков ребаунд-синдрома. В случаях повторных рецидивов показана консультация специалистов по лазерному лечению либо хирургов, но торопиться с передачей этих пациентов в руки соответствующих специалистов не следует. Терпение, терпение и еще раз терпение!
Литература
1. Современная стратегия и тактика ведения детей с инфантильными гемангиомами / Н.П. Котлукова [и др.] // Практика педиатра. 2020. № 4. С. 4-12.
2. Современная системная фармакотерапия младенческих гемангиом / Н.П. Котлукова [и др.] // Практика педиатра. 2021. № 1. С. 52-56.
3. Bagazgoitia L., Hernandez-Martin A., Torrelo A. Recurrenceof infantile hemangiomas treated with propranolol // Pediatric Dermatology. 2011. No. 28. P. 658-662.
4. Rebound of infantile hemangioma after cessation of oral propranolol / N. Shehata [et al.] // Pediatric Dermatology. 2013. Vol. 30, No. 5. P. 587-591.
5. Re: propranolol treatment for hemangioma of infancy: risks and recommendations / S.J. Bayliss [et al.] // Pediatric Dermatology. 2010. No. 27. P. 319-320.
6. Lawley L.P., Siegfried E., Todd J.L. Propranolol treatment for hemangioma of infancy: risks and recommendations // Pediatric Dermatology, 2009. No. 26. P. 610-614.
7. Use of propranolol in infantile haemangioma among Chinese children / K.K. Chik [et al.] // HongKong Medical Journal 2010. No. 16. P. 341-346.
8. Case report:treatment failure using propranolol for treatment offocal subglottic hemangioma / K.T. Canadas [et al.] // International Journal of Pediatric Otorhinolaryngology. 2010. No. 74. P. 956-958.
9. Beta-blockers for the treatment of problematic hemangiomas / V.K. Sharma [et al.] // Canadian Journal of Plastic Surgery. 2013. Vol. 21, No. 1. P. 23-28.
10. Lynch M., Lenane P., O'Donnell B.F. Propranolol for the treatment of infantile haemangiomas: our experience with 44 patients // Clinical and Experimental Dermatology. 2014. Vol. 39, No. 2. P. 142.
Комментарии
ПРАКТИКА ПЕДИАТРА

