Смотри также:
Современный подход к терапии инфекции мочевыводящих путей у детей в условиях нарастания антибиотикорезистентности
СтатьиГ.Б. Бекмурзаева, канд. мед. наук, И.Н. Захарова, д-р мед. наук, профессор, И.М. Османов, д-р мед. наук, профессор, Е.В. Тамбиева, канд. мед. наук, Н.В. Шестериков, И.В. Иванина, О.Б. Кольбе, канд. мед. наук, Е.Г. Пичугина, Г.Н. Безрукова, ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Ключевые слова: инфекция мочевыводящих путей, E. coli, дети, антибиотикорезистентность, антимикробные пептиды, секвенирование микробиома
Keywords: urinary tract infection, E. coli, children, antibiotic resistance, antimicrobial peptides, microbiome sequencing
Резюме. В статье представлен обзор половозрастной и этиологической структуры инфекций мочевыводящих путей у детей на основании данных последних когортных исследований. Проанализированы факторы риска возникновения и рецидивирования заболевания у различных групп пациентов. Показана актуальность микробиологического мониторинга и взаимосвязь рецидивирующих инфекций у пациентов с сопутствующим нарушением микробиома кишечника. Дана оценка роли исследования микробиома мочи и применения антимикробных пептидов и растительных препаратов в разработке персонализированного подхода к терапии и профилактике антибиотикорезистентности.
Summary. The article presents the review of the sex age etiological structure of urinary tract infections in children based on data of recent cohort studies. The risk factors for the occurrence and recurrence of the disease in various groups of patients were analyzed. The relevance of microbiological monitoring and the interconnection recurrent urinary tract infections in patients with concomitant disorders of the intestinal microbiome are presented. The role of the research of the urinary microbiome and antimicrobial peptides and herbal preparations use for the development of personalized approach to the treatment and prevention of antibiotic resistance is given.
Для цитирования: Современный подход к терапии инфекций мочевыводящих путей у детей в условиях нарастания антибиотикорезистентности / ГБ. Бекмурзаева [и др.] // Практика педиатра. 2023. № 2. С. 60-64.
For citation: Bekmurzaeva G.B. et al. Modern approach to the treatment of urinary tract infections in children with increasing antibiotic resistance Pediatrician's Practice. 2023;(2):60-64. (In Russ.)
Инфекции мочевыводящих путей (ИМП) составляют 70-80% в структуре нефрологических заболеваний у детей как по данным мировых и российских исследований, так и результатам статистического анализа сведений, полученных от амбулаторно-поликлинических и стационарных учреждений Департамента здравоохранения г. Москвы. Для оптимизации работы, ранней диагностики и профилактики прогрессирования ИМП рабочей группой во главе с главным внештатным детским нефрологом Департамента здравоохранения г. Москвы разработан алгоритм раннего выявления факторов риска с учетом возможности его реализации начиная с первого обращения женщины в женскую консультацию (рис. 1).
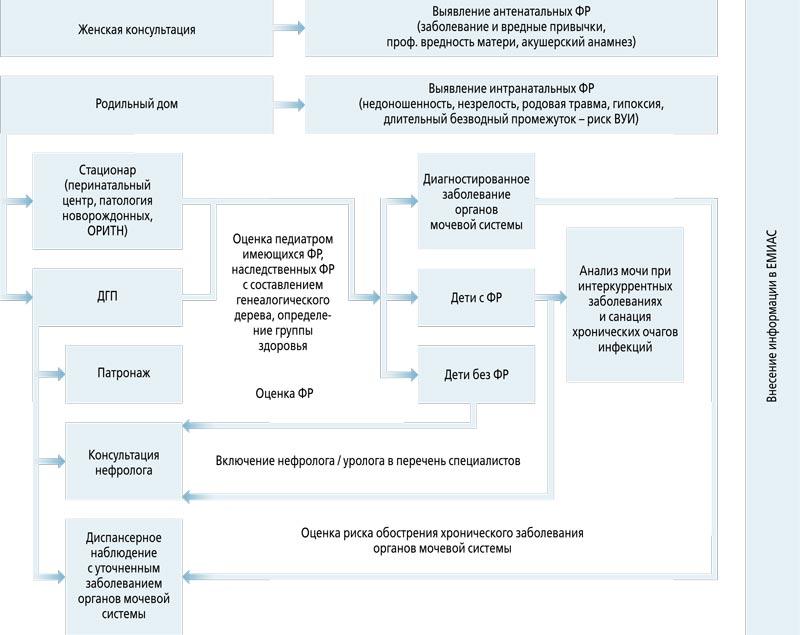 Рис. 1. Алгоритм выявления факторов риска по профилю «нефрология». Примечание: ВУИ – внутриутробная инфекция, ДГП – детская городская поликлиника, ЕМИАС – единая медицинская информационно-аналитическая система, ОРИТН – отделение реанимации и интенсивной терапии новорожденных, ФР – факторы риска
Рис. 1. Алгоритм выявления факторов риска по профилю «нефрология». Примечание: ВУИ – внутриутробная инфекция, ДГП – детская городская поликлиника, ЕМИАС – единая медицинская информационно-аналитическая система, ОРИТН – отделение реанимации и интенсивной терапии новорожденных, ФР – факторы риска
При рецидивирующем течении ИМП с целью профилактики прогрессирования определена схема маршрутизации пациентов (рис. 2).
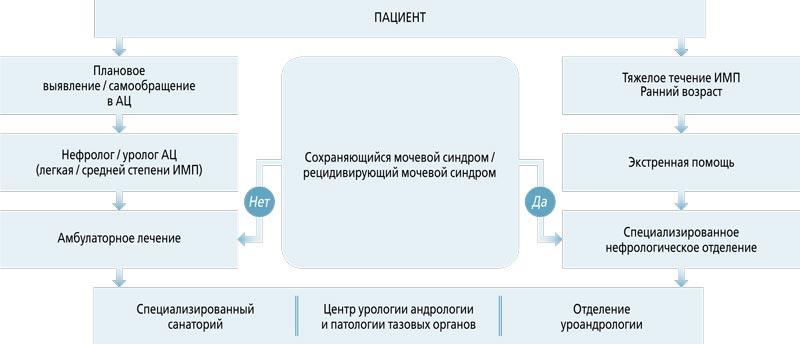 Рис. 2. Схема маршрутизации пациента с инфекцией мочевыводящих путей (ИМП). Примечание: АЦ – амбулаторный центр
Рис. 2. Схема маршрутизации пациента с инфекцией мочевыводящих путей (ИМП). Примечание: АЦ – амбулаторный центр
Несмотря на наличие разработанных клинических рекомендаций [1] и методических пособий, педиатры, нефрологи, урологи сталкиваются с проблемой антибиотикорезистентности. В связи с нарастанием антибиотикорезистентности становится актуальным вопрос об определении текущей распространенности возбудителей ИМП в детской популяции с определением чувствительности к противомикробным препаратам в конкретном регионе.
На базе Детской городской клинической больницы им. З.А. Башляевой Департамента здравоохранения г. Москвы было проведено ретроспективное исследование, в которое были включены 1572 пациента в возрасте от 1 мес до 17 лет, находившихся на стационарном лечении в нефрологическом отделении больницы в период с 01.01.2021 по 31.12.2021. Всем пациентам выполнено бактериологическое исследование мочи (средней порции) с определением возбудителя и его чувствительности к антибактериальным препаратам.
Положительный результат бактериологического исследования мочи получен в 491 случае, диагностический значимый титр возбудителя обнаружен в 197 (40%) из 491 пробы. Наиболее распространенными патогенными микроорганизмами стали E. coli (45%), бактерии рода Staphylococcus (15%) и Enterococcus (13%).
Диагностически значимый титр (105) E. coli был выявлен у 88 пациентов, из них 28% детей – в возрасте до 1 года, 12% – от 1 года до 3 лет, 18% – от 4 до 7 лет, 21% – от 8 до 11 лет, 9% – от 12 до 14 лет, 12% – от 15 до 17 лет. У 1/3 пациентов ИМП диагностирована впервые. У 43% наблюдалось рецидивирующее течение. У 32% ИМП была осложнена диагностированной анатомической патологией (в большинстве случаев – пузырно-мочеточниковым рефлюксом различной степени выраженности). Частота резистентности E. coli к амоксициллину/клавулановой кислоте составила 16%, к цефотаксиму – 33,3%, к цефепиму – 26,7%, к цефтриаксону – 27,7%. Чувствительность E. coli к препарату 2-й линии, амикацину, выявлена в 95,3%. Максимальная чувствительность бактерий в исследуемых образцах была зафиксирована к препаратам группы карбапенемов (ямеропенему, имипенему, эртапенему); она составляла 98,8-100%.
Основой лечения ИМП является применение антибактериальных препаратов, уросептиков. В большинстве случаев терапия назначалась эмпирическим путем: 55% пациентов получали цефиксим, 38% – фуразидин, у 3% в лечении применялся амоксициллин/клавулановая кислота, у 3% – цефотаксим и у 1% – ципрофлоксацин. Эффективность терапии составила 98,6%.
В настоящее время основное внимание уделяется изучению микробных сообществ, населяющих желудочно-кишечный тракт, но все большее число исследований подтверждает существование микробиома мочеполовой системы. По результатам культивирования микробов мочи, секвенирования бактериального генома и метагеномного анализа выявлены различия в микробиоме мочи у здоровых людей и пациентов с нефроурологическими заболеваниями. Это опровергает давнее представление о том, что мочевой пузырь – это стерильная среда. Моча в мочевом пузыре содержит множество грамположительных организмов, таких как лактобациллы, стрептококки и стафилококки. Желудочно-кишечный тракт считается основным источником большинства бактериальных инфекций в мочевыводящих путях. Кишечная палочка является доминирующим уропатогеном и образует резервуары внутри слизистой оболочки мочевого пузыря [2]. Путем анализа последовательности всего генома изолятов E. coli из образцов мочи и кала мужчин и женщин в возрасте от 18 до 94 лет выявлены специфичные для каждой системы органов генетические адаптации. Кроме того, штаммы E. coli, колонизирующие как мочевые пути, так и кишечник, обладают более высоким генетическим разнообразием. Ключевые наблюдения, сделанные авторами, позволяют предположить, что на эволюционное развитие патогенных штаммов влияют специфические для каждой ниши потребности в приспособлении к кишечнику или мочевыводящим путям, которые осуществляются путем отбора случайных генетических мутаций или приобретения мобильных генетических элементов (MGEs) – последовательностей ДНК, которые могут перемещаться внутри генома [3].
Экспериментальные исследования показали, что кишечная микробиота имеет большое значение в случае острого повреждения почек, оказывая нефропротекторное или нейропатогенное действие. Клинически почечное повреждение индуцирует дисбиоз кишечника, который включает нарушение жизнедеятельности видов Escherichia coli, Bacteroidetes, Bifidobacterium, Salmonella, Lactobacillus, Clostridium, Ruminococcus, Rothia, Staphylococcus, Enterobacter, Faecalibacterium, Lachnospiraceae и др. [4-7].
Дисбиоз кишечника также приводит к развитию воспаления в тканях и, как следствие, к повышенной кишечной проницаемости. Упомянутые выше факторы играют решающую роль в рецидивировании ИМП [8].
Клинический пример
Девочка 17 лет наблюдалась у онколога с ноября 2019 г. в связи с диагностированной саркомой Юинга. 2 декабря 2019 г. выполнена ламинэктомия L2-L3 с удалением экстрадурального образования. Проведено 9 курсов полихимиотерапии, достигнута ремиссия. В дальнейшем у ребенка сформировалось нарушение функций тазовых органов (неадаптированно-арефлекторный мочевой пузырь, недержание мочи, хронические запоры), длительное время осуществлялась постоянная катетеризация мочевого пузыря, далее периодическая, стул 1 раз в неделю после очистительной клизмы. Наблюдалась у уролога и нефролога по поводу рецидивирующего мочевого синдрома. Неоднократно стационарно проходила лечение по поводу обострения хронического пиелонефрита (каждые 2-3 мес). Проведено несколько курсов антибактериальной терапии (цефотаксим, ципрофлоксацин, амикацин) с кратковременным положительным эффектом. При посеве мочи выявлялась E. Coli в диагностическом титре (107-108 КОЕ/мл), которая со временем стала практически полирезистентной (низкая чувствительность к имипенему, пиперациллину-тазобактаму, амикацину).
В связи с рецидивирующим течением пиелонефрита пациентке выполнена ретроградная цистоуретрография вне обострения (рис. 3): тень мочевого пузыря однородно контрастировалась в проекции таза с неровными волнистыми контурами. В проекции мочевого пузыря до момента микции определялись выпячивания с неровными контурами на 14, 16, 17, 20 и 21 часе, внутри содержалось контрастное вещество. Рентгенологических данных, свидетельствующих о пузырно-мочеточниковом рефлюксе, не получено.
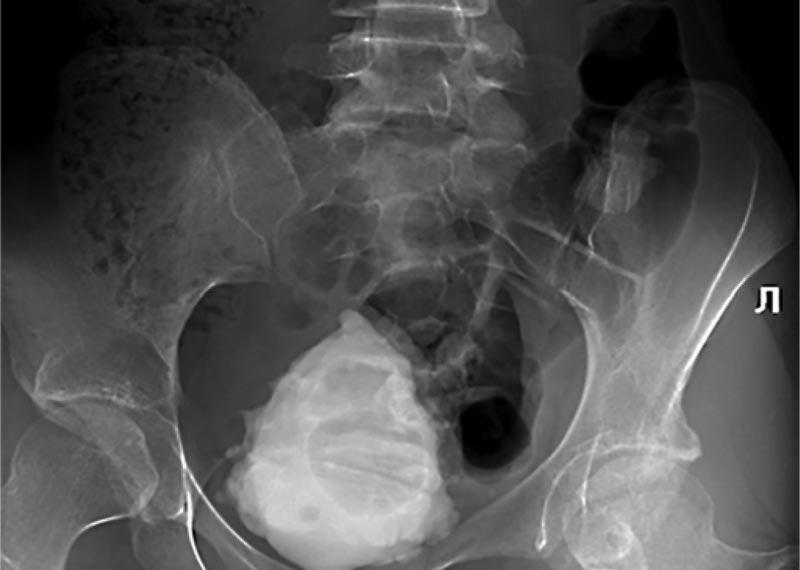 Рис. 3. Цистоуретрография пациентки с саркомой Юинга и нарушением функций тазовых органов
Рис. 3. Цистоуретрография пациентки с саркомой Юинга и нарушением функций тазовых органов
При диагностической цистоскопии в мочевом пузыре обнаружены в большом количестве сгустки фибрина и эпителия; слизистая оболочка – с выраженной инъекцией сосудов и очаговой гиперемией, буллезные образования по всей слизистой оболочке. Определялась выраженная трабекулярность с образованием множественных ложных дивертикулов разных размеров. Треугольник Льето и межмочеточниковая складка выражены очень слабо.
За время госпитализации были выработаны гигиенические навыки, рекомендовано продолжить периодическую катетеризацию, регулярное (1 раз в 2 дня) проведение очистительных клизм. Рекомендованы уросептики и длительный прием пробиотических препаратов, достигнута клинико-лабораторная ремиссия.
Таким образом, у девочки с рецидивирующей ИМП с нарушением функции тазовых органов на фоне органического поражения с развившейся полирезистентностью E. coli к антибактериальным препаратам добиться стойкой клинико-лабораторной ремиссии удалось с помощью комплексного подхода к восстановлению уродинамики, регулярного опорожнения кишечника и нормализации его микрофлоры, а не только путем использования антибактериальных препаратов.
В свою очередь, использование пробиотических препаратов и растительных уросептиков сокращает длительность применения антимикробных средств (антибиотиков, уросептиков), что снижает вероятность формирования резистентности и отрицательного влияния на состав микробиоты. Из фитоуро-септиков эффективен препарат «Канефрон Н». Это комбинированный препарат растительного происхождения (трава золототысячника, корень любистока и листья розмарина). «Канефрон Н» обладает мочегонным, противовоспалительным, спазмолитическим, сосудорасширяющим, нефропротекторным и антимикробным действием. Антимикробный механизм действия может быть объяснен свойствами биологически активных веществ в составе препарата. Например, фенолкарболовые кислоты и флавоноиды способны повреждать клеточные мембраны бактерий, нарушая их целостность, а также угнетать аэробное дыхание и энергетический синтез [9]. Известна антимикробная активность следующих веществ, содержащихся в траве розмарина: розмариновая, карнозиновая, кофейная кислоты, карнозол. В эксперименте было показано, что эфирное масло розмарина в 86,3% случаев способно подавлять рост биопленок, выделенных у пациентов с ИМП в возрасте от 2 мес до 90 лет. Продемонстрировано также повышение чувствительности E. coli к цефтазидиму и цефтриаксону при сочетанном применении с экстрактом розмарина [10].
После купирования острой фазы следует продолжить лечение фитопрепаратом еще 2-4 нед [11].
В мочевыделительной системе присутствует множество естественных компонентов иммунной системы, включая разнообразные классы антимикробных пептидов и других белков с антимикробной активностью. Антимикробные пептиды не только обладают противомикробным эффектом, но и сами по себе являются многофункциональными факторами иммунной защиты. Их универсальные механизмы действия на различные возбудители, способность модулировать иммунный ответ, а также неспособность микроорганизмов формировать факторы резистентности по отношении к антимикробным пептидам создают перспективу использования этих препаратов в качестве альтернативы антибактериальным препаратам, что требует дальнейшего изучения. Противоинфекционная защита иммунной системы непосредственно связана с присутствием нормальной микробиоты слизистых оболочек и кишечника. В исследовании in vivo продемонстрированы микробиомпротективные свойства препарата «Канефрон Н» и отсутствие негативного влияния на микробное разнообразие, в отличие от антибиотика фосфомицина и нитрофурантоина [12].
Создание новых препаратов на основе естественных антимикробных пептидов имеет ряд недостатков, включая высокую стоимость их синтеза и исследований их безопасности и эффективности, снижение активности антимикробных пептидов под действием солей, протеолитических ферментов, изменчивости рН, возможные аллергические реакции при их использовании, а также некоторые сопутствующие биологические эффекты, такие как ангиогенез. Тем не менее на сегодняшний день ряд препаратов на основе антимикробных пептидов проходит II и III фазы клинических исследований [13].
Антибиотикорезистентность продолжает оставаться актуальной и сложной проблемой, но развитие технологий секвенирования микробиома мочи, разработка альтернативных методов лечения дают возможность применить индивидуальный подход к терапии ИМП и профилактике рецидивов. Необходимо также продолжать микробиологический мониторинг, что позволит скорректировать действующие клинические рекомендации и подходы к терапии с учетом индивидуальных особенностей пациента и региона проживания.
Литература
- Инфекция мочевыводящих путей у детей. Клинические рекомендации. 2021-2022-2023 (10.11.2021). Утверждены Минздравом России, ID 281
- Jones-Freeman B. The microbiome and host mucosal interactions in urinary tract diseases // Mucosal Immunology. 2021. Vol. 14. P. 779-792. DOI: 10.1038/s41385-020-00372-5.
- Gut-bladder axis enters the stage: Implication for recurrent urinary tract infections / A.M. Salazar, M.L. Neugent, N.J. De Nisco, I.U. Mysorekar // Cell Host Microbe. 2022. Vol. 30, No. 8. P. 1066-1069. DOI: 10.1016/j.chom.2022.07.008.
- Hypoxia: A cause of acute renal failure and alteration of gastrointestinal microbial ecology / A. Samanta [et al.] // Saudi Journal of Kidney Diseases and Transplantation. 2018. Vol. 29. P. 879-888.
- Gut microbiota-derived D-serine protects against acute kidney injury / Y. Nakade [et al.] // JCI Insight. 2018. Vol. 3. e97957.
- Microbiome-metabolome signature of acute kidney injury / N.V Andrianova [et al.] // Metabolites. 2020. Vol. 10. P. 142.
- Intestinal microbiota control acute kidney injury severity by immune modulation / J. Yang [et al.] // Kidney International. 2020. Vol. 98. P. 932-946.
- Chou Y.-T. Acute kidney injury and gut dysbiosis: a narrative review focus on pathophysiology and treatment // International Journal of Molecular Sciences. 2022. Vol. 23, No. 7. P.3658
- Амосов А.В., Султанова Е.А. Канефрон®Н. Обзор фармакологических и клинических данных / под ред. Ю.Г. Аляева. : М., 2011. 127 с.
- Antimicrobial activity of spices popularly used in Mexico against urinary tract infections / A.J. Ortega-Lozano, E.Y. Hernandez-Cruz, T. Gomez-Sierra, J. Pedraza-Chaverri // Antibiotics. 2023. Vol. 12. P. 325. DOI: 10.3390/antibiotics12020325.
- Комплексная противорецидивная терапия инфекции мочевыводящих путей у детей / И.М. Османов [и др.] // Практика педиатра. 2021. № 2. С. 60-64.
- Contribution of symptomatic, herbal treatment options to antibiotic stewardship and microbiotic health / B. Nausch [et al.] // Antibiotics, 2022. Vol. 11. P. 1331. DOI: 10.3390/antibiotics11101331.
- Роль антимикробных пептидов в защите от инфекций мочевых путей / И.Н. Захарова [и др.] // Медицинский совет. 2019. № 2. С. 143-150. DOI: 10.21518/2079-701X-2019-2-143-150.

