Тканевый ингибитор матриксных металлопротеиназ 1-го типа как фактор риска развития осложнений синдрома Альпорта у детей
СтатьиЗ.Р. Баширова, Научно-исследовательский клинический институт педиатрии и детской хирургии им. акад. Ю.Е. Вельтищева, И.М. Османов, д-р мед. наук, профессор кафедры госпитальной педиатрии № 1 и директор Университетской клиники педиатрии РНИМУ им. Н.И. Пирогова Минздрава России, главный внештатный специалист-педиатр ДЗМ, главный внештатный детский специалист-нефролог ДЗМ, главный врач ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой ДЗМ»
Резюме. Синдром Альпорта - редкое наследственное заболевание, проявляющееся прогрессирующей почечной недостаточностью и развитием тубулоинтерстициального фиброза. Основа формирования тубулоинтерстициального фиброза - это дисбаланс между синтезом и деградацией (протеолизом) компонентов экстрацеллюлярного матрикса. Главную роль в процессах расщепления компонентов экстрацеллюлярного матрикса играют матриксные металлопротеиназы (ММП) и их ингибиторы (ТИМП). Цель исследования: определить связь уровня ММП-2, ММП-3, ММП-9 и их ингибиторов ТИМП-1, ТИМП-2, ингибитора активатора плазминогена 1-го типа в крови и моче с критериями тяжести синдрома Альпорта у детей. Материал и методы. В исследование включено 32 ребенка с синдромом Альпорта. Уровень ММП и ТИМП, ингибитора активатора плазминогена 1-го типа в сыворотке крови и моче определяли методом иммуноферментного анализа. Критериями тяжести синдрома Альпорта выбраны: выраженность артериальной гипертензии в зависимости от перцентиля систолического и/или диастолического артериального давления, суточная экскреция белка с мочой, стандартизированная на поверхность тела, наличие нейросенсорной тугоухости. Результаты. Анализ показал, что фактором риска артериальной гипертензии является повышение содержания ТИМП-1 в моче (относительный риск 4,57 (2,75-7,6); чувствительность 82%, специфичность 70%, положительная прогностическая ценность 64%, отрицательная прогностическая ценность 86%); фактором риска суточной потери белка с мочой нефротического уровня у детей с синдромом Альпорта - повышение уровня ТИМП-1 в моче (относительный риск 1,87 (1,16-3,01); чувствительность 100%, специфичность 76%, положительная прогностическая ценность 68%, отрицательная прогностическая ценность 100%). Заключение. Уровень ТИМП-1 в моче может быть использован в педиатрической практике для прогнозирования развития осложнений синдрома Альпорта - артериальной гипертензии более 95 перцентиля в зависимости от перцентиля систолического и/или диастолического артериального давления и суточной экскреции белка с мочой, стандартизированной на поверхность тела, нефротического уровня с целью выбора тактики лечения и своевременного его начала.
Ключевые слова: матриксные металлопротеиназы, тканевый ингибитор матриксной металлопротеиназы 1-го типа, дети, синдром Альпорта, протеинурия, артериальная гипертензия
Summary. Alport syndrome is a rare hereditary disease that manifests itself as progressive renal failure. The progression of fibrosis in the renal parenchyma is determined by the development of tubulointerstitial fibrosis. The basis for the formation of tubulointerstitial fibrosis is an imbalance between the synthesis and degradation (proteolysis) of the components of the extracellular matrix. The main role in the destruction of extracellular matrix components belongs to matrix metalloproteinases (MMP) and their inhibitors (TIMP). The aim of this study was to determine the association of MMP-2, MMP-3 and MMP-9 and their inhibitors TIMP-1 and TIMP-2, plasminogen activator inhibitor type 1 in the blood and urine with criteria for the severity of Alport syndrome in children. Materials and methods. The study included 32 children with Alport syndrome. The level of MMp-2, MMP-3 and MMP-9 and their inhibitors TIMP-1 and TIMP-2, plasminogen activator inhibitor type 1 in blood serum and urine was determined by enzyme-linked immunosorbent assay. The criteria for the severity of Alport's syndrome were chosen: the severity of arterial hypertension depending on the percentile of systolic and/or diastolic blood pressure, daily excretion of protein in the urine, standardized on the body surface, sensorineural hearing loss. Results. The analysis of the association of matrix metalloproteinases and their inhibitors in blood serum and urine with the criteria for the severity of Alport's syndrome found that the risk factor for arterial hypertension is an increase in tissue TIMP-1 in urine (relative risk 4.57 (2.75-7.6); sensitivity 82%, specificity 70%, positive predictive value 64%, negative predictive value 86%); a risk factor for daily loss of protein in the urine of a nephrotic level in children with Alport syndrome in children is also an increase in tissue TIMP-1 in the urine (relative risk 1.87 (1.16-3.01); sensitivity 100%, specificity 76%, positive predictive value 68%, negative predictive value 100%). Conclusion. Our study demonstrates that a TIMP-1 in urine can be used in pediatric practice to predict complications of Alport's syndrome in the form of arterial hypertension over 95th percentile depending on the percentile of systolic and/or diastolic blood pressure and daily urinary protein excretion, standardized to the body surface of the nephrotic level for the timely start and choice of treatment tactics.
Keywords: matrix metalloproteinases, tissue inhibitor of matrix metalloproteinase-1, children, Alport syndrome, proteinuria, arterial hypertension
Введение
Синдром Альпорта - это редкое в популяции, но наиболее часто встречающееся в структуре наследственно обусловленных заболеваний почек с прогрессирующим течением заболевание, обусловленное мутацией в генах COL4A5, COL4A3 или COL4A4, кодирующих а3-, а4- и а5-цепи коллагена IV, основного коллагенового компонента базальных мембран в клубочках, улитке, роговице, хрусталике и сетчатке. Эти мутации выявляются у 30% пациентов с генетической причиной хронической болезни почек (ХБП). Синдром Альпорта характеризуется гематурией, протеинурией, нейросенсорной тугоухостью, вызванной аномалиями коллагена IV типа во внутреннем ухе (у детей старшего возраста часто двусторонней) [1, 2]. Также могут наблюдаться множественные глазные изменения: передний лентиконус, который приводит к аномальной рефракции и снижению остроты зрения, субкапсулярная катаракта, аномальные пигментные изменения сетчатки с желтыми или белыми пятнами (точечная ретинопатия), задняя полиморфная дистрофия и эрозии роговицы [3]. В итоге у пациентов прогрессирует протеинурия, артериальная гипертензия, что ведет к утрате почками своей функции и терминальной стадии почечной недостаточности [4]. Распространенность синдрома Альпорта варьирует от 1 : 5000 до 1 : 53000 [5, 6]. Возраст достижения терминальной стадии почечной недостаточности у пациентов с синдромом Альпорта характеризуется большой индивидуальной вариабельностью, даже между членами семьи, имеющими одну и ту же мутацию. Прогноз при Х-сцепленной форме синдрома Альпорта: около 50% мужчин нуждаются в диализе или трансплантации почки в возрасте до 30 лет, 80% - к 40 годам и 100% - к 60 годам. Пациенты женского пола с Х-сце-пленным синдромом Альпорта имеют более благоприятный прогноз: к 45 годам терминальная стадия почечной недостаточности развивается примерно у 12%, к 60 годам этот показатель увеличивается до 30%, а к 80 - до 40%.
Прогрессирование заболевания почек на морфологическом уровне характеризуется развитием нефро- и артериосклероза. Формирование клиниколабораторных признаков прогрессирования, таких как артериальная гипертензия, протеинурия, снижение скорости клубочковой фильтрации, может быть отсроченным, поэтому поиск маркеров, отражающих тяжесть состояния, прогрессирование на ранних этапах заболевания, позволяющих прогнозировать течение нефропатий, с целью разработки новых методов терапии для замедления прогрессирования заболевания и продления додиализного этапа является актуальной задачей современной нефрологии.
Как известно, прогрессирование фиброза в паренхиме почек, ведущее к почечной недостаточности, рассматривается как характерная черта ХБП независимо от ее этиологии, и развитие в том числе синдрома Альпорта определяется прогрессированием тубулоинтерстициального фиброза [7-9]. В основе формирования тубулоинтерстициального фиброза лежит дисбаланс между синтезом и деградацией (протеолизом) компонентов экстрацеллюлярного матрикса (ЭЦМ). Главную роль в процессах расщепления компонентов ЭЦМ играют матриксные металлопротеиназы (ММП), протеолитическая активность которых регулируется системой ингибиторов, включающей тканевые ингибиторы металлопротеиназ (ТИМП) и ингибитор активатора плазминогена 1-го типа (plasminogen activator inhibitor type 1, PAI-1) [10-12].
Таким образом, нарушение системы протеолиза приводит к развитию нефросклероза, но данных об особенностях изменения системы протеолиза, ее клиническом значении при синдроме Альпорта накоплено недостаточно, что обусловливает актуальность данного исследования.
Материал и методы
В исследование включено 32 ребенка (15 мальчиков и 17 девочек) с синдромом Альпорта в возрасте от 2 до 17 лет, находившихся на обследовании и лечении в отделе наследственных и приобретенных болезней почек им. проф. М.С. Игнатовой Научно-исследовательского клинического института педиатрии и детской хирургии им. акад. Ю.Е. Вельтищева. Медиана возраста детей - 10,5 года (7,5-15,0) (у мальчиков - 10,0 (8,0-15,0) года, у девочек - 11,0 (6,0-15,0) года). Все дети получали ингибиторы ангиотензинпревращающего фермента, назначенные с нефропротективной и/ или гипотензивной целью off-label с согласия законных представителей в дозе 0,1 мг/кг/сут (0,07-1,66 мг).
С целью уточнения возможности использования факторов протеолиза в качестве факторов прогнозирования риска развития осложнений синдрома Альпорта у детей был проведен анализ связи факторов протеолиза с критериями тяжести состояния и выраженностью клинических проявлений.
Функциональное состояние почек оценивалось по скорости клубочковой фильтрации, которая рассчитывалась по формуле G.J. Schwartz [13].
Всем детям было проведено суточное мониторирование артериального давления с использованием аппаратов ABPM-0,2/M («Медитек», Венгрия) и BPlab («Петр Телегин», Россия). Анализировались средние значения систолического (САД) и диастолического (ДАД) артериального давления в дневные, ночные часы и за 24-часовой период. Показатели были стандартизированы по полу, возрасту и росту детей. Данные оценивались с использованием референсных значений для соответствующего возраста, пола и роста детей.
Согласно рекомендациям Европейского общества гипертонии по лечению повышенного артериального давления у детей и подростков (2016 г.) c модификациями («Руководство по клинической практике для скрининга и лечения высокого кровяного давления у детей и подростков», 2017 г.), артериальная гипертензия определялась как среднее САД и/или ДАД ≥ 95-го перцентиля (на основе перцентилей возраста, пола и роста) [14, 15].
Суточная потеря белка с мочой у детей с синдромом Альпорта была стандартизирована на поверхность тела для исключения влияния роста и веса. Согласно рекомендациям Международной ассоциации педиатров-нефрологов (2020 г.) нефротическим уровнем суточной экскреции с мочой принято считать протеинурию >40 мг/м2/ч или ≥1000 мг/м2/сут [16].
Наличие нейросенсорной тугоухости у детей с синдромом Альпорта констатировалось на основании результатов тональной пороговой аудиометрии.
В исследуемых группах иммуноферментным методом оценивали уровень в крови и экскрецию с мочой ММП-2, ММП-3, ММП-9 -протеаз, которые расщепляют основные компоненты ЭЦМ, а также ТИМП-1, ТИМП-2 в моче, PAI-1 в крови и моче. Уровень ММП-2, ММП-3, ММП-9, ТИМП-1, ТИМП-2 в моче определяли с помощью набора реактивов ELISA/R&D Systems Quantikine (США); PAI-1 - реактивов Technoclone (Австрия). Для стандартизации уровня в моче показатели пересчитывались на уровень креатинина в моче и выражались в нг/ммоль Cr для ММП, ТИМП и PAI-1, а для активности PAI-1 в моче - ед./ммоль/Cr.
За пороговые были приняты значения, полученные в контрольной группе - между 25 и 75% (референсный диапазон), низким считали уровень маркеров ниже 25% (нижняя граница нормы), высоким - выше 75% (верхняя граница нормы).
Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (IBM Corporation) и GraphPad Prism 8.0 (GraphPad Software, США). Количественные значения оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Шапиро - Уилка, а также показатели асимметрии и эксцесса. При распределении, отличном от нормального, значения представляли в виде медианы и интерквартильного размаха (25-го и 75-го процентилей). Номинальные данные описывались с указанием абсолютных и относительных (процентных) значений. При сравнении независимых выборок по одному признаку использовался непараметрический критерий Манна - Уитни. Сравнение номинальных данных проводилось при помощи критерия Фишера. Различия считались статистически значимыми при p < 0,05.
Результаты
Медиана скорости клубочковой фильтрации у пациентов с синдромом Альпорта составила 113 (105132) мл/мин/1,73 м2. Ввиду того, что у 84,4% детей, включенных в исследование, ХБП соответствовала I стадии и только у 15,6% - II стадии, анализ связи факторов протеолиза в зависимости от стадии ХБП не был проведен.
Частота артериальной гипертензии у пациентов с прогрессирующими заболеваниями почек значительно превышает частоту в популяции. ХБП, независимо от этиологии, и артериальная гипертензия имеют тесную причинно-следственную связь. Снижение функции почек обычно связано с повышением артериального давления, а устойчивое повышение давления ускоряет снижение функции почек [17].
Артериальная гипертензия - основное осложнение ХБП и модифицируемый фактор риска прогрессирования ХБП как у взрослых, так и у детей, в том числе с синдромом Альпорта. Артериальная гипертензия при синдроме Альпорта коррелирует с морфологическими изменениями почек, такими как формирование фокально-сегментарного гломерулосклероза на фоне изменений гломерулярной базальной мембраны и, как следствие, повышенное образование межклеточного матрикса, воспаление и фиброз почечной паренхимы [18].
Так как артериальная гипертензия является осложнением и фактором прогрессирования синдрома Альпорта, была проанализирована связь показателей артериального давления c уровнем ММП и ТИМП в крови и моче у детей с синдромом Альпорта. Дети с синдромом Альпорта были разделены на 2 группы в зависимости от перцентиля САД и/или ДАД. Из 32 детей САД < 95% было у 25 (78,1%) человек (12 мальчиков и 13 девочек, медиана возраста 9,0 (8,0-13,0) года), САД ≥ 95% - у 7 (21,9%) человек (3 мальчиков и 4 девочек, медиана возраста 12,5 (10,5-14,5) года).
При оценке частоты изменений факторов протеолиза в крови у детей с синдромом Альпорта в зависимости от наличия артериальной гипертензии (≥95%) статистически значимых различий получено не было (р ≥ 0,05) (табл. 1).
При проведении статистического анализа частоты изменений факторов протеолиза в моче у детей с синдромом Альпорта выявлено, что частота повышения ТИМП-1 в моче у детей с САД ≥ 95% была статистически значимо выше, чем у пациентов с САД <95% (р = 0,033). Шансы выявления САД > 95% при повышении ТИМП-1 в моче увеличивались в 10,6 раза (95% доверительный интервал (ДИ) 1,10-103) по сравнению с таковыми у пациентов с САД < 95%. Связь между сопоставляемыми признаками была относительно сильной (V Крамера = 0,412) (табл. 2).
Таблица 1.
Частота изменения факторов протеолиза в крови в зависимости от наличия артериальной гипертензии (САД ≥ 95%) у детей с синдромом Альпорта (n = 32)
| Изменение уровня факторов протеолиза | Число детей в зависимости от уровня систолического артериального давления | Р | |||
| <95% (n = 25) | ≥95% (n = 7) | ||||
| абс. | % | абс. | % | ||
| ММП-2, снижение | 8 | 32 | 1 | 14,3 | 0,640 |
| ММП-3, снижение | 7 | 28 | 0 | 0 | 0,169 |
| ММП-9, снижение | 12 | 48 | 6 | 85,7 | 0,104 |
| ТИМП-1, повышение | 9 | 36 | 4 | 57,1 | 0,401 |
| ТИМП-2, повышение | 3 | 12 | 0 | 0 | 0,577 |
| PAI-1, антиген, повышение | 13 | 52 | 5 | 71,4 | 0,426 |
| PAI-1, активность, повышение | 8 | 32 | 4 | 57,1 | 0,379 |
Таблица 2.
Частота изменения факторов протеолиза в моче (с поправкой на уровень креатинина) в зависимости от наличия артериальной гипертензии (САД ≥ 95%) у детей с синдромом Альпорта (n = 32)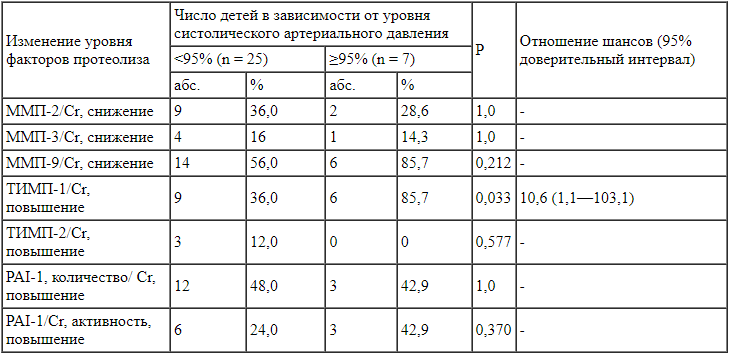 Известно, что протеинурия не только является маркером повреждения почек, но и ответственна за прогрессирование этого процесса. Увеличение количества белка в моче либо за счет повреждения стенки капилляров клубочков, либо за счет уменьшения канальцевой реабсорбции белка вызывает повреждение клеток почечных канальцев.
Известно, что протеинурия не только является маркером повреждения почек, но и ответственна за прогрессирование этого процесса. Увеличение количества белка в моче либо за счет повреждения стенки капилляров клубочков, либо за счет уменьшения канальцевой реабсорбции белка вызывает повреждение клеток почечных канальцев.
Исследования показывают, что и у взрослых, и у детей повышенный уровень общего белка мочи служит независимым фактором риска прогрессирующего снижения функции почек [19-21].
Ввиду того, что протеинурия рассматривается как фактор риска прогрессирования и показатель тяжести синдрома Альпорта, нами было проведено исследование связи суточной потери белка с мочой (мг/м2/сут) с уровнем ММП и ТИМП.
В зависимости от уровня суточной потери белка с мочой дети с синдромом Альпорта были разделены на 2 группы: с суточной потерей белка меньше нефротического уровня (менее 1000 мг/м2/сут) -25 (78,1%) детей (10 мальчиков, 15 девочек; медиана возраста 10,0 (6,0-13,0) года), с суточной потерей белка нефротического уровня - 7 (21,9%) детей (5 мальчиков, 2 девочки; медиана возраста 15,0 (12,5-15,0) года).
Сравнение частоты изменения матриксных металлопротеиназ и их ингибиторов в зависимости от суточной экскреции белка с мочой, стандартизированной на поверхность тела, в сыворотке крови не выявлено статистически значимых различий (р ≥ 0,05) (табл. 3).
Таблица 3.
Частота изменения факторов протеолиза в крови в зависимости от уровня суточной экскреции белка с мочой у детей с синдромом Альпорта (n = 32)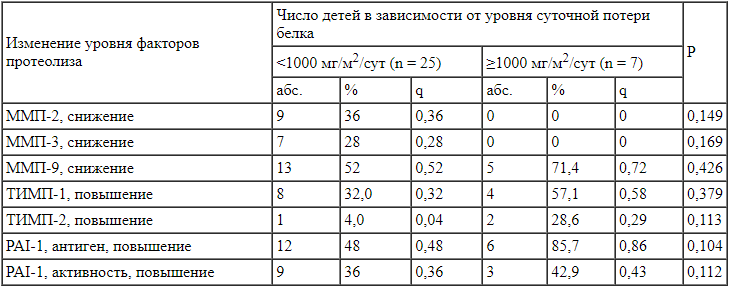 В результате анализа установлено, что уровень ТИМП-1 в моче у детей с синдромом Альпорта с суточной экскрецией белка с мочой ≥1000 мг/м2/сут был статистически значимо более высоким, чем у детей с суточной экскрецией белка с мочой <1000 мг/м2/сут (р = 0,002). Шансы выявления суточной потери белка нефротического уровня при наличии повышенного уровня ТИМП-1 в моче возрастали в 1,87 раза (95% ДИ 1,16-3,01). Выявленная связь, оцененная с помощью V Крамера, была относительно сильной (V = 0,563) (табл. 4).
В результате анализа установлено, что уровень ТИМП-1 в моче у детей с синдромом Альпорта с суточной экскрецией белка с мочой ≥1000 мг/м2/сут был статистически значимо более высоким, чем у детей с суточной экскрецией белка с мочой <1000 мг/м2/сут (р = 0,002). Шансы выявления суточной потери белка нефротического уровня при наличии повышенного уровня ТИМП-1 в моче возрастали в 1,87 раза (95% ДИ 1,16-3,01). Выявленная связь, оцененная с помощью V Крамера, была относительно сильной (V = 0,563) (табл. 4).
Таблица 4.
Частота изменения факторов протеолиза в моче (с поправкой на уровень креатинина) в зависимости от уровня суточной экскреции белка с мочой у детей с синдромом Альпорта (n = 32)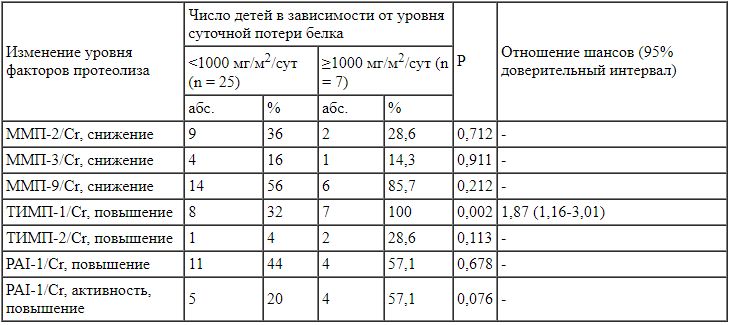 Одним из частых осложнений синдрома Альпорта, ухудшающим качество жизни пациентов, является нейросенсорная тугоухость. Она диагностирована у 11 (34,4%) детей с синдромом Альпорта: I степени -у 5 (15,6%) детей, II степени - у 4 (12,5%), III степени -у 2 (6,3%), в связи с малочисленностью групп все эти дети объединены в одну группу (8 мальчиков, 3 девочки; медиана возраста 14,0 (10,0-15,0) года). У 21 (65,6%) слух был в норме (7 мальчиков, 14 девочек; медиана возраста 9,0 (6,0-12,0) года).
Одним из частых осложнений синдрома Альпорта, ухудшающим качество жизни пациентов, является нейросенсорная тугоухость. Она диагностирована у 11 (34,4%) детей с синдромом Альпорта: I степени -у 5 (15,6%) детей, II степени - у 4 (12,5%), III степени -у 2 (6,3%), в связи с малочисленностью групп все эти дети объединены в одну группу (8 мальчиков, 3 девочки; медиана возраста 14,0 (10,0-15,0) года). У 21 (65,6%) слух был в норме (7 мальчиков, 14 девочек; медиана возраста 9,0 (6,0-12,0) года).
Выявлен статистически значимо повышенный уровень ТИМП-1 в моче (р = 0,04; 1063 (83-1430) нг/ ммоль Cr у детей с нейросенсорной тугоухостью по сравнению с таковым у детей с сохранным слухом (295,2 (221-468) нг/ммоль Cr). Однако при проведении частотного анализа повышения ТИМП-1 в моче в зависимости от наличия нейросенсорной тугоухости у детей с синдромом Альпорта статистически значимых различий получено не было (р = 0,266; частота у детей без тугоухости 38,1%, у детей с тугоухостью 63,6%; V Крамера = 0,243; ОШ 2,8; 95% ДИ (0,62-12,8).
Обсуждение
У больных с синдромом Альпорта велика вариабельность изменения скорости прогрессирования и в некоторых случаях отмечается несоответствие тяжести фенотипических проявлений характеру выявленной мутации [22].
Цель терапии при синдроме Альпорта - задержка прогрессирования почечной недостаточности до терминальной стадии.
Прогрессирующий тубулоинтерстициальный фиброз - общий путь для всех заболеваний почек, ведущих к хронической почечной недостаточности, он является надежным маркером прогрессирования. Независимо от причины возникновения ХБП патогенез характеризуется избыточным отложением внеклеточного матрикса в клубочках и канальцевом ин-терстиции и прогрессирующим снижением почечной функции (вплоть до полной утраты) вследствие прогрессирующего уменьшения числа функционирующих нефронов. Прогрессирующий почечный фиброз является результатом дисбаланса между образованием ЭЦМ и его деградацией. Выявление ранних биомаркеров фиброза почек имеет большое значение для пациентов с ХБП, поскольку раннее начало нефропротективной терапии может отсрочить развитие поздних стадий ХБП.
ММП представляют собой большое семейство цинксодержащих ферментов. Основная биологическая функция ММП - расщепление белков и гликопротеинов ЭЦМ, мембранных рецепторов. ММП участвуют во многих биологических процессах, таких как восстановление и ремодуляция тканей, клеточная дифференцировка, эмбриогенез, морфогенез, ангиогенез, пролиферация и миграция клеток, заживление ран, апоптоз. Нарушение регуляции активности ММП приводит к прогрессированию различных патологий. В настоящее время известно более 30 ММП, объединенных в 6 групп. Они различаются молекулярной структурой, субстратной специфичностью и распределением в тканях. Протеолитическая активность ММП зависит от взаимодействия факторов, способствующих активации латентных проММП (плазмин, система урокиназа/ рецептор урокиназы), и факторов, ингибирующих эти процессы. Среди последних особое место занимают ТИМП и PAI-1. Баланс между ММП и ТИМП -критический фактор ремоделирования нормальной и патологической ткани [23].
Для оценки тяжести состояния и выраженности клинических проявлений синдрома Альпорта нами выбраны выраженность артериальной гипертензии в зависимости от перцентиля САД и/или ДАД, суточная экскреция белка с мочой, стандартизированная на поверхность тела, наличие нейросенсорной тугоухости.
Анализ показал, что фактором риска артериальной гипертензии является повышение уровня ТИМП-1 в моче (относительный риск 4,57 (2,757,6); чувствительность 82%, специфичность 70%, положительная прогностическая ценность 64%, отрицательная прогностическая ценность 86%); фактором риска суточной потери белка с мочой нефротического уровня у детей с синдромом Альпорта также служит повышение уровня ТИМП-1 в моче (относительный риск 1,87 (1,16-3,01); чувствительность 100%, специфичность 76%, положительная прогностическая ценность 68%, отрицательная прогностическая ценность 100%).
Роль ТИМП-1 также продемонстрирована в ряде клинических и экспериментальных исследований, так, показано увеличение экспрессии ТИМП-1 и PAI-1 в ткани почки по мере формирования тубулоинтерстициального фиброза и прогрессирования почечной недостаточности [24, 25].
В научной литературе обсуждается вопрос о том, как ТИМП-1 связан с почечным фиброзом и избыточная экспрессия ТИМП-1 может способствовать почечному интерстициальному фиброзу через воспалительные пути [26, 27].
Фиброз in vivo ассоциируется с увеличением уровня ТИМП-1, что подразумевает снижение активности ММП и, следовательно, увеличение накопления ЭЦМ [28].
Заключение
Уровень ТИМП-1 в моче может быть использован в педиатрической практике для прогнозирования осложнений синдрома Альпорта - артериальной гипертензии (САД > 95%) и суточной экскреции белка с мочой нефротического уровня, стандартизированной на поверхность тела. Это позволяет выбрать тактику лечения и своевременно начать его.
Литература
1. Molecular basis, diagnostic challenges and therapeutic approaches of alport syndrome: a primer for clinicians / R. Martinez-Pulleiro [et al.] II International Journal of Molecular Sciences. 2021. Vol. 22, No. 20. P 11063.
2. Diagnostic utility of exome sequencing for kidney disease I E.E. Groopman [et al.] II New England Journal of Medicine. 2019. Vol. 380, No. 2. P 142-151.
3. Ocular features in alport syndrome: pathogenesis and clinical significance I J. Savige [et al.] II CJASN. 2015. Vol. 10, No. 4. P 703-709.
4. Long-term survival in Japanese renal transplant recipients with Alport syndrome: a retrospective study I A. Katsuma [et al.] II BMC Nephrology. 2018. Vol. 19, No. 1. Р 1-9.
5. Alport syndrome: no evidence of improved prognosis in modern era I Y. Kelly [et al.] II Journal of Clinical Nephrology and Renal Care. 2018. Vol. 4, No. 1. Р. 36.
6. Advances and unmet needs in genetic, basic and clinical science in Alport syndrome: report from the 2015 International Workshop on Alport Syndrome I O. Gross [et al.] II Nephrology Dialysis Transplantation. 2017. Vol. 32, No. 6. P. 916-924.
7. Clinicopathological predictors for progression of chronic kidney disease in nephrosclerosis: a biopsy-based cohort study I M. Yamanouchi [et al.] II Nephrology Dialysis Transplantation. 2019. Vol. 34, No. 7. P 1182-1188.
8. Bagnasco S.M., Rosenberg A.Z. Biomarkers of chronic renal tubulointerstitial injury II Journal of Histochemistry and Cytochemistry. 2019. Vol. 67, No. 9. P 633-641.
9. Safirstein R. A clear pathway to tubulointerstitial disease: is an exclusive focus on fibrosis justified? II Journal of Clinical Investigation. 2021. Vol. 131, No. 5. P. 144803.
10. Eddy A.A., Fogo A.B. Plasminogen activator inhibitor-1 in chronic kidney disease: evidence and mechanisms of action II Journal of the American Society of Nephrology. 2006. Vol. 17, No. 11.
11. Pakshir P., Hinz B. The big five in fibrosis: Macrophages, myofibroblasts, matrix, mechanics, and miscommunication II Matrix Biology. 2018. Vol. 68-69. P 81-93.
12. Plasminogen activator inhibitor type-1 as a regulator of fibrosis I R. Rabieian [et al.] II Journal of Cellular Biochemistry. 2018. Vol. 119, No. 1. P 17-27.
13. Schwartz G.J., Brion L.P., Spitzer A. The use of plasma creatinine concentration for estimating glomerular filtration rate in infants, children, and adolescents II Pediatric Clinics of North America. 1987. Vol. 34, No. 3. P 571-590. DOI: 10.1016I s0031-3955(16)36251-4.
14. European Society of Hypertension guidelines for the management ofhigh blood pressure in children and adolescents I E. Lurbe [et.al.] II Journal of Hypertension. 2016. Vol. 34, No. 10. P 1887-1920.
15. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents I J.T. Flynn [et al.] II Pediatrics. 2017. Vol. 140, No. 3. Р e20171904.
16. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome I A. Trautmann [et al.] II Pediatric Nephrology. 2020. Vol. 35, No. 8. P 1529-1561.
17. Judd E., Calhoun D.A. Management of hypertension in CKD: beyond the guidelines II Advances in Chronic Kidney Disease. 2015. Vol. 22, No. 2. P 116-122.
18. Clinico-pathological correlations in 127 patients in 11 large pedigrees, segregating one of three heterozygous mutations in the CO-L4A3/COL4A4 genes associated with familial haematuria and significant late progression to proteinuria and chronic kidney disease from focal segmental glomerulosclerosis I A. Pierides [et al.] II Nephrology Dialysis Transplantation. 2009. Vol. 24, No. 9. P 2721-2729.
19. Liu D., Lv L.-L. New Understanding on the role of proteinuria in progression of chronic kidney disease II Advances in Experimental Medicine and Biology. 2019. Vol. 1165. P. 487-500.
20. The effect of amiloride on proteinuria in patients with proteinuric kidney disease I W. Shen [et al.] II American Journal of Nephrology. 2021. Vol. 52, No. 5. P. 368-377.
21. Chan E.Y.-H., Ma A.L.-T., Tullus K. When should we start and stop ACEiIARB in paediatric chronic kidney disease? II Pediatric Nephrology. 2021. Vol. 36, No. 7. P. 1751-1764.
22. Milder clinical aspects of X-linked Alport syndrome in men positive for the collagen IV a5 chain I Y Hashimura [et al.] II Kidney International. 2014. Vol. 85, No. 5. P 1208-1213. DOI: 10.1038Iki.2013.479.
23. Structure and function of matrix metalloproteinases and TIMPs I H. Nagase [et al.] II Cardiovascular Research. 2006. Vol. 69, No. 3. P. 562-573.
24. Ahmed A.K.H. Matrix metalloproteinases and their inhibitors in kidney scarring: culprits or innocents II Journal of Health Science. 2009. Vol. 55, No. 4. P. 473-483.
25. Tissue inhibitors of metalloproteinases: structure, regulation and biological functions I D.E. Gomez [et al.] II European Journal of Cell Biology. 1997. Vol. 74, No. 2. P. 111-122.
26. Tissue inhibitor of metalloproteinase-1 exacerbated renal interstitial fibrosis through enhancing inflammation I G. Cai [et al.] II Nephrology Dialysis Transplantation. 2008. Vol. 23, No. 6. P 1861-1875.
27. Elevation of serum and urine levels of TIMP-1 and tenascin in patients with renal disease I J.H. Horstrup [et al.] II Nephrology Dialysis Transplantation. 2002. Vol. 17, No. 6. P. 1005-1013.
28. TIMP-1 deficiency does not attenuate interstitial fibrosis in obstructive nephropathy I H. Kim [et al.] II Journal of the American Society of Nephrology. 2001. Vol. 12, No. 4. P. 736-748.
Комментарии
ПРАКТИКА ПЕДИАТРА

