Патология сердечно-сосудистой системы у детей, родившихся с очень низкой и экстремально низкой массой тела
СтатьиА.К. Миронова, канд. мед. наук, А.С. Шарыкин, д-р мед. наук, ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Резюме. Представлены результаты анализа данных о заболеваниях сердечно-сосудистой системы у глубоконедоношенных детей, рожденных с очень низкой и экстремально низкой массой тела. Продемонстрирована значительно более высокая частота патологий сердечно-сосудистой системы в группе глубоконедоношенных детей, которая обратно коррелировала с гестационным возрастом. Это определяет необходимость последующего целенаправленного мониторирования состояния здоровья детей данной группы с целью своевременной коррекции выявленных нарушений со стороны сердечно-сосудистой системы.
Ключевые слова: глубоконедоношенные дети, поражение сердечно-сосудистой системы, очень низкая масса тела, экстремально низкая масса тела, абилитация
Summary. The results of the analysis of diseases of the cardiovascular system in preterm infants born with very low and extremely low body weight are presented. A significantly higher frequency of cardiovascular system pathologies was demonstrated in the group of preterm infants, which was inversely correlated with gestational age. This determines the need for further targeted monitoring of the health status of children in this group in order to timely correct the identified disorders of the cardiovascular system.
Keywords: deeply premature babies, diseases of the cardiovascular system, very low body weight, extremely low body weight, habilitation
Введение
Поражения сердечно-сосудистой системы (ССС) у глубоконедоношенных детей, родившихся с очень низкой (ОНМТ) и экстремально низкой (ЭНМТ) массой тела, встречаются значительно чаще, чем у доношенных. Высокая частота обусловлена различными факторами, в том числе отягощенным течением беременности (которое имеет место в большинстве случаев), приводящим к замедлению созревания всех органов и систем и их выраженной морфофункциональной незрелости.
После рождения глубоконедоношенного ребенка происходит запуск процессов постнатальной адаптации, которые касаются всего сердечно-легочного континуума. При этом, по данным разных авторов, у 40-70% детей отмечаются постгипоксические нарушения работы ССС, синдром персистирующего фетального кровообращения, транзиторная легочная гипертензия и респираторный дистресс-синдром. Последствия этих нарушений могут сохраняться длительное время, регистрируются в различные возрастные периоды и становятся причиной многих заболеваний, в том числе требующих хирургической коррекции [1, 2].
Ведущим фактором поражения органов, в том числе ССС, является гипоксия (внутриутробная, интра-или постнатальная), встречающаяся у глубоконедоношенных детей в 100% случаев. В настоящее время неврологические и легочные проблемы у недоношенных новорожденных изучены достаточно полно, однако влияние патологии ССС, зарегистрированной при рождении, на состояние и развитие детей детально описано лишь в ограниченном количестве работ.
Цель настоящего исследования - изучение проявлений патологии ССС и ее влияния на функционирование других органов и систем у глубоконедоношенных детей.
Материал и методы
На базе ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы» с 2012 г. функционирует Центр восстановительного лечения детей, родившихся с очень низкой и экстремально низкой массой тела. Нами проведена подробная оценка поражения органов ССС у 5961 младенца, получавшего медицинскую помощь в больнице в период с 2012 по 2021 г. Из них 2961 ребенок (I группа) родился глубоконедоношенным. В зависимости от массы тела при рождении были выделены подгруппы: Ia - 1160 детей с ЭНМТ (<1000 г) и Ib - 1801 детей с ОНМТ (от 1000 до 1500 г). В группу сравнения (II группа) вошли 3000 доношенных детей (средний вес которых составлял 3325 г (2750-4120 г)), проходивших лечение в отделении реанимации и интенсивной терапии новорожденных и отделениях патологии новорожденных.
У всех пациентов проведена клиническая оценка состояния неонатологом, неврологом, кардиологом, а также выполнено ультразвуковое исследование внутренних органов, головного мозга и эхокардиографическое исследование на аппаратах GE Logic E микроконвексным датчиком 8C-RS (4,2-11,0 МГц) и линейным датчиком 9L-RS (3,0-9,0 МГц) и Philips EPIQ7 линейным датчиком еL18-4 (2-22 МГц), секторным датчиком S5-1 (1-5 МГц), конвексным датчиком C5-1 (4-10 МГц).
Оценка гемодинамического значения открытого артериального протока (ОАП) выполнялась в соответствии с общепринятыми критериями (табл. 1). ОАП считали гемодинамически значимым при обнаружении всех основных критериев и как минимум одного дополнительного.
После выписки из стационара эхокардиография проводилась всем детям в 6, 12, 24 и 36 мес. корригированного возраста.
Таблица 1.
Критерии диагностики гемодинамически значимого открытого артериального протока
| Основные |
|
| Дополнительные |
|
Для дополнительного анализа клинико-морфологических параллелей были исследованы данные 430 детей, умерших в неонатальном периоде (в числе которых было 310 глубоконедоношенных и 120 доношенных детей) и поступивших для аутопсии в пато-морфологическое отделение больницы из различных учреждений.
Результаты
Полученные данные о частоте патологий ССС и структуре заболеваемости новорожденных представлены в табл. 2-5.
Таблица 2.
Структура заболеваемости новорожденных патологиями сердечно-сосудистой системы*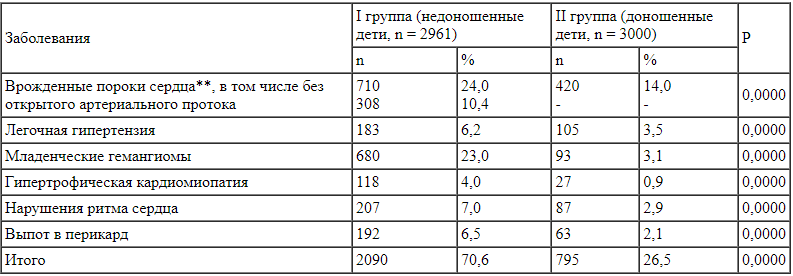 * У некоторых пациентов имелось несколько патологий.
* У некоторых пациентов имелось несколько патологий.
** Включены гемодинамически значимые открытый артериальный проток и открытое овальное окно.
Таблица 3.
Структура врожденных пороков сердца в группе глубоконедоношенных детей*
| Врожденный порок сердца | Частота | |
| абс. | % | |
| Гемодинамически значимый открытый артериальный проток | 557 | 78 |
| Гемодинамически значимый открытый артериальный проток + межпредсердное сообщение | 129 | 18 |
| Дефект межжелудочковой перегородки | 85 | 12 |
| Дефект межпредсердной перегородки | 64 | 9 |
| Стеноз аортального клапана | 14 | 2 |
| Стеноз легочной артерии | 6 | 1 |
| Двухстворчатый аортальный клапан | 5 | 1 |
| Аортолегочные коллатерали | 134 | 19 |
| Всего патологий без открытого артериального протока и открытого овального окна | 308 | 43,4 |
* У некоторых пациентов имелось несколько патологий: у 710 обследованных детей выявлено 994 патологии.
Таблица 4.
Структура врожденных пороков сердца в группе доношенных детей*
| Врожденный порок сердца | Частота | |
| абс. | % | |
| Дефект межжелудочковой перегородки | 229 | 54,5 |
| Дефект межпредсердной перегородки | 175 | 41,6 |
| Сопутствующие гемодинамически значимые функционирующие фетальные коммуникации, в том числе: открытый артериальный проток открытое овальное окно |
59 17 41 |
14,0 4,0 9,7 |
| Умеренный клапанный стеноз легочной артерии | 3 | 0,7 |
| Атриовентрикулярный канал, неполная форма | 4 | 1,0 |
| Праволежащая дуга аорты | 9 | 2,1 |
| Всего патологий без открытого артериального протока и открытого овального окна | 420 | 88,0 |
* У некоторых пациентов имелось несколько патологий: у 420 обследованных детей выявлено 479 патологий.
Таблица 5.
Влияние веса при рождении на количество врожденных пороков сердца, сопутствующих заболеваний и осложнений у глубоконедоношенных детей* * У некоторых пациентов имелось несколько патологий.
* У некоторых пациентов имелось несколько патологий.
Патология ССС выявлена у 70,6% недоношенных. Морфологические изменения сердца или внутри-грудных сосудов, имеющие функциональное или потенциально функциональное значение (в т. ч. врожденные пороки сердца (ВПС)), были представлены в 1203 (40,6%) случаях. Их структура отражена в табл. 3 и 4.
По данным литературы, частота ВПС значительно варьирует в различных популяциях и реестрах (от 0,49 до 1,0%), в основном из-за различий во включении в анализ более легких аномалий [1-4]. Отягощенное течение беременности сопровождается более внимательным изучением статуса плода, в том числе с применением фетальной эхокардиографии. Однако, несмотря на интенсивное развитие этой службы, антенатально диагностируют в среднем только около 47,3% случаев ВПС. Хорошо поддаются диагностике пороки с выраженными нарушениями анатомии [1, 2]. Это позволяет планировать и оказывать быструю помощь в кардиохирургических стационарах, где подвергаются оперативному вмешательству до 87% из них [1]. В то же время более простые пороки, однако также требующие наблюдения и лечения после рождения (аортальный стеноз, легочный стеноз, коарктация аорты), выявляются лишь в 26% случаев [1].
В результате значительная часть таких патологий становится неожиданностью для врачей после рождения ребенка. Улучшить диагностику может двухзонное измерение сатурации крови (пульсоксиметрический скрининг) [1].
Центр восстановительного лечения детей, родившихся с очень низкой и экстремально низкой массой тела, не имеет кардиохирургической службы, однако частота ВПС среди наблюдавшихся в нем пациентов была высока. При исключении ОАП и открытого овального окна (ООО) суммарное число ВПС в группе недоношенных детей составило 10,6% и было лишь ненамного ниже, чем среди родившихся доношенными (13,9%, p < 0,0001). При этом следует отметить, что последняя группа состояла из новорожденных, находившихся в стационаре, в том числе и по причине выявленных или предполагаемых ВПС, и не отражала истинную частоту встречаемости ВПС в популяции. При учете гемодинамически значимых ОАП и ООО частота ВПС среди недоношенных повышалась до 22,9%. У 283 (9,5%) детей патология сердца носила сочетанный характер.
Результаты исследования аутопсийного материала также указывают на высокую частоту поражения ССС как у недоношенных, так и у доношенных детей (табл. 6). При этом можно отметить значительное преобладание гемодинамически значимых ОАП и ООО в группе недоношенных младенцев (р = 0,0000). В 11 (3,55%) случаев наличие патологии ССС было важным компонентом танатогенеза.
Таблица 6.
Патология сердечно-сосудистой системы по результатам исследования аутопсийного материала новорожденных*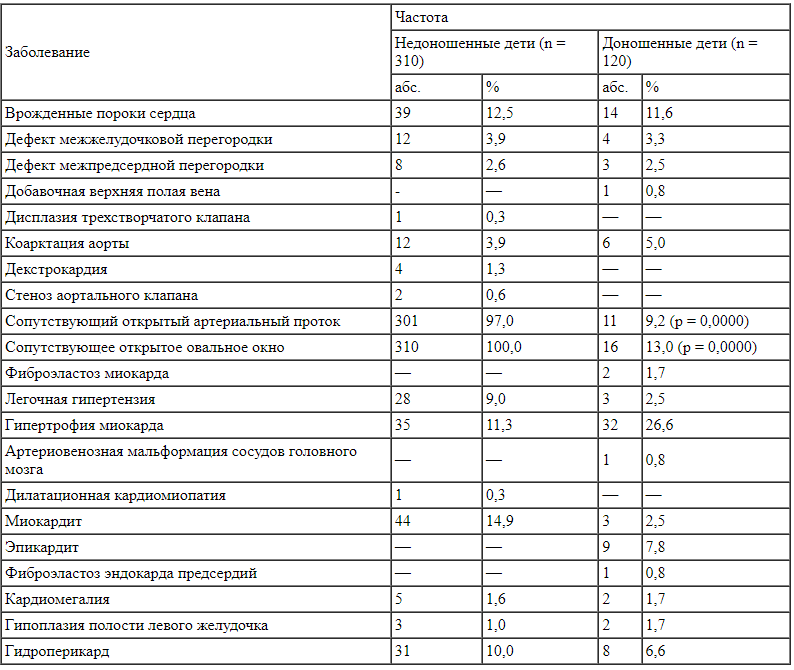 * У некоторых пациентов имелось несколько патологий.
* У некоторых пациентов имелось несколько патологий.
Влияет ли дефицит веса дополнительно на частоту сердечно-сосудистой патологии?
В наших наблюдениях частота ВПС, оказывающих влияние на кровообращение, была существенно выше в подгруппе Ia, чем в подгруппе Ib (р = 0,0000), и сопровождалась развитием более тяжелой сердечной недостаточности и осложнений, связанных с низким сердечным выбросом. Особенностью детей с ЭНМТ является достоверное преобладание гемодинамически значимых ОАП и ООО, которые приобретали самостоятельное значение, и в результате общее количество серьезных сердечных патологий возрастало до 22,9% (p = 0,0000) (см. табл. 3 и 4). В группе доношенных детей они только сопровождали основной порок и оценивались как персистирующие фетальные коммуникации.
Возможные непосредственные последствия врожденных пороков сердца
Последствия малой массы тела у недоношенных детей для головного мозга, легочной системы и организма в целом изучены в достаточной степени и характерны для периода новорожденности - это повышенный риск дыхательных расстройств, персистирование фетального кровообращения, гипогликемия, гипотермия, нарушения гемокоагуляции, инфекция, повышенная неонатальная смертность [2]. Однако в успешном переходе от плода к новорожденному помимо дыхательной системы большая роль принадлежит и системе кровообращения [1], в связи с чем ее состояние требует соответствующей оценки.
В этом аспекте можно выделить следующие проблемы.
1. Развитие сердечной недостаточности вследствие повреждения миокарда.
2. Развитие сердечной недостаточности вследствие наличия ВПС.
3. Влияние нарушений гемодинамики на другие органы и системы.
Наиболее частыми симптомами ВПС у обследованных детей были шум в сердце (92%), стойкая тахикардия (39%) и цианоз (21%). Практически у всех недоношенных детей (96-98%) отмечались тахикардия, тахипноэ, артериальная гипотензия и гипотермия, свидетельствующие о низком сердечном выбросе, в основном связанном с ВПС. В подгруппе Ia чаще, чем в подгруппе Ib, наблюдалось быстрое прогрессирование сердечной недостаточности (21,3% против 14,3%, р = 0,0196), требовавшее проведения искусственной вентиляции легких.
Миокард недоношенного ребенка обладает достаточной сократительной способностью, однако она быстро истощается по мере увеличения постнагрузки на сердце из-за ограниченных функциональных возможностей незрелой мышцы. В связи с этим адаптация недоношенных затруднена из-за замедленного снижения резистентности легочных сосудов и синдрома дыхательных расстройств, повышающих нагрузку на правые отделы сердца [1]. Нагрузка на миокард может быть вызвана и целым рядом сопутствующих заболеваний - врожденным гиперинсулинизмом, различными метаболическими синдромами, сахарным диабетом матери, патологией саркомеров и т. д. [2].
Некоторые авторы указывают, что задержка внутриутробного развития не приводит к явному изменению размеров и функции сердца в неонатальном периоде, однако отмечают персистирующее снижение отношения толщины интимы/медии в сонной артерии, что может отражать недостаточное питание матери.
Кроме того, нередко встречается повреждение миокарда вследствие его транзиторной ишемии в перинатальный период. Деструктивные изменения в таких случаях выявляют у 21,9% детей; об органическом повреждении сердца свидетельствует концентрация тропонина I выше 0,5 нг/мл [1, 2].
Другим механизмом развития дисфункции ССС является перераспределение системного и легочного кровотока, сопровождающееся объемной перегрузкой разных отделов сердца и/или низким системным сердечным выбросом. Эти нарушения обычно сопровождаются повышением концентрации в крови NT-proBNP. Причем его уровень ожидаемо выше у пациентов с ВПС, чем без них, а также выше при тяжелых пороках, чем при легких [1]. Данные изменения встречаются как при классических ВПС, так и гемодинамически значимом ОАП у недоношенных.
Частота наличия гемодинамически значимого ОАП обратно пропорциональна гестационному возрасту и массе тела при рождении. По данным различных авторов, артериальный проток продолжает функционировать на 4-е сутки у 7% пациентов с массой тела 1500-2000 г и у 85% пациентов с массой тела менее 1500 г [2, 3, 5-8]. По данным нашего исследования, ОАП был проходимым у 2398 (81%) недоношенных детей после 72 ч жизни и был гемодинамически значимым у 270 (15%) детей с ОНМТ при рождении и у 416 (35,8%) детей, родившихся с ЭНМТ (р = 0,0000). В результате частота ВПС среди недоношенных детей с была почти в 2 раза выше, чем среди доношенных новорожденных, несмотря на специфический по ВПС характер последней группы.
Целесообразно отметить, что у 355 (68,5%) из 518 пациентов с ООО его размер превышал 3 мм и оно также могло иметь гемодинамическое значение. Однако в связи с низкой скоростью перетока крови из левого в правое предсердие и относительно высоким сопротивлением легочных сосудов величина шунта была небольшой по сравнению с шунтом при ОАП.
Влияние врожденных пороков сердца на состояние других органов
В подгруппе Ia по сравнению с подгруппой Ib более часто формировались синдром дыхательных расстройств (p = 0,0000) и бронхолегочная дисплазия (р = 0,0011), чему могла способствовать быстро прогрессирующая сердечная недостаточность, требовавшая проведения вспомогательной вентиляции легких (21,3% против 14,3%, p = 0,0196).
Нестабильность гемодинамики сочеталась со значительным числом случаев внутрижелудочковых кровоизлияний в головном мозге, некротизирующего энтероколита и легочных кровотечений (табл. 5). Суммарное количество этих осложнений составило 587 в подгруппе Ia и 270 в подгруппе Ib (1,33 и 1,0 случая на 1 пациента соответственно).
Наличие ВПС даже после их коррекции может влиять и на последующее неврологическое развитие маловесных детей [1, 2].
Необходимость длительного катамнестического наблюдения за детьми с врожденными пороками сердца
Последние десятилетия характеризуются повышенным вниманием к скрытым последствиям малого веса при рождении. Низкий гестационный возраст при рождении связывают с более высокими рисками смерти по всем основным причинам (включая респираторные, сердечно-сосудистые, эндокринные, неврологические, онкологические и внешние причины) от рождения до 45 лет [1-3]. Обсуждается гипотеза, что хроническая гипоксия плода вызывает не только задержку роста плода, но и сердечно-сосудистую дисфункцию и программирует повышенный риск сердечных заболеваний у взрослого потомства [1]. Очевидно, что дефицит массы тела при рождении сочетается с малыми размерами сердца и других органов. В процессе последующего постнатального развития происходит наверстывание размеров тела (нередко с элементами ожирения [30]) и массы миокарда. Однако полного восстановления структур сердца может не происходить, так как естественная гиперплазия кардиомиоцитов завершается в раннем послеродовом периоде, и у подростков и взрослых обнаруживают задержку роста сердца [2]. Помимо недоношенности на морфологические характеристики сердца могут влиять и такие факторы, как пол, раса, состав тела, ожирение, уровень физической активности, социально-экономическое положение и т. п. Обязательно следует учитывать возрастные нормативы ребенка, так как существуют доказанные корреляции между величиной площади тела и необходимым сердечным выбросом [1]. В результате могут быть получены три варианта их сочетания в катамнезе:
1. Недостаточное физическое развитие детей, не требующее высокого сердечного выброса и больших размеров сердца.
2. Достаточное физическое развитие детей, но адекватный сердечный выброс обеспечивается за счет более высокой частоты сердечных сокращений, а не размеров сердца и ударного выброса (увеличения размеров сердца не требуется).
3. Имеются нарушения роста сердца, которые приводят к дефициту выброса, роста и веса детей (обратная зависимость).
Только при такой комплексной оценке находят объяснение разногласия в работах, посвященных анатомии сердца у подростков и взрослых, родившихся недоношенными. Так, по данным K.N. Goss и соавт., подростки и молодые люди, рожденные недоношенными, имели статистически значимо меньшие размеры желудочков, но без гипертрофической реакции и с сохраненной функцией в покое [9]. А в работе A.I. Lewandowski и соавт. объем и ударный выброс левого желудочка были меньше, чем в контрольной группе на фоне большей массы, толщины межжелудочковой перегородки и нарушенной диастолической функции. Причиной этого может быть зарегистрированный ими диффузный фиброз миокарда (по данным магнитно-резонансной томографии) у родившихся преждевременно. Авторы высказывают гипотезу, что истоки различного развития структур и геометрии сердца в катамнезе могут быть связаны с характером нарушенного течения беременности, например наличием преэклампсии [1].
В процессе развития детей выявляют и другие проблем:
1. Нарушения диастолической функции правого желудочка [1], чаще наблюдающиеся у детей с перенесенной длительной искусственной вентиляцией легких.
2. Задержка роста аорты, эндотелиальная дисфункция, повышенное содержание коллагена в стенке аорты и атероматоз. По некоторым данным, на каждый дополнительный 1 см длины тела на момент рождения в среднем приходится дополнительно 0,24 мм диаметра корня аорты [10].
3. Системная и легочная гипертензия [11]. Значения артериального давления тем ниже, чем выше значения массы тела при рождении; к 6 годам 15,2% имеют артериальную гипертензию, а еще 11,1% - маскированную гипертензию [1]. Центральное систолическое артериальное давление в раннем взрослом возрасте было связано с размерами глубоко недоношенного ребенка и увеличением прибавки в весе в период с 2,5 до 6 лет. Риск развития артериальной гипертензии возрастает в 2,45 (1,82-3,31) раза у новорожденных с экстремально низким сроком гестации [1].
4. Повышенный риск развития сердечной недостаточности у подростков и взрослых (в 4 раза при гестационном возрасте до 31 нед. и в 17 раз - если срок гестации менее 28 нед.). Это может быть объяснено снижением функционального резерва миокарда, так как недоношенные молодые люди имеют нарушенный систолический ответ левого желудочка на физиологический стресс средней и высокой интенсивности, несмотря на сохраненную фракцию выброса левого желудочка в покое [1].
5. Определенные закономерности отмечены различными авторами и в отношении ишемической болезни сердца. Риск ее возникновения среди родившихся недоношенными возрастает в 1,32-1,53 раза [12]. К этому следует добавить более частые (в 1,22,0 раза) нарушения липидного обмена. А стандартизованный показатель смертности достигает 102% у мужчин и 83% у женщин, родившихся с массой тела менее 2500 г, в то время как у родившихся с массой 4500 г и более - 66 и 49% соответственно [10].
Заключение
Наши и литературные данные свидетельствуют о том, что недоношенность в сочетании с низкой массой тела характеризуется формированием патологии ССС, частота которой обратно коррелирует с массой тела. Возникающие нарушения гемодинамики приводят к развитию сердечной недостаточности, ухудшению функции других органов и систем и участвуют в танатогенезе умерших младенцев.
Возникновение приспособительных реакций эмбриона или плода к патологической маточно-плацентарной среде создают условия для фетального программирования сердечно-сосудистых заболеваний во взрослом возрасте. В связи с этим дети с ОНМТ или ЭНМТ нуждаются не только в непосредственной консультации кардиолога, но и в систематическом диспансерном наблюдении и своевременной коррекции возникающих сердечно-сосудистых проблем. В настоящее время нет клинических руководств по наблюдению за недоношенными пациентами за пределами детского возраста, но наблюдения показывают, что информация о гестационном возрасте может быть полезной при оценке риска различных хронических заболеваний у подростков и молодых людей.
Литература
1. Актуальные проблемы перинатальной кардиологии / В.А. Таболин [и др.] // Педиатрия. 2000. № 5. С. 13-22.
2. Белозеров Ю.М. Кровообращение плода и новорожденного // Физиология и патология сердечно-сосудистой системы у детей первого года жизни / под ред. М.А. Школьниковой, Л.А. Кравцовой. М. : Медпрактика-М, 2002. С. 16.
3. Prevalence, treatment, and outcome of heart disease in liveborn children: a prospective analysis of 91,823 live-born children / M. Samanek [et al.] // Pediatric Cardiology. 1989. Vol. 10, No. 4. P 205-211.
4. Birth prevalence of congenital heart disease worldwide: a systematic review and meta-analysis / D. van der Linde [et al.] // Journal of the American College of Cardiology. 2011. Vol. 58, No. 21. P 2241-2247.
5. Birth prevalence of congenital heart disease in China, 19802019: a systematic review and meta-analysis of 617 studies / L. Zhao [et al.] // European Journal of Epidemiology. 2020. Vol. 35, No. 7. P 631-642.
6. Severe congenital heart defects: incidence, causes and time trends of preoperative mortality in Norway / G. Wik [et al.] // Archives of Disease in Childhood. 2020. Vol. 105, No. 8. P. 738-743.
7. Trends in prenatal diagnosis, pregnancy termination, and perinatal mortality of newborns with congenital heart disease in France, 19832000: a population-based evaluation / B. Khoshnood [et al.] // Pediatrics. 2005. Vol. 115, No. 1. P 95-101.
8. Bonnet D. Impacts of prenatal diagnosis of congenital heart diseases on outcomes // Translational Pediatrics. 2021. Vol. 10, No. 8. P 2241-2249.
9. Association between preterm birth and arrested cardiac growth in adolescents and young adults / K.N. Goss [et al.] // JAMA Cardiology 2020. Vol. 5, No. 8. P 910-919.
10. Кельмансон И.А. Отсроченный риск кардиоваскулярной патологии, ассоциированный с малой массой тела при рождении // Российский вестник перинатологии и педиатрии. 1999. № 2. С. 12-18.
11. Giussani D.A. Breath of life: heart disease link to developmental hypoxia // Circulation. 2021. Vol. 144, No. 17. P. 1429-1443.
12. Crump C. An overview of adult health outcomes after preterm birth // Early Human Development. 2020. Vol. 150. P. 105187.

