Оценка массы тела у детей грудного возраста, рожденных с задержкой внутриутробного развития легкой степени
СтатьиОпубликовано в журнале "Практика педиатра" №1 2022
В.В. Деревцов1, д-р мед. наук; Е.В. Неудахин2, заслуженный врач РФ, д-р мед. наук, профессор; Д.О. Иванов3, заслуженный врач РФ, д-р мед. наук, профессор, главный внештатный специалист-неонатолог Минздрава России; А.В. Деревцова4, студентка 3-го курса педиатрического факультета
1 МБУЗ «Детский центр диагностики и лечения им. Н.А. Семашко», г. Москва
2 ГБУЗ «Научно-практический центр специализированной медицинской помощи детям им. В.Ф. Войно-Ясенецкого» Департамента здравоохранения г. Москвы
3 ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
4 ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России
Резюме. Обследованы 166 детей, рожденных в срок. Из них 141 ребенок родился от матерей с отягощенным анамнезом. Они были разделены на группы: 1-я группа - 72 ребенка с задержкой внутриутробного развития легкой степени (подгруппа 1а - 57 детей с гипотрофическим типом; подгруппа 1б - 15 детей с гипопластическим типом), 2-я группа -69 детей без задержки внутриутробного развития. Контрольную (3-ю) группу составили 25 практически здоровых детей, рожденных практически здоровыми матерями. Все дети осматривались в динамике: в возрасте 2-3 сут (n = 166), 1 мес (n = 146), 3 мес (n = 138), 6 мес (n = 131), 12 мес (n = 119). Анализировались данные анамнеза, физикального осмотра, массы тела. Оценивалась масса тела в граммах. Медицинское вмешательство не проводилось. Использовались непараметрические методы статистического анализа. Обнаружено, что 1а и 1б подгруппы, а также 1,2 и 3-я группы по оцениваемому показателю статистически значимо различались. Выявление нарушений на ранних этапах развития патологического процесса способствует выделению групп диспансерного наблюдения и решению вопроса о проведении корригирующих мероприятий, в том числе с применением препарата Элькар®, у детей от матерей с осложненной беременностью.
Ключевые слова: дети, масса тела, задержка внутриутробного развития, гипопластический и гипотрофический типы, хронический стресс, энерготропная терапия, L-карнитин
Summary. One hundred and sixty-six children born on time were examined. Of these, 141 children were born to mothers with a medical history. They were divided into groups: group 1 - 72 children with mild intrauterine development delay (subgroup 1a - 57 children with hypotrophic type; subgroup 1b - 15 children with hypoplastic type), group 2 - 69 children without intrauterine development delay. The control (3rd) group consisted of 25 practically healthy children born to practically healthy mothers. All children were examined in dynamics: at the age of 2-3 days (n = 166), 1 month (n = 146), 3 months (n = 138), 6 months (n = 131), 12 months (n = 119). The data of anamnesis, physical examination, body weight were analyzed. The body weight in grams was estimated. No medical intervention was performed. Nonparametric methods of statistical analysis were used. It was found that the 1a and 1b subgroups, as well as the groups 1,2 and 3 were statistically significantly different according to the estimated indicator, the detection of violations at the early stages of the development of the pathological process contributes to the identification of groups of dispensary observation and the solution of the issue of corrective measures, including with the use of Elkar®, in children from mothers with complicated pregnancies.
Keywords: children, body weight, intrauterine growth retardation, hyperplastic and hypertrophic types, chronic stress, energotropic therapy, L-carnitine
Введение
Несмотря на известность проблемы и изученность последствий задержки внутриутробного развития (ЗВУР) [1-13], до настоящего времени практикующие врачи не уделяют должного внимания адекватной оценке физического развития у детей грудного возраста, что не позволяет своевременно предотвращать нарушение состояния здоровья индивида в последующие периоды жизни. У детей с ЗВУР имеется предрасположенность к задержке полового созревания, к нарушению гармоничности развития, формированию артериальной гипертензии, сахарного диабета, иммунодефицитных состояний, к изменению психологического здоровья, социальной адаптации и т. д. Однако подавляющее большинство таких детей выписываются из отделений физиологии новорожденных перинатальных центров как практически здоровые. Результаты анализа показали, что практикующие врачи обычно не проводят дифференциальную диагностику разных типов ЗВУР, не обращают внимания на индивидуальные закономерности роста и развития, формирование патологических состояний, нуждающихся в проведении ранних коррекционных мероприятий.
Цель исследования - оценка массы тела у детей грудного возраста, рожденных с ЗВУР разных типов легкой степени, в сравнении между собой, с детьми грудного возраста, рожденными без ЗВУР, а также с практически здоровыми детьми грудного возраста от практически здоровых матерей.
Материалы и методы
Проведено поперечное (одномоментное), выполненное через определенные промежутки времени исследование. Набор материала осуществлялся на базах отделений физиологии новорожденных и консультативно-диагностических перинатальных центров клиник Национального медицинского исследовательского центра им. В.А. Алмазова и Санкт-Петербургского государственного педиатрического медицинского университета.
ЗВУР изначально диагностировалась врачами-гинекологами, а в последующем этот диагноз подтверждали врачи-неонатологи, что отражено документально. Все новорожденные с диагностированной ЗВУР имели показатели массы тела ниже перцентиля P по сравнению с референтной массой тела для гестационного возраста. Все новорожденные, рожденные с ЗВУР гипотрофического типа легкой степени, имели массу тела в интервале перцентилей Р10-Р3 при нормальной или умеренно сниженной длине тела по отношению к сроку гестации. Все новорожденные, рожденные с ЗВУР гипопластического типа легкой степени, имели массу тела и длину тела ниже перцентиля Р3 по отношению к сроку гестации. При оценке данных использовались международные стандарты Intergrowth-21st.
Включение детей в исследование осуществлялось исключительно по добровольному желанию законных представителей. В исследование не включали детей, рожденных с ЗВУР, которая обусловлена наследственными и инфекционными факторами. Под нашим наблюдением находились дети, рожденные на 37-42-й неделях одноплодной беременности. Подавляющее большинство из них были выписаны на 3-5-е сутки жизни.
В исследование на 2-3-и сутки жизни было включено 350 детей. Из них не оценено по критериям включения - 80, выбыли из исследования из-за отказа родителей - 60, по иным причинам - 10. Оценены по критериям включения 200 детей, из них исключены из исследования - 23, отказались от участия - 11. Для анализа оказались доступными данные 166 детей. Из этих детей 141 ребенок родился от матерей с отягощенным соматическим и акушерско-гинекологическим анамнезом:
- 72 - с ЗВУР (1-я группа), из них 57 - с гипотрофическим типом (1а подгруппа), 15 - с гипопластическим типом (1б подгруппа);
- 69 детей - без ЗВУР (2-я группа).
Контрольную (3-ю) группу составили 25 практически здоровых детей, родившихся от практически здоровых матерей. Точками обследования наблюдаемых детей были: 2-3-и сутки, 1, 3, 6, 12-й месяцы. Смещения их не произошло. Выполнен сбор и анализ анамнестических данных, клинических, инструментальных и лабораторных показателей у детей. В динамике оценивалась медиана массы тела в граммах. Медицинское вмешательство не проводилось.
Методика измерения массы тела. Для измерения массы тела использовались электронные детские весы Momert 6470 (производитель Momert Co Ltd, Венгрия). Масса тела определялась у здоровых на момент обследования детей. Перед каждым использованием весов проверялось их ровное горизонтальное положение, проводилась регулировка. Измерения осуществляли примерно в одно и то же время, в присутствии родителей. Детей до 6 мес укладывали на весы в положение «на спине». Дети старше 6 мес находились на весах в сидячем положении. Детей раздевали и клали или высаживали по центру на предварительно застеленный пеленкой лоток обнуленных весов. Измерение выполняли в отделениях физиологии новорожденных - в палате, а в консультативно-диагностических отделениях -в специальном кабинете. Вблизи не было другой создающей помехи аппаратуры. Температура в помещении колебалась от 24 до 26°С. Грудных детей подготавливали к процедуре: с ними разговаривали, устанавливали контакт и доверительные отношения.
Все стадии исследования соответствовали российскому законодательству, международным этическим нормам и нормативным документам исследовательских организаций; они одобрены соответствующими комитетами Национального медицинского исследовательского центра им. В.А. Алмазова (выписка из протокола № 59 от 17.03.2014) и Санкт-Петербургского государственного педиатрического медицинского университета (выписка из протокола № 12/3 от 04.12.2017).
Масса тела в граммах у детей с задержкой внутриутробного развития легкой степени и без таковой (данные описательной статистики)
Статистический анализ. Размер выборки предварительно не рассчитывался. Использовали пакет компьютерных программ для статистического анализа StatSoft Statisticа v. 6.1. Подсчитывались следующие параметры: количество (n), медиана (Ме), квартили (Q1; Q3), минимальное (min) и максимальное (max) значения, размах, интерквартильный размах. В связи с тем, что проверка на нормальность распределения данных не проводилась, использовали методы непараметрического статистического анализа. Сопоставление количественных данных двух независимых выборок выполняли при помощи критерия Колмогорова - Смирнова. Коррекция результатов не проводилась. Статистически значимыми считали различия при р < 0,05. Ограничением исследования следует признать достаточно небольшой размер выборок.
Результаты
Данные о соматическом состоянии здоровья матерей и особенностях течения у них беременности и родов, а также некоторые данные о наблюдаемых детях были представлены нами ранее [14, 15]. Приведены показатели общей и первичной заболеваемости в выборках детей [16], а также динамики длины тела [17], частоты нарушений сердечно-сосудистой [18-20] и нейровегетативной [21, 22] систем, степени адаптации организма к условиям среды [23, 24].
Сравнение массы тела в граммах между выборками детей грудного возраста с применением критерия Колмогорова - Смирнова (см. таблицу) показало, что Ме массы тела в выборке детей 1а подгруппы:
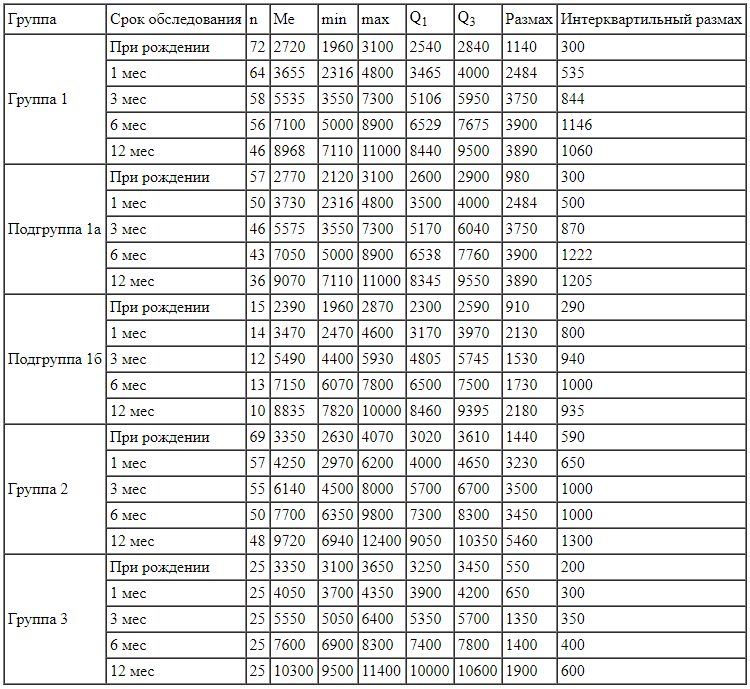 Примечание: n - число детей, Me - медиана, min - минимальное значение, max - максимальное значение, Q1 и Q3 - 1-й и 3-й квартили соответственно.
Примечание: n - число детей, Me - медиана, min - минимальное значение, max - максимальное значение, Q1 и Q3 - 1-й и 3-й квартили соответственно.Ме массы тела в выборке детей 1б подгруппы по сравнению с Ме массы тела детей 2-й и 3-й групп меньше (р < 0,05) при рождении на 960 и 960 г, в 1 мес - на 780 и 580 г, в 6 мес - на 550 и 450 г, в 12 мес -на 885 и 1465 г соответственно.
Ме массы тела в выборке детей 1-й группы по сравнению с Ме массы тела в выборке детей 2-й группы меньше (р < 0,05) при рождении на 630 г, в 6 мес -на 600 г и в 12 мес - на 752 г, а по сравнению с выборкой детей 3-й группы меньше (р < 0,05) в 6 мес на 500 г и в 12 мес - на 1332 г.
Оценка прибавки массы тела в выборках детей грудного возраста (см. рисунок), показала, что прибавка Ме массы тела в граммах у детей 1-й группы (в том числе 1а подгруппы) и 2-й группы в анализируемые периоды роста и развития существенно не отличалась, а в сравнении с детьми 3-й группы отмечены большие прибавки с рождения до 1 месяца и с 1-го по 3-й месяц и меньшие - с 3-го по 6-й месяц и с 6-го по 12-й месяц. Вместе с тем анализируемый показатель у детей 1б подгруппы имел особенности в сравнении с показателем детей 1а подгруппы, 1, 2 и 3-й групп. Так, он был больше в периоде роста и развития от рождения до 1 мес, от 1-го до 3-го месяца и меньше - от 6-го до 12-го месяца.
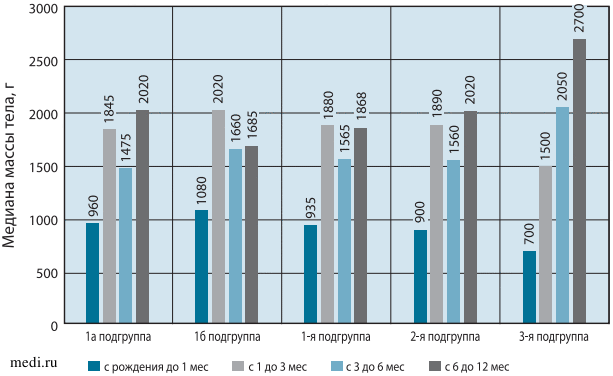 Оценка прибавки медианы массы тела у детей с задержкой внутриутробного развития легкой степени и без таковой
Оценка прибавки медианы массы тела у детей с задержкой внутриутробного развития легкой степени и без таковой
В литературе отмечено, что патогенетической основой ЗВУР, а следовательно, и патологических состояний, связанных с фетальным программированием, является хроническая стрессовая реакция [25]. У детей, рожденных с ЗВУР гипотрофического типа легкой степени, по сравнению с детьми, рожденными без ЗВУР, при рождении, в 1, 3, 6 и 12 мес, а также по сравнению с практически здоровыми детьми в 3, 6 и 12 мес регистрируются выраженные проявления хронического стресса. Особенно следует отметить, что у детей, рожденных с ЗВУР гипопластического типа легкой степени, по сравнению с детьми, рожденными с ЗВУР гипотрофического типа легкой степени, при рождении, в 1, 3, 6 и 12 мес и по сравнению с детьми 2-й и 3-й группы при рождении, в 1, 6 и 12 мес признаки хронического стресса более выражены.
Полученные в нашем исследовании данные, которые характеризуют особенности физического развития детей, рожденных с ЗВУР разных типов легкой степени, частично совпадают с данными других исследователей [2, 4, 11]. Так, установлено, что масса тела в выборке детей, рожденных с ЗВУР, в большинстве случаев достигает возрастных нормативов в 3 мес. Ме массы тела в 3 мес в выборках детей 1-й и 3-й групп, а также 1-й и 2-й групп не имела статистически значимых различий. Вместе с тем нами обнаружены статистически значимые различия при сравнении между собой 1а и 1б подгрупп, а также этих выборок со 2-й и 3-й группами, что обусловлено более высокой частотой развития анемий при гипопластическом типе [16, 23]. По нашим данным, у детей с гипопластическим типом ЗВУР чаще отмечались структурные изменения: крипторхизм, патология почек, функционирующее межпредсердное сообщение, дефект межжелудочковой перегородки в мышечной части, открытый артериальный проток [15].
У детей 1а подгруппы по сравнению с детьми 1б подгруппы в 6 мес меньшая Ме массы тела объясняется тем, что они в период с 3 до 6 мес чаще переносили острые респираторные инфекции и дерматит [16, 23]. У детей с гипотрофическим типом ЗВУР чаще диагностировались метаболические нарушения: гипогликемия, желтуха, нарушения обменных процессов в миокарде и др. [15].
Выявленные при оценке массы тела различия подчеркивают, что особенности соматического и акушерско-гинекологического анамнеза матери, а также наличие ЗВУР разных типов легкой степени у новорожденного модифицированы течением хронического стресса. Отсутствие своевременного оказания медицинской помощи детям в такой ситуации приводит к перестройке метаболизма в организме индивида и к нарушению формирования адаптации. Однако цена такой перестройки для последующих этапов роста и развития организма остается неизвестной.
Разделяя мнение ряда ученых [26, 27], мы подчеркиваем, что дети, рожденные с ЗВУР, нуждаются в дифференциальной диагностике транзиторной потери первоначальной массы тела (по гипопластическому или по гипотрофическому типу), коррекции недостаточности питания, более поздней выписке из перинатального центра, в охранительном режиме, оптимальном вскармливании, антиоксидантной метаболической терапии, регулировании витаминно-минеральной обеспеченности, а также в назначении препаратов, способствующих улучшению реологических свойств крови, в проведении заместительной иммунотерапии (по показаниям).
Основополагающим звеном патогенеза патологических последствий задержки роста и развития плода у детей является нарушение энергетического обмена. У детей, рожденных с ЗВУР, отмечается выраженное нарушение аккумуляции энергии в АТФ [28]. В связи с этим показано назначение энерготропных препаратов, в первую очередь препаратов L-карнитина [25, 27, 29]. Именно такой подход к ведению и лечению детей, перенесших ЗВУР, необходим для снижения частоты и тяжести ее последствий.
На российском рынке в настоящее время наиболее широко используется лекарственный препарат L-карнитина отечественной разработки - Элькар® (МНН: левокарнитин, ООО «ПИК-ФАРМА»), представляющий собой водный раствор левокарнитина для приема внутрь 300 мг/мл. У доношенных новорожденных с ЗВУР его назначают через 3 нед после рождения в дозе 50-100 мг/кг в сутки 3 раза в день на 1 месяц [25, 29-34]. Эффективность применения препаратов L-карнитина зависит от его содержания в организме, биологических ритмов и особенностей метаболизма [25, 33, 37].
Карнитин принимает участие в обеспечении различных жизненных функций развивающегося организма с момента зачатия [35, 36]. При оплодотворении карнитин из сперматозоида проникает в яйцеклетку, где активирует генетические механизмы образования собственного карнитина. В связи с этим начинают функционировать ферментные системы зародыша, происходит образование новых клеток, обладающих способностью вырабатывать свой карнитин. Данные процессы протекают в течение всей жизни. Наиболее активно карнитин синтезируется в структурах с высокой энергетической потребностью. Высокий его уровень зафиксирован в гипоталамусе, мозжечке, коре, спинном мозге [36]. L-карнитин оказывает антиоксидантное, нейрозащитное действие, влияет на генетическую экспрессию. Особенно активны эти процессы в перинатальном периоде, в периоде эмбриогенеза, формирования мозга, миелиновой оболочки [35, 36]. В начальной стадии развития нервной системы карнитин является единственным нейротрансмиттером. Он имеет большое структурное сходство с ацетилхолином и, возможно, благодаря этому участвует в формировании нейротрофических холинергических структур, нервно-мышечной рецепции. Не исключено, что генетически запрограммированная смерть клеток обусловлена прекращением внутриклеточного синтеза карнитина. При его недостатке нарушается синтез фосфолипидов клеточных мембран и других органелл клетки, в результате чего усиливаются процессы апоптоза, возникает гипоплазия тканей [35].
Основная функция L-карнитина - биоэнергетическая (энерготропная). Он обеспечивает транспорт длинноцепочечных жирных кислот из цитоплазмы в митохондрии, где в цикле Кребса осуществляется их В-окисление с образованием ацетил-КоА. Последний необходим для образования АТФ, холина и его эфиров, из которых синтезируется ацетилхолин [35-38]. Ацетилхолин, образующийся в синапсах, является медиатором как симпатической, так и парасимпатической нервной системы. Он повышает чувствительность тканей к инсулину, принимает участие в метаболизме фосфолипидов, замедляет распад белковых и углеводных молекул, что свидетельствует о его трофотропной (анаболической) активности. Следовательно, L-карнитин принимает участие в обеспечении альтернативного взаимодействия отделов вегетативной нервной системы и метаболических процессов в организме. Благодаря перечисленным эффектам L-карнитин обладает как энерготропной, так и трофотропной активностью [30, 39-43].
Многочисленные исследования свидетельствуют о широком диапазоне метаболических и органо-протективных эффектов L-карнитина. Доказано, что L-карнитин может оказывать антиоксидантное, иммуномодулирующее, противовоспалительное, антиагрегантное, вазодилатирующее действие. Вследствие этого он обладает нейропротективным, кардиопротективным, вегетотропным и другими жизненно значимыми эффектами [37, 40-42, 44-48], в коррекции которых нуждаются дети, рожденные с ЗВУР.
Следовательно, карнитин является метаболитом, сопровождающим всю жизнь человека от зачатия до старости. Вместе с тем работ, показывающих дифференцированный подход к применению препаратов L-карнитина в зависимости от типа ЗВУР, в анализируемой доступной литературе нам не встретилось.
Таким образом, по нашим данным, у детей, рожденных с гипотрофическим типом ЗВУР, на первом году жизни чаще отмечались острые респираторные инфекции, указывающие на неполноценность иммунных механизмов, преобладали метаболические расстройства. У детей, рожденных с гипопластическим типом ЗВУР, чаще определялась анемия, в большинстве случаев имеющая железодефицитный характер, преобладали структурные изменения [16, 23, 25]. Все это ассоциировано с энергодефицитным состоянием, которое нарушает функционирование электролитно-транспортной цепи митохондрий, а также вызывает нарушение кислородтранспортной функции крови. В результате развивается гипоксия в тканях, замедляется линейный рост и прибавление массы тела. Назначение L-карнитина способствует устранению отмеченных нарушений.
Заключение
Обнаруженные статистически значимые различия со стороны массы тела и ее динамики обосновывают персонифицированный подход к ведению детей, рожденных с ЗВУР разных типов легкой степени, на первом году жизни. ЗВУР гипопластического и гипотрофического типов даже легкой степени определяет физическое и физиологическое развитие ребенка, что необходимо учитывать при осуществлении диспансерного наблюдения. Своевременное выявление нарушений на ранних этапах развития патологического процесса способствует выделению групп диспансерного наблюдения и решению вопроса о целесообразности проведения корригирующих мероприятий, в том числе с применением препарата Элькар®.
[Финансирование и конфликт интересов: авторы статьи подтвердили отсутствие финансовой или какой-либо другой поддержки / конфликта интересов, о которых необходимо сообщать.
Вклад авторов: Иванов Д.О. - организация и сопровождение выполнения проекта, Неудахин Е.В. -научная корректировка материала, Деревцов В.В., Деревцова А.В. - выполнение проекта.]
Литература
1. Башмакова Н.В., Гончарова С.В. Особенности полового и физического развития девочек-подростков, перенесших внутриутробную гипотрофию // Уральский медицинский журнал. 2011. № 4. С. 110-117.
2. Влияние инсулиноподобного фактора роста-1 на внутриутробный и постнатальный рост у детей, родившихся с задержкой внутриутробного развития / К.Ф. Исламова, Ю.В. Петренко, Д.О. Иванов, С.Н. Филиппова // Вестник современной клинической медицины. 2013. Т. 6, № 6. С. 36-39.
3. Задержка развития плода при табакокурении матерей / Л.Г. Киселева [и др.] // Неонатология: новости, мнения, обучение. 2017. № 3. С. 89-96.
4. Ожегов А.М., Петрова И.Н., Трубачев Е.А. Особенности адаптации в грудном возрасте детей, родившихся с задержкой внутриутробного развития // Лечение и профилактика. 2013. Т. 1, № 5. С. 19-25.
5. Ожегов А.М., Трубачев Е.А., Петрова И.Н. Мозговая и сердечная гемодинамика у детей первого года жизни, родившихся с задержкой внутриутробного развития // Детская больница. 2012. Т. 48, № 2. С. 34 - 36.
6. Петрова И.Н. Особенности неонатального периода у доношенных детей с задержкой внутриутробного развития // Врач-аспирант. 2013. Т. 56, № 1.1. С. 218-226.
7. Особенности тиреоидной регуляции обмена коллагена у грудных детей, родившихся с задержкой внутриутробного развития / И.Н. Петрова, А.М. Ожегов, Д.Н. Королева, Е.В. Неудахин // Детская больница. 2013. Т. 54, № 4. С. 9-12.
8. Плюснина Н.Н., Захарова С.Ю., Павличенко М.В. Анализ состояния здоровья детей раннего возраста, рожденных с задержкой внутриутробного роста плода // Вестник Уральской медицинской академической науки. 2011. № 4. С. 59-62.
9. Смирнова М.В. Здоровье детей подросткового возраста, рожденных с задержкой внутриутробного развития // Врач-аспирант. 2013. Т. 56, № 1. С. 92-97.
10. Шабалов Н.П. Неонатология. М.: ГЭОТАР-Медиа, 2016.
11. Щуров В.А., Сафонова А.В. Влияние различных форм внутриутробной задержки развития на динамику роста детей // Успехи современного естествознания. 2013. № 2. С. 17-21.
12. Bjarnegard N., Morsing E., Cinthio M. Cardiovascular function in adulthood following intrauterine growth restriction with abnormal fetal blood flow // Ultrasound in obstetrics a gynecology. 2013. Vol. 41, No. 2. P. 177-184.
13. Ivanov D.O., Derevtsov V.V Modern technologies of improving output outcome of delay of intra-growth and development in babies // International Journal of Pregnancy & Child Birth. 2017. Vol. 3, No. 3. Р 67.
14. Деревцов В.В., Иванов Д.О. Состояние здоровья детей с задержкой роста плода в раннем неонатальном периоде // Детская медицина Северо-Запада. 2014. Т. 5, № 4. С. 27-39.
15. Деревцов В.В. Некоторые аспекты состояния здоровья детей, рожденных с разными типами внутриутробной задержки роста, в раннем неонатальном периоде // Казанский медицинский журнал. 2017. Т. 98, № 1. С. 44-52.
16. Козлова Л.В., Иванов Д.О., Деревцов В.В. Некоторые аспекты состояния здоровья детей в возрасте одного года при задержке роста плода // Вестник Смоленской государственной медицинской академии. 2016. Т. 15, № 5. С. 23-32.
17. Иванов Д.О., Деревцов В.В. Оценка длины тела у детей грудного возраста, рожденных с задержкой внутриутробного развития разных типов легкой степени тяжести // Педиатр. 2019. Т. 10, № 6. С. 13-18.
18. Особенности электрокардиограмм у детей грудного возраста, рожденных с задержкой внутриутробного роста и развития: одномоментное исследование / В.В. Деревцов [и др.] // Педиатрия. Conilium Medicum. 2021. № 3. С. 231-238.
19. Особенности состояния сердечно-сосудистой системы у младенцев, рожденных с разными типами внутриутробной задержки роста / Л.В. Козлова, Д.О. Иванов, В.В. Деревцов, Н.Ф. Прийма // Российский вестник перинатологии и педиатрии. 2017. Т. 62, № 2. С. 30-38.
20. Иванов Д.О., Деревцов В.В. Особенности функционального состояния сердца у детей, рожденных с разными типами легкой степени замедления внутриутробного роста, на первом году жизни // Педиатрия им. Г.Н. Сперанского. 2020. Т. 99, № 1. С. 70-75.
21. Иванов Д.О., Козлова Л.В., Деревцов В.В. Вегетативный статус и адаптация у младенцев, имевших разные типы внутриутробной задержки роста // Педиатр. 2017. Т. 8, № 2. С. 15-23.
22. Иванов Д.О., Деревцов В.В. Оценка состояния вегетативной нервной системы у младенцев, рожденных с разными типами легкой степени тяжести замедления внутриутробного роста // Вестник Смоленской государственной медицинской академии. 2019. Т. 18, № 4. С. 60-66.
23. Иванов Д.О., Деревцов В.В., Серова Н.П. Оценка адаптации организма младенцев, рожденных с разными типами легкой степени тяжести замедления внутриутробного роста // Педиатр. 2019. Т. 10, № 3. С. 5-16.
24. Иванов Д.О., Деревцов В.В. Оценка состояния компенсаторных ресурсов организма у младенцев, рожденных с легкой степенью тяжести замедления внутриутробного роста // Вестник Смоленской государственной медицинской академии. 2019. Т. 18, № 3. С. 217-224.
25. Неудахин Е.В. Роль левокарнитина в реабилитации детей с перинатальной патологией. Педиатрия. Consilium Medicum. 2019. № 3. C. 115-121.
26. Андреева А.А., Якушенко Н.С., Опарина Т.И. Механизмы нарушений функций сердечно-сосудистой системы у новорожденных детей с задержкой внутриутробного развития и отдаленные последствия // Журнал акушерства и женских болезней. 2011. Т. 60, № 3. С. 32-36.
27. Думова С.В., Чугунова О.Л. Коррекция внутриклеточного энергообмена у недоношенных новорожденных детей с задержкой внутриутробного развития // Педиатрия. Журнал имени Г.Н. Сперанского. 2016. Т. 95, № 1. С. 17-23.
28. Энергодефицитное состояние - основа гипотрофии и коморбидной патологии у детей / Ф.Н. Гильмиярова [и др.] // Медицинский альманах. 2016. Т. 42, № 2. С. 60-62.
29. Неудахин Е.В., Деревцов В.В. Патогенетические особенности атерогенеза при задержке внутриутробного развития плода // Практика педиатра. 2021. № 3. С. 43-50.
30. Брин И.Л., Дунайкин М.Л., Лисицина С.В. Проблема дозирования препаратов карнитина в детском возрасте // Российский вестник перинатологии и педиатрии. 2014. № 4. С. 16-22.
31. Неудахин Е.В. Целесообразность использования препаратов карнитина при лечении хронических расстройств питания у детей // Практика педиатра. 2015. № 2. С. 48-52.
32. Иванова И.И., Гнусаев С.Ф., Ильина А.А. Клинические проявления нарушений клеточного энергообмена при соматических заболеваниях у детей // Российский вестник перинатологии и педиатрии. 2018. Т. 63, № 2. С. 27-33.
33. Чугунова О.Л., Думова С.В. Возможность терапевтической коррекции нарушений клеточного энергообмена и дефицита L-карнитина у новорожденных детей различного гестационного возраста // Практика педиатра. 2015. Сентябрь-октябрь. С. 20-25.
34. Неудахин Е.В. Особенности метаболизма L-карнитина у недоношенных и доношенных новорожденных детей. Опыт применения элькара // Практика педиатра. 2015. Ноябрь-декабрь. С. 58-63.
35. Кузин В.М. Карнитин хлорид (25 лет в клинической практике) // Российский медицинский журнал. 2003. Т. 11, № 10. С. 5-9.
36. Шалькевич Л.В., Малаш А.В. Метаболическая терапия заболеваний нервной системы у детей лекарственными средствами на основе карнитина // Медицинские новости. 2016. № 4. С. 28-32.
37. Брин И.Л., Неудахин Е.В., Дунайкин М.Л. Карнитин в педиатрии: исследования и клиническая практика. М.: Мед-практика-М, 2015.
38. Hoppel Ch. The role of carnitine in normal and altered fatty acid metabolism // American Journal of Kidney Diseases. 2003. Vol. 41, № 4. P 4-12.
39. Неудахин Е.В. Основные представления о синдроме вегетативной дистонии у детей и принципах лечения // Практика педиатра. 2018. № 2. С. 5-10.
40. Сухоруков В.С. Митохондриальная патология и проблемы патогенеза психических нарушений // Журнал неврологии и психиатрии имени С.С. Корсакова. 2008. № 6. С. 83-90.
41. Сухоруков В.С., Ключников С.О. Энерготропная терапия в современной педиатрии // Вестник педиатрической фармакологии и нутрициологии. 2006. № 6. С. 4-9.
42. Seim H., Eichler K., Kleber H. L-carnitine and its precursor, gamma byterobetaine // Nutraceuticals in Health and Disease Prevention. New York: Marcel Dekker Inc., 2001.
43. Binienda Z.K. Neuroprotective effects of L-carnitine in induced mitochondrial dysfunction // Annals of the New York Academy of Sciences. 2003. No. 993. P. 289-295.
44. L-carnitine supplementation attenuates intermittent hypoxia induced oxidative stress and delays muscle fatigue in rats /A.Dutta [et al.] // Experimental Physiology. 2008. No. 93. P 1139-1146.
45. Scott I. The role of mitochondria in the mammalian antiviral system // Mitochondrion. 2010. No. 10. P. 316-320.
46. The antioxidant properties of carnitine in vitro / K. Solarska, A. Lew-inska, A. Karowicz-Bitinska, Gr. Bartosz // Cellular & Molecular Biology Letters. 2010. Vol. 15, No. 1. P 90-97.
47. Ferreira G.C., Mckenna M.C. L-carnitine and acetyl-L-carnitine roles and neuroprotection in developing brain // Neurochemical Research. 2017. Vol. 42, No. 6. P. 1661-1675.
48. L-carnitine treatment of insulin resistance: a systematic review and meta-analysis / Y. Xu [et al.] // Advances in Clinical and Experimental Medicine. 2017. Vol. 26, No. 2. P. 333-338.

