Современная стратегия и тактика ведения детей с младенческими гемангиомами
СтатьиОпубликовано в журнале:
«Практика педиатра» № 4, 2020
Н.П. Котлукова1,2, д-р мед. наук, профессор, Н.К. Константинова1,2, И.И. Трунина1,2, д-р мед. наук, профессор, Н.Д. Тележникова2, Т.Р. Лаврова2, канд. мед. наук, А.Н. Гришкин2, Е.В. Карелина2
1 ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
2 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Ключевые слова: инфантильная гемангиома, пропранолол, лечение, β-блокаторы, сердечно-сосудистая система, синдром отмены
Keywords: infantile hemangioma, propranolol, treatment, β-blockers, cardiovascular system, rebound syndrome
Резюме. Статья посвящена актуальной проблеме – лечению младенческих гемангиом. Опыт применения пропранолола у 554 пациентов свидетельствует о его эффективности и безопасности. Авторским коллективом разработан протокол ведения пациентов с инфантильными гемангиомами различной локализации на всех этапах лечения. Особое внимание уделено кардиологическому аспекту наблюдения с применением современных методов инструментальной диагностики. Благодаря строгому следованию протоколу с использованием ультразвукового контроля в большинстве случаев удалось добиться полного излечения данной патологии, минимизировать нежелательные эффекты и избежать рецидивов (синдрома отмены). Эффективность разработанного протокола диагностики и лечения подтверждается клинической картиной и результатами инструментальных исследований.
Summary. The article is devoted to the actual problem of modern treatment of infant hemangiomas. The accumulated 10-year experience of using propranolol to 512 patients has shown its effectiveness and safety. The team of authors developed a protocol for managing patients with infantile hemangiomas of various localization at all stages of treatment. Special attention was paid to the cardiological aspect of patient monitoring using modern methods of instrumental diagnostics. Due to the clear application of the created protocol with the use of ultrasound control, in most cases, it was possible to achieve complete cure of this pathology, minimize the occurrence of undesirable effects and avoid the formation of relapses (rebound syndrome). The effectiveness of the developed algorithm of diagnosis and treatment is confirmed by both clinical results and the results of instrumental examinations.
Младенческие (инфантильные) гемангиомы (ИГ) – это распространенные доброкачественные сосудистые новообразования младенческого и раннего детского возраста, обладающие уникальными клиническими и гистопатологическими характеристиками. ИГ входят в большую группу сосудистых аномалий, современная классификация которых приведена в табл. 1. Данная классификация была принята на 20-й конференции Международного общества изучения сосудистых аномалий (International Society for the Study of Vascular Anomalies) в Мельбурне в апреле 2014 г. и пересмотрена в мае 2018 г. [1].
Таблица 1. Классификация сосудистых аномалий, предложенная Международным обществом изучения сосудистых аномалий (International Society for the Study of Vascular Anomalies) [1]
| Сосудистые опухоли | Сосудистые мальформации |
| Доброкачественные
• Инфантильная гемангиома • Врожденные гемангиомы (быстро инволютирующая, неинволютирующая, частично инволютирующая) • Веретеноклеточная гемангиома • Эпителиоидная гранулема • Пиогенная гранулема • Другие | Простые
• Капиллярная мальформация • Венозная мальформация • Лимфатическая мальформация • Артериовенозная мальформация • Артериовенозная фистула |
| Пограничные
• Капошиподобная гемангиоэндотелиома • Саркома Капоши • Опухоль Дабска • Другие | Комбинированные (больше двух)
• Капиллярно-венозная мальформация • Капиллярно-лимфатическая мальформация • Капиллярно-артериовенозная мальформация • Лимфатико-венозная мальформация • Капиллярно-лимфатико-венозная мальформация • Капиллярно-лимфатико-артериовенозная мальформация • Капиллярно-венозно-артериовенозная мальформация • Капиллярно-лимфатико-венозно-артериовенозная мальформация |
| Злокачественные
• Ангиосаркома • Эпителиодная гемангиоэндотелиома • Другие | Ассоциированные с другими аномалиями (синдромы)
• Клиппеля-Треноне • Штурге-Вебера • Маффуччи • Сервелла-Мартореля • Протея • Другие |
Актуальность проблемы ИГ очевидна в связи с высокой распространенностью, ранним началом заболевания (с периода новорожденности), частым развитием осложнений в виде изъязвлений, нагноений, кровотечений, а также возможным появлением функциональных и эстетических нарушений: подскладковые гемангиомы гортани способны стать причиной дыхательной недостаточности, гемангиомы печени – вызвать сердечную недостаточность и легочную гипертензию, гемангиомы периорбитальной области – амблиопию. Остаточные явления (рубцы, атрофия и фиброзно-жировые изменения) обусловливают усиление психологического стресса как у детей, так и у родителей [2-6]. Распространенность данной патологии колеблется от 3 до 10% среди доношенных детей и достигает 30% среди недоношенных. У девочек ИГ встречаются в 3 раза чаще. Наиболее часто ИГ расположены в челюстно-лицевой области (до 60%) [7].
В своем развитии ИГ проходит следующие стадии:
- начальных проявлений,
- пролиферации (активного роста),
- начала инволюции (остановки роста, или стабилизации),
- выраженной инволюции,
- резидуальных проявлений.
Особенности ИГ – развитие в течение первых недель и месяцев жизни, быстрый рост с последующей постепенной медленной инволюцией, а также выявляемая при иммуногистохимическом исследовании продукция белка – транспортера глюкозы эритроцитарного типа (GLUT-1). Наиболее бурный рост наблюдается в течение первых 2 мес жизни ребенка, что является определяющим фактором при определении срока начала терапии. Завершается рост ИГ чаще всего к 5 мес жизни, после чего начинается процесс инволюции, который может продолжаться несколько лет.
Патогенез ИГ заключается в реактивном «опухолеподобном» росте тканей, в основе которого лежит пролиферация клеток эндотелия капилляров с дальнейшей инволюцией. Такие характеристики ИГ позволили В.В. Рогинскому и соавт. предложить термин «сосудистая гиперплазия», или «гиперплазия кровеносных сосудов» взамен термина «гемангиома». По мнению авторов, важно заменить термин «гемангиома» при обозначении данной патологии, поскольку представление о ней как об опухоли часто приводит к неадекватно агрессивному лечению, оправданному при опухолях, но неоправданному при обратимом реактивном процессе [8].
Этиология данных сосудистых образований не известна, но установлено, что играет роль наследственная предрасположенность, а также что триггером нередко становится гипоксия. Анализ течения беременности и родов позволил выявить следующие факторы риска: плацентарная недостаточность (предлежание плаценты, отслойка плаценты, плацентит), угроза выкидыша и медикаментозное сохранение беременности, многоплодная беременность (в том числе после экстракорпорального оплодотворения), обвитие пуповины, преэклампсия, внутриполостные инвазивные диагностические вмешательства (амниоцентез, биопсия трофобласта), анемия во время беременности, возраст матери >35 лет. Вероятно, гипоксия плода в результате воздействия вышеперечисленных факторов является пусковым моментом для роста капиллярной сети как компенсаторной реакции, направленной на улучшение питания тканей [3]. Основными регуляторами ангиогенеза являются VEGF (васкулоэндотелиальный фактор) и FRF (фактор роста фибробластов), уровень которых повышается в фазе пролиферации и снижается в фазе стабилизации и инволюции.
В настоящее время выделяют различные формы и типы ИГ (табл. 2) [1].
Таблица 2. Формы и типы младенческих гемангиом
| Формы | Типы |
| Очаговая | Поверхностная |
| Множественная | Глубокая |
| Сегментарная | Смешанная (поверхностная + глубокая) |
| Пограничная | Ретикулярная (абортивная) с минимальным ростом и др. |
Клиническая картина ИГ определяется стадией поражения. Стадия первичных проявлений характеризуется появлением участка покраснения кожи или слизистой оболочки. Постепенно участок увеличивается в размерах и приобретает насыщенную ярко-красную или багрово-синюю окраску, что характеризует стадию пролиферации. ИГ становится плотной и горячей при пальпации, повышается ее местная температура. В стадии стабилизации наблюдается остановка роста и побледнение очага сосудистого поражения, которое происходит постепенно, как правило от центра к периферии. В стадии выраженной инволюции очаг гиперплазии уменьшается в размерах, приобретает еще более светлый оттенок. Продолжительность стадий зависит от времени образования сосудистого поражения, начальной площади поражения, объема вовлеченных в процесс тканей, проводимой терапии. Конечным этапом раз вития является стадия резидуальных проявлений – телеангиоэктазий на коже или объемных фиброзно-жировых комплексов в толще тканей. Следует от метить, что самопроизвольную инволюцию претерпевают 70-90% сосудистых поражений, лишь 10% требуют терапии. К факторам, определяющим необходимость лечения ИГ, относятся локализация, распространенность, глубина, множественность сосудистых образований, наличие ассоциированных аномалий, таких как PHACE(S)-синдром (posterior fossa abnormality, hemangioma, arterial anomaly, cardiac defects, eye abnormality, sterna defect) и lumbar-синдром, а также осложнения, вызывающие функциональные и косметические дефекты.
В связи с разнообразием сосудистых патологий важна своевременная и правильная диагностика ИГ. В первый раз ребенок может попасть в поле зре ния педиатра, хирурга, кардиолога, онколога. Диагностика включает клинический осмотр ребенка со сбором подробного анамнеза течения беременности и оценкой стадии развития образования. Для уточнения объема и глубины поражения, определения его гемодинамических особенностей, топографии, а также с целью дифференциальной диагностики используются ультразвуковые методы. Детальная оценка топографии в случае необходимости хирургического вмешательства производится при помощи магнитно-резонансной или компьютерной томографии с контрастированием. Морфологические исследования (гистологическое, иммуногистохимическое) проводятся с целью оценки пролиферативной активности клеток эндотелия и определения уровня специфических белков-маркеров.
Для лечения ИГ традиционно применялись консервативные и инвазивные методы лечения. Выбор метода зависит от возраста пациента, размера и локализации патологического очага, стадии его развития. Из лекарственных средств использовались глюкокортикостероиды, винкристин, интерферон, а из инвазивных методов – криодеструкция, лазерная хирургия, рентгенотерапия, склерозирование и эмболизация питающих сосудов, хирургическое удаление. В настоящее время ряд применявшихся ранее методов нельзя считать адекватными. Использование лазера наиболее оправданно при небольших очагах гиперплазии кровеносных сосудов в стадии активного роста и при коррекции резидуальных проявлений. Хирургический метод лечения применяется в стадии инволюции, когда имеются остаточные деформации кожи, атрофические и гипертрофические рубцы, участки растянувшейся, потерявшей эластичность кожи, а также остаточная фиброзно-жировая ткань в избыточном объеме, что вызывает значительные эстетические и функциональные нарушения. Преимущество хирургического лечения именно на стадии инволюции обусловлено более низким риском кровотечения и потенциально меньшим размером очага в связи с естественным течением процесса [9].
После случайного открытия влияния пропранолола на ИГ в 2008 г. в Европе медикаментозная терапия пропранололом стала самым распространенным консервативным методом лечения ИГ во всем мире, эффективность которого доказана [10, 11].
Пропранолол хорошо известен кардиологам. Он с успехом применяется для лечения тахиаритмий, артериальной гипертензии, тиреотоксикозов, кардиомиопатий, сердечной недостаточности, врожденных пороков сердца с подклапанным стенозом легочной артерии. Терапевтический эффект препарата заключается в снижении артериального давления, умень шении частоты сердечных сокращений, купировании тахикардии. При тетраде Фалло пропранолол применяется для купирования и профилактики одышечно-цианотических приступов. В то же время препарат оказывает отрицательный инотропный эффект, снижая сократительную функцию миокарда и потребность миокарда в кислороде. Пропранолол влияет на показатели гликемии. Его метаболизм происходит в печени. Таким образом, используя пропранолол для лечения, необходимо учитывать возможность появления нежелательных эффектов. Доза препарата для лечения вышеуказанных состояний колеблется от 1 до 8 мг/кг/с.
Пропранолол относится к неселективным β-блокаторам, он конкурентно блокирует как β-1-адренорецепторы, находящиеся в сердце, так и β-2-адренорецепторы, которые преимущественно локализуются в бронхах и в периферических сосудах. Случайно обнаруженный положительный эффект пропранолола при лечении ИГ, во-первых, основан на способности препарата осуществлять периферическую вазоконстрикцию, в том числе и в сосудах гемангиом, благодаря частичному подавлению образования и высвобождения оксида азота (NO). Во-вторых, пропранолол ингибирует процессы ангиогенеза, снижая экспрессию VEGF и FGF, участвующих в процессах ангиогенеза. В процессе ангиогенеза также принимают участие матриксные металлопротеиназы (ММР-2 и ММР-9), уровень которых повышается в фазе пролиферации ИГ. Их деятельность регулируется β-адренорецепторами. Пропранолол ингибирует деятельность ММР-2 и ММР-9, снижая тем самым активность процессов ангиогенеза. В-третьих, установлено, что пропранолол запускает процессы апоптоза эндотелиальных клеток [12, 13].
В результате вазоконстрикции уменьшается скорость кровотока в гемангиоме, сосудистое образование меняет цвет на более бледный, изменяется его напряженность и снижается местная температура. Данные изменения наблюдаются уже в 1-2-е сутки приема препарата. Это соответствует ранней фазе обратного развития сосудистой гиперплазии. Затем рост сосудистого образования прекращается и начинается медленный регресс с частым формированием остаточных фиброзно-жировых изменений.
До недавнего времени терапия ИГ пропранололом проводилась с отступлениями от инструкции по применению препарата, в связи с чем она оказывалась возможной только после получения разрешения этического комитета медицинского учреждения и информированного согласия родителей [14].
В настоящее время пропранолол официально зарегистрирован для лечения пролиферирующих ИГ, требующих системной терапии. Это новый стандарт лечения, в том числе в России. Выпускается препарат «Гемангиол» – специальная пероральная форма про пранолола для детей в виде сиропа. Один миллилитр раствора содержит 3,75 мг пропранолола. Рекомендуемая доза 2-3 мг/кг/с. В многоцентровых рандомизированных плацебо-контролируемых исследованиях «Гемангиола» выявлена положительная динамика после 5 нед лечения у 88% пациентов, а к 24-й неделе терапевтическая эффективность была доказана у 60% больных [15]. После получения убедительных доказательств эффективности и безопасности препарат был включен в европейские и американские рекомендации по лечению ИГ, став первым и единственным на сегодняшний день препаратом, одобренным для лечения данной патологии [16, 17].
Применение других β-блокаторов, в частности атенолола и надолола, которые также назначаются как в России, так и за рубежом, относятся к терапии off-label [16]. Кроме того, следует отметить, что атенолол обладает большей кардиоселективностью, чем пропранолол, следовательно, имеет большее влияние на сердечно-сосудистую систему.
С 2010 г. нами накоплен большой опыт успешно го применения пропранолола в терапии ИГ. Прошли лечение 554 ребенка раннего возраста с ИГ различной локализации, включая пациентов с ИГ печени, подскладковыми ИГ гортани и детей в наиболее тяжелом состоянии – с РНАСЕ(S)-синдромом. Возраст пациентов к началу терапии варьировал от 1 мес до 4,5 года [18-21]. С 2019 г. по настоящее время 42 ребенка прошли лечение препаратом «Гемангиол».
В сотрудничестве с кафедрой госпитальной педиатрии им. В.А. Таболина Российского национального исследовательского медицинского университета им. Н.И. Пирогова в кардиологическом отделении Детской городской клинической больницы (ДГКБ) им. З.А. Башляевой осуществлено обследование и лечение этих детей согласно разработанному протоколу [22].
Протокол обследования и ведения пациентов с ИГ состоит из 4 этапов.
На I этапе выявляются показания к системно му лечению младенческих гемангиом пропранололом, проводится базовое обследование, включающее обследование сердечно-сосудистой системы, и при отсутствии противопоказаний назначается терапия пропранололом с постепенным титрованием дозы препарата. Параллельно контролируется наличие или отсутствие нежелательных эффектов на фоне терапии. Одно из важнейших исследований на данном этапе – ультразвуковое исследование (УЗИ). В ходе него определяется толщина сосудистого образования и количество сосудов; в доплеровском режиме оценивается линейная скорость кровотока (ЛСК) и индекс резистентности в питающих и интрапаренхиматозных сосудах.
II этап лечения осуществляется в амбулаторных условиях под наблюдением педиатра и детского кардиолога. Он заключается в правильном и регулярном приеме препарата, коррекции его дозы на фоне изменяющейся массы тела ребенка, проведении регулярных обследований и фотодокументировании.
III этап – динамическое стационарное обследование, которое осуществляется каждые 3 мес в течение всего периода лечения, а также после его завершения. III этап включает кардиологическое и обще клиническое обследование, а также динамическое УЗИ сосудов ИГ. Кроме этого, корректируется доза препарата, регистрируются возможные нежелательные кардиальные и экстракардиальные эффекты, а также принимается решение о сроках завершения терапии.
IV этап начинается после отмены терапии пропранололом, когда ребенок вновь проходит обследование. На данном этапе важно исключить наличие синдрома отмены (рецидивов).
Средний возраст обследованных к началу лечения составил 3 мес. До начала терапии пропранололом у всех пациентов с ИГ проводилось фотодокументирование и определялись исходные ультразвуковые параметры – толщина, размеры ИГ, а также характеристики кровотока (рис. 1-3). Исследование осуществлялось с использованием ультразвукового аппарата экспертного уровня Toshiba Aplio 500.
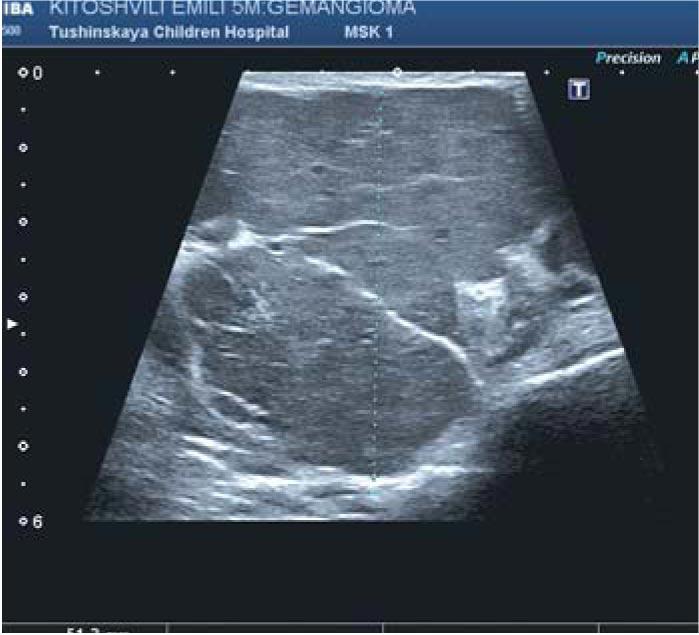 Рис.1. Ультразвуковое исследование инфантильной гемангиомы. Измерение толщины сосудистого образования в области правой околоушной железы
Рис.1. Ультразвуковое исследование инфантильной гемангиомы. Измерение толщины сосудистого образования в области правой околоушной железы
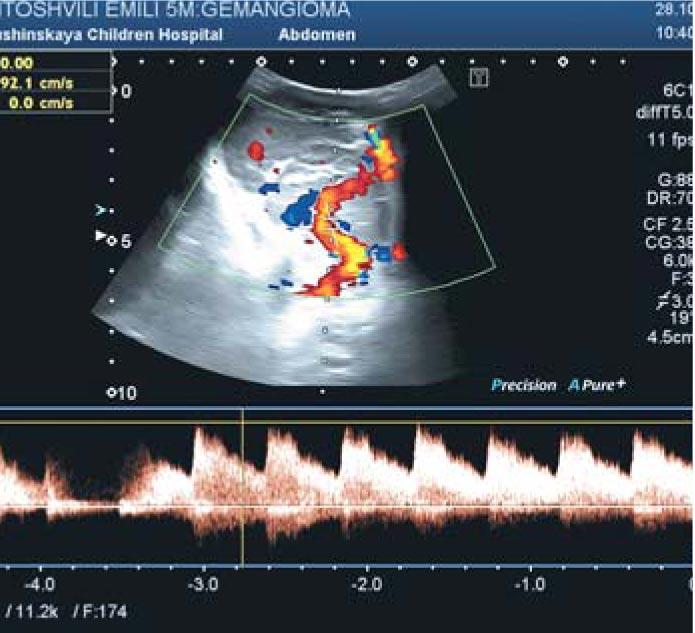 Рис. 2. Ультразвуковое исследование инфантильной гемангиомы в режиме доплерографии. Линейная скорость кровотока по питающему сосуду в области правой околоушной железы
Рис. 2. Ультразвуковое исследование инфантильной гемангиомы в режиме доплерографии. Линейная скорость кровотока по питающему сосуду в области правой околоушной железы
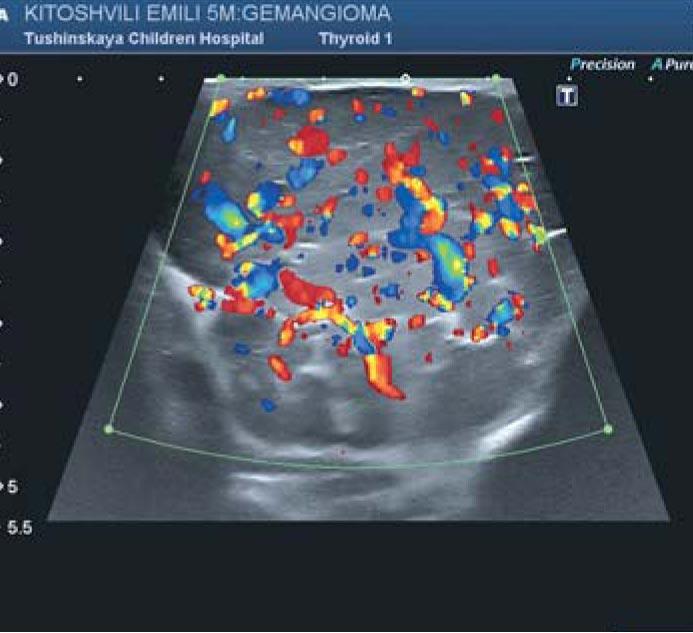 Рис. 3. Ультразвуковое исследование инфантильной гемангиомы в режиме доплерографии. Множественность сосудов. Линейная скорость кровотока по интрапаренхиматозным сосудам в области правой околоушной железы
Рис. 3. Ультразвуковое исследование инфантильной гемангиомы в режиме доплерографии. Множественность сосудов. Линейная скорость кровотока по интрапаренхиматозным сосудам в области правой околоушной железы
Во всех случаях на фоне системной монотерапии пропранололом у пациентов был отмечен быстрый и стойкий эффект: уже на этапе подбора дозы наблюдалась инфолюция ИГ, которые становились более бледными, менее напряженными. При этом положительный эффект был зафиксирован как при ИГ, находящихся в стадии пролиферации, так и при ИГ в стадии инволюции. Дети были выписаны из стационара для продолжения лечения в домашних условиях под наблюдением педиатра и кардиолога с диагнозом «стадия начала медикаментозной инволюции». Положительная динамика была явной как в течение 1-го месяца с момента назначения лечения, так и при каждом обследовании с целью коррекции дозы препарата (по мере увеличения массы тела). Анализ показал, что наиболее заметным положительный эффект был у тех детей, у которых лечение пропранололом начато в первые 2 мес жизни и которые ранее не проходили другого лечения.
Наибольший эффект от терапии получен в первые 6 мес. Об эффективности терапии свидетельствовали фотодокументы, предоставляемые родителями, и данные контрольных УЗИ (снижение ЛСК, уменьшение числа функционирующих сосу дов и глубины поражения). У детей, начавших лечение в возрасте 1 мес жизни, через 3 мес лечения отмечен наиболее значительный регресс сосудистых гиперплазий. Толщина мягких тканей в области ИГ уменьшилась на 65% от исходной, количество функционирующих сосудов – на 86%. ЛСК по питающим сосудам снизилась на 53% от исходной, по крупным интрапаренхиматозным сосудам – на 32%, по поверхностным – на 27%.
Ввиду гипотензивного и антиаритмического действия пропранолола всем пациентам требовался контроль состояния сердечно-сосудистой системы. О его необходимости свидетельствовали и результаты исходного кардиологического обследования: у 6% детей были выявлены врожденные пороки сердца, включая такой критический порок сердца, как коарктация аорты. У 1 ребенка имела место кардиомиопатия – синдром некомпактного миокарда левого желудочка, у 2 пациентов – симптомы сердечной недостаточности. У 3 детей наблюдались хромосомные и моногенные синдромы.
Через 3 мес от начала терапии по данным холтеровского мониторирования у всех детей среднесуточная частота сердечных сокращений снизилась на 8% – до 120,0±9,1 в мин (Ме±σ). Максимальное снижение этого показателя по данным офисных измерений составило 20,31 в мин (р = 0,01). Артериальная гипотензия зафиксирована у 3% пациентов. После завершения терапии у всех детей частота сердечных сокращений восстановилась. Значимое снижение сократительной способности миокарда по данным эхокардиографии выявлено у 1 ребенка. По результатам суточного холтеровского мониторирования АВ-блокада I степени выявлена у 17% больных, а паузы сердечного ритма, превышающие норму, – у 5%. У 3 детей паузы ритма сердца возникали во время аффективно-респираторных пароксизмов, сопровождаясь синкопальными состояниями. У этих детей терапия пропранололом была отменена.
Помимо оценки влияния пропранолола на состояние сердечно-сосудистой системы на фоне лечения и после ее завершения анализировались и возможные экстракардиальные нежелательные эффекты. Зафиксировано повышение уровня печеночных трансаминаз (АСТ у 17% больных, АЛТ у 2%), нейтропения – у 5%, гипогликемия – у 5%. У 3 детей вследствие неправильного приема препарата на дому (нерегулярно и натощак) развилось острое гипогликемическое состояние, потребовавшее их срочной госпитализации. Нарушение сна было от мечено только у 1 ребенка. Бронхообструктивный синдром стал причиной отмены препарата у 1 недоношенного пациента, имевшего признаки бронхолегочной дисплазии. В остальных случаях присоединения бронхообструкции во время острой вирусной инфекции препарат отменяли временно. У 1 ребенка имела место спленомегалия с гиперспленизмом и анемией I-II степени. У 3 детей отмечалось снижение температуры конечностей в первые 48 ч приема препарата, что обусловлено спазмом периферических сосудов.
Средняя продолжительность лечения пропранололом составила 15 мес. Дети с недоношенностью и задержкой внутриутробного развития в анамнезе, токсикозом и/или многоводием у матери во время беременности проходили лечение в среднем на 3,2 мес дольше. Наиболее длительно лечились дети с РНАСЕ(S)-синдромом, ИГ периорбитальной области, области околоушных желез. Продолжительность лечения в каждом случае определялась индивидуально по показателям ЛСК в сосудах ИГ. Нами установлены объективные критерии (скоростные параметры) оценки необходимости постепенной от мены терапии.
Благодаря индивидуальному подходу синдром отмены наблюдался лишь у 3% наших пациентов, только у половины этих детей потребовалось продление лечения пропранололом. Группу риска синдрома отмены составили дети с РНАСЕ(S)-синдромом, сегментарными гемангиомами и дети, имеющие синдромальную форму патологии. По поводу остаточных явлений (телеангиэктазий, синдрома избыточной кожи, фиброзно-жировых изменений) после завершения терапии проводилась консультация хирургов и специалистов по лазеротерапии. Местное использование пропранолола в виде аппликаций (0,5% раствора тимолола) давало эффект в ходе многомесячного применения лишь при поверхностных младенческих гемангиомах не больших размеров.
Клинический пример
Пациентка Г. в возрасте 9 мес 23 дней впервые поступила в отделение кардиологии ДГКБ им. З.А. Башляевой. Из анамнеза известно, что ребенок родился от матери 32 лет, от первой беременности, протекавшей на фоне стресса, с угрозой прерывания на 24-й неделе (мать находилась на стационарном лечении, получала генипрал). Роды первые, самостоятельные, преждевременные на 34-35-й неделе (раннее излитие околоплодных вод), безводный промежуток 24 ч. Масса тела при рождении – 2700 г, длина 46 см, оценка по шкале Апгар 8 баллов. Привита БЦЖ и от гепатита в родильном доме.
После выписки из родильного дома мать обратила внимание на красное пятно больших размеров в области левого плеча. Осмотрена хирургом в возрасте 13 с. ж. (рис. 4). Заподозрена младенческая гемангиома. Рекомендовано наблюдение. На 3-й неделе жизни начался бурный рост сосудистого образования, постепенно оно приобрело бугристость, появились изъязвления (рис. 5, 6). Хирург по-прежнему рекомендовал продолжить динамическое наблюдение. В возрасте 7 мес получена консультация онколога. Поставлен диагноз: Смешанная гемангиома в области плеча. Стадия стабилизации с признаками регресса. Онколог также рекомендовал наблюдение с контрольным осмотром в возрасте 1 года.
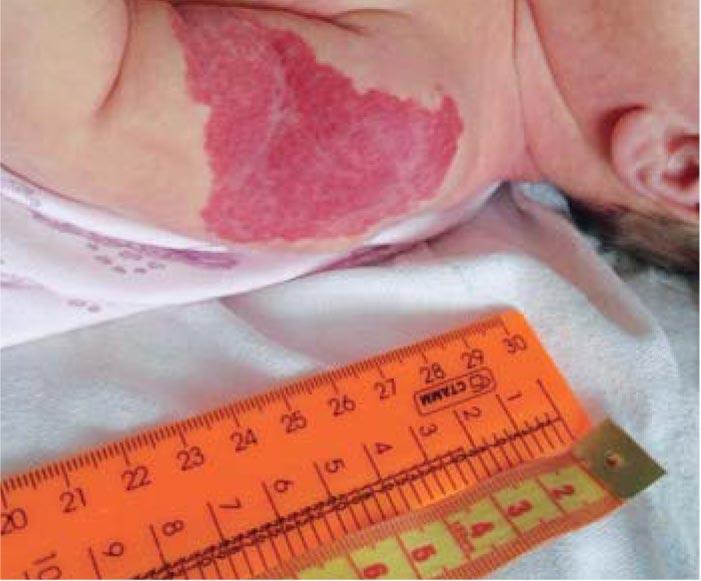 Рис. 4. Смешанная инфантильная гемангиома мягких тканей левого плеча на 13-е сутки жизни (стадия начальных проявлений)
Рис. 4. Смешанная инфантильная гемангиома мягких тканей левого плеча на 13-е сутки жизни (стадия начальных проявлений)
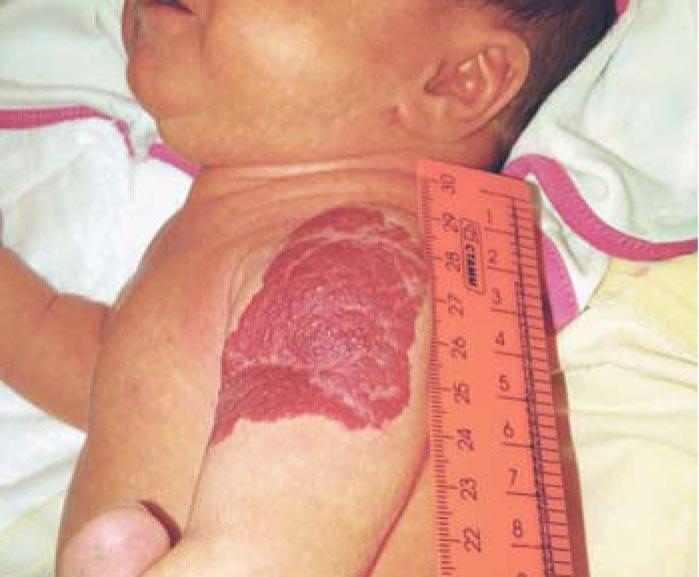 Рис. 5. Смешанная инфантильная гемангиома мягких тканей левого плеча на 23-и сутки жизни (стадия начала пролиферации)
Рис. 5. Смешанная инфантильная гемангиома мягких тканей левого плеча на 23-и сутки жизни (стадия начала пролиферации)
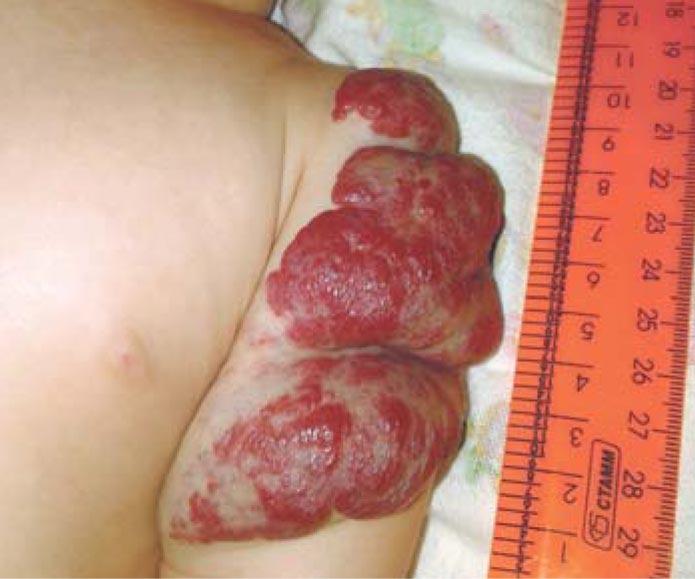 Рис. 6. Смешанная инфантильная гемангиома мягких тканей левого плеча в возрасте 4 мес (стадия пролиферации
Рис. 6. Смешанная инфантильная гемангиома мягких тканей левого плеча в возрасте 4 мес (стадия пролиферации
Из средств массовой информации мать узнала о возможности лечения пропранололом, в частности в отделении кардиологии ДГКБ им. З.А. Башляевой. При поступлении (рис. 7) девочке был поставлен диагноз: смешанная младенческая гемангиома в области мягких тканей левого плеча, осложненная изъязвлениями. По данным УЗИ толщина сосудистого образования составила 20-25 мм, ЛСК была очень высокой: в питающих сосудах – 124 см/с, в крупных интрапаренхиматозных сосудах – 64 см/с, в мелких – 40 см/с. После исходного базового кардиологического обследования при отсутствии противопоказаний девочке в возрасте 10 мес с 17.07.2017 начата терапия пропранололом.
Уже за период нахождения в стационаре отмечена положительная динамика – уменьшение яркости и напряженности ИГ, появление большей складчатости. Изъязвления сохранялись, кровоточили. Была добавлена местная терапия кремом «Аргосульфан».
После стабилизации состояния и подбора терапии девочка была выписана; назначенное лечение продолжалось. Ребенок регулярно поступал в отделение каждые 3 мес для обследования и коррекции терапии. В ходе каждой госпитализации проводилась коррекция дозы пропранолола в соответствии с изменяющейся массой тела.
Инволюция протекала медленно; в январе 2018 г. (через 6 мес от начала лечения) в области одной из эпителизировавшихся прежде язв сформировался абсцесс, вскрытие которого не было осложнено кровотечением. Из нежелательных экстракардиальных явлений имела место нейтропения I степени, диагностированная через 3 мес от начала лечения. По данным УЗИ, проведенного в возрасте 1 года 11 мес (продолжительность лечения 1 год 1 мес), отмечено уменьшение толщины ИГ с 25 до 10 мм, ЛСК со 124 до 66 см/с в питающем сосуде, с 64 до 28 см/с в крупных интрапаренхиматозных сосудах и с 40 до 15 см/с в мелких сосудах. На месте язв формировались рубцы. Терапия была продолжена (рис. 8).
Спустя 3 мес толщина ИГ составила 5-7 мм, ЛСК в питающем сосуде – 53 см/с, в крупных интрапаренхиматозных сосудах – 17 см/с, в мелких – 10 см/с. Нейтропении не было.
В августе 2019 г. при достижении ЛСК по мелким сосудам 8 см/с и при дозе пропранолола 2,75 мг/кг/с была начата постепенная отмена терапии. На фоне уменьшения дозы (2 мг/кг/с) появились клинические признаки синдрома отмены – покраснение кожи, в связи с чем дальнейшее снижение дозы было прекращено и лечение продлено еще на 3 мес с последующим медленным снижением дозы вплоть до полной отмены 20.06.2020.
Таким образом, лечение было полностью завершено в возрасте 3 лет 4 мес, а общая продолжительность монотерапии пропранололом составила 2 года 6 мес. Признаков синдрома отмены после завершения лечения не было. Данные УЗИ через 2 нед после завершения лечения свидетельствовали об инволюции ИГ: в области наружной поверхности левого плеча определялась подкожно-жировая клетчатка толщиной 8 мм, структура обычной эхогенности с мелкими гиперэхогенными включениями фиброзной ткани. В режиме цветокодирования лоцировались единичные сосуды в 1 ультразвуковом срезе с ЛСК 8 см/с. Индекс резистентности сосудов составил 0,76. Резидуальные изменения заключались в фиброзно-жировых изменениях в виде дряблой и избыточной кожи, а также небольших рубцах в местах бывших изъязвлений (рис. 9).
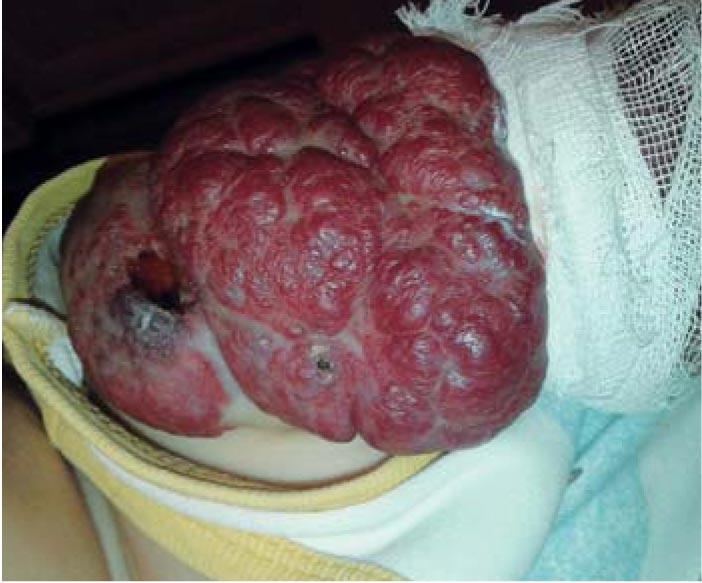 Рис. 7. Смешанная инфантильная гемангиома мягких тканей левого плеча, осложненная изъязвлением в возрасте 9 мес 23 дней (при поступлении)
Рис. 7. Смешанная инфантильная гемангиома мягких тканей левого плеча, осложненная изъязвлением в возрасте 9 мес 23 дней (при поступлении)
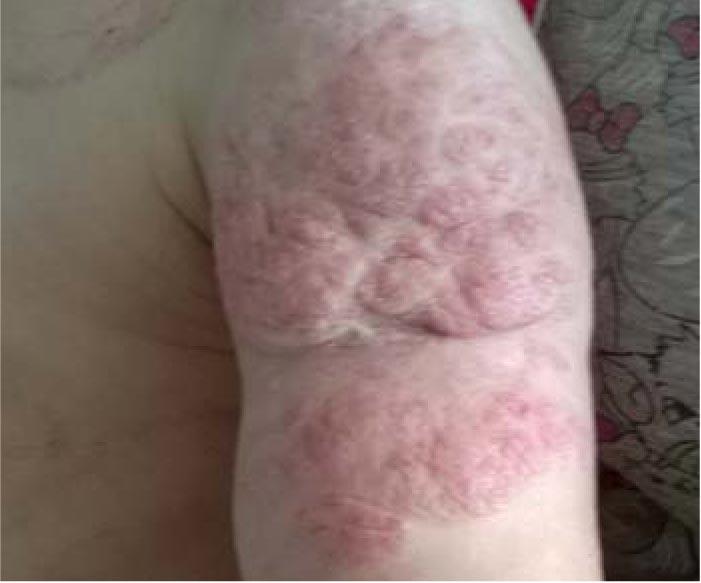 Рис. 8. Смешанная инфантильная гемангиома мягких тканей левого плеча в возрасте 1 года 11 мес на фоне лечения пропранололом (продолжительность монотерапии 1 год 1 мес) (стадия инволюции)
Рис. 8. Смешанная инфантильная гемангиома мягких тканей левого плеча в возрасте 1 года 11 мес на фоне лечения пропранололом (продолжительность монотерапии 1 год 1 мес) (стадия инволюции)
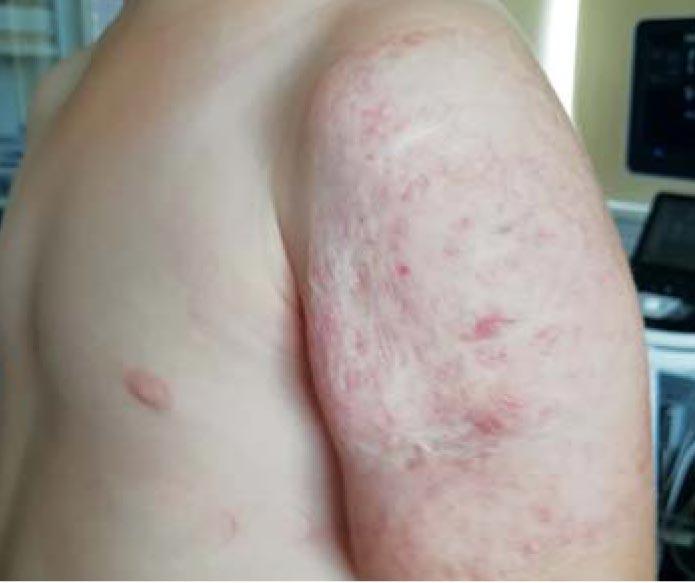 Рис. 9. Смешанная инфантильная гемангиома мягких тканей левого плеча у пациентки в возрасте 3 лет 4 мес после отмены пропранолола (продолжительность монотерапии 2 года 6 мес) (стадия резидуальных изменений)
Рис. 9. Смешанная инфантильная гемангиома мягких тканей левого плеча у пациентки в возрасте 3 лет 4 мес после отмены пропранолола (продолжительность монотерапии 2 года 6 мес) (стадия резидуальных изменений)
Данный клинический пример наглядно демонстрирует неоправданность длительного режима наблюдения обширной смешанной младенческой гемангиомы с бурным ростом, упущение адекватного «окна возможностей», что привело к позднему старту терапии, развитию осложнений в виде изъязвлений и нагноений, очень медленной инволюции сосудистой патологии, появлению синдрома отмены и формированию достаточно грубых резидуальных изменений с косметическим дефектом. Дополнительных нежелательных эффектов не выявлено. Рецидивов нейтропении не было. Девочка начала посещать детский сад, что привело к появлению вопросов как у самого ребенка, так и окружающих ее сверстников по поводу кожных изменений на руке. У пациентки возникли симптомы психологического дискомфорта. Рекомендована консультация специалиста по лазеротерапии.
Заключение
Накопленный в отделении кардиологии ДГКБ им. З.А. Башляевой опыт применения неселективного β-адреноблокатора пропранолола в рамках созданного авторами протокола ведения пациентов с ИГ свиде тельствует об эффективности и целесообразности данного вида лечения как 1-й линии терапии. Об эффективности лечения свидетельствуют фотодокументы и показатели УЗИ, позволяющие в динамике оценивать толщину ИГ, количество сосудов, ЛСК, а также индекс резистентности. К процессу фотодокументирования всегда привлекаются родители, что делает их активными участниками лечебного процесса. В отдельных случаях для оценки эффективности лечения применялась компьютерная томография с контрастированием. Динамическое УЗИ с доплерографией на фоне лечения пропранололом и сразу после его окончания способствовало установлению индивидуальной продолжительности лечения и максимальному снижению часто ты синдрома отмены – до 3%.
Включение в протокол обследования детей с ИГ тщательного лабораторно-инструментального, в том числе кардиологического обследования с проведением эхокардиографии, суточного мониторирования электрокардиограммы (до назначения терапии пропранололом, во время и после ее завершения), позволило своевременно выявить нежелательные эффекты, провести коррекцию дозы препарата или полностью отменить терапию. Несомненно, суточное холтеровское мониторирование – более информативный, объективный и, соответственно, эффективный метод оценки безопасности лечения по сравнению со стандартной электрокардиографией.
Тщательный анализ как кардиальных, так и экстракардиальных нежелательных эффектов позволил нам выявить пациентов, составляющих группу риска. Это дети с синдромальной формой патологии, недоношенные дети, дети с PHACE(S)- и lumbar-синдромами.
Составленный и внедренный в клиническую практику алгоритм ведения пациентов с ИГ дал нам возможность избежать применения более агрессивных методов лечения, а применение неселективного β-блокатора пропранолола под контролем детского кардиолога обеспечило безопасность назначенного лечения.
Целесообразно начинать консервативную терапию пропранололом с первых месяцев жизни ребенка в стадии активного роста ИГ до применения других видов лечения и до развития таких осложнений, как амблиопия, сердечная и дыхательная недостаточность, изъязвления, кровотечения, нагноения. Позднее начало терапии чревато формированием косметических дефектов, требующих дополнительной коррекции. Режим наблюдения, предлагаемый хирургами, часто является неоправданным.
Лечение пропранололом должно осуществляться и контролироваться врачом-кардиологом.
Строгое соблюдение протокола с проведением 1-го этапа лечения в кардиологическом стационаре, предварительное общеклиническое и кардиологическое обследование для выявления противопоказаний к терапии, постепенный подбор дозы препарата, тщательное наблюдение за ребенком в ходе всего периода лечения, а также постепенная отмена лечения позволяют получить достаточный клинический эффект, минимизировать либо полностью исключить нежелательные явления.
Литература
- ISSVA. Classification of vascular anomalies. International Society for the Study of Vascular Anomalies; 2014. [cited 2018 Jan 18]. issva.org/classification.
- Dickison P., Christou E., Wargon O. A prospective study of infantile hemangiomas with a focus on incidence and rick factors // Pediatrics Dermatology. 2011. No. 28. P. 663-669.
- Luu M., Freiden I.J. Hemangioma: clinical course, complications and management // British Journal of Dermatology. 2013. Vol. 169. No. 1. P. 20-30.
- Munden A., Butschek R., Tom W.L. et al. Prospective study of infantile hemangiomas: incidence, clinical characteristics and association with placental anomalies // British Journal of Dermatology. 2014. Vol. 170. No. 4. P. 907-913.
- Котлукова Н.П., Мосин И.М., Константинова Н.К. и др. Младенческие гемангиомы параорбитальной области: опыт консервативного лечения неселективным бета-адреноблокатором пропранололом // Педиатрия им. Г.Н. Сперанского. Т. 98. № 4. С. 57-62.
- Котлукова Н.П., Константинова Н.К., Пыков М.И. и др. Множественные гемангиомы печени у новорожденного в сочетании с врожденным пороком сердца – успешное лечение и хороший прогноз // Педиатрия им. Г.Н. Сперанского. 2018. Т. 97. № 4. С. 187-191.
- Захарова И.Н., Котлукова Н.П., Рогинский В.В. и др. Что нужно знать педиатру о младенческих гемангиомах // Медицинский совет. 2016. № 16. С. 32-37.
- Рогинский В.В. Прощай, гемангиома! Новый взгляд. М., 2020. 16 с.
- Шарафанович Е.М., Конопля Н.Е., Аверин В.И. Современные возможности медикаментозного лечения сосудистых образований у детей // Новости хирургии. 2019. Т. 27. № 1. С. 81-90.
- Leaute-Labreze C., Dumas de la Roque E., Hubiche T. et al. Propranolol for severe hemangiomas of infancy // New England Journal of Medicine. 2008. Vol. 358. No. 24. P. 2649-2651.
- Drolet B.A. Frommelt P.C., Chamlin S.L. et al. Initiation and use of proranolol for infantile hemangioma: report of a consensus conference // Pediatrics. 2013. Vol. 131. No. 1. P. 128-140.
- Lamy S., Lachambre M.P., Lord-Dufor S., Beliveau R. Propranolol suppresses angiogenesis in vitro: inhibicion of proliferacion, migration, and differentiation of endothelial cells // Vascular Pharmacology. 2010. Vol. 53. No. 5-6. P. 200-208.
- Tu J.B., Ma R.Z., Dong Q. et al. Induction of apoptosis in infantile hemangioma endothelial cells by propranolol // Experimental and Therapeutic Medicine. 2013. Vol. 6. No. 2. P. 574-578.
- Котлукова Н.П., Рогинский В.В., Тимофеева М.Ю. и др. Новый взгляд на лечение инфантильных гемангиом (сосудистых гиперплазий) // Педиатрия им. Г.Н. Сперанского. 2012. Т. 91. № 6. С. 60-64.
- Leaute-Labreze C., Hoeger P., Mazereeuw-Hautier J. et al. A randomized, controlled trial of oral propranolol in infantile hemagioma // New England Journal of Medicine. 2015. Vol. 372. P. 735-746.
- Hoeger P.H., Harper J.I., Baselga E. et al. Treatment of infantile haemangiomas: recommendations of a European expert group // European Journal of Pediatrics. 2015. Vol. 174. No. 7. P. 855-865.
- Clinical Practice Guideline for the Management of Infantile Hemangiomas. American Academy of Pediatrics // Journal of Pediatrics. 2019. Vol. 143. No. 1.
- Солдатский Ю.Л., Тимофеева М.Ю., Котлукова Н.П. и др. Эффективность пропранолола при лечении подскладковой гемангиомы у детей первого года жизни // Вестник отоларингологии. 2014. № 1. С. 44-48.
- Тимофеева М.Ю., Репина Э.А., Котлукова Н.П. и др. PHACE-синдром: современные возможности диагностики и лечения // Педиатрия им. Г.Н. Сперанского. 2013. Т. 92. № 2 С. 68-72.
- Поляев Ю.А., Котлукова Н.П., Постников С.С. и др. Пропранолол в лечении инфантильных гемангиом // Детская хирургия. 2013. № 5. С. 35-37.
- Репина Э.А., Рогинский В.В., Котлукова Н.П. Тактика лечения детей с сосудистыми гиперплазиями (т. н. детскими гемангиомами) челюстно-лицевой области (обзор литературы и результат собственных исследований) // Стоматология. 2013. С. 34-41.
- Котлукова Н.П., Константинова Н.К., Лаврова Т.Р. и др. Патент на изобретение «Способ лечения инфантильных гемангиом». № 2701213 от 25.09.2019 г.
Комментарии
ПРАКТИКА ПЕДИАТРА

