Поражения кожи и слизистых оболочек при сочетанной микоплазменной и герпесвирусной инфекции у детей
СтатьиОпубликовано в журнале:
Практика педиатра № 3, 2020
Н.О. Кувардина1, Ф.С. Харламова1, О.В. Шамшева1, И.В. Полеско1, И.М. Османов2, Э.Р. Самитова2, Ю.В. Романова3, О.С. Остапущенко4
1 ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
2 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
3 ГБУЗ «Морозовская детская городская клиническая больница Департамента здравоохранения г. Москвы»
4 ООО «Вэссел Клиник», г. Москва
Ключевые слова: внереспираторные поражения при микоплазмозе, сочетающемся с герпесвирусной инфекцией, васкулит, уртикарная сыпь, везикулезный васкулит, мукозит, кольцевидная, узловатая эритема, синдром Стивенса-Джонсона, некротический эпидермальный некролиз, многоформная экссудативная эритема, аутоантитела к антигенам эндотелия и гладких мышц сосудов
Keywords: extra-respiratory lesions in mycoplasmosis combined with herpesvirus infection, vasculitis, urticaria, vesicular vasculitis, mucositis, ring-shaped, nodular erythema, Stevens-Johnson syndrome, necrotic epidermal necrolysis, multiform exudative erythema, autoantibodies to endothelial and vascular smooth muscle antigens
Резюме. Актуальность исследования обусловлена ростом числа штаммов микоплазм с резистентностью к макролидам, что способствует широкому распространению персистирующих вариантов микоплазмоза с развитием внереспираторных поражений различных органов и систем. Среди таких поражений педиатры нередко регистрируют поражения кожи, которые в прежние годы часто расценивались дерматологами и аллергологами как аллергодерматозы.
Summary. The relevance of the study is due to the growing number of Mycoplasma strains, that form resistance to macrolides, which contributes to the wide spread of persistent variants of the course of mycoplasmosis with the development of extra-respiratory lesions of various organs and systems. Among which pediatricians often register skin lesions, which in previous years were mostly regarded by dermatologists and allergologists as allergodermatoses.
Введение
Актуальность обсуждаемой проблемы обусловлена неуклонным ростом заболеваемости микоплазменной инфекцией, нередко сочетающейся с герпесвирусными заболеваниями у детского и взрослого населения России. По данным Роспотребнадзора, в 2018 г. было зарегистрировано 77 вспышек внебольничных пневмоний, в этиологической структуре которых микоплазменная инфекция составила 79% [1].
Доказано, что помимо респираторных поражений, микоплазменная инфекция может быть триггером аутоиммунных заболеваний, таких как микоплазменная бронхиальная астма, микоплазменый синдром Стивенса-Джонсона, а при сочетании с герпесвирусной инфекцией (ГВИ) – геморрагического васкулита, кардита, аритмии и др. [2-4].
Микоплазмы занимают промежуточное положение между вирусами, бактериями и простейшими. Их выживание и формирование системы паразит – хозяин в ряде случаев обусловлено тем, что они образуют внеклеточные мембранные везикулы, которые представляют собой важнейшую часть бактериального секретома и могут содержать, помимо мембранных компонентов, цитоплазматические белки, токсины, РНК. Именно везикулы определяют такие важнейшие свойства микоплазм, как токсигенность, инвазивность и патогенность: проникая первыми в клетку хозяина, они нарушают ее ультраструктуру, индуцируют модуляцию экспрессии генов и синтеза белков в инфицированной клетке. Заражение микоплазмами провоцирует изменение экспрессии широкого ряда генов клетки хозяина, таких как гены, кодирующие регуляторные белки-онкогены, гены-супрессоры опухолевого роста, цитокины, рецепторы и компоненты сигнальных путей. Внеклеточные везикулы обеспечивают не только белковый трафик и перенос детерминант вирулентности, но и формируют резистентность к антибактериальным препаратам как механизм выживания и адаптации [5].
В основе патогенеза микоплазменной инфекции лежат уникальные свойства мембранных паразитов: с помощью специфических прикрепительных органелл липопротеиновой природы мембрана микоплазмы способна к тесному слиянию с мембраной клетки хозяина. В структуру этих органелл входит ряд адгезинов: HMV1, HMV2, HMV3, P90, P40 и P30, главную роль среди которых играет белок P1 [6]. Благодаря тому, что у микоплазм отсутствуют такие компоненты клеточной стенки, как X-E-диаминопимелиновая кислота и мукопептидный комплекс, они могут адсорбироваться на любых клетках (реснитчатом эпителии бронхов, эритроцитах, эндотелии сосудов и др.). Фактором, определяющим патогенность микоплазм, является CARDS-токсин (community acquired respiratory distress syndrome toxin), который отвечает за связывание сурфактантного белка А и поступление микоплазм в клетки хозяина путем клатрин-зависимого эндоцитоза. Указанный токсин вызывает ядерную фрагментацию, стимулирует выработку провоспалительных цитокинов, острую клеточную воспалительную реакцию и митогенную стимуляцию В- и Т-лимфоцитов, формируя аутоиммунную реакцию [6, 7].
Показана роль Toll-like рецепторов b1, b2, b6, прикрепляясь к которым микоплазмы индуцируют воспалительный процесс с последующим развитием цитопатического эффекта за счет перекиси водорода и супероксидных радикалов. Комплекс цитоадгезинов Mycoplasma pneumoniae вызывает мощное воспаление, напоминающее гиперчувствительность замедленного типа, во время которого развивается цитокиновый дисбаланс и острая системная воспалительная реакция [8-10].
Клинические легочные и внелегочные поражения сопровождаются стимуляцией и макрофагов, которые продуцируют интерлейкин-6, TNF-α, а нейтрофильная инфильтрация индуцируется различными поверхностными липопротеинами [11]. В тех случаях, когда микоплазмы не перевариваются фагоцитами (нейтрофилами и макрофагами), последние становятся пермиссивной средой – разносчиками инфекции, содействуя ее генерализации. Микоплазмы вначале оказывают цитотоксический эффект, что активизирует систему комплемента, за этим следует иммунокомплексный процесс, а через 5-6 нед инициируются аутоиммунные механизмы. Аутоиммунные реакции развиваются вследствие сходства аминокислотных последовательностей микоплазменных адгезинов с рецепторами клеток тканей человека. Аутоиммунный ответ играет важную роль в патогенезе внелегочных проявлений микоплазмоза [12-13].
В настоящее время известно, что существуют резистентные к макролидам штаммы M. pneumoniae с доминирующими мутациями A2063G, A2064G, а также редкий вариант C2617G в гене 23S-rRNA через домен V, на фоне которых развиваются внереспираторные поражения различных органов и систем, нередко без типичных симптомов респираторного заболевания [14].
Недостатком алгоритма диагностики внереспираторных проявлений микоплазмоза является то, что в большинстве случаев он сводится только к поиску M. pneumoniae, в то время как известно о 17 видах микоплазм, для которых человек является естественным хозяином, и 5 из них можно выявить по антигенемии и иммунному ответу методами РАГА (реакция агрегат-гемагглютинации), реакции пассивной агглютинации и иммуноферментного анализа.
По данным различных авторов, примерно у 25% пациентов M. pneumoniae могут вызывать внелегочные поражения одновременно с поражением респираторного тракта, а нередко и независимо от такового. M. incognitus. является причиной малоизученного генерализованного инфекционного процесса. M. fermentans и M. penetrans, по данным последних исследований, играют роль в развитии иммунодефицита. M. hominis, M.genitalium, M. urealiticum являются возбудителями урогенитального микоплазмоза; они обнаруживаются у женщин при спонтанных абортах, вызывают аномалии развития плода. M. orale, M. salivarium выделяемые из полости рта, вызывают периодонтиты, пульпиты, стоматиты, хронические остеомиелиты, а M. fermentans, M. arthritidis – заболевания суставов. У одного и того же больного можно наблюдать антигенемию и иммунный ответ одновременно в отношении 5 видов микоплазм [15].
Среди внелегочных проявлений микоплазмоза часто описывают неврологические поражения (энцефалиты, миелиты, синдром Гийена-Барре), поражения сердца и сосудов (к которым можно отнести перикардиты, миокардиты и эндокардиты), желудочно-кишечного тракта, суставов и кожи.
По данным M. Narita, существует 3 патогенетических механизма развития всех внелегочных проявлений микоплазменной инфекции. При первом (прямом) варианте ключевая роль отводится локально индуцированным цитокинам, формируется гиперчувствительность. Второй путь – непрямой, при нем основную роль играют так называемые иммунные изменения в организме, приводящие к аутоиммунным заболеваниям. Третий путь патогенеза связан с возникновением васкулита и/или тромбоза, которые формируются в результате окклюзии сосудов [16]. Возможно сочетание этих механизмов [17]. M. pneumoniae может действовать локально на сосудистую стенку путем индуцирования цитокинов и хемокинов, таких как фактор некроза опухоли а и интерлейкин-8, которые вызывают местные васкулитные и/или тромботические сосудистые окклюзии без системного гиперкоагулятивного состояния. Кроме того, обобщенные тромботические сосудистые окклюзии могут возникнуть в результате системного гиперкоагулятивного состояния, которое, в свою очередь, является следствием иммунной модуляции, ведущей к активации химических посредников, таких как фибрин-D-димер.
Особо уязвимыми группами населения являются дети и взрослые с ослабленным иммунитетом (иммунодефицитом). Микоплазменную инфекцию сложно своевременно диагностировать из-за слабого антительного (IgM и IgG) ответа. Поэтому разнообразные внелегочные соматические поражения при отсутствии клинически выраженных респираторных симптомов и пневмонии не рассматриваются как следствие микоплазменной инфекции и не ставится вопрос о необходимости исключения этой инфекции при дифференциальной диагностике этих поражений.
Яркое проявление аутоиммунных реакций при сочетании микоплазмоза с герпетической инфекцией – демиелинизирующие заболевания центральной нервной системы, сердечно-сосудистая патология, что нашло отражение в исследованиях сотрудников кафедры инфекционных болезней у детей педиатрического факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова. Результаты этих исследований [18] согласуются с данными M. Narita и соавт. [19], по мнению которых микоплазменная инфекция, в моноварианте и особенно в сочетании с инфекциями, вызванными вирусом Эпштейна-Барр и вирусом герпеса 6-го типа, при остром и персистирующем варианте их течения является триггером цитокин-индуцированных реакций, вызывающих системный сосудистый воспалительный ответ, который клинически может сопровождаться патологией различных органов: перикардитом, эндокардитом, гепатитом, панкреатитом, артритом, энцефалитом, миелитом, асептическим менингитом, буллезным мирингитом, слизисто-кожным синдромом Стивенса-Джонсона, многоформной экссудативной эритемой, уртикарными высыпаниями, анафилактической пурпурой, узловатой эритемой, кожным васкулитом, Mycoplasma-ассоциированным мукозитом и субкорнеальным пустулезным дерматозом.
Уже широко известно такое понятие, как инфекционный васкулит, но очень важным и неоднозначным остается вопрос о том, является ли он осложнением инфекционного заболевания или же основным звеном в его патогенезе. Инфекционные агенты, преодолевая биологические барьеры, попадают в организм и распространяются преимущественно гематогенным путем, активируя иммунные реакции, направленные на элиминацию возбудителя, попутно вызывая деструкцию клеток-хозяина. В сосудистом русле патоген контактирует с эндотелием, что приводит к нарушениям структуры и функций эндотелия и, неминуемо, к васкулиту. Васкулит – это патологический процесс, для которого характерно воспаление, некроз сосудистой стенки и периваскулярной зоны, а как результат – ишемические изменения различных органов и тканей [20, 21].
До настоящего времени в отечественной литературе недостаточно данных о поражениях кожи у детей при микоплазменной инфекции и ее сочетании с ГВИ. Поражения кожного покрова, по данным зарубежных авторов, регистрируются у 10-25% больных с M. pneumoniae и расцениваются в большинстве случаев как неспецифические (как различные экзантемы, везикулиты, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и узловатая эритема). Последние редко связывают с таким триггером, как микоплазмоз. Уточнение этиологии кожных поражений представляет собой непростую диагностическую задачу, для решения которой необходимо учитывать дополнительные признаки, характерные для инфекционной и неинфекционной патологии. По мнению F. Greco и соавт., поражение кожи – наиболее частое внереспираторное проявление микоплазменной инфекции [22]. Иммунные механизмы, ответственные за поражения кожи и слизистых оболочек, до конца не изучены, однако они включают иммунокомплексноопосредованную васкуляризацию, клеточно-опосредованный иммунный ответ, цитотоксическое поражение иммунных клеток и аутоиммунные механизмы.
Необходимо помнить и о том, что поражение кожи может являться следствием патологии сосудистой стенки [23].
Патогенетическую связь иммунных воспалительных изменений сосудов и гемостаза при микоплазмозе можно проследить в развитии синдрома Кавасаки, узловатой эритемы, а также поражений слизистых оболочек и клеток крови. В спектре внереспираторных аутоиммунных поражений, ассоциированных с микоплазмозом, описывается и дерматомиозит [23, 24].
Одно из редких проявлений ГВИ – узловатая эритема (erythema nodosum), именуемая также перегородочным панникулитом. Она проявляется болезненными узелками невоспалительного характера, обычно локализующимися на передних поверхностях нижних конечностей. Узловатая эритема не изъязвляется и обычно рассасывается без образования рубцов.
Несмотря на то что точная причина возникновения данного поражения остается малоизученной, в научной литературе описаны случаи возникновения узловатой эритемы на фоне микоплазменной инфекции, как с поражением респираторного тракта, так и без него [20].
Тяжелыми и опасными для жизни могут быть заболевания кожи, относящиеся к группе острых тяжелых распространенных дерматозов, которые отличаются друг от друга по степени тяжести и площади распространения эпидермального некролиза кожи. Эта группа включает многоформную экссудативную эритему, синдром Стивенса-Джонсона, токсический эпидермальный некролиз (синдром Лайелла).
Это разные по степени тяжести заболевания, но с единым патогенезом, в основе которого – иммунопатологические IgE-опосредованные реакции с повреждением органов, содержащих цитохромы (печень, легкие, желудочно-кишечный тракт), различная степень вовлеченности которых и определяет клиническую тяжесть процесса. Установлено, что синдром Стивенса-Джонсона является полиэтиологическим заболеванием, которое может быть индуцировано воздействием инфекционных агентов (таких, как герпесвирусы, микоплазмы).
Схожесть данных заболеваний подтверждается и сходством гистологической картины, для которой характерны выраженная лимфоцитарная инфильтрация в области перехода эпидермиса в дерму и вокруг сосудов дермы, ее отек, некроз эпидермиса, формирование субэпидермальных булл. Такая картина помогает четко отличить синдром Стивенса-Джонсона и токсический эпидермальный некролиз от других заболеваний, но не друг от друга [18].
Многоформная экссудативная эритема относится к иммуноопосредованным воспалительным реакциям кожи и слизистых оболочек, зачастую связана ГВИ; заболевание манифестирует также под влиянием вируса Эпштейна-Барр, M. pneumonia, бактериальных и грибковых инфекционных агентов, которые формируют в организме очаг хронической персистенции с периодически возникающими обострениями, которые способствуют сенсибилизации к инфекционному агенту с характерными мишеневидными очагами поражения, периферической локализацией. Различают малую форму (легкая степень) этого заболевания, при которой клинически определяется изолированное поражение кожи без интоксикационного синдрома, и большую форму (тяжелую), при которой помимо распространенных высыпаний наблюдается смешанная реакция гиперчувствительности с иммунокомплексным компонентом той или иной степени выраженности. Эта форма чаще регистрируется у подростков и молодых людей. У детей развивается в 20% случаев на коже и слизистых оболочках, присутствует выраженный интоксикационный синдром. Везикулы могут опалесцировать, нередко сливаются, образуя на коже рисунок, подобный гирлянде или дуге, обнажая обширные эрозивные участки, на месте которых образуются корки, чешуйки и участки гиперпигментации. При поражении слизистых оболочек везикулы быстро вскрываются, формируются болезненные очаги эрозии. Обратное развитие высыпаний длится в среднем 2-3 нед [25].
Целью настоящего исследования стало изучение частоты и характера кожных поражений у детей, страдающих микоплазмозом в моноварианте и в сочетании с ГВИ.
Материалы и методы
Под наблюдением находились 109 пациентов с проявлениями микоплазменной инфекции и ГВИ в моно- и сочетанном варианте, у которых диагностировали кардиоваскулярную патологию, среди них 60 – с поражениями кожи.
Основную группу составили дети (n = 60) в возрасте от 1 до 16 лет с поражениями кожи и слизистых оболочек на фоне ранее диагностированного васкулита. В группу сравнения были включены дети (n = 49) в возрасте от 1 до 16 лет с васкулитом, но без поражений кожи и слизистых оболочек (табл. 1).
Таблица 1. Возрастной состав детей с кардиоваскулярной патологией и кожными поражениями на фоне микоплазменной и герпесвирусной инфекции
| Возраст, лет | Без кожных поражений (n = 49) | С кожными поражениями (n = 60) |
| 1-3 | 9 | 11 |
| 4-7 | 17 | 16 |
| 8-12 | 15 | 17 |
| 13-17 | 8 | 16 |
Больные находились на стационарном лечении в отделениях Детской городской клинической больницы им. З.А. Башляевой, Морозовской детской городской клинической больницы (г. Москва), а также наблюдались в амбулаторных условиях клиники «Вэссел Клиник» (собран катамнез). Основные диагнозы, по поводу которых больные обращались за врачебной помощью: рецидивирующий бронхит, внебольничная пневмония, длительный фебрилитет или субфебрилитет, кожный васкулит, геморрагический васкулит, везикулезный дерматит и мукозит, уртикарная сыпь, кольцевидная гранулема, синдром Стивенса-Джонсона, многоформная экссудативная эритема, токсический эпидермальный некролиз, синдром хронической усталости, синдром вегетативной дисфункции (рис. 1).
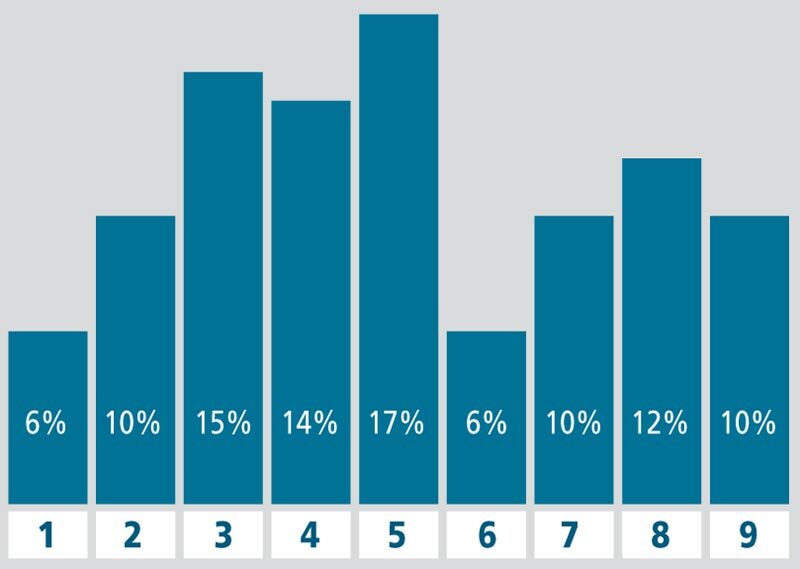 Рис. 1. Клинические диагнозы на момент поступления в стационар (n = 101). 1 – пневмония; 2 – лимфаденопатия; 3 – синдром хронической усталости; 4 – лихорадка неясного генеза; 5 – геморрагический васкулит; 6 – судорожный синдром; 7 – инфекционный мононуклеоз; 8 – обструктивный бронхит; 9 – субфебрилитет
Рис. 1. Клинические диагнозы на момент поступления в стационар (n = 101). 1 – пневмония; 2 – лимфаденопатия; 3 – синдром хронической усталости; 4 – лихорадка неясного генеза; 5 – геморрагический васкулит; 6 – судорожный синдром; 7 – инфекционный мононуклеоз; 8 – обструктивный бронхит; 9 – субфебрилитет
Проводились общий и биохимический анализ периферической крови, анализ мочи, коагулограмма, определение специфического антигена микоплазм методом РАГА, выявление методом иммуноферментного анализа антител классов IgM и IgG к микоплазмам, антител классов IgM и IgG к токсоплазмам, к вирусу герпеса 1, 2, 4, 5 и 6-го типов, к пневмоцистам, антител классов IgA, IgM и IgG к хламидиям; методом непрямой реакции иммунофлюоресценции определяли антигены указанных типов герпеса в мононуклеарах периферической крови, методом полимеразной цепной реакции в крови выявляли ДНК герпеса с определением количества копий. Исследовали показатели интерферонового статуса и клеточного иммунитета. C целью исключения аллергодерматоза больных консультировали дерматолог и аллерголог, определяли уровень IgE. Выполняли электрокардиограмму, эхокардиограмму и холтеровское мониторирование (по показаниям).
Анализ полученных данных проведен методами вариационной статистики, статистическую значимость различий определяли путем расчета t-критерия Стьюдента. Критерием статистической значимости считали величины p <0,05, р <0,001.
Результаты
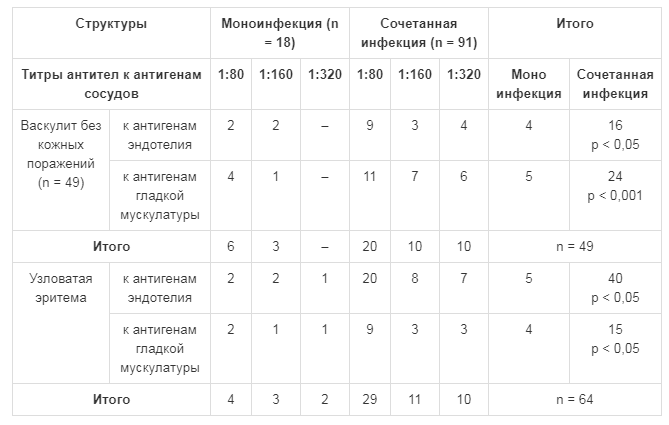
Сравнительные данные о вариантах течения микоплазмоза, ГВИ и их сочетаний (рис. 2), а также о нагрузке патогенами микоплазмоза и ГВИ у больных с васкулитом и у больных с васкулитом и кожными поражениями представлены в табл. 2. С целью диагностики сосудистой патологии с помощью ультразвуковой доплерографии проводилась оценка состояния комплекса интима – медиа сосудов брахиоцефального отдела, линейной скорости кровотока, тонуса артерий и вен шейного и транскраниального отделов у всех больных с микоплазмозом и сочетанной микоплазменно-герпесвирусной инфекцией. Оценивали также выраженность поствоспалительного фиброза сосудов с помощью иммунологического теста, характеризующего течение стереотипной асептической воспалительной реакции («кожного окна» по J.A. Rebuck), выраженность депрессии морфофункционального состояния макрофагов и степень фиброзирования зоны воспаления (рис. 3-5). В качестве маркера аутоиммунного процесса при диагностике васкулита исследовали уровень аутоантител к антигенам эндотелия и гладких мышц сосудов. Полученные показатели у больных с васкулитом, в том числе сопровождающимся кожными поражениями, свидетельствовали о статистически значимом нарастании количества аутоантител к антигенам эндотелия и гладкомышечным структурам сосудов по мере увеличения количества патогенов у больных при сочетании микоплазменной инфекции и ГВИ, протекавшей с кожными поражениями и васкулитом (р <0,05, р <0,001) (табл. 3).
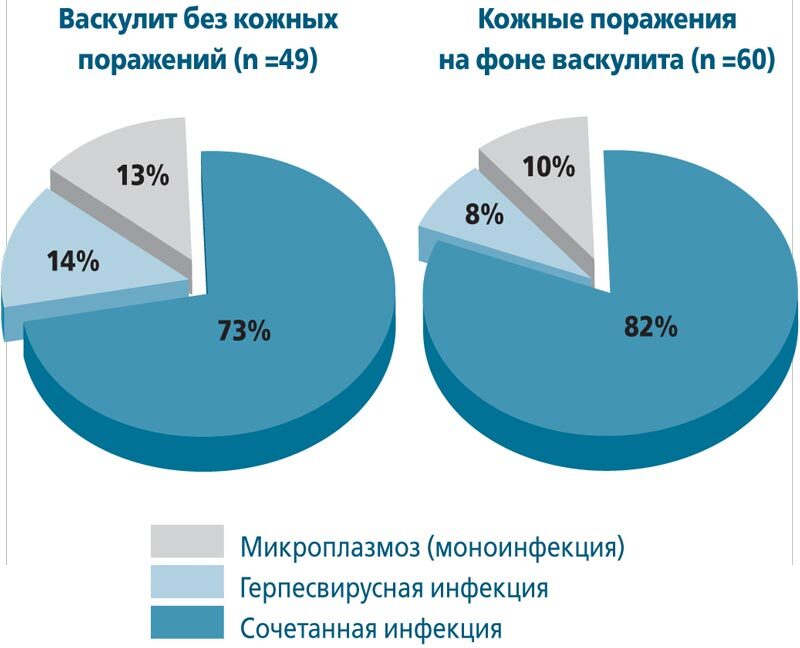 Рис. 2. Варианты течения микоплазмоза и герпесвирусной инфекции у детей с васкулитом и кожными поражениями на фоне васкулита
Рис. 2. Варианты течения микоплазмоза и герпесвирусной инфекции у детей с васкулитом и кожными поражениями на фоне васкулита
Таблица 2. Этиологическая структура поражений кожи у детей, страдающих микоплазмозом и герпесвирусной инфекцией (n = 109)
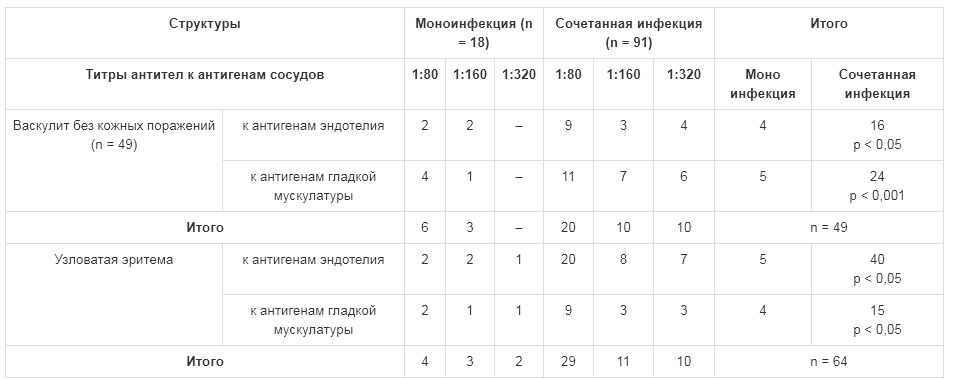
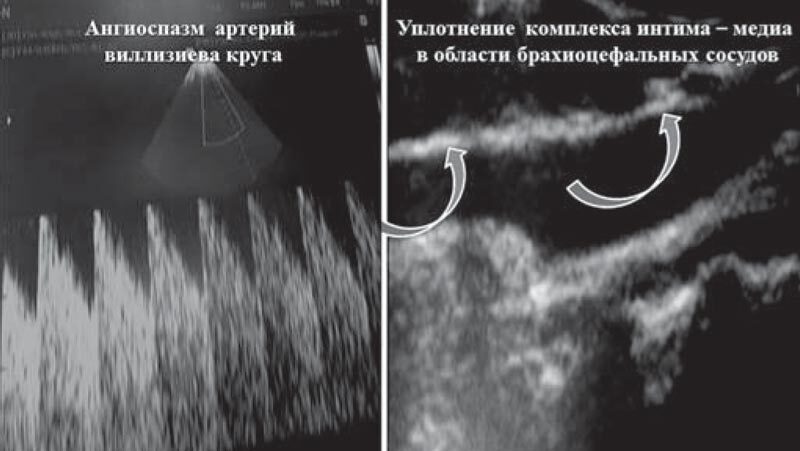 Рис. 3. Морфофункциональные расстройства сосудов при васкулите на фоне микоплазмоза и герпесвирусной инфекции у детей
Рис. 3. Морфофункциональные расстройства сосудов при васкулите на фоне микоплазмоза и герпесвирусной инфекции у детей
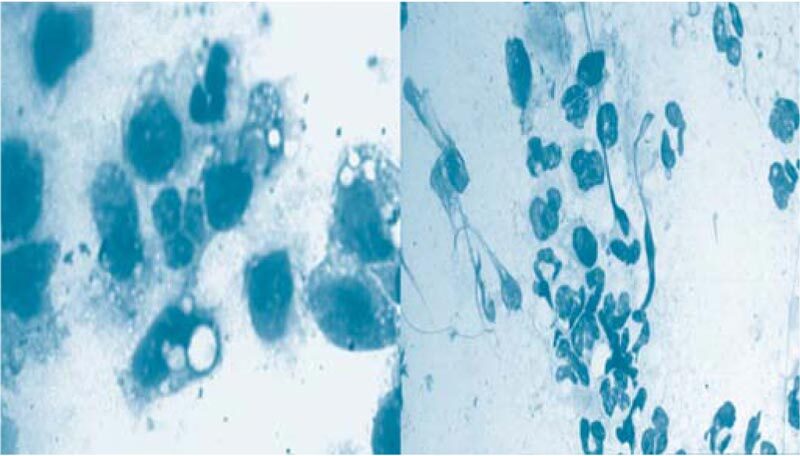 Рис. 4. Слабое накопление нежных волокон в единичных полях зрения в зоне асептической воспалительной реакции при нормальной функциональной активности макрофагов
Рис. 4. Слабое накопление нежных волокон в единичных полях зрения в зоне асептической воспалительной реакции при нормальной функциональной активности макрофагов
 Рис. 5. Значительное накопление волокон с видимой продукцией фибробластами коллагена в виде массивных пучков при значительном скоплении экссудата и грубой структурной деградации макрофагальных элементов в зоне асептической воспалительной реакции (n = 50). Модифицированный тест «кожного окна» J.A. Rebuck
Рис. 5. Значительное накопление волокон с видимой продукцией фибробластами коллагена в виде массивных пучков при значительном скоплении экссудата и грубой структурной деградации макрофагальных элементов в зоне асептической воспалительной реакции (n = 50). Модифицированный тест «кожного окна» J.A. Rebuck
Таблица 3. Уровень аутоантител к сосудистым антигенам у детей с васкулитом и поражением кожи на фоне васкулита при микоплазмозе и герпесвирусной инфекции (n = 109)
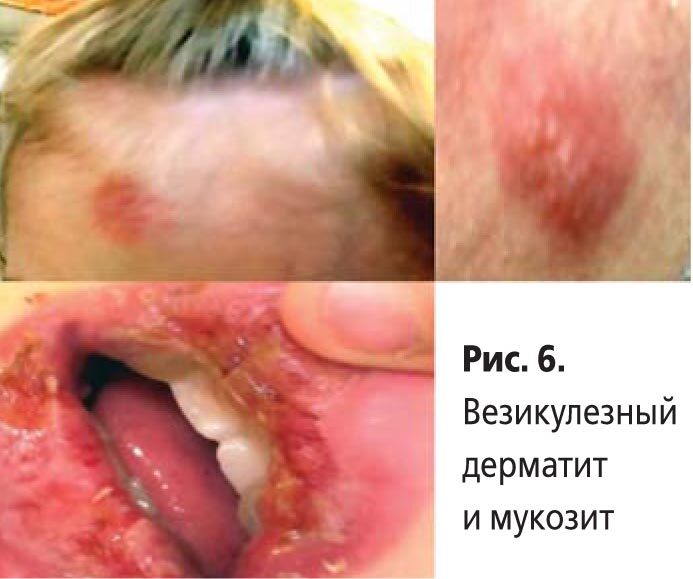
В процессе обследования в спектре кожных поражений везикулезный дерматит с явлениями мукозита в ротовой полости диагностировали у 9 больных с сочетанной инфекцией, при которой обнаружено 20 антигенов микоплазмоза и 17 маркеров ГВИ, в среднем на 1 пациента – более 4 патогенов микоплазмоза и ГВИ (рис. 6, табл. 3).
Уртикарная сыпь имела место у 18 больных, у которых выявлены 30 антигенов микоплазм и 27 маркеров ГВИ, в среднем на 1 больного – по 3 патогена (рис. 7, табл. 3).
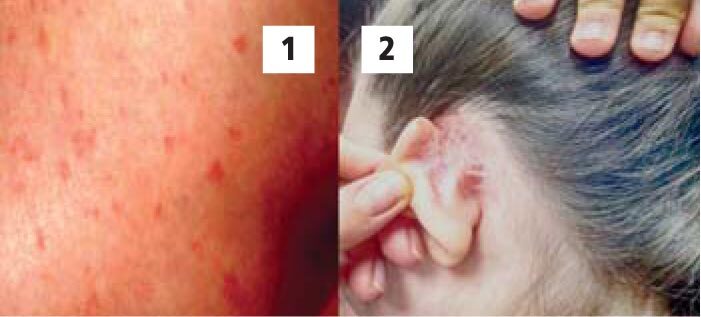 Рис. 7. Уртикарная сыпь (1) и экзематозные проявления (2) у пациентки с инфекцией, вызванной вирусом Эпштейна-Барр, вирусом герпеса 6-го типа и вирусом простого герпеса 1-го типа в сочетании с микоплазмозом
Рис. 7. Уртикарная сыпь (1) и экзематозные проявления (2) у пациентки с инфекцией, вызванной вирусом Эпштейна-Барр, вирусом герпеса 6-го типа и вирусом простого герпеса 1-го типа в сочетании с микоплазмозом
У 20 детей с геморрагическим и кожным васкулитом обнаружен 21 антиген микоплазмоза и 26 маркеров ГВИ, что в среднем составило более 2 патогенов на 1 больного (рис. 8-10, табл. 3).
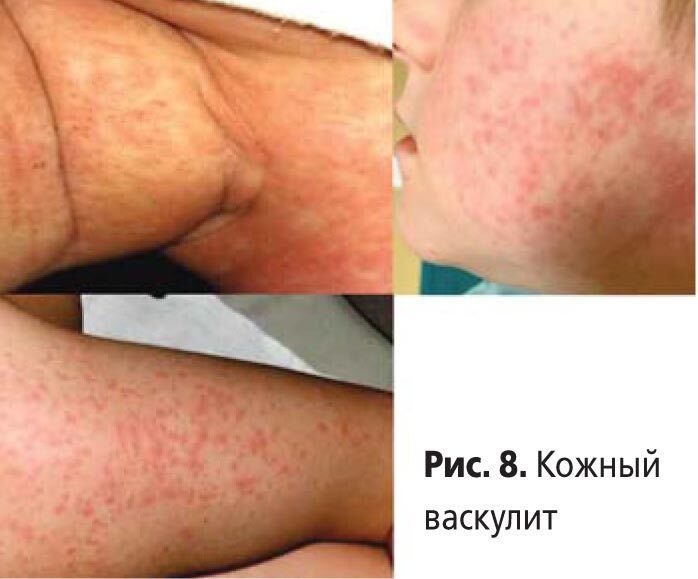
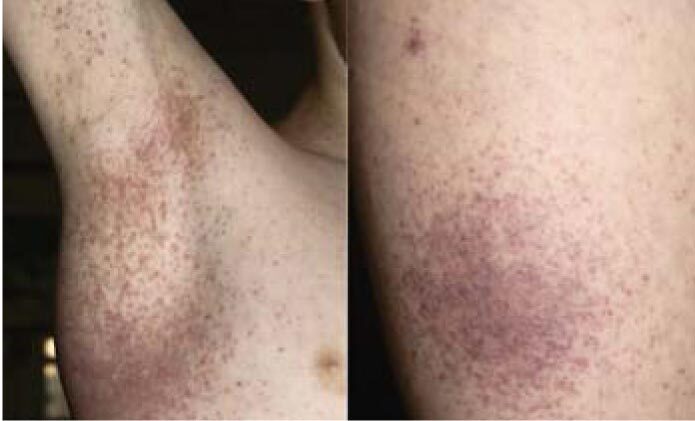 Рис. 9. Геморрагическая сыпь и лимфаденопатия в области подмышечной впадины и голени у больного с васкулитом на фоне активно текущей персистирующей инфекции, вызванной цитомегаловирсом и вирусом герпеса 6-го типа
Рис. 9. Геморрагическая сыпь и лимфаденопатия в области подмышечной впадины и голени у больного с васкулитом на фоне активно текущей персистирующей инфекции, вызванной цитомегаловирсом и вирусом герпеса 6-го типа
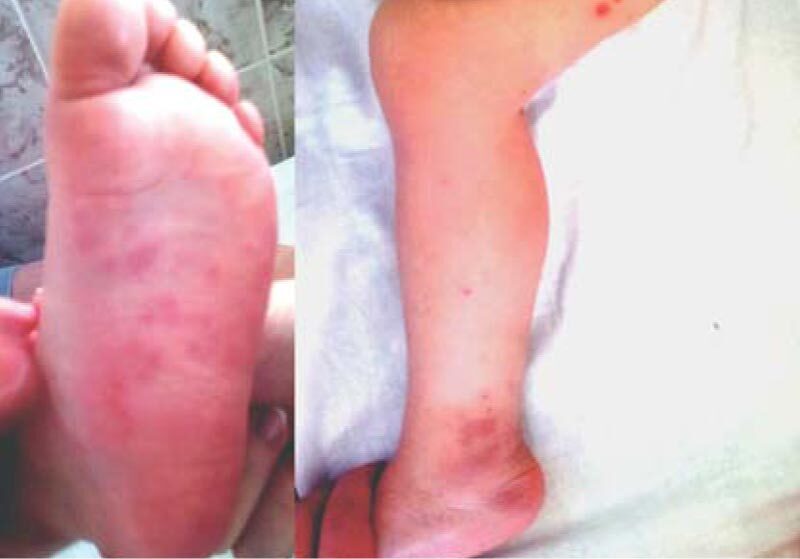 Рис. 10. Васкулит при мегаловирусной инфекции в сочетании с инфекцией, вызванной вирусом Эпштейна-Барр
Рис. 10. Васкулит при мегаловирусной инфекции в сочетании с инфекцией, вызванной вирусом Эпштейна-Барр
Кольцевидную эритему диагностировали у 2 больных, а у 1 – кольцевидную гранулему. У этих пациентов выявлено 6 антигенов микоплазм и 4 маркера ГВИ, т. е. на 1 больного в среднем – более 3 патогенов (рис. 11, табл. 3).
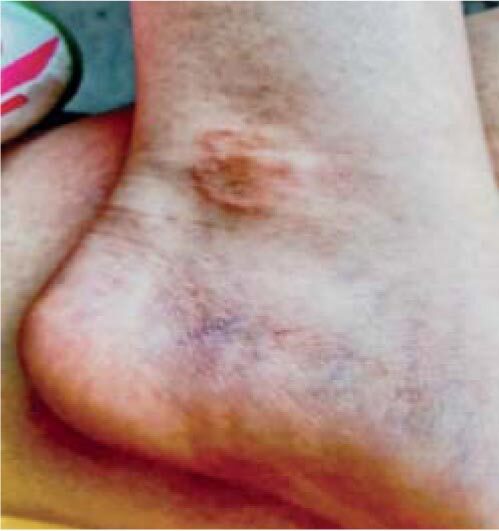 Рис. 11. Кольцевидная гранулема у больного с сочетанной микоплазменной и герпесвирусной инфекцией
Рис. 11. Кольцевидная гранулема у больного с сочетанной микоплазменной и герпесвирусной инфекцией
Узловатая эритема имела место у 2 детей, у которых обнаружено 2 антигена микоплазм и 3 маркера ГВИ, что в среднем составило более 2 патогенов на 1 больного.
Многоформная экссудативная эритема диагностирована у 4 больных, у которых выявлено 3 антигена микоплазм и 5 маркеров ГВИ, в среднем на 1 больного – 2 патогена (рис. 12, табл. 3).
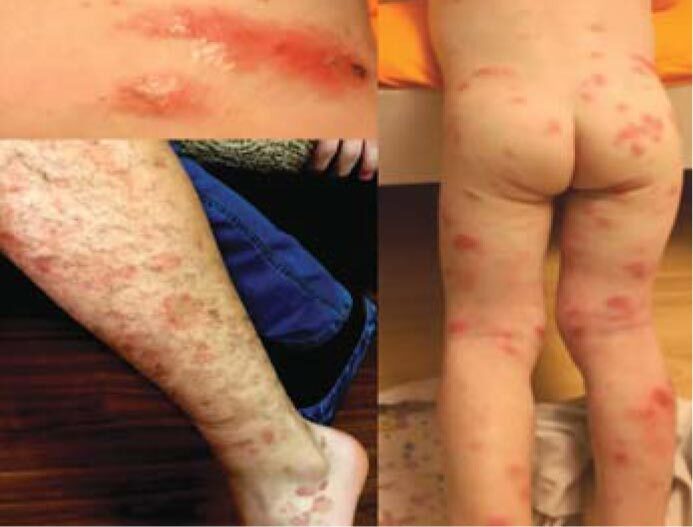 Рис. 12. Многоформная экссудативная эритема
Рис. 12. Многоформная экссудативная эритема
Синдром Стивенса-Джонсона имел место у 4 больных, из них у 1 больного – с исходом в токсический эпидермальный некролиз в области нижних конечностей. У этих пациентов обнаружено 7 антигенов микоплазм и 7 маркеров ГВИ, в среднем – более 4 патогенов на 1 больного (рис. 13-15, табл. 3).
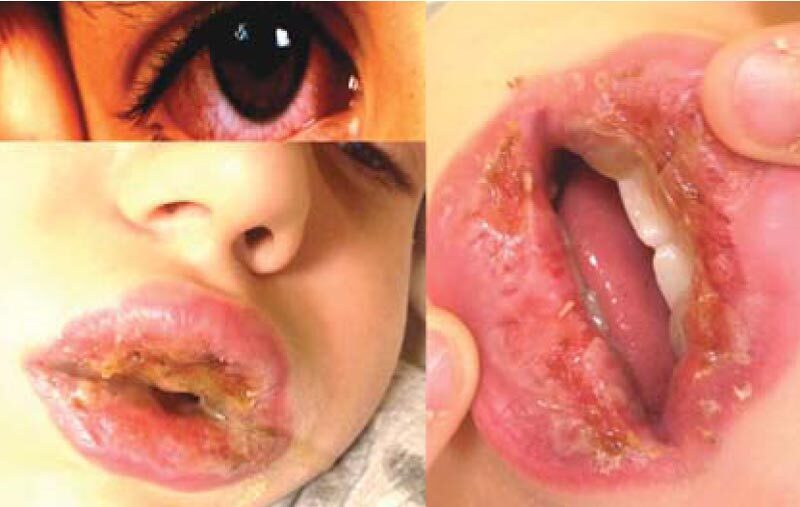 Рис. 13. Мукозит слизистой оболочки глаз и ротовой полости при синдроме Стивенса-Джонсона
Рис. 13. Мукозит слизистой оболочки глаз и ротовой полости при синдроме Стивенса-Джонсона
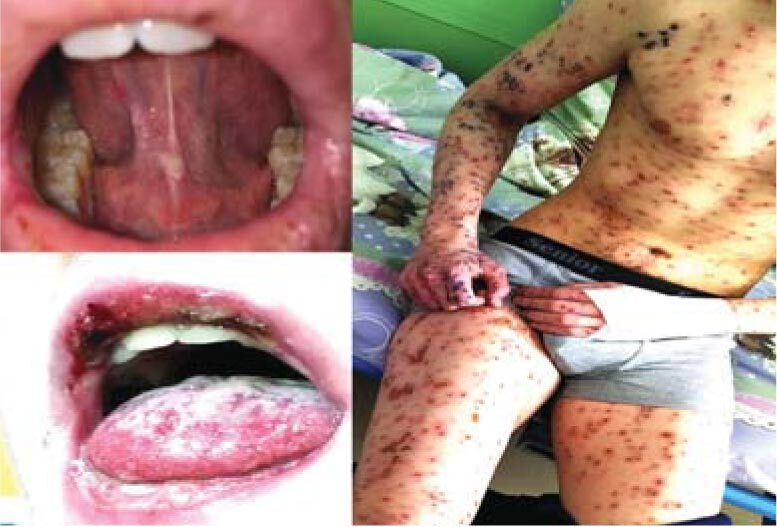 Рис. 14. Мукозит ротовой полости и геморрагически-везикулезный дерматит при синдроме Стивенса-Джонсона
Рис. 14. Мукозит ротовой полости и геморрагически-везикулезный дерматит при синдроме Стивенса-Джонсона
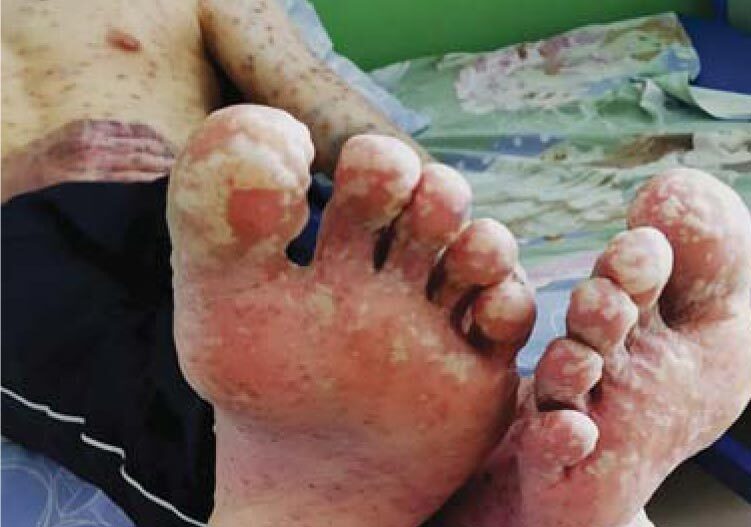 Рис. 15. Токсический эпидермальный некролиз
Рис. 15. Токсический эпидермальный некролиз
У пациентов с кожными поражениями наблюдалось снижение спонтанной продукции интерферона-α и фагоцитарного индекса нейтрофилов.
Заключение
Следует отметить рост числа штаммов, резистентных к макролидам, что способствует более широкому распространению персистирующих вариантов микоплазмоза, нарастанию количества случаев осложненного течения микоплазмоза с развитием внереспираторных поражений различных органов и систем. Среди внереспираторных поражений педиатры довольно часто регистрируют поражения кожи, которые в прежние годы чаще расценивались дерматологами и аллергологами как аллергодерматозы. На основании полученных нами данных можно предполагать, что развивающийся васкулит является основным звеном патогенеза при микоплазмозе и особенно усугубляется при сочетании с ГВИ. Внереспираторные поражения при микоплазмозе, сочетающемся с ГВИ, у детей являются актуальной междисциплинарной проблемой, но до настоящего времени недостаточно изученной и редко освещаемой в отечественной литературе, особенно это касается разнообразных кожных поражений. Это диктует необходимость углубленных исследований и комплексного междисциплинарного подхода к дифференциальной диагностике, лабораторному тестированию, а также оптимизации терапии с участием инфекциониста, иммунолога, окулиста и дерматолога. Важен поиск оптимальных схем рациональной комплексной терапии с применением препаратов разнонаправленного действия: этиотропных, иммунокорригирующих, усиливающих фагоцитарную активность клеток системы мононуклеарных фагоцитов-СМФ (система мононуклеарных фагоцитов), нейтрофилов, нормализующих функциональное состояние Т-клеточного звена иммунитета и интерфероновый статус.
Литература
- Государственный доклад «О состоянии санитарноэпидемиологического благополучия населения в Российской Федерации в 2018 г.». С. 120. https://gosudarstvennyy-doklad-o-sostoyanii-sanitarno_epidemiologicheskogo-blagopoluchiya-naseleniya-v-rossiyskoy-federatsii-v-2018-godu.pdf
- Центнер И.С., Черепова Н.Х, Антипина Н.В. «Рецидивирующий обструктивный бронхит или бронхиальная астма?» Катамнез детей, перенесших рецидивирующий обструктивный синдром в раннем возрасте // Вестник Челябинской областной клинической больницы. 2016. № 2 (32). С. 55-60.
- Reichert-Penetrat S., Barbaud A., Antunes A. et al. An unusual form of Stevens – Johnson syndrome with subcorneal pustules associated with Mycoplasma pneumoniae infection // Pediatric Dermatology. 2000. Vol. 17. No. 3. P. 202-204. DOI: 10.1046/j.1525-1470.2000.01752.x.
- Харламова Ф.С., Шамшева О.В., Воробьева Д.А. и др. Микоплазмоз – триггер в формировании соматической патологии у детей // Лечащий врач. 2016. № 9. С. 68-74.
- Чернов В.М., Чернова О.А., Санчес-Вега Х.Т. и др. Микоплазменные контаминации клеточных культур: везикулярный трафик у бактерий и проблема контроля инфектогенов // Acta Naturae. 2014. № 3(22). С. 43-54.
- Waites K.B., Talkington D.F. Mycoplasma pneumoniae and its role as a human pathogen // Clinical Microbiology Reviews. 2004. Vol. 17. No. 4. P. 697-728.
- Попова Н.В., Деев И.Е., Петренко А.Г. Клатрин-зависимый эндоцитоз и белки-адаптеры // Acta Naturae. 2013. Т. 5. № 3(48). С. 66-77.
- Mikerov A.N. Role of the surfactant protein A in the lung immune defense // Fundamental Research. 2012. No. 2. P. 204-207.
- Shimizu T., Kimura Y., Kida Y. et al. Cytadherence of Mycoplasma pneumoniae induces inflammatory responses through autophagy and toll-like receptor 4 // Infection and Immunity. 2014. Vol. 82. No. 7. P. 3076-3086. DOI: 10.1128/IAI.01961-14.

