Тразимера - инструкция по применению
См. откуда получены инструкции МЕДИ РУ
Регистрационный номер:
ЛП-005920Торговое наименование препарата:
Тразимера®
Международное непатентованное наименование:
трастузумаб
Лекарственная форма:
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий
Состав
1. Один флакон с лиофилизатом 150 мг содержит:
действующее вещество: трастузумаб – 150 мг;
вспомогательные вещества: L-гистидин – 2,8 мг; L-гистидина гидрохлорид моногидрат – 3,4 мг; полисорбат 20 – 0,6 мг; сахароза – 138,0 мг.
2. Один флакон с лиофилизатом 440 мг содержит:
действующее вещество: трастузумаб – 440 мг;
вспомогательные вещества: L-гистидин – 8,3 мг; L-гистидина гидрохлорид моногидрат – 10,0 мг; полисорбат 20 – 1,8 мг; сахароза – 405,0 мг.
Растворитель (бактериостатическая вода для инъекций 20 мл, содержащая 1,1% бензилового спирта в качестве антимикробного консерванта): бензиловый спирт – 220,0 мг; вода для инъекций – 20,0 мл.
Описание
Лиофилизированная масса белого цвета.
Фармакотерапевтическая группа:
Противоопухолевое средство – моноклональные антитела.
Код АТХ
L01XC03
Фармакологические свойства
Фармакодинамика
Трастузумаб представляет собой рекомбинантные гуманизированные моноклональные антитела, которые избирательно взаимодействуют с внеклеточным доменом рецепторов эпидермального фактора роста человека 2 типа (HER2). Эти антитела представляют собой IgG1, состоящие из человеческих регионов (константные участки тяжелых цепей) и определяющих комплементарность мышиных участков антитела р185 HER2 к HER2.
Прото-онкоген HER2 или c-erВ2 кодирует трансмембранный рецептороподобный белок с молекулярной массой 185 кДа, который структурно подобен другим членам семейства рецепторов эпидермального фактора роста. Гиперэкспрессия HER2 обнаруживается в ткани первичного рака молочной железы (РМЖ) у 15-20% пациентов.
Общая частота выявления HER2-положительного статуса в ткани распространенного рака желудка при скрининге пациентов составила 15% ИГХ (метод иммуно-гистохимической реакции) 3+ и ИГХ2+/FISH+ (метод гибридизации in situ) или 22,1% при применении более широкого определения ИГХЗ+ или FISH+. Амплификация гена HER2 приводит к гиперэкспрессии белка HER2 на мембране клеток опухоли, что в свою очередь вызывает постоянную активацию рецептора HER2. Внеклеточный домен рецептора (ECD, р105) может попадать («слущиваться») в кровоток и определяться в образцах сыворотки крови.
Исследования показывают, что пациенты с раком молочной железы, у которых отмечена амплификация или гиперэкспрессия HER2 в ткани опухоли, обладают меньшей выживаемостью без признаков заболевания по сравнению с пациентами без амплификации или гиперэкспрессии HER2 в ткани опухоли.
Трастузумаб блокирует пролиферацию опухолевых клеток человека с гиперэкспрессией HER2 in vivo и in vitro. In vitro антитело-зависимая клеточная цитотоксичность трастузумаба преимущественно направлена на опухолевые клетки с гиперэкспрессией НER2.
Иммуногенность
В исследовании неоадъювантной-адъювантной терапии раннего рака молочной железы (медиана последующего наблюдения >70 месяцев) у 10,1% пациентов, получавших препарат трастузумаб внутривенно, появились антитела к нему. Нейтрализующие антитела к трастузумабу были выявлены, по сравнению с исходным уровнем, у 2 из 30 пациентов, получавших препарат внутривенно.
Клиническая значимость этих антител неизвестна. Данные антитела не оказывали влияния на фармакокинетику, эффективность (определяемую по полному патологическому ответу и выживаемости без событий) и безопасность (определяемую по частоте инфузионных реакций) трастузумаба при внутривенном введении. Данные по иммуногенности при применении препарата Тразимера® для лечения рака желудка отсутствуют.
Фармакокинетика
Фармакокинетика трастузумаба оценивалась на основании популяционного фармакокинетического анализа с использованием двухкамерной модели с параллельным линейным и нелинейным выведением из центральной камеры. Благодаря нелинейному выведению уменьшение концентрации препарата сопровождалось увеличением общего клиренса. Линейный клиренс составил 0,127 л/день у пациентов с раком молочной железы (метастатический рак молочный железы (мРМЖ) и ранний рак молочной железы (рРМЖ)) и 0,176 л/день у пациентов с распространенным раком желудка. Значения нелинейных параметров выведения по модели Михаэлиса-Ментен составили 8,81 мг/день для максимальной скорости выведения (Vmax) и 8,92 мг/л для константы Михаэлиса-Ментен (Кm). Объем распределения в центральной камере составил 2,62 л у пациентов с РМЖ и 3,63 л у пациентов с распространенным раком желудка.
Рассчитанные с помощью популяционного анализа значения экспозиции препарата (5й-95й перцентили) и значения фармакокинетических параметров при клинически значимых концентрациях (максимальная концентрация (Сmax) и минимальная концентрация (Cmin)) у пациентов с РМЖ и распространенным раком желудка (РРЖ) при применении препарата еженедельно и каждые 3 недели представлены в таблицах 1 и 2 (в равновесном состоянии).
Таблица 1. Рассчитанные значения популяционных фармакокинетических показателей экспозиции в цикле 1 при внутривенном введении у пациентов с РМЖ и РРЖ (5й-95йперцентили).
| Режим дозирования |
Тип опухоли |
N – число пациентов |
Cmin (мкг/мл) |
Сmax (мкг/мл) |
AUC* (мкг.день/мл) |
| 8 мг/кг + 6 мг/кг 1 раз в 3 недели | мРМЖ/ рРМЖ | 1195 | 29,4 (5,8-59,5) |
178 (117-291) |
1373 (736-2245) |
| РРЖ | 274 | 23,1 (6,1-50,3) |
132 (84,2-225) |
1109 (588-1938) |
|
| 4 мг/кг + 2 мг/кг 1 раз в неделю | мРМЖ/ рРМЖ | 1195 | 37,7 (12,3-70,9) |
88,3 (58-144) |
1066 (586-1754) |
*AUC – площадь под кривой «концентрация-время»
Таблица 2. Рассчитанные значения популяционных фармакокинетических показателей экспозиции в равновесном состоянии для режимов дозирования препарата Тразимера® при внутривенном введении у пациентов с РМЖ и РРЖ (5й – 95й перцентили).
| Режим дозирования |
Тип опухоли |
N – число пациентов |
Cmin,ss (мкг/мл) |
Cmax,ss (мкг/мл) |
AUC** (мкг.день/ мл) |
Время до достижения равновесного состояния (недели) | Диапазон значений общего клиренса в равновесном состоянии (л/день) |
| 8 мг/кг + 6 мг/кг 1 раз в 3 недели | мРМЖ/рРМЖ | 1195 | 47,4 (5-115) |
179 (107-309) |
1794 (673-3618) |
12 | 0,173- 0,283 |
| РРЖ | 274 | 32,9 (6,1-88,9) |
131 (72,5-251) |
1338 (557-2875) |
9 | 0,189- 0,337 |
|
| 4 мг/кг + 2 мг/кг 1 раз в неделю | мРМЖ/рРМЖ | 1195 | 66,1 (14,9-142) |
109 (51,0-209) |
1765 (647-3578) |
12 | 0,201- 0,244 |
Отмывочный период (washout time period) трастузумаба после внутривенного введения оценивался с помощью популяционного фармакокинетического моделирования. По крайней мере, у 95% пациентов концентрация трастузумаба в сыворотке крови достигает значения <1 мкг/мл (что составляет около 3% от рассчитанной минимальной концентрации в равновесном состоянии (Cmin,ss) или выведению 97% препарата) через 7 месяцев после приема последней дозы.
Циркулирующий «слущивающийся» внеклеточный домен рецептора HER2-(HER2-ECD)
Результаты поискового анализа ковариант на основании информации в подгруппах пациентов позволяют предполагать, что у пациентов с высокой концентрацией «слущивающегося» рецептора HER2-ECD в плазме крови клиренс трастузумаба выше (более низкий показатель Кm). Наблюдалась корреляция между «слущивающимся» с клетки антигеном и активностью сывороточной глутамат оксалоацетат трансаминазы (СГОТ)/ аспартатаминотрансферазы (ACT); воздействие «слущивающегося» с клетки антигена на клиренс может частично объясняться активностью СГОТ/АСТ.
Исходные концентрации «слущивающегося» HER2-ECD, наблюдавшиеся у пациентов с метастатическим раком желудка, были сопоставимы с таковыми у пациентов с метастатическим и ранним раком молочной железы; явного влияния на клиренс трастузумаба не отмечалось.
Фармакокинетика у особых групп пациентов
Подробные фармакокинетические исследования у пациентов пожилого возраста и пациентов с почечной или печеночной недостаточностью не проводились.
Пожилой возраст
Возраст не влияет на распределение трастузумаба.
Почечная недостаточность
По данным популяционного фармакокинетического анализа почечная недостаточность не влияет на фармакокинетические параметры (клиренс) трастузумаба.
Показания
Рак молочной железы
Метастатический рак молочной железы с опухолевой гиперэкспрессией HER2:
- в виде монотерапии, после одной или более схем химиотерапии;
- в комбинации с паклитакселом или доцетакселом, в случае отсутствия предшествующей химиотерапии (первая линия терапии);
- в комбинации с ингибиторами ароматазы при положительных гормональных рецепторах (эстрогеновых и/или прогестероновых) у женщин в постменопаузе.
Ранние стадии рака молочной железы с опухолевой гиперэкспрессией HER2:
- в виде адъювантной терапии после проведения хирургического вмешательства, завершения химиотерапии (неоадъюваитиой или адъювантной) и лучевой терапии;
- в комбинации с паклитакселом или доцетакселом после адъювантной химиотерапии доксорубицином и циклофосфамидом;
- в комбинации с адъювантной химиотерапией, состоящей из доцетаксела и карбоплатина;
- в комбинации с неоадъювантной химиотерапией и последующей адъювантной монотерапией препаратом Тразимера®, при местно-распространенном (включая воспалительную форму) заболевании или в случаях, когда размер опухоли превышает 2 см в диаметре.
Распространенный рак желудка
Распространенная аденокарцинома желудка или пищеводно-желудочного перехода с опухолевой гиперэкспрессией HER2:
- в комбинации с капецитабином или внутривенным введением фторурацила и препаратом платины в случае отсутствия предшествующей противоопухолевой терапии по поводу метастатической болезни.
Противопоказания
- Повышенная чувствительность к трастузумабу, любому компоненту препарата, в т.ч. к бензиловому спирту, содержащемуся в качестве консерванта в бактериостатической воде для инъекций, прилагающейся к каждому многодозовому флакону 440 мг, или белку мыши.
- Беременность и период грудного вскармливания.
- Детский возраст до 18 лет (эффективность и безопасность применения у детей не установлены).
- Тяжелая одышка в покое, вызванная метастазами в легкие, или требующая поддерживающей терапии кислородом.
- Больные на ранних стадиях РМЖ с инфарктом миокарда в анамнезе, стенокардией, требующей лечения, застойной сердечной недостаточностью (II-IV функциональный класс по NYHA), ФВЛЖ <55%, кардиомиопатией, аритмией, клинически значимыми пороками сердца, неконтролируемой артериальной гипертензией, гемодинамически значимым перикардиальным выпотом (эффективность и безопасность препарата у данных групп пациентов не изучены); одновременное применение препарата с антрациклинами в составе адъювантной терапии у пациентов с ранними стадиями РМЖ.
С осторожностью
Ишемическая болезнь сердца, артериальная гипертензия, сердечная недостаточность, сопутствующие заболевания легких или метастазы в легкие, предшествующая терапия кардиотоксичными лекарственными средствами, в т.ч. антрациклинами/циклофосфамидом, фракция выброса левого желудочка (ФВЛЖ) <50%, пожилой возраст.
Применение во время беременности и в период грудного вскармливания
Фертильность
Неизвестно, влияет ли препарат Тразимера® на репродуктивную способность. Результаты исследований у животных не выявили признаков нарушения фертильности или негативного влияния на плод.
Контрацепция
Женщинам детородного возраста во время лечения препаратом Тразимера® и в течение 7 месяцев после окончания лечения необходимо использовать надежные методы контрацепции.
Беременность
В случае наступления беременности во время лечения или в течение 7 месяцев после последней дозы препарата необходимо предупредить женщину о возможности вредного воздействия на плод. Если беременная продолжит получать терапию препаратом Тразимера®, то она должна находиться под тщательным наблюдением врачей разных специальностей (см. также раздел «Противопоказания»).
Период грудного вскармливания
Вскармливание грудным молоком не рекомендуется во время лечения и в течение 7 месяцев после окончания терапии препаратом Тразимера® (см. также раздел «Противопоказания»).
Способ применения и дозы
Тестирование на опухолевую экспрессию HER2 до начала лечения препаратом Тразимера® является обязательным.
Препарат Тразимера® должен вводиться квалифицированным медицинским персоналом. Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Препарат Тразимера® вводят только внутривенно капельно!
Вводить препарат внутривенно струйно или болюсно нельзя!
Внимание!
Препарат Тразимера® не совместим с 5% раствором декстрозы из-за возможности агрегации белка. Также препарат Тразимера® нельзя смешивать или разводить вместе с другими лекарственными препаратами.
Раствор препарата Тразимера® совместим с инфузионными пакетами, изготовленными из поливинилхлорида, полиэтилена и полипропилена.
Приготовление раствора
Подготовка препарата к введению должна проводиться в асептических условиях.
Инструкция по приготовлению концентрата, флаконы 150 мг
Содержимое флакона с препаратом Тразимера® растворяют в 7,2 мл стерильной воды для инъекций. В результате получается концентрат раствора, содержащий 21 мг трастузумаба в 1 мл и имеющий pH 6,0.
Во время растворения следует аккуратно обращаться с препаратом. При растворении следует избегать избыточного ценообразования, последнее может затруднить набор нужной дозы препарата из флакона.
1. Стерильным шприцем медленно ввести 7,2 мл стерильной воды для инъекций во флакон с 150 мг препарата Тразимера®, направляя струю жидкости прямо на лиофилизат.
2. Для растворения аккуратно покачать флакон вращательными движениями.
Не встряхивать!
При растворении препарата нередко образуется небольшое количество пены. Во избежание этого необходимо дать раствору постоять около 5 минут. Восстановленный раствор – прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета.
Концентрат раствора препарата Тразимера® не содержит консервант и поэтому должен использоваться сразу после приготовления. При необходимости концентрат может храниться не более 24 часов при температуре от 2 до 8 °С и должен быть утилизирован по истечении этого времени. Не замораживать!
Инструкция но приготовлению концентрата, флаконы 440 мг
Содержимое флакона с препаратом Тразимера® растворяют в 20 мл поставляемой вместе с препаратом бактериостатической воды для инъекций, содержащей 1,1% бензилового спирта в качестве антимикробного консерванта. В результате получается концентрат раствора, пригодный для многократного использования, содержащий 21 мг трастузумаба в 1 мл и имеющий pH 6,0.
Во время растворения следует аккуратно обращаться с препаратом. При растворении следует избегать избыточного пенообразования, последнее может затруднить набор нужной дозы препарата из флакона.
1. Стерильным шприцем медленно ввести 20 мл бактериостатической воды для инъекций во флакон с 440 мг препарата Тразимера®, направляя струю жидкости прямо на лиофилизат.
2. Для растворения аккуратно покачать флакон вращательными движениями.
Не встряхивать!
При растворении препарата нередко образуется небольшое количество пены. Во избежание этого необходимо дать раствору постоять около 5 минут. Восстановленный раствор – прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета.
Концентрат раствора препарата Тразимера®, приготовленный на бактериостатической воде для инъекций, стабилен в течение 28 дней при температуре от 2 до 8°С. Приготовленный концентрат содержит консервант и поэтому может использоваться многократно. Через 28 дней неиспользованный остаток концентрата следует утилизировать. Не замораживать! В качестве растворителя препарата Тразимера® 440 мг допускается использование стерильной воды для инъекций (без консерванта). Применения других растворителей следует избегать. В случае использования в качестве растворителя стерильной воды для инъекций, концентрат физически и химически стабилен только в течение 24 часов при температуре от 2 до 8°С и должен быть утилизирован по истечении этого времени. Не замораживать!
Инструкция по приготовлению раствора для инфузии
Определить объем раствора:
- необходимый для введения нагрузочной дозы трастузумаба, равной 4 мг/кг массы тела, или поддерживающей дозы, равной 2 мг/кг, определяется по следующей формуле:
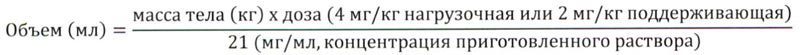
- необходимый для введения нагрузочной дозы трастузумаба, равной 8 мг/кг массы тела, или поддерживающей дозы, равной 6 мг/кг каждые 3 недели, определяется по следующей формуле:
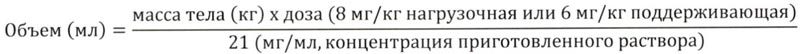
Из флакона с приготовленным концентратом следует набрать соответствующий объем и ввести его в инфузионный пакет с 250 мл 0,9% раствора натрия хлорида. Затем инфузионный пакет следует осторожно перевернуть для перемешивания раствора, избегая пенообразования. Перед введением раствор следует проверить (визуально) на предмет отсутствия механических примесей и изменения окраски. Раствор для инфузий вводят сразу после его приготовления.
В исключительных случаях приготовленный раствор для инфузий может храниться не более 24 часов при температуре от 2 до 8°С, если растворение концентрата и приготовление раствора для инфузий происходило в контролированных и валидированных асептических условиях. При этом за условия хранения (правила хранения и продолжительность) отвечает специалист, готовивший раствор.
Инструкции по утилизации неиспользованного препарата или с истекшим сроком годности
Попадание лекарственного препарата в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Необходимо строго соблюдать следующие рекомендации по использованию и утилизации шприцев и расходных материалов.
Иглы и шприцы нельзя использовать повторно. Использованные иглы и шприцы помещают в защищенный от проколов контейнер (емкость). Утилизацию препарата Тразимера® и расходных материалов следует проводить в соответствии с местными требованиями.
Стандартный режим дозирования
Во время каждого введения трастузумаба необходимо тщательно наблюдать за пациентом на предмет появления озноба, лихорадки и других инфузионных реакций (в течение 6 ч после начала первой инфузии и в течение 2 ч после начала последующих инфузий). Следует уменьшить скорость инфузии или на время прекратить введение препарата при развитии инфузионной реакции. После исчезновения симптомов инфузионных реакций легкой и умеренной степени тяжести согласно NCI-CTC (общие критерии токсичности Национального института рака в США) возможно возобновление инфузии. В случае развития тяжелых или жизнеугрожающих инфузионных реакций следует рассмотреть вопрос о прекращении дальнейшей терапии препаратом Тразимера®.
Метастатический рак молочной железы
Еженедельное введение
Нагрузочная доза: 4 мг/кг массы тела в виде 90-минутной внутривенной капельной инфузии.
Поддерживающая доза: 2 мг/кг массы тела один раз в неделю. Поддерживающая доза вводится через 1 неделю после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии.
Альтернативное введение – через 3 недели
Нагрузочная доза: 8 мг/кг массы тела в виде 90-минутной внутривенной капельной инфузии.
Поддерживающая доза: 6 мг/кг массы тела каждые 3 недели. Поддерживающая доза вводится через 3 недели после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии.
Применение в комбинации с паклитакселом или доцетакселом
Паклитаксел или доцетаксел вводились на следующий день после введения трастузумаба (рекомендации по дозированию см. в соответствующих инструкциях по медицинскому применению) или сразу же после последующего введения препарата трастузумаб, если при предшествовавшем введении препарат трастузумаб переносился хорошо.
Применение в комбинации с ингибитором ароматазы
Трастузумаб и анастрозол вводились в день 1. Ограничений по времени введения трастузумаба и анастрозола не было (рекомендации по дозированию см. в инструкции по медицинскому применению анастрозола или других ингибиторов ароматазы).
Ранние стадии рака молочной железы
Еженедельное введение
При еженедельном введении препарат Тразимера® вводится в нагрузочной дозе 4 мг/кг массы тела, далее в поддерживающей 2 мг/кг массы тела один раз в неделю. Поддерживающая доза вводится через 1 неделю после нагрузочной. Нагрузочная доза вводится в виде 90-минутной внутривенной капельной инфузии. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии.
Введение через 3 недели
При введении через 3 недели нагрузочная доза: 8 мг/кг массы тела (в виде 90-минутной внутривенной капельной инфузии).
Поддерживающая доза: 6 мг/кг массы тела каждые 3 недели. Поддерживающая доза вводится через 3 недели после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии. Применение трастузумаба при ранних стадиях рака молочной железы изучено в комбинации с химиотерапией согласно схемам, описанным ниже:
Применение в комбинации с паклитакселом или доцетакселом после химиотерапии доксорубицином и циклофосфамидом
Паклитаксел:
80 мг/м² в виде длительной внутривенной (в/в) инфузии, еженедельно, в течение 12 недель или 175 мг/м² в виде длительной в/в инфузии, каждые 3 недели в течение 4 циклов (в день 1 каждого цикла).
Доцетаксел:
100 мг/м² в виде в/в инфузии в течение 1 ч, каждые 3 недели, в течение 4 циклов (начиная в день 2 в цикле 1, далее в день 1 в каждый последующий цикл).
Трастузумаб:
начиная с первой дозы паклитаксела или доцетаксела, трастузумаб вводился согласно еженедельной схеме во время химиотерапии (нагрузочная доза 4 мг/кг, далее в поддерживающей дозе 2 мг/кг каждую неделю).
В дальнейшем монотерапия трастузумабом продолжалась согласно еженедельной схеме после применения в комбинации с паклитакселом или согласно введению через 3 недели после применения в комбинации с доцетакселом. Общая продолжительность терапии трастузумабом от момента первого введения составила 1 год, независимо от количества полученных или пропущенных доз. Если паклитаксел или доцетаксел и трастузумаб должны были вводиться в один день, то паклитаксел или доцетаксел вводился первым.
Применение в комбинации с доцетакселом и карбоплатином
Доцетаксел/Карбоплатин (каждые 3 недели в течение 6 циклов, начиная со дня 2 первого цикла, далее в день 1 в каждый последующий цикл): доцетаксел в дозе 75 мг/м² в виде в/в инфузии в течение 1 ч, за которым следовал карбоплатин в дозе для достижения целевой AUC – 6 мг/мл/мин, в виде в/в инфузии, в течение 30-60 мин.
Трастузумаб:
Трастузумаб совместно с химиотерапией вводился согласно еженедельной схеме (нагрузочная доза 4 мг/кг, далее в поддерживающей дозе 2 мг/кг каждую неделю). После химиотерапии монотерапия препаратом трастузумаб продолжалась согласно введению через 3 недели. Общая продолжительность терапии препаратом трастузумаб от момента первого введения составила 1 год, независимо от количества полученных или пропущенных доз. Если доцетаксел, карбоплатин и препарат трастузумаб должны были вводиться в один день, то первым вводился доцетаксел, за которым следовал карбоплатин, далее трастузумаб.
Неоадъювантная/адъювантная терапия
Трастузумаб вводился согласно режиму каждые 3 недели в комбинации с неоадъювантной химиотерапией (10 циклов):
доксорубицин 60 мг/м² и паклитаксел 150 мг/м², каждые 3 недели, в течение 3 циклов; далее паклитаксел 175 мг/м², каждые 3 недели, в течение 4 циклов;
далее циклофосфамид, метотрексат и фторурацил в день 1 и 8, каждые 4 недели, в течение 3 циклов.
После проведения оперативного вмешательства адъювантная монотерапия трастузумабом продолжалась согласно режиму каждые 3 недели. Общая продолжительность терапии трастузумабом составила 1 год.
Распространенный рак желудка
Введение через 3 недели
Нагрузочная доза: 8 мг/кг массы тела в виде 90-минутной внутривенной капельной инфузии.
Поддерживающая доза: 6 мг/кг массы тела каждые 3 недели. Поддерживающая доза вводится через 3 недели после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии.
Метастатический и ранние стадии РМЖ и распространенный рак желудка
Продолжительность теpanии
Лечение препаратом Тразимера® у пациентов с метастатическим РМЖ или распространенным раком желудка проводится до прогрессирования заболевания или развития неприемлемой токсичности. Пациенты с ранними стадиями РМЖ должны получать терапию препаратом Тразимера® в течение 1 года или до рецидива заболевания или развития неприемлемой токсичности (в зависимости от того, что произойдет быстрее). Лечение препаратом Тразимера® пациентов с ранними стадиями РМЖ свыше одного года не рекомендуется.
Пропуск в плановом введении
Если пропуск в плановом введении препарата Тразимера® составил 7 дней или менее, следует как можно быстрее ввести препарат в обычной поддерживающей дозе (еженедельный режим: 2 мг/кг массы тела; режим каждые 3 недели: 6 мг/кг массы тела), не ожидая следующего планового введения. Далее вводить препарат в поддерживающей дозе через 7 дней или 21 день в соответствии с еженедельным режимом или режимом каждые 3 недели, соответственно.
Если перерыв во введении препарата составил более 7 дней, необходимо как можно быстрее снова ввести нагрузочную дозу трастузумаба (еженедельный режим: 4 мг/кг массы тела; режим каждые 3 недели: 8 мг/кг массы тела) в виде 90-минутной внутривенной капельной инфузии. Затем продолжить введение препарата в поддерживающей дозе через 7 дней или 21 день в соответствии с еженедельным режимом или режимом каждые 3 недели, соответственно.
Коррекция дозы
В период возникновения обратимой миелосупрессии, вызванной химиотерапией, курс терапии препаратом Тразимера® может быть продолжен после снижения дозы химиотерапии или временной ее отмены (согласно соответствующим рекомендациям в инструкциях по применению паклитаксела, доцетаксела или ингибитора ароматазы), при условии тщательного контроля осложнений, обусловленных нейтропенией.
При снижении фракции выброса левого желудочка (ФВЛЖ, в%) на ≥10 единиц от исходной и ниже значения 50% лечение должно быть приостановлено. Повторная оценка ФВЛЖ должна быть проведена приблизительно через 3 недели. При отсутствии улучшения показателя ФВЛЖ или его дальнейшем снижении, или при появлении симптомов застойной сердечной недостаточности (ЗСП) необходимо рассмотреть вопрос о прекращении лечения препаратом Тразимера®, если только польза для конкретного пациента не превосходит риски. Все эти пациенты должны быть направлены к кардиологу для проведения обследования и находиться под наблюдением.
Особые указания по дозированию
Пациенты пожилого возраста
Снижение дозы препарата Тразимера® у пациентов ≥65 лет не требуется.
Пациенты с почечной недостаточностью
Изменение дозы препарата Тразимера® у пациентов с легкой и средней степенью нарушения функции ночек не требуется. В связи с ограниченными данными дать рекомендации по дозированию препарата у пациентов с тяжелой степенью нарушения функции почек не представляется возможным.
Пациенты с печеночной недостаточностью
В связи с отсутствием данных дать рекомендации по дозированию препарата у пациентов с нарушением функции печени не представляется возможным.
Побочное действие
В настоящее время наиболее серьезными и/или частыми нежелательными реакциями, о которых сообщалось при использовании трастузумаба, являются: дисфункция сердца, инфузионные реакции, гематотоксичность (в частности нейтропения), инфекции и нарушения со стороны легких.
Для описания частоты нежелательных реакций в данном разделе используется следующая классификация: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), неизвестно (не может быть вычислена на основе имеющихся данных). В рамках каждой группы нежелательные реакции представлены в соответствии со снижением серьезности.
Ниже представлены нежелательные реакции, о которых сообщалось при применении трастузумаба как в монотерапии, так и в комбинации с химиотерапией в базовых клинических исследованиях и при постмаркетинговом использовании. Частота указана в соответствии с максимально встречавшейся в базовых клинических исследованиях.
Инфекционные и паразитарные заболевания: очень часто – инфекции, назофарингит; часто – нейтропенический сепсис, цистит, Herpes zoster, грипп, синусит, инфекции кожи, ринит, инфекции верхних дыхательных путей, инфекции мочевыводящих путей, рожа, флегмона, фарингит; нечасто – сепсис.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): неизвестно – прогрессирование злокачественного новообразования, прогрессирование новообразования:
Нарушения со стороны крови и лимфатической системы: очень часто – фебрильная нейтропения, анемия, нейтропения, лейкопения, тромбоцитопения; неизвестно – гипопротромбинемия, иммунная тромбоцитопения.
Нарушения со стороны иммунной системы: часто – реакции гиперчувствительности; неизвестно – анафилактические реакции†, анафилактический шок†.
Нарушения со стороны обмена веществ: очень часто – снижение массы тела, анорексия; неизвестно – гиперкалиемия.
Нарушения психики: очень часто – бессонница; часто – тревога, депрессия, нарушение мышления.
Нарушения со стороны нервной системы: очень часто – тремор1, головокружение, головные боли, парестезии, дисгевзия (искажение вкусовых восприятий); часто – периферическая нейропатия, мышечный гипертонус, сонливость, атаксия; редко – парез; неизвестно – отек мозга.
Нарушения со стороны органа зрения: очень часто – конъюнктивит, повышенное слезоотделение; часто – сухость глаз; неизвестно – отек диска зрительного нерва, кровоизлияние в сетчатку.
Нарушения со стороны органа слуха и лабиринтные нарушения: нечасто – глухота.
Нарушения со стороны сердечно-сосудистой системы: очень часто – снижение и повышение артериального давления (АД)1, нарушение сердечного ритма1, сердцебиение1, трепетание (предсердий или желудочков)1, снижение фракции выброса левого желудочка*, «приливы»; часто – сердечная недостаточность (застойная)†, суправентрикулярная тахиаритмия†1, кардиомиопатия, артериальная гипотензия†1, вазодилатация; нечасто – перикардиальный выпот; неизвестно – кардиогенный шок, перикардит, брадикардия, ритм «галопа».
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто – хрипы в легких†1, одышка†, кашель, носовое кровотечение, ринорея; часто – пневмония†, бронхиальная астма, нарушение функции легких, плевральный выпот†; редко – пневмонит; неизвестно – легочный фиброз†, дыхательная недостаточность†, инфильтрация легких†, острый отек легких†, острый респираторный дистресс-синдром†, бронхоспазм†, гипоксия†, снижение насыщения гемоглобина кислородом†, отек гортани, ортопноэ, отек легкого, интерстициальная болезнь легких.
Нарушения со стороны желудочно-кишечного тракта: очень часто – диарея, рвота, тошнота, отек губ1, боли в животе, диспепсия, запор, стоматит; часто – геморрой, сухость во рту.
Нарушения со стороны печени и желчевыводящих путей: часто – гепатоцеллюлярное повреждение, гепатит, болезненность в области печени; редко – желтуха; неизвестно – печеночная недостаточность.
Нарушения со стороны кожи и подкожных тканей: очень часто – эритема, сыпь, отек лица1, алопеция, нарушение структуры ногтей, ладонно-подошвенный синдром; часто – акне, сухость кожи, экхимоз, гипергидроз, макуло-папулезная сыпь, зуд, онихоклазия, дерматит; нечасто – крапивница; неизвестно – ангионевротический отек.
Нарушения со стороны костно-мышечной и соединительной ткани: очень часто – артралгия, мышечная скованность1, миалгия; часто – артрит, боли в спине, оссалгия, спазмы мышц, боль в области шеи, боли в конечностях.
Нарушения со стороны почек и мочевыводящих путей: часто – заболевание почек; неизвестно – мембранозный гломерулонефрит, гломерулонефропатия, почечная недостаточность.
Беременность, послеродовые и перинатальные состояния: неизвестно – олигогидрамнион, фатальная гипоплазия легких и гипоплазия и/или нарушение функции почек у плода.
Нарушения со стороны половых органов и молочной железы: часто – воспаление молочной железы/мастит.
Общие расстройства и нарушения в месте введения: очень часто – астения, боли в груди, озноб, утомляемость, гриппоподобное заболевание, инфузионные реакции, боли, лихорадка, мукозит, периферические отеки; часто – недомогание, отеки.
Травмы, интоксикации и осложнения манипуляций: часто – ушиб.
† нежелательные реакции, которые в сообщениях ассоциировались с летальным исходом.
1 нежелательные реакции, которые в основном сообщались в связи с инфузионными реакциями. Точное процентное количество не установлено.
* нежелательные реакции наблюдались при комбинированной терапии после антрациклинов и в комбинации с таксанами.
Ниже представлена информация по отдельным нежелательным реакциям.
Дисфункция сердца
Застойная сердечная недостаточность (ЗСН) II-IV функционального класса по NYHA (классификация Нью-Йоркской Ассоциации Кардиологов) является частой нежелательной реакцией при применении препарата Тразимера® и ассоциировалась с фатальным исходом. У пациентов, получавших препарат Тразимера®, наблюдались следующие признаки и симптомы нарушения функции сердца: одышка, ортопноэ, усиление кашля, отек легких, ритм «галопа» или снижение фракции выброса левого желудочка.
В 3 базовых клинических исследованиях применения трастузумаба в комбинации с адъювантной химиотерапией частота сердечной дисфункции 3/4 степени (а именно, симптоматическая застойная сердечная недостаточность) не отличалась от таковой у пациентов, получавших только химиотерапию (т.е. без трастузумаба) и получавших трастузумаб, последовательно, после терапии таксанами (0,3-0,4%). Частота была наибольшей у пациентов, получавших трастузумаб совместно с таксанами (2,0%). Опыт использования трастузумаба в комбинации с низкодозовыми режимами антрациклинов в неоадъювантной терапии ограничен.
При применении трастузумаба в течение одного года после завершения адъювантной химиотерапии, сердечная недостаточность III-IV функционального класса по NYHA наблюдалась у 0,6% пациентов при медиане наблюдения 12 месяцев и у 0,8% пациентов при медиане наблюдения 8 лет. Частота легкой симптоматической и бессимптомной дисфункции левого желудочка составила 4,6%.
Тяжелая ЭСН была обратима в 71,4% случаев (обратимость определялась как минимум двумя последовательными повышениями показателя ФВЛЖ ≥50% после явления). Легкая симптоматическая и бессимптомная дисфункция левого желудочка была обратима в 79,5% случаев. Приблизительно 17% явлений, связанных с дисфункцией сердца, возникли после завершения терапии трастузумабом.
В базовых клинических исследованиях при метастатическом РМЖ частота сердечной дисфункции при внутривенном введении трастузумаба в сочетании с паклитакселом варьировала от 9% до 12% по сравнению с 1%-4% для монотерапии паклитакселом. Для монотерапии трастузумабом частота составила 6%-9%. Наибольшая частота сердечной дисфункции наблюдалась у пациентов, получающих трастузумаб одновременно с анграциклинами/циклофосфамидом (27%), что значительно выше, чем для терапии антрациклинами/циклофосфамидом (7%-10%). В исследовании с проспективным мониторингом функции сердца частота симптоматической ЗСН составила 2,2% у пациентов, получавших трастузумаб и доцетаксел, по сравнению с 0% у пациентов, получавших монотерапию доцетакселом. У большинства пациентов (79%) с сердечной дисфункцией наблюдалось улучшение состояния после получения стандартной терапии ЗСН.
Инфузионные реакции и реакции гиперчувствительности
Подсчитано, что около 40% пациентов, получающих трастузумаб, испытывают инфузионные реакции в той или иной форме. Однако большинство инфузионных реакций являются легкими и умеренными по степени тяжести (согласно NCI-CTC) и имеют тенденцию возникать в начале лечения, т.е. во время 1, 2 и 3-ей инфузий, при последующих введениях возникают реже. Реакции включают в себя следующие симптомы: озноб, лихорадка, одышка, артериальная гипотензия, хрипы в легких, бронхоспазм, тахикардия, снижение насыщения гемоглобина кислородом, респираторный дистресс-синдром, сыпь, тошнота, рвота и головная боль.
Частота инфузионных реакций всех степеней тяжести варьирует и зависит от показания, методологии сбора информации, а также от того вводился ли трастузумаб совместно с химиотерапией или применялся в монотерапии.
Тяжелые анафилактические реакции, требующие немедленных дополнительных медицинских вмешательств, чаще всего могут возникать во время первой или второй инфузий трастузумаба, такие реакции ассоциировались с летальным исходом. В отдельных случаях наблюдались анафилактоидные реакции.
Гематологическая токсичность
Очень часто возникали фебрильная нейтропения, лейкопения, анемия, тромбоцитопения и нейтропения. Частота возникновения гипопротромбинемии неизвестна. Риск нейтропении может быть несколько выше при применении трастузумаба в комбинации с доцетакселом после терапии препаратами антрациклинового ряда.
Нарушения со стороны легких
С применением трастузумаба ассоциируются тяжелые нежелательные явления со стороны легких (в том числе с фатальным исходом). Данные реакции включают в себя (но не ограничиваются): инфильтраты в легких, острый респираторный дистресс-синдром, пневмонию, пневмонит, плевральный выпот, острый отек легких и дыхательную недостаточность.
Передозировка
В клинических исследованиях случаев передозировки препарата не наблюдалось. Введение трастузумаба в разовых дозах более 10 мг/кг не изучалось. Трастузумаб в дозах ≤10 мг/кг переносился хорошо.
Взаимодействие с другими лекарственными средствами
Специальные исследования лекарственных взаимодействий препарата Тразимера® у человека не проводились.
В клинических исследованиях клинически значимых взаимодействий между трастузумабом и одновременно применяемыми препаратами не отмечалось.
В случаях, когда трастузумаб применялся в комбинации с доцетакселом, карбоплатином или анастрозолом, фармакокинетика вышеназванных препаратов не изменялась.
Концентрации паклитаксела и доксорубицина и их основных метаболитов (6-альфа-гидроксипаклитаксел и доксорубицинол) не изменяются в присутствии трастузумаба. Тем не менее, трастузумаб может повысить общую экспозицию одного из метаболитов доксорубицина (7-дезокси-13-дигидродоксорубицинон). Биологическая активность этого метаболита и клиническое значение повышения его экспозиции неизвестны. В присутствии паклитаксела и доксорубицина изменений в концентрации трастузумаба не наблюдалось. Результаты изучения фармакокинетики капецитабина и цисплатина при использовании в комбинации с трастузумабом или без него предполагают, что экспозиция биологически активных метаболитов капецитабина (например, фторурацил) не изменялась при одновременном применении цисплатина или цисплатина и трастузумаба. Однако были зарегистрированы более высокие концентрации капецитабина и более длительный период его полувыведения при комбинации с трастузумабом. Данные также указывают, что фармакокинетика цисплатина не изменялась при одновременном применении капецитабина или капецитабина в комбинации с трастузумабом.
Препарат Тразимера® не совместим с 5% раствором декстрозы из-за возможности агрегации белка. Препарат Тразимера® нельзя смешивать или растворять вместе с другими лекарственными препаратами.
Признаков несовместимости между раствором препарата Тразимера® и инфузионными пакетами, изготовленными из поливинилхлорида, полиэтилена или полипропилена, не наблюдалось.
Особые указания
В медицинской документации пациента следует указывать торговое наименование и номер серии препарата.
Терапия препаратом Тразимера® должна назначаться только врачом, имеющим опыт лечения онкологических заболеваний.
Введение препарата проводится при наличии доступа к набору для оказания экстренной помощи. Врач, имеющий опыт применения химиотерапевтических препаратов, должен быть доступен в процессе проводимой терапии.
HER2 тестирование должно быть проведено в специализированной лаборатории, которая может обеспечить контроль качества процедуры тестирования.
Препарат Тразимера® должен использоваться у пациенток с метастатическим РМЖ или ранними стадиями РМЖ только при наличии опухолевой гиперэкспрессии HER2, определенной методом иммуно-гистохимической реакции (ИГХ), или амплификации гена HER2, определенной методом гибридизации in situ (FISH или CISH). Следует использовать точные и валидированные методы определения.
Препарат Тразимера® должен использоваться у пациентов с метастатическим раком желудка только при наличии опухолевой гиперэкспрессии HER2, определенной методом ИГХ как ИГХ2+ и подтвержденной результатами SISH или FISH, или ИГХЗ+. Следует использовать точные и валидированные методы определения.
При использовании препарата у пациента флакон может храниться при температуре не выше 30 °С в течение единого периода времени продолжительностью не более 3 месяцев.
В настоящее время отсутствуют данные из клинических исследований о пациентах, получавших препарат Тразимера® повторно после применения в адъювантной терапии.
Дисфункция сердца
Общие указания
Пациенты, получающие препарат Тразимера® в качестве монотерапии или в комбинации с паклитакселом или доцетакселом, особенно после химиотерапии, включающей антрациклины (доксорубицин или эпирубицин), имеют повышенный риск развития застойной сердечной недостаточности (ЗСН) (II-IV функциональный класс по NYHA) или бессимптомных нарушений функции сердца. Тяжесть этих явлений может варьировать от средней до тяжелой степени. Эти явления могут привести к смертельному исходу. Кроме этого, необходимо соблюдать осторожность при лечении пациентов с высоким сердечно-сосудистым риском, например, у пациентов пожилого возраста, с артериальной гипертензией, документально подтвержденной ишемической болезнью сердца, застойной сердечной недостаточностью, фракцией выброса левого желудочка (ФВЛЖ) <55%.
Пациенты, которым планируется назначение препарата Тразимера®, особенно те из них, которые ранее получали препараты антрациклинового ряда и циклофосфамид, должны вначале пройти тщательное кардиологическое обследование, включающее сбор анамнеза, физикальный осмотр, электрокардиографию (ЭКГ), эхокардиографию и/или радиоизотопную вентрикулографию (MUGA) или магнитно-резонансную томографию (МРТ). Мониторирование может позволить выявить пациентов с возникшими нарушениями функции сердца. Исходно проведенное кардиологическое обследование должно повторяться каждые 3 месяца во время терапии и каждые 6 месяцев мосле ее окончания в течение 24 месяцев с момента введения последней дозы препарата.
До начала лечения препаратом Тразимера® необходимо тщательно сопоставить возможную пользу и риск от его применения.
По данным, полученным в результате популяционного фармакокинетического моделирования, трастузумаб может находиться в крови до 7 месяцев после завершения терапии. У пациентов, которые получают антрациклины после завершения лечения препаратом Тразимера®, возможно повышение риска дисфункции сердца. По возможности врачи должны избегать назначения химиотерапии на основе антрациклинов в течение 7 месяцев после завершения терапии препаратом Тразимера®. При применении препаратов антрациклинового ряда следует проводить тщательный мониторинг функции сердца. Следует оценить необходимость проведения стандартного кардиологического обследования у пациентов с подозрением на сердечно-сосудистые заболевания.
У всех пациентов следует мониторировать функцию сердца во время лечения (например, каждые 12 недель). В результате мониторинга можно выявить пациентов, у которых развились нарушения функции сердца.
У пациентов с бессимптомным нарушением функции сердца может оказаться полезным более частое проведение мониторинга (например, каждые 6-8 недель). При продолжительном ухудшении функции левого желудочка, не проявляющемся симптоматически, целесообразно рассмотреть вопрос об отмене препарата, за исключением случаев, когда лечащий врач считает, что польза для конкретного пациента превосходит риск.
Безопасность продолжения или возобновления терапии препаратом Тразимера® пациентов, у которых развилось нарушение функции сердца, не изучалась.
При снижении фракции выброса левого желудочка (ФВЛЖ, в%) на ≥10 единиц от исходной И ниже значения 50% лечение должно быть приостановлено. Повторная оценка ФВЛЖ должна быть проведена приблизительно через 3 недели. При отсутствии улучшения показателя ФВЛЖ или его дальнейшем снижении, или при появлении симптомов застойной сердечной недостаточности (ЗСН) необходимо рассмотреть вопрос о прекращении лечения препаратом Тразимера®, если только польза для конкретного пациента не превосходит риски. Все эти пациенты должны быть направлены к кардиологу для проведения обследования и находиться под наблюдением.
Если на фоне терапии препаратом Тразимера® развивается симптоматическая сердечная недостаточность, необходимо провести соответствующую стандартную медикаментозную терапию ЭСП.
У большинства пациентов с ЗСН или бессимптомной дисфункцией сердца в базовых исследованиях наблюдалось улучшение состояния на фоне стандартной медикаментозной терапии ЗСН: ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина и бета-адреноблокаторы. При наличии клинической пользы от применения трастузумаба большинство пациентов с побочными реакциями со стороны сердца продолжили терапию без проявления дополнительных клинически значимых реакций со стороны сердца.
Метастатический рак молочной железы
Не рекомендуется применять препарат Тразимера® совместно в комбинации с антрациклинами для лечения метастатического рака молочной железы.
Риск развития дисфункции сердца у пациентов с метастатическим раком молочной железы повышен при предшествующей терапии антрациклинами, однако он ниже по сравнению с таковым при одновременном применении антрациклинов и препарата Тразимера®.
Ранние стадии рака молочной железы
Пациентам с ранними стадиями рака молочной железы следует проводить кардиологическое обследование перед началом лечения, каждые 3 месяца во время терапии и каждые 6 месяцев мосле её окончания в течение 24 месяцев с момента введения последней дозы препарата. Рекомендуется более длительный мониторинг после лечения препаратом Тразимера® в комбинации с антрациклинами с частотой обследований 1 раз в год в течение 5 лет с момента введения последней дозы препарата Тразимера® или далее, если наблюдается постоянное снижение ФВЛЖ.
Лечение препаратом Тразимера® не рекомендуется пациентам на ранних стадиях РМЖ (адъювантная и неоадъювантная терапия) с: инфарктом миокарда в анамнезе; стенокардией, требующей лечения; ЗСН (II-IV функциональный класс по NYHA) в анамнезе или в настоящее время; ФВЛЖ ниже 55%; другими кардиомиопатиями; аритмиями, требующими лечения; клинически значимыми пороками сердца; плохо контролируемой артериальной гипертензией, за исключением артериальной гипертензии, поддающейся стандартной медикаментозной терапии; гемодинамически значимым перикардиальным выпотом, поскольку эффективность и безопасность применения препарата у таких пациентов не изучены.
Адъювантная терапия
Не рекомендуется применять препарат Тразимера® совместно в комбинации с антрациклинами в составе адъювантной терапии.
У пациентов с ранними стадиями РМЖ, получавших трастузумаб после химиотерапии па основе антрациклинов, наблюдалось повышение частоты симптоматических и бессимптомных нежелательных явлений со стороны сердца по сравнению с таковыми, получавшими химиотерапию доцетакселом и карбоплатином (режимы, не содержащие препараты антрациклинового ряда). При этом разница была больше в случаях совместного применения трастузумаба и таксанов, чем при последовательном использовании. Независимо от использовавшегося режима, большинство симптоматических кардиальных явлений возникало в первые 18 месяцев лечения. В одном из 3 проведенных базовых исследований (с медианой периода последующего наблюдения 5,5 лет) наблюдалось продолжительное увеличение кумулятивной частоты симптоматических кардиальных явлений или явлений, связанных со снижением ФВЛЖ: у 2,37% пациентов, получавших трастузумаб совместно с таксанами после терапии антрациклинами, по сравнению с 1% пациентов в группах сравнения (в группе терапии антрациклинами и циклофосфамидом, далее таксанами, и в группе терапии таксанами, карбоплатином и препаратом трастузумаб).
Идентифицированными факторами риска развития нежелательных явлений со стороны сердца при адъювантной терапии препаратом Тразимера® являются: возраст >50 лет, низкая исходная ФВЛЖ (<55%) перед и после начала лечения паклитакселом, снижение ФВЛЖ на 10-15 единиц, предшествующий или сопутствующий прием антигипертензивных препаратов. Риск нарушения сердечной функции у пациентов, получавших трастузумаб после завершения адъювантной химиотерапии, ассоциировался с более высокой суммарной дозой антрациклинов перед началом лечения трастузумабом и с индексом массы тела (ИМТ) >25 кг/м².
Неоадъювантная-адъювантная терапия
Для пациентов с ранними стадиями РМЖ, которым может быть назначена неоадъювантная-адъювантная терапия, применение препарата Тразимера® совместно с антрациклинами рекомендовано только в случае, если они ранее не получали химиотерапию и только при использовании низкодозовых режимов терапии антрациклинами (максимальная суммарная доза доксорубицина 180 мг/м² или эпирубицина 360 мг/м²). У пациентов, получивших полный курс низкодозовых антрациклинов и препарат Тразимера® в составе неоадъювантной терапии, не рекомендуется проведение дополнительной цитотоксической химиотерапии после проведения хирургического вмешательства. Во всех других случаях решение о необходимости дополнительной цитотоксической химиотерапии принимается на основании индивидуальных факторов.
Опыт применения трастузумаба совместно с низкодозовыми режимами терапии антрациклинами ограничен двумя исследованиями.
При применении трастузумаба в лекарственной форме для внутривенного введения совместно с неоадъювантной химиотерапией, включавшей три никла доксорубицина (суммарная доза 180 мг/м²), в клиническом исследовании частота симптоматического нарушения функции сердца составила 1,7%.
При применении трастузумаба в лекарственной форме для внутривенного введения совместно с неоадъювантной химиотерапией, включавшей 4 цикла эпирубицина (суммарная доза 300 мг/м²), в клиническом исследовании частота развития сердечной недостаточности/застойной сердечной недостаточности составила 0,3% при медиане наблюдения в >70 месяцев. Клинический опыт применения у пациентов в возрасте старше 65 лет ограничен.
Инфузионные реакции и реакции гиперчувствительности
При введении трастузумаба возникали серьезные инфузионные реакции: одышка, артериальная гипотензия, хрипы в легких, артериальная гипертензия, бронхоспазм, суправентрикулярная тахиаритмия, снижение насыщения гемоглобина кислородом, анафилаксия, респираторный дистресс-синдром, крапивница и ангионевротический отек. Для снижения риска возникновения этих явлений может быть использована премедикация. Большинство этих реакций возникало во время инфузий или в течение 2,5 ч от начала первого введения. При возникновении инфузионной реакции следует уменьшить скорость инфузии или на время прекратить введение препарата и тщательно наблюдать за пациентом до устранения всех симптомов. Для купирования этих симптомов возможно применение аналыетиков/антиииретиков, таких как парацетамол, или антигистаминных препаратов, таких как дифенгидрамин. Большинство пациентов после разрешения симптомов инфузионных реакций смогли продолжить терапию трастузумабом.
Эффективная терапия серьезных реакций заключается в применении бета-адреностимуляторов, глюкокортикостероидов, ингаляции кислорода. В случае развития тяжелых или жизнеугрожающих инфузионных реакций следует рассмотреть вопрос о прекращении дальнейшей терапии препаратом Тразимера®.
В редких случаях данные реакции ассоциировались с фатальным исходом. Риск развития летальных инфузионных реакций выше у пациентов с одышкой в покое, вызванной метастазами в легкие или сопутствующими заболеваниями, поэтому таким пациентам не следует проводить терапию препаратом Тразимера®.
Сообщались случаи, при которых после первоначального улучшения наблюдалось ухудшение состояния, а также случаи с отсроченным стремительным ухудшением состояния. Летальный исход возникал в течение часов или одной недели после инфузии. В очень редких случаях у пациентов появлялись симптомы инфузионных реакций или легочные симптомы (более чем через 6 ч после начала введения трастузумаба). Следует предупредить пациентов о возможном отсроченном развитии этих симптомов и о необходимости немедленного контакта с лечащим врачом в случае их возникновения.
Нарушения со стороны легких
При применении трастузумаба в пострегистрационном периоде регистрировались тяжелые явления со стороны легких, которые иногда сопровождались летальным исходом. Кроме того, наблюдались случаи интерстициальной болезни легких (ИБЛ), включая легочные инфильтраты, острый респираторный дистресс-синдром, пневмонию, пневмонит, плевральный выпот, острый отек легких и дыхательную недостаточность. Факторы риска, ассоциированные с ИБЛ, включают: ранее проводимую или сопутствующую терапию другими противоопухолевыми препаратами, которые, как известно, связаны с ИБЛ (таксаны, гемцитабин, винорельбин и лучевая терапия). Данные явления могут возникать как проявления инфузионных реакций, так и отсрочено. Риск тяжелых реакций со стороны легких выше у пациентов с метастатическим поражением легких, сопутствующими заболеваниями, сопровождающимися одышкой в покое. Поэтому такие пациенты не должны получать препарат Тразимера®. Следует соблюдать осторожность, особенно у пациентов, получающих сопутствующую терапию таксанами, из-за развития пневмонита.
Бензиловый спирт, содержащийся в качестве консерванта в бактериостатической воде для инъекций, прилагающейся к каждому многодозовому флакону 440 мг, оказывает токсическое действие у новорожденных и детей до 3 лет.
При применении препарата Тразимера® у больного с гиперчувствительностью к бензиловому спирту препарат нужно растворять водой для инъекций, при этом из каждого многодозового флакона можно отбирать только одну дозу. Оставшийся препарат следует утилизировать (инструкцию по утилизации см. выше).
Влияние на способность управлять автомобилем и работать с механизмами
Исследования по изучению влияния препарата Тразимера® на способность управлять автомобилем и работать с механизмами не проводились. В случае возникновения симптомов инфузионных реакций пациентам не следует управлять автомобилем или работать с механизмами до полного разрешения симптомов.
Форма выпуска
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий, 150 мг и 440 мг.
По 150 мг трастузумаба в стеклянном флаконе (I типа) объемом 15 мл, укупоренном пробкой из хлорбутилкаучука и обжатом алюминиевым колпачком под обкатку, закрытом сверху пластиковой крышкой.
1 флакон с инструкцией по применению помещают в картонную пачку с контролем первого вскрытия или без него.
По 440 мг трастузумаба в стеклянном флаконе (I типа) объемом 30 мл, укупоренном пробкой из хлорбутилкаучука и обжатом алюминиевым колпачком под обкатку, закрытом сверху пластиковой крышкой.
По 20 мл растворителя (бактериостатическая вода для инъекций) в стеклянном флаконе (I типа), укупоренном пробкой из хлорбутилкаучука и обжатом алюминиевым колпачком под обкатку, закрытом сверху пластиковой крышкой.
1 флакон с лекарственным препаратом и 1 флакон с растворителем с инструкцией по применению помещают в картонную пачку с контролем первого вскрытия или без него.
Срок годности
Лиофилизат – 4 года.
Растворитель – 5 лет.
Условия хранения
Лиофилизат:
Хранить флакон при температуре от 2 до 8 °С.
Не замораживать.
Растворитель:
Флакон может храниться при температуре от 2 до 30 °С.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
Пфайзер Инк., США
235 Ист 42-я Стрит, Нью-Йорк, штат Нью-Йорк, 10017 США.
Pfizer Inc., USA
235 East 42nd Street, New York, New York, 10017 USA.
Производитель/выпускающнй контроль качества
Пфайзер МФГ Бельгия Н.В., Бельгия
Рийксвег 12, 2870 Пюрс, Бельгия.
Pfizer MEG Belgium N.V., Belgium
Rijksweg 12, 2870 Puurs, Belgium.
Претензии потребителей направлять по адресу ООО «Пфайзер»:
123112 Москва, Пресненская паб., д. 10
БЦ «Башня на Набережной» (Блок С)
Комментарии
ПРАКТИКА ПЕДИАТРА
