Медроскан, 99mТс - инструкция по применению
См. откуда получены инструкции МЕДИ РУ
Регистрационный номер: ЛП-№(005559)-(РГ-RU) от 24.05.2024
Листок-вкладыш – информация для пациента
Медроскан, 99mТс, лиофилизат для приготовления раствора для внутривенного введения
Действующее вещество: Технеция [99mТс] медроновая кислота
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нем содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к врачу-радиологу.
- Если у Вас возникнут какие-либо нежелательные реакции, обратитесь к врачу-радиологу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Медроскан, 99mТс, и для чего его применяют.
- О чем следует знать перед применением препарата Медроскан, 99mТс.
- Применение препарата Медроскан, 99mТс.
- Возможные нежелательные реакции.
- Хранение препарата Медроскан, 99mТс.
- Содержимое упаковки и прочие сведения.
1. Что из себя представляет препарат Медроскан, 99mТс и для чего его применяют
Данный препарат является радиофармацевтическим лекарственным препаратом и применяется исключительно в диагностических целях.
Показания к применению
Медроскан, 99mТс применяется у взрослых и детей для сцинтиграфии (метод радионуклидной диагностики), чтобы выявить какие-либо аномалии (нарушения) скелета.
Способ действия препарата
Это лекарство представляет собой порошок, который при смешивании с раствором радиоактивного вещества пертехнетата натрия (Tc-99m) образует раствор для инъекций, содержащий комплекс технеций [99mТс] медроновая кислота.
При введении в организм комплекса технеций [99mTc] медроновая кислота он временно поглощается костями. Количество вводимого радиофармацевтического препарата таково, что испускаемое им излучение легко улавливается снаружи тела с помощью специальных камер и позволяет сделать снимок (называемый сцинтиграммой). Снимок показывает распределение излучения в костях.
С помощью сцинтиграфии врач может определить, есть ли какие-либо аномалии (нарушения) в скелете.
Применение препарата Медроскан, 99mТс связано с воздействием небольшого количества излучения.
Ваш лечащий врач и врач-радиолог пришли к выводу, что клиническая польза, которую Вы получите от процедуры с радиофармпрепаратом, перевешивает риск, связанный с облучением.
2. О чем следует знать перед применением препарата Медроскан, 99mТс
Противопоказания
Препарат Медроскан, 99mТс нельзя применять, если у Вас аллергия на любое вещество, входящее в состав препарата (см. раздел 6 листка-вкладыша).
Особые указания и меры предосторожности
Перед введением Вам препарата Медроскан, 99mТс проконсультируйтесь с врачом-радиологом. Обязательно сообщите врачу-радиологу:
- Вы беременны или можете быть беременны,
- Вы кормите грудью.
Перед введением препарата Медроскан, 99mТс Вам следует:
- употреблять много воды, особенно перед началом исследования, чтобы как можно чаще мочиться в первые часы после исследования,
- избегать любой значительной физической активности.
Дети и подростки
Обсудите со своим врачом-радиологом возможность применение препарата Медроскан, 99mТс в случае, если Вам меньше 18 лет. Если Вам меньше 18 лет, облучение выше, особенно в растущей кости. Ваш врач должен принять во внимание этот факт.
Другие препараты и препарат Медроскан, 99mТс
Сообщите врачу-радиологу о том, что Вы принимаете, принимали или можете начать принимать какие-либо другие препараты.
Пожалуйста, сообщите своему врачу, если Вы применяете или применяли какие-либо из следующих лекарств/веществ, поскольку они могут помешать врачу интерпретировать изображения:
- соединения железа,
- препараты группы бисфосфонатов (применяются для предотвращения потери костной массы),
- различные противоопухолевые препараты,
- препараты, подавляющие иммунную систему,
- антациды, содержащие алюминий,
- рентгеноконтрастные вещества (контрастные вещества, применяемые для радиологических обследований),
- антибиотики,
- противовоспалительные средства,
- инъекции глюконата кальция (применяется для лечения низкого содержания кальция в крови),
- гепарин кальция (применяется для предотвращения образования тромбов),
- аминокапроновая кислота (применяется для остановки кровотечений),
- этидроновая кислота (препарат для предотвращения потери костной массы).
Беременность и грудное вскармливание
Если Вы беременны или кормите грудью, думаете, что забеременели или планируете беременность, перед началом применения препарата проконсультируйтесь с врачом-радиологом.
Перед введением препарата Медроскан, 99mТс Вы должны сообщить врачу-радиологу, если есть вероятность, что Вы можете быть беременны, если у Вас задержка менструации или если Вы кормите грудью.
В случае сомнений необходимо проконсультироваться со своим врачом-радиологом, который будет проводить процедуру.
Если Вы беременны
Врач-радиолог будет применять этот препарат во время беременности только в том случае, если ожидаемая польза превышает риск.
Если Вы кормите грудью
Сообщите об этом врачу-радиологу, который порекомендует на какое время Вы должны прервать кормление грудью, пока радиоактивное излучение не выведется из организма.
Спросите врача-радиолога, когда Вы сможете возобновить грудное вскармливание. Как правило, на это требуется приблизительно 12 часов. Сцеживаемое грудное молоко следует уничтожить. Возобновление кормления грудью должно быть согласовано с врачом-радиологом, контролирующим проведение процедуры.
Управление транспортными средствами и работа с механизмами
Маловероятно, что препарат Медроскан, 99mТс повлияет на способность управлять транспортными средствами и работать с механизмами.
Препарат Медроскан, 99mТс содержит натрий
Готовый лекарственный препарат в 1 мл содержит от 3,92 до 4,29 мг натрия, что необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия.
3. Применение препарата Медроскан, 99mТс
Существуют строгие юридические нормы, регулирующие использование, обращение и утилизацию радиофармацевтических препаратов.
Препарат Медроскан, 99mТс будет применяться только в специально контролируемых зонах. Обращение с данным препаратом и его введение разрешено только лицам, прошедшим соответствующую подготовку и получившим квалификацию по его безопасному применению. Такие лица обязаны соблюдать особые меры предосторожности по безопасному применению данного препарата, а также должны информировать Вас о своих действиях.
Врач-радиолог, проводящий процедуру, примет решение о количестве препарата Медроскан, 99mТс, которое будет использоваться в вашем случае. Это будет наименьшее количество, необходимое для получения желаемой информации.
Вводимое количество, обычно рекомендуемое для взрослых пациентов, составляет от 300 до 740 МБк (МБк = мегабеккерель, единица, используемая для выражения радиоактивности).
Для тучных взрослых пациентов количество вводимого препарата может составлять от 11 до 13 МБк/кг.
Применение у детей и подростков
У детей и подростков вводимое количество препарата будет адаптировано к массе тела ребенка.
Введение препарата Медроскан, 99mТс и проведение процедуры
Препарат Медроскан, 99mТс вводят путем инъекции в вену. Одной дозы препарата достаточно для выполнения обследования, назначенного врачом. Перед процедурой Вас попросят помочиться, чтобы повысить качество сканирования.
Сканирование можно проводить в любое время после инъекции. Когда именно будет проведено сканирование, зависит от типа исследования.
Чтобы препарат можно было использовать максимально эффективно, рекомендуется избегать значительной физической нагрузки сразу после инъекции до тех пор, пока не будет получено удовлетворительное изображение.
Продолжительность процедуры
Врач-радиолог проинформирует Вас об обычной продолжительности процедуры.
После введения препарата Медроскан, 99mТс Вам следует:
- избегать тесного контакта с маленькими детьми и беременными женщинами в течение 12 часов после инъекции.
- чаще мочиться, чтобы вывести препарат из организма. Ваш врач может посоветовать Вам много пить, чтобы следы радиоактивности быстрее выводились из организма.
Врач-радиолог сообщит Вам, если Вам нужно принять какие-либо особые меры предосторожности после введения этого лекарства. Свяжитесь с врачом-радиологом, если у Вас есть какие-либо вопросы.
Если Вам ввели больше препарата Медроскан, 99mТс, чем следовало
Передозировка маловероятна, поскольку Вы получите только одну дозу препарата Медроскан, 99mТс, строго контролируемую врачом-специалистом, проводящим процедуру. Тем не менее, в случае передозировки Вам будет проведено соответствующее лечение.
Если у Вас есть какие-либо дополнительные вопросы об использовании препарата Медроскан, 99mТс, обратитесь к врачу-радиологу, который проводит процедуру.
4. Возможные нежелательные реакции при применении препарата
Подобно всем лекарственным препаратам препарат Медроскан, 99mТс может вызывать нежелательные реакции, однако они возникают не у всех.
Серьезные нежелательные реакции
Немедленно обратитесь за медицинской помощью, если заметите появление следующих симптомов:
- затруднение дыхания, отек лица, языка или горла, обильная сыпь, обморок.
Эти симптомы могут быть первыми проявлениями опасной для жизни аллергической реакции (анафилаксии), которая наблюдалась очень редко (может возникать не более чем у 1 человека из 10000).
Другие возможные нежелательные реакции
Очень редко (могут возникать не более чем у 1 человека из 10000):
- аллергическая реакция (гиперчувствительность);
- воспаление сосудов (васкулит);
- высыпание на коже и слизистых оболочках в виде покраснений, пятен, пузырьков, эрозий, корок (многоформная эритема);
- местная или распространенная сыпь с зудом и раздражением кожи;
- головная боль;
- снижение артериального давления, которое может проявляться головокружением, учащенным пульсом, ощущением слабости, сонливости, вплоть до предобморочного состояния;
- расширение подкожных сосудов;
- кашель;
- тошнота;
- рвота;
- желтуха;
- отеки конечностей;
- озноб;
- боль в суставах (артралгия);
- боль в мышцах (миалгия);
- уменьшение объема выделяемой мочи (олигурия);
- лихорадка;
- недомогание.
Если у Вас возникнет любая из перечисленных выше нежелательных реакций, обратитесь к врачу.
Данный радиофармацевтический препарат будет испускать малое количество ионизирующего излучения – риск рака и наследственных аномалий считается низким.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом-радиологом. К ним также относятся любые нежелательные реакции, не указанные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
109012, Москва, Славянская площадь, д. 4, стр. 1
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Веб сайт: www.roszdravnadzor.gov.ru
5. Хранение препарата Медроскан, 99mТс
Вам не придется хранить Медроскан, 99mТс. Препарат Медроскан, 99mТс хранится под ответственностью специалиста в соответствующих помещениях. Хранение радиофармпрепаратов осуществляется в соответствии с национальными нормами и правилами обращения с радиоактивными материалами.
Следующие сведения предназначены исключительно для медицинских работников.
Препарат нельзя применять после истечения срока годности (срока хранения), указанного на упаковке после «Годен до:». Датой истечения срока годности является последний день данного месяца.
Если в какой-либо момент при приготовлении этого препарата целостность флакона будет нарушена, его нельзя использовать.
6. Содержимое упаковки и прочие сведения
Препарат Медроскан, 99mТс содержит
Действующим веществом является технеция [99mТс] медроновая кислота.
Каждый флакон с лиофилизатом содержит 10 мг медроновой кислоты (в виде натриевой соли), 1 мг олова дихлорида дигидрата и 2 мг аскорбиновой кислоты.
Для получения готового препарата лиофилизат восстанавливают раствором натрия пертехнетата (99mТс) для инъекций (не входит в состав препарата).
В 1 мл готового препарата содержится технеций-99м в виде технеция [99mТс] медроновой кислоты 185-1480 МБк.
Прочими ингредиентами (вспомогательными веществами) являются медроновая кислота (в виде натриевой соли), олова дихлорида дигидрат, аскорбиновая кислота, натрия хлорид, вода для инъекций.
Препарат Медроскан, 99mТс содержит натрий (см. раздел 2).
Внешний вид препарата Медроскан, 99mТс и содержимое упаковки
Лиофилизат для приготовления раствора для внутривенного введения.
Лиофилизат: белый или почти белый лиофилизат в виде лепешки или отдельных агрегатов, или в виде порошка. Готовый препарат: бесцветная, прозрачная жидкость.
Препарат Медроскан, 99mТс является набором для приготовления радиофармацевтического препарата. Его необходимо восстановить раствором пертехнетата натрия (99mTc) для инъекций (не входит в этот набор). После восстановления лекарственный препарат представляет собой прозрачный раствор.
По 10 мг медроновой кислоты во флаконах вместимостью 10 мл из бесцветного стекла 1 гидролитического класса, герметично укупоренных пробками резиновыми из резины на основе хлор-бутилового или бром-бутилового каучука тип 1 и обжатых колпачками алюминиевыми или алюминиево-пластиковыми. По 5 флаконов во вкладыше из картона вместе с листком-вкладышем помещают в пачку картонную.
Держатель регистрационного удостоверения и производитель
Россия
ООО «ДИАМЕД», 123183, г. Москва, ул. Живописная, д.46, стр. 8
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к держателю регистрационного удостоверения.
Листок-вкладыш пересмотрен:
Прочие источники информации
Подробные сведения о данном препарате содержатся на веб-сайте Союза eec.eaeunion.org/.
Следующие сведения предназначены исключительно для медицинских работников:
С целью обеспечения медицинских работников дополнительной научной и практической информацией о применении данного радиофармацевтического препарата в печатной версии листка-вкладыша после линии отрыва или отреза представлена общая характеристика лекарственного препарата Медроскан, 99mTc.
Общая характеристика лекарственного препарата
1. Наименование лекарственного препарата
Медроскан, 99mТс, лиофилизат для приготовления раствора для внутривенного введения
2. Качественный и количественный состав
Действующее вещество: Технеция [99mТс] медроновая кислота
Лиофилизат
Каждый флакон вместимостью 10 мл содержит 10 мг медроновой кислоты (в виде натриевой соли), 1 мг олова дихлорида дигидрата и 2 мг аскорбиновой кислоты.
Готовый препарат
В 1 мл готового препарата содержится технеций-99м в виде технеция [99mТс] медроновой кислоты 185-1480 МБк.
Радионуклид входит в состав только готового препарата (см. часть 12).
Вспомогательные вещества, которые надо учитывать в составе лекарственного препарата: натрий (см. раздел 4.4.).
Полный перечень вспомогательных веществ приведен в разделе 6.1.
3. Лекарственная форма
Лиофилизат для приготовления раствора для внутривенного введения.
Лиофилизат подлежит восстановлению раствором натрия пертехнетата (99mTc) для инъекций (не входит в состав препарата).
Лиофилизат
Белый или почти белый лиофилизат в виде лепешки или отдельных агрегатов, или в виде порошка.
Готовый препарат
Бесцветная, прозрачная жидкость.
рН от 4,0 до 7,0.
4. Клинические данные
4.1 Показания к применению
Лекарственный препарат применяется исключительно в диагностических целях.
После растворения лиофилизата в растворе натрия пертехнетата, 99mTc полученный радиофармацевтический лекарственный препарат показан взрослым и детям для проведения сцинтиграфических исследований костной системы для выявления участков измененного остеогенеза, связанного со следующими заболеваниями и состояниями:
Новообразования
- Установление стадии распространения остеосаркомы
- Обнаружение и последующее наблюдение метастазов в костях
Неопухолевые поражения
В качестве дополнительного метода исследования при оценке:
- Остеомиелита
- Аваскулярного некроза
- Болезни Педжета
- Стрессовых переломов, синдрома «расколотой голени»
- Скрининга на несостоятельность или инфицирование протеза в случае, когда результаты проведенной рентгенографии не дали окончательного результата
- Рефлекторного симпатического синдрома
- Жизнеспособности костного трансплантата
При положительных результатах остеосцинтиграфии для снижения риска получения ложноположительных результатов могут потребоваться дополнительные исследования, поскольку области измененного остеогенеза потенциально выявляются с высокой чувствительностью, но низкой специфичностью.
Работа с препаратом должна проводиться в соответствии с «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99/2010), «Нормами радиационной безопасности» (НРБ-99) и методическими указаниями «Гигиенические требования по обеспечению радиационной безопасности при проведении радионуклидной диагностики с помощью радиофармпрепаратов» (МУ 2.6.1.1892-04).
4.2 Режим дозирования и способ применения
Режим дозирования
Взрослые: оптимальная активность при введении Медроскана, 99mТс может варьировать в зависимости от характеристик пациента, типа диагностической задачи и технических характеристик оборудования для визуализации. В соответствии с рекомендациями Европейской ассоциации ядерной медицины средняя активность при однократной внутривенной инъекции составляет 500 МБк (300-740 МБк). Однако может быть оправдано изменение величины активности. В соответствии с рекомендациями Европейской ассоциации ядерной медицины для взрослых пациентов с выраженным ожирением может потребоваться активность до 11-13 МБк/кг.
Особые популяции пациентов
Пациенты пожилого возраста
Необходимость коррекции дозы у пациентов пожилого возраста специально не изучалась. Снижение функции почек (см. ниже) и снижение остеогенеза у пожилых людей могут влиять на поглощение, распределение или выведение препарата Медроскан, 99mТс из организма.
Пациенты с нарушением функций почек
Необходимы тщательный расчет и оценка величины вводимой активности для каждого пациента из-за риска увеличения дозы облучения. Необходимость коррекции дозы у пациентов с почечной недостаточностью специально не изучалась.
Пациенты с нарушением функций печени
Необходимость коррекции дозы у пациентов с печеночной недостаточностью специально не изучалась. Поскольку препарат Медроскан, 99mТс выводится из организма через почки, коррекция величины вводимой активности препарата для пациентов с печеночной недостаточностью не требуется.
Дети
Новорожденные, младенцы, дети и подростки: исследования для определения оптимальной вводимой активности технеция [99mТс] в инъекции препарата Медроскан, 99mТс у детей и подростков не проводились, так как величина активности при применении препарата у детей и подростков рассчитывается индивидуально, исходя из клинических потребностей и оценки соотношения риска и пользы в этой группе пациентов. Вводимая активность детям и подросткам, может быть рассчитана в соответствии со следующей таблицей:
Таблица вводимой активности для детей в соответствии с рекомендациями Рабочей группы по педиатрии Европейской ассоциации ядерной медицины (Paediatric Task Group Pediatric Activity Schedule European Association of Nuclear Medicine)
| Масса тела | % от активности для взрослых | Масса тела | % от активности для взрослых | Масса тела | % от активности для взрослых |
| 3 кг | 10% | 22 кг | 50% | 42 кг | 78% |
| 4 кг | 14% | 24 кг | 53% | 44 кг | 80% |
| 6 кг | 19% | 26 кг | 56% | 46 кг | 82% |
| 8 кг | 23% | 28 кг | 58% | 48 кг | 85% |
| 10 кг | 27% | 30 кг | 62% | 50 кг | 88% |
| 12 кг | 32% | 32 кг | 65% | 52-54 кг | 90% |
| 14 кг | 36% | 34 кг | 68% | 56-58 кг | 92% |
| 16 кг | 40% | 36 кг | 71% | 60-62 кг | 96% |
| 18 кг | 44% | 38 кг | 73% | 64-66 кг | 98% |
| 20 кг | 46% | 40 кг | 76% | 68 кг | 99% |
Для получения изображений удовлетворительного качества у детей необходимая минимальная активность должна составлять 20-40 МБк.
Способ применения
Препарат предназначен только для внутривенного введения.
Информацию по подготовке пациента см. в разделе 4.4.
Инструкции по приготовлению лекарственного препарата перед применением см. в части 12.
Необходимо строго избегать случайного попадания препарата в окружающие ткани при внутривенном введении для исключения их лучевого повреждения.
Получение изображений
Параметры и процедуры получения изображений будут различаться в зависимости от диагностической задачи и типа доступного оборудования. Оптимальное время от введения дозы до визуализации специально не исследовалось. При проведении трехфазной остеосцинтигрофии для оценки кровотока исследуемой области изображения регистрируются сразу же после введения препарата, для определения объема крови в патологическом очаге – через несколько минут. Оптимальные изображения распределения препарата Медроскан, 99mТс в костях регистрируют через 2-5 ч после введения пациенту. Более поздние изображения (6-24 ч) иллюстрируют более высокое соотношение цели к фону и, таким образом, позволяют более точно оценить накопление и распределение препарата в костях таза, в случае если оно затруднено из-за физиологического накопления активности в мочевом пузыре на обычных (2-5 ч) изображениях. Отсроченная визуализация на срок от 6 до 24 ч также может быть особенно полезной у пациентов с почечной недостаточностью или нарушениями периферического кровообращения, а также у пациентов с задержкой мочеиспускания.
4.3 Противопоказания
Гиперчувствительность к любому веществу, входящему в состав препарата (см. часть 2 и раздел 6.1).
4.4 Особые указания и меры предосторожности при применении
Остеомиелит
Дополнительно к результатам визуализации необходимо тщательное сопоставление с данными других диагностических исследований, а также с данными физикального обследования пациента. Специфичность остеосцинтиграфии повышается в случае, если регистрация очага повышенной остеобластической/остеогенной активности соответствует положительным результатам физикального осмотра, особенно если они согласуются с внешними симптомами заболевания (боль, покраснение, припухлость). Специфичность исследования также повышается с учетом результатов лабораторных исследований, таких как лейкоцитоз, повышение скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ). Рекомендуется выполнение трехфазной остеосцинтиграфии (оценка кровотока, определения объема крови в патологическом очаге и обычные отсроченные изображения), которая имеет более высокую чувствительность и специфичность в выявлении остеомиелита или других заболеваний по сравнению с протоколами однофазных отсроченных исследований.
Скрининг на несостоятельность или инфицирование протеза
Перед проведением остеосцинтиграфии необходимо тщательное сопоставление данных истории болезни пациента, данных физикальных обследований и сроков оперативного вмешательства. Следует соблюдать осторожность при проведении диагностики несостоятельного или инфицированного протеза в ближайшем послеоперационном периоде в течение нескольких месяцев после оперативного вмешательства. Как и при сцинтиграфической диагностике остеомиелита и других заболеваний, настоятельно рекомендуется проведение трехфазной остеосцинтиграфии.
Обнаружение и последующее наблюдение метастазов в костях
Требуется сопоставление результатов исследования и данных истории болезни пациента. Как известно, чувствительность метода остеосцинтиграфии к выявлению остеогенной/остеобластной активности высокая, в то время как специфичность этого метода для диагностики конкретного заболевания ниже из-за отсутствия сопоставимой информации о данных других диагностических исследований, а также о данных физикального обследования пациента. При этом специфичность в отношении выявления общей остеобластической активности, при положительном результате исследования, сопоставима с чувствительностью. Однофотонная остеосцинтиграфия является высокочувствительным методом диагностического исследования для оценки метастатических заболеваний костей, но не является неоспоримо верным. Отрицательный результат исследования при отсутствии клинических данных, таких как наличие боли или других рентгенологических или КТ-признаков имеет очень высокую вероятность истинно отрицательного результата; однако при наличии у пациента локализованной боли в костях, не связанной с артритом, для диагностики костных метастазов может оказать помощь наличие положительных визуальных результатов других исследований (литические или склеротические изменения костной ткани при проведении позитронно¬эмиссионной томографии (ПЭТ) с соответствующим радиофармпрепаратом, при его наличии).
ПРИМЕЧАНИЕ: ПЭТ костей с натрия фторидом (18F) будет иметь те же ограничения при преобладающем остеокластном поражении, поэтому факторы, которые необходимо учитывать в отношении специфичности, также применимы к ПЭГ костей с натрия фторидом (18F).
Требуется осторожность при интерпретации результатов при проведении остеосцинтиграфии в течение нескольких месяцев после лучевой и специальной медикаментозной терапии онкологических заболеваний. В этом интервале времени повышение интенсивности накопления препарата в костной ткани, при ранее выявленных поражениях, может не отражать процесс прогрессирования заболевания или отсутствие эффективности терапии, а скорее являться ответной «вспышкой» вследствие благоприятного репаративного процесса остеобластов, вторичного по отношению к успешно проведенному лечению. Прежде чем расценивать повышение интенсивности накопления препарата в костной ткани, как прогрессирование метастатического процесса в костях, требуется тщательное сопоставление результатов с клиническими данными, а также рекомендуется последующее повторное проведение остеосцинтиграфии либо с препаратом Медроскан, 99mТс, либо ПЭТ с фторидом натрия (18F). Однако, если при вышеуказанных обстоятельствах выявляются дополнительные, новые поражения костей, это является аргументом в пользу прогрессирования метастатического процесса в костях. Кроме того, признаки прогрессирования (новые поражения) могут возникать на фоне улучшения в выявленных ранее областях, если проводится целенаправленная лучевая терапия одного или нескольких заданных очагов поражения.
Риск возникновения реакций гиперчувствительности или анафилактических реакций
В случае возникновения реакций гиперчувствительности или анафилактических реакций введение лекарственного препарата Медроскан, 99mТс следует немедленно прекратить и начать специфическое лечение, при необходимости внутривенно. Для обеспечения незамедлительных лечебных мероприятий в чрезвычайных ситуациях в доступности всегда должны быть необходимые лекарственные препараты и оборудование, такое как интубационная трубка и аппарат искусственной вентиляции легких.
Подготовка пациента к исследованию
Перед началом исследования пациент должен выпить достаточное количество питьевой воды, и в течение первых часов после исследования пациенту необходимо настоятельно рекомендовать как можно чаще мочиться для снижения лучевой нагрузки на организм. Во время исследования пациенту также следует увеличить пероральное потребление жидкости и частоту опорожнения мочевого пузыря для уменьшения лучевой нагрузки на мочевой пузырь, особенно при введении высокой активности препарата. Пациентов с проблемами мочеиспускания следует катетеризировать после введения высокой активности. Во избежание накопления препарата в мышцах рекомендуется воздерживаться от физических нагрузок сразу после введения до тех пор, пока не будет получено удовлетворительное изображение кости.
После процедуры
После процедуры следует ограничить близкое общение пациента с младенцами и беременными женщинами в течение 12 ч.
Меры предосторожности в отношении риска для окружающей среды см. в разделе 6.6.
Вспомогательные вещества
Готовый лекарственный препарат в 1 мл содержит от 3,92 до 4,29 мг натрия, что необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия.
Дети
Информацию о применении у детей см. в разделе 4.2. Требуется тщательно проанализировать показания для диагностического исследования, поскольку эффективная доза (мЗв/МБк) выше, чем у взрослых (см. часть 11). Особое внимание следует обратить на относительно более высокую радиационную нагрузку на эпифизы растущей кости.
4.5 Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Сообщается о повышенном внекостном накоплении радиофармпрепарата при применении железосодержащих соединений, однократном приеме дифосфоната, некоторых цитостатических и иммунодепрессивных лекарственных средств, алюминий-содержащих антацидов, рентгеноконтрастных средств, антибиотиков, противовоспалительных средств, инъекционном введении кальция глюконата, гепарина кальция и γ-аминокапроновой кислоты. Поскольку этидроновая кислота ингибирует абсорбцию медроновой кислоты костной тканью, остеосцинтиграфию следует проводить не ранее, чем через 2-4 недели после введения этидроновой кислоты.
Дети
Исследования взаимодействия проводились только у взрослых.
4.6 Фертильность, беременность и лактация
Женщины с детородным потенциалом
До введения радиофармпрепаратов женщине детородного возраста, необходимо установить наличие или отсутствие беременности. Любая женщина, у которой отсутствует менструация, должна считаться беременной, пока не будет доказано обратное. При подозрении на возможную беременность (при отсутствии менструации, нерегулярных менструациях и т.п.) пациентке должны быть предложены альтернативные методы диагностики без использования ионизирующего излучения (если таковые имеются).
Беременность
Дозы облучения при радионуклидных исследованиях, проводимых у беременных женщин, также воздействуют на плод. Поэтому во время беременности следует проводить только необходимые исследования, когда вероятная польза проводимого исследования значительно превышает риск для матери и плода. Основываясь на опубликованных данных, инъекция технеция [99mТс] медроновая кислота в дозе 500 МБк пациентке с нормальным поглощением кости приводит к поглощенной дозе в матке 3,15 мГр. Доза снижается до 1,45 мГр у пациенток с высоким поглощением костной ткани и/или тяжелыми нарушениями функции почек. В опубликованных отчетах у беременных пациенток оценочные дозы облучения плода составляли от 2,6 до 4,6 мкГр/МБк (от 1,3 до 2,3 мГр/500 МБк). Хотя маловероятно, что такой уровень радиации представляет повышенный риск для плода, тем не менее, применение препарата Медроскан, 99mТс во время беременности не рекомендуется, за исключением случаев крайней необходимости.
Лактация
Перед введением радиофармпрепаратов кормящей матери следует рассмотреть возможность отсрочки введения радионуклида до прекращения грудного вскармливания матерью, а также выбрать наиболее подходящий радиофармпрепарат, принимая во внимание секрецию активности радионуклида с грудным молоком. Если введение считается необходимым, грудное вскармливание следует прервать на 12 ч и отказаться от кормления сцеженным молоком.
В это время следует ограничить тесный контакт с младенцем.
4.7 Влияние на способность управлять транспортными средствами и работать с механизмами
Исследований влияния на способность управлять транспортными средствами и механизмами не проводилось.
4.8 Нежелательные реакции
Резюме нежелательных реакций
Нежелательные реакции классифицированы в соответствии с системно-органным классом словаря MedDRA и частотой возникновения. Категория частоты приводится в соответствии со следующей градацией: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1 000, но <1/100), редко (≥1/10 000, но <1/1 000), очень редко (< /10 000).
Нарушения со стороны иммунной системы
Очень редко: реакции гиперчувствительности, васкулит, многоформная эритема, жизнеугрожающая анафилаксия через 8-48 ч после введения.
Нарушения со стороны нервной системы
Очень редко: головная боль
Нарушения со стороны сосудов
Очень редко: падение артериального давления и симптомы гипотензии, расширение подкожных сосудов.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Очень редко: кашель
Желудочно-кишечные нарушения
Очень редко: тошнота, рвота
Нарушения со стороны печени и желчевыводящих путей
Очень редко: желтуха
Нарушения со стороны кожи и подкожных тканей:
Очень редко: местная или генерализованная сыпь с зудом и раздражением кожи. Начало реакции обычно наступает через несколько часов после инъекции и может длиться до 48 ч. Целесообразно проведение лечения неседативными блокаторами H1-гистаминовых рецепторов. Отеки конечностей.
Нарушения со стороны мышечной, скелетной и соединительной ткани
Очень редко: озноб, артралгия, миалгия
Нарушения со стороны почек и мочевыводящих путей
Очень редко: олигурия
Общие нарушения и реакции в месте введения
Очень редко: лихорадка, недомогание
Другие нарушения
С воздействием ионизирующего излучения связано возникновение рака, а также возможность развития наследственных дефектов. Влияние дозы облучения, возникающего в результате воздействия препарата, может привести к увеличению частоты развития рака и мутаций. Поэтому, в каждом случае необходимо следить за тем, чтобы риск вреда организму пациента от облучения при выполнении исследования был ниже, чем от самого заболевания. Поскольку эффективная доза составляет 2,85 мЗв (для человека с массой тела 70 кг) при средней рекомендуемой активности 500 МБк, ожидается, что вероятность развития этих нежелательных явлений низкая.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
Российская Федерация
109012, Москва, Славянская площадь, д. 4, стр. 1
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Веб сайт: www.roszdravnadzor.gov.ru
4.9 Передозировка
Лечение
В случае радиационной передозировки препарата Медроскан, 99mТс поглощенная доза пациентом должна быть снижена, насколько это возможно, путем увеличения выведения радионуклида из организма за счет форсированного диуреза и частого опорожнения мочевого пузыря. Следует также оценить примененную эффективную дозу.
5. Фармакологические свойства
5.1 Фармакодинамические свойства
Фармакотерапевтическая группа: диагностические радиофармацевтические средства; средства для исследования скелета; соединения технеция (99mТс)
Код АТХ: V09BA02
Фармакодинамические эффекты
При введении в обычных дозах препарат Медроскан, 99mТс не проявляет фармакодинамических эффектов, обнаруживаемых клинически и/или аналитически.
5.2 Фармакокинетические свойства
В первые 3 минуты после инъекции технеция [99m1с] медроновая кислота происходит его поглощение мягкими тканями и накопление в почках. По мере увеличения клиренса из этих органов и тканей наблюдается прогрессирующее накопление в костной системе, первоначально в поясничных позвонках и тазовой области. Клиренс из крови протекает в 3 фазы: 1 – быстрая фаза (период полувыведения [Т1/2] = 3,5 мин), 2 – средняя фаза (Т1/2 = 27 мин) и 3 – медленная фаза (Т1/2 = 144 мин). Быстрая фаза представляет собой перенос радиоактивного вещества из кровотока во внесосудистую систему, средняя фаза включает поглощение скелетом. Медленная фаза, вероятно, связана с высвобождением введенного в организм внутривенным путем комплекса технеция [99mТс] медроновая кислота из комплекса, связанного с белком. Около 50% введенной активности накапливается в скелете. Максимальное накопление в кости достигается через 1 ч после инъекции и остается практически постоянным до 72 ч. Циркулирующий несвязанный комплекс выводится почками. Пик активности, выводимой почками достигается примерно через 20 минут. В течение 1 ч при нормальной функции почек клубочковой фильтрации подвергается около 32% от общего количества несвязанного комплекса, в течение 2 ч – 47,5% и в течение 6ч – 60%. Количество фосфоната в рекомендуемом диапазоне активности не влияет на почечную экскрецию. Количество, выводимое через кишечник, незначительно.
Степень накопления в костной системе зависит от циркуляции и степени регенерации основного костного материала. Удержание в организме составляет 31,6±5% у здоровых людей, 38,2±7% у лиц с обширными метастазами, 49±11% при первичном гиперпаратиреозе и 45% при остеопорозе.
5.3 Данные доклинической безопасности
Нежелательные явления у животных после внутривенного введения комплекса с медроновой кислотой наблюдались только при дозах, значительно превышающих терапевтические дозы у человека. Повторное введение очень высоких доз дифосфонатов может вызвать нарушения минерализации. Исследования мутагенности и долгосрочные исследования канцерогенности не проводились.
6. Фармацевтические свойства
6.1 Перечень вспомогательных веществ
Лиофилизат
Медроновая кислота (в виде натриевой соли)
Олова дихлорида дигидрат
Аскорбиновая кислота
Готовый препарат
Медроновая кислота (в виде натриевой соли)
Олова дихлорида дигидрат
Аскорбиновая кислота
Натрия хлорид
Вода для инъекций
6.2 Несовместимость
Реакция, связанная с получением комплекса технеция [99mТс] медроновая кислота, зависит от сохранения некоторого количества олова в двухвалентном состоянии. Присутствие окисляющих соединений в растворе пертехнетата (99mТс) может отрицательно сказаться на мечении.
Данный лекарственный препарат не следует смешивать с другими лекарственными препаратами, за исключением упомянутых в части 12.
6.3 Срок годности (срок хранения)
Лиофилизат
18 месяцев.
Готовый препарат
6 ч с даты и времени изготовления.
6.4 Особые меры предосторожности при хранении
Лиофилизат
При температуре от 2°С до 8°С.
При транспортировке допускается отклонение от температурного режима хранения при температуре не выше 25°С не более 1 месяца с момента изменения условий хранения.
Готовый препарат
Хранить при температуре не выше 25°C. В соответствии с действующими «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99/2010).
6.5 Характер и содержание первичной упаковки
По 10 мг медроновой кислоты во флаконах вместимостью 10 мл из бесцветного стекла 1 гидролитического класса, герметично укупоренных пробками резиновыми из резины на основе хлор-бутилового или бром-бутилового каучука тип 1 и обжатых колпачками алюминиевыми или алюминиево-пластиковыми.
По 5 флаконов во вкладыше из картона вместе с листком-вкладышем помещают в пачку картонную.
6.6 Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Общие меры предосторожности
Следует избегать непреднамеренного или случайного подкожного введения технеция [99mTc] медроновая кислота, поскольку для дифосфонатов технеция (99mTc) описано периваскулярное воспаление. Радиофармпрепараты должны получать, использовать и вводить только уполномоченные лица в специально отведенных клинических условиях. Их получение, хранение, использование, передача и утилизация регулируются правилами и/или соответствующими лицензиями местной компетентной официальной организации. Радиофармпрепараты должны быть приготовлены таким образом, чтобы удовлетворялись как требования радиационной безопасности, так и фармацевтического качества. Должны быть приняты соответствующие асептические меры предосторожности. Содержимое флакона предназначено только для приготовления инъекций технеция [99mTc] медроновая кислота и не должно вводиться непосредственно пациенту без предварительной подготовительной процедуры. Инструкции по приготовлению лекарственного средства перед введением см. в части 12. Если в какой-либо момент при приготовлении этого продукта целостность флакона будет нарушена, его нельзя использовать. Процедуры введения должны осуществляться таким образом, чтобы свести к минимуму риск загрязнения лекарственного средства и облучения операторов. Адекватное экранирование является обязательным. Содержимое набора перед экстемпоральным приготовлением не радиоактивно. Однако после добавления раствора пертехнетата натрия (99mTc) для инъекций необходимо поддерживать адекватную защиту конечного препарата. Готовый препарат – бесцветная, прозрачная жидкость.
Введение радиофармпрепаратов создает для других людей риск внешнего облучения или заражения в результате разлития мочи, рвоты и т. д. Поэтому необходимо принимать меры предосторожности и радиационной защиты в соответствии с национальными правилами. Эта подготовка, вероятно, приведет к относительно высокой дозе облучения для большинства пациентов. Препарат может представлять опасность для окружающей среды.
Весь неиспользованный лекарственный препарат или отходы следует утилизировать в установленном порядке.
7. Держатель регистрационного удостоверения
Россия
123182 ООО «ДИАМЕД», г. Москва, ул. Живописная, д.46, стр. 8
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Россия
123182 ООО «ДИАМЕД», г. Москва, ул. Живописная, д.46, стр. 8
8. Номер регистрационного удостоверения
9. Дата первичной регистрации (подтверждения регистрации, перерегистрации)
Дата первой регистрации:
10. Дата пересмотра текста
11. Дозиметрия
Технеций (99mTc) производится с помощью генератора (99Mo/99mTc) и распадается с испусканием гамма-излучения со средней энергией 140 кэВ и периодом полураспада 6,02 ч до технеция (99mTc), который ввиду его длительного периода полураспада 2.13×105 можно считать квазистабильным.
Эффективная доза (Е) технеция (99mTc) при введении с медроновой кислотой составляет 0,00619 мЗв/МБк для женщин и 0,00475 мЗв/МБк для мужчин. Эффективная доза при веденной активности для взрослых 8 МБк/кг у женщин массой тела 70 кг составит 3,5 мЗв, у мужчин массой тела 80 кг эффективная доза составит 3,0 мЗв.
Эффективная доза для взрослых
| Доза (МБк/кг) | Е (мЗв/МБк) | Масса тела | Е (мЗв) | |
| Женщины | 8 | 0.00619 | 70 | 3.47 |
| Мужчины | 8 | 0.00475 | 80 | 3.04 |
Эффективная доза для детей (мЗв/МБк)
| 0 | 1 год | 5 лет | 10 лет | 15 лет |
| 0.0631 | 0.0263 | 0.0142 | 0.00904 | 0.0059 |
Эффективная доза в МБк будет выше у пациентов со сниженной функцией почек и у пациентов с высоким поглощением костной ткани. Органом-мишенью является поверхность кости (0,063 мГр/МБк). При введенной активности 600 МБк доза облучения на поверхность кости составляет 37,8 мГр. Критическим органом является стенка мочевого пузыря (0,048 мГр/МБк). При введенной активности 600 МБк доза облучения стенки мочевого пузыря составляет 28,8 мГр. В таблице ниже приведены поглощенные дозы, рассчитанные в соответствии с Публикацией 80 Международной комиссии по радиологической защите (ICRP, 1998. Radiation Dose to Patients from Radiopharmaceuticals (Addendum to ICRP Publication 53). ICRP Publication 80. Ann. ICRP 28 (3).
Поглощенные дозы облучения: 99mТс-фосфат и фосфонат (мГр/МБк)
| Орган | Поглощенная доза на введенную активность (мГр/МБк) | ||||
| Взрослые | 15 лет | 10 лет | 5 лет | 1 год | |
| Надпочечники | 0.0021 | 0.0027 | 0.0039 | 0.0058 | 0.011 |
| Стенка мочевого пузыря | 0.048 | 0.060 | 0.088 | 0.073 | 0.13 |
| Поверхность костей | 0.063 | 0.082 | 0.13 | 0.22 | 0.53 |
| Мозг | 0.0017 | 0.0021 | 0.0028 | 0.0043 | 0.0061 |
| Молочная железа | 0.00071 | 0.00089 | 0.0014 | 0.022 | 0.0042 |
| Желчный пузырь | 0.0014 | 0.0019 | 0.0035 | 0.0042 | 0.0067 |
| Желудочно-кишечный тракт | |||||
| Стенка желудка | 0.0012 | 0.0018 | 0.0025 | 0.0035 | 0.0066 |
| Тонкий кишечник | 0.0023 | 0.0029 | 0.0044 | 0.0053 | 0.0095 |
| Верхний отдел тонкого кишечника | 0.0019 | 0.0024 | 0.0039 | 0.0051 | 0.0089 |
| Нижний отдел тонкого кишечника | 0.0038 | 0.0047 | 0.0072 | 0.0075 | 0.013 |
| Толстая кишка | 0.0027 | 0.0034 | 0.0053 | 0.0061 | 0.011 |
| Сердце | 0.0012 | 0.0016 | 0.0023 | 0.0034 | 0.0060 |
| Почки | 0.0073 | 0.0088 | 0.012 | 0.018 | 0.032 |
| Печень | 0.0012 | 0.0016 | 0.0025 | 0.0036 | 0.0066 |
| Легкие | 0.0013 | 0.0016 | 0.0024 | 0.0036 | 0.0068 |
| Мышцы | 0.0019 | 0.0023 | 0.0034 | 0.0044 | 0.0079 |
| Пищевод | 0.0010 | 0.0013 | 0.0019 | 0.0030 | 0.0053 |
| Яичники | 0.0036 | 0.0046 | 0.0066 | 0.0070 | 0.012 |
| Поджелудочная железа | 0.0016 | 0.0020 | 0.0031 | 0.0045 | 0.0082 |
| Красный костный мозг | 0.0092 | 0.01 | 0.017 | 0.033 | 0.067 |
| Кожа | 0.0010 | 0.0013 | 0.0020 | 0.0029 | 0.0055 |
| Селезенка | 0.0014 | 0.0018 | 0.0028 | 0.0045 | 0.0079 |
| Яички | 0.0024 | 0.0033 | 0.0055 | 0.0058 | 0.011 |
| Тимус | 0.0010 | 0.0013 | 0.0019 | 0.0030 | 0.0053 |
| Щитовидная железа | 0.0013 | 0.0016 | 0.0023 | 0.0035 | 0.0056 |
| Матка | 0.0063 | 0.0076 | 0.012 | 0.011 | 0.018 |
| Оставшиеся органы | 0.0019 | 0.0023 | 0.0034 | 0.0045 | 0.0079 |
| Эффективная доза (мГр/МБк) | 0.0057 | 0.0070 | 0.0110 | 0.0140 | 0.0270 |
Для препарата Медроскан, 99mTc эффективная доза при введении 500 МБк технеция [99mTc] медроновая кислота составляет 2,85 мЗв (для человека массой тела 70 кг).
Доза облучения органа-мишени, поверхности кости, составляет 31,5 мГр/500 МБк.
Для этой активности 500 МБк дозы облучения, доставленные в орган-мишень (костная поверхность), составляют 31,5 мГр/500 МБк, а типичная доза облучения критического органа, стенки мочевого пузыря, составляет 24,0 мГр/500 МБк.
12. Инструкции по приготовлению радиофармацевтических препаратов
Готовый препарат, представляющий собой раствор для внутривенного введения, изготавливается in situ непосредственно в медицинских организациях.
Приготовление препарата
- процесс приготовления препарата проводят в асептических условиях с соблюдением требований радиационной безопасности;
- в соответствии с руководством по эксплуатации, из генератора технеция-99м получают стерильный раствор натрия пертехнетата, 99mТс (элюат) и при необходимости разбавляют элюат 0,9% раствором натрия хлорида до требуемой объемной активности. Раствор натрия пертехнетата, 99mТс должен быть получен не позднее, чем через 24 ч после предыдущего элюирования генератора технеция-99м.
- 4-8 мл раствора натрия пертехнетата, 99mТс с активностью 740-11840 МБк в асептических условиях вводят с помощью шприца во флакон с лиофилизатом, помещенным в свинцовый контейнер с толщиной стенки 3 мм, прокалывая резиновую пробку иглой;
- перемешивают содержимое флакона встряхиванием до полного растворения лиофилизата (около 1 минуты);
- полученный раствор выдерживают при комнатной температуре не менее 10 минут. Препарат готов к применению.
Готовый препарат – бесцветная, прозрачная жидкость.
Полученный препарат можно применять в течение 6 ч после приготовления.
Приготовление препарата необходимо проводить с соблюдением правил асептики и радиационной защиты.
Контроль готового лекарственного препарата:
Содержание радиохимических примесей в готовом препарате определяется методом тонкослойной хроматографии.
А. Определение содержания гидролизованного восстановленного технеция-99м (далее ГВТ):
На хроматографической пластинке из стекловолокна, импрегнированной силикагелем, ITLC-SG размером 10×100 мм, отступив от одного из краев, отмечают линию старта на расстоянии 15 мм от нижнего края. На линию старта пластинки наносят 0,001-0,005 мл раствора препарата. Не давая пятну высохнуть, проводят хроматографирование восходящим методом, используя в качестве растворителя (подвижная фаза) 13,6% раствор ацетата натрия до достижения подвижной фазы верхнего края пластинки. По окончанию хроматографирования полученную хроматограмму высушивают при комнатной температуре, обклеивают с двух сторон лентой полиэтиленовой с липким слоем. Для определения распределения активности по хроматограмме используют хроматограмм-сканер. В указанном режиме хроматографирования Rf гидролизованного восстановленного технеция-99м составляет 0±0,05. Содержание ГВТ в препарате определяют как отношение активности участка хроматограммы (0-25) мм к активности всей хроматограммы.
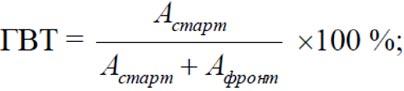 где:
где: Астарт – относительная активность участка хроматограммы, содержащего гидролизованный восстановленный технеций (ГВТ);
Афронт – относительная активность остальной части хроматограммы.
В. Определение содержания пертехнетат-ионов:
На хроматографической пластинке из стекловолокна, импрегнированной силикагелем, ITLC-SG размером 10×100 мм, отступив от одного из краев, отмечают линию старта на расстоянии 15 мм от нижнего края. На линию старта пластинки наносят 0,001-0,005 мл раствора препарата. После подсушивания пятна на воздухе проводят хроматографирование восходящим методом, используя в качестве растворителя (подвижная фаза) метилэтилкетон до достижения подвижной фазы верхнего края пластинки. По окончанию хроматографирования полученную хроматограмму высушивают при комнатной температуре, обклеивают с двух сторон лентой полиэтиленовой с липким слоем. Для определения распределения активности по хроматограмме используют хроматограмм-сканер. В указанном режиме хроматографирования Rf пертехнетат-ионов составляет 0,95±0,05.
Содержание пертехнетат-ионов в препарате определяют как отношение активности участка хроматограммы (80-100) мм к активности всей хроматограммы.
 где:
где: Афронт – относительная активность участка хроматограммы, содержащего пертехнетат-ионы (ТсО4-);
Астарт – относительная активность остальной части хроматограммы.
Содержание пертехнетат-ионов в препарате должно быть не более 2%.
Суммарное содержание примесей (пертехнетат-ионов и ГВТ) не должно превышать 5%.
Утилизация
Весь неиспользованный лекарственный препарат или отходы следует утилизировать в установленном порядке.
Общая характеристика лекарственного препарата Медроскан, 99mТс доступна на информационном портале Евразийского союза в информационно-коммуникационной сети «Интернет» eec.eaeunion.org/.
Комментарии
ПРАКТИКА ПЕДИАТРА
