Коэйт-ДВИ - инструкция по применению
См. откуда получены инструкции МЕДИ РУ
Регистрационный номер
П N012353/01
Торговое наименование препарата
Коэйт-ДВИ
Международное непатентованное наименование
Фактор свертывания крови VIII
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
1 флакон содержит:| Активная субстанция: |
| ||
| Фактор свертывания крови VIII | 200-399 ME* | 400-799 ME* | 800-1400 ME* |
| Вспомогательные вещества: |
| ||
| Альбумин человека | 0,025 г | 0,025 г | 0,05 г |
| Натрия хлорид | 0,044 г | 0,044 г | 0,088 г |
| L-гистидин | 0,016 г | 0,016 г | 0,0316 г |
| Кальция хлорид | 0,0007 г | 0,0007 г | 0,0015 г |
| Растворитель: |
|
|
|
| Вода для инъекций | 5 мл | 5 мл | 10 мл |
*Активность фактора свертывания крови VIII (VIII:С) определялась в соответствии с Международным стандартом (ВОЗ) для концентратов фактора VIII. Специфическая активность после добавления Альбумина (человеческого) составляет 9-22 МЕ/мг белка.
Описание
Лиофилизат: белая или светло-желтая аморфная масса.
Растворитель: прозрачная бесцветная жидкость.
Восстановленный препарат: прозрачная или слабо опалесцирующая, бесцветная или светло-желтая жидкость, возможно присутствие незначительного количества фибрилл (волокон).
Фармакотерапевтическая группа
Гемостатическое средство
Код АТХ
B02BD02
Фармакодинамика:
КОЭЙТ-ДВИ представляет собой высокоочищенный сухой концентрат фактора свертывания крови фVIII, приготовленный из человеческой плазмы, дважды вирусинактивированный (обработка горячим паром и сольвент-детергентная обработка).
Активированный фактор VIII является кофактором активации фактора IX, который ускоряет переход фактора X в активированный фактор X. Активированный фактор X ускоряет переход фактора X в активированный фактор X.
Активированный фактор X необходим для превращения протромбина в тромбин. Тромбин, в свою очередь, превращает фибриноген в фибрин, и формируется сгусток.
Гемофилия А - наследственное сцепленное с полом нарушение свертывающей системы крови, обусловленное дефицитом фVIII, в результате которого у больных развиваются профузные кровотечения или кровоизлияния в суставы, мышцы или внутренние органы как в результате травм и хирургических вмешательств, так и спонтанно. Заместительная терапия повышает содержание фVIII в плазме и тем самым временно корректирует дефицит фактора и снижает тенденцию к кровоточивости. Препарат КОЭЙТ-ДВИ содержит также фактор фон Виллебранда естественного происхождения.
Фармакокинетика:
После введения препарата повышение активности фVIII в плазме составляет от 80 до 120% от ожидаемого.
В фармакокинетических исследованиях восстановление фVIII in vivo через 10 мин после введения КОЭЙТ-ДВИ в среднем составило 1,9% на кг массы тела.
Активность фVIII в плазме крови снижается по двухфазной экспоненциальной кривой. В начальной фазе происходит его распределение между внутрисосудистым руслом и внесосудистыми тканевыми жидкостями с периодом полувыведения из плазмы 3 - 6 часов; примерно от 2/3 до 3/4 внутривенно введенного фVIII остается в сосудистом русле. Последующая, медленная фаза, возможно, отражает распад фVIII. В этой фазе период полувыведения составляет от 8 до 20 часов, в среднем 16,12 часов. Это отражает истинный биологический период полувыведения фVIII.
Показания:
Лечение и профилактика кровотечений при наследственных (гемофилия А) и приобретенных дефицитах фVIII.
Противопоказания:
Повышенная чувствительность к компонентам препарата.
Беременность и лактация:
Контролируемые исследования, подтверждающие безопасность применения концентратов фактора свертывания крови VIII человека в период беременности и лактации, не проводились. Поэтому в период беременности и лактации препарат следует назначать только по строгим показаниям, когда ожидаемая польза превышает возможный риск для плода, матери или грудного ребенка.
Способ применения и дозы:
Препарат после приготовления раствора вводится внутривенно медленно струйно или капельно. После приготовления раствор должен быть введен в течение трех часов. Не замораживать приготовленный раствор!
Терапия должна начинаться под наблюдением врача, имеющего опыт лечения гемофилии. Дозы и продолжительность заместительной терапии зависят от степени дефицита фVIII, локализации, интенсивности кровотечения и тяжести клинического состояния больного.
Количество вводимого фVIII выражается в Международных Единицах (ME), которые соответствуют общепринятому стандарту ВОЗ для препаратов, содержащих фVIII. Активность фVIII в плазме выражается или в процентах (соответствует нормальной плазме человека), или в Международных Единицах (соответствует Международному Стандарту для фVIII в плазме).
Одна Международная Единица (ME) активности фVIII эквивалентна такому же количеству фVIII в 1 мл нормальной плазмы человека.
Расчет дозы
Расчет требуемой дозы фVIII основывается на эмпирически установленном факте, что при введении 1 ME фVIII на кг массы тела активность фVIII в плазме повышается на 1,5-2% от нормальной активности.
Доза препарата рассчитывается по следующей формуле:
|
Необходимая доза КОЭЙТ-ДВИ (ME фVIII) = масса тела (кг) х желаемое повышение фVIII (в %) / 2%/МЕ/кг. |
Пример, ребенок массой тела 15 кг:
Необходимая доза (ME фVIII) = 15 кг х 100% / 2%/МЕ/кг = 750 ME
В каждом конкретном случае количество вводимого препарата и частота введения должны соотноситься с клинической эффективностью.
Если при помощи рассчитанной дозы не удается достичь ожидаемой концентрации уровня фVIII, или если не удается контролировать кровотечение после введения расчетной дозы, следует заподозрить у больного наличие ингибиторов, наличие и уровень которых должно быть подтверждено лабораторно соответствующими тестами. В случае наличия ингибитора, необходимая доза фVIII существенно варьирует и доза может определяться лишь клиническим ответом. Некоторые пациенты с низким титром ингибитора (до 10 единиц Бетезда) могут продолжить лечение фVIII без существенного подъема титра ингибитора. У пациентов с более высоким титром ингибитора может быть необходимо использование других лекарственных средств. Лечение иммунологической толерантности с использованием повторных доз концентрата фVIII, вводимых по заранее расписанной схеме, может привести к исчезновению ингибитора. Наиболее успешным были режимы применения высоких доз фVIII, вводимых как минимум, один раз в день. Однако, считающегося наиболее эффективным режима введения какой-либо определенной дозы выработано не было.
Легкое кровотечение: Несильные поверхностные или ранние кровотечения могут прекращаться при введении дозы равной 10 МЕ/кг массы тела, что приводит к повышению уровня фVIII примерно на 20% in vivo. До появления признаков дальнейшего кровотечения повторного введения не требуется.
Умеренное кровотечение: Для более серьезных кровотечений (например, одиночные гемартрозы, определенные травмы), уровень фVIII следует поднимать на 30-50% путем введения примерно 15-25 МЕ/кг массы тела. При необходимости продолжения терапии повторные дозы могут составлять 10-15 МЕ/кг массы тела и вводиться каждые 8-12 часов до полной остановки кровотечения.
Тяжелые кровотечения: Для достижения гемостаза у больных с угрожающими жизни кровотечениями или кровотечениями в жизненно важные органы (например, центральная нервная система, заглоточное или забрюшинное пространство, влагалище подвздошно-поясничной мышцы) уровень фVIII необходимо увеличить на 80-100% от нормального. Это можно достичь у большинства пациентов при введении КОЭЙТ-ДВИ из расчета 40-50 МЕ/кг массы тела, поддерживающая доза составит 20-25 МЕ/кг массы тела, вводимая каждые 8-12 часов до полной остановки кровотечения.
Хирургические вмешательства: Для крупных хирургических вмешательств уровень фVIII следует поднять примерно до 100% путем введения предоперационно дозы 50 МЕ/кг массы тела. Уровень фVIII следует контролировать до и во время всего операционного периода для подтверждения адекватности заместительной терапии. Для поддержания гемостатического уровня могут понадобиться повторные введения каждые 6-12 часов в течение 10-14 дней после операции. Интенсивность необходимой заместительной терапии фVIII зависит от типа хирургического вмешательства и последующего послеоперационного режима.
Гемостаз для мелких хирургических вмешательств может быть обеспечен менее интенсивными лечебными режимами.
Длительная профилактика: Для длительной профилактики при тяжелых формах гемофилии А рекомендуются дозы 20-40 ME фVIII на кг массы тела каждые 2-3 дня. В некоторых случаях, особенно у пациентов младшего возраста, для профилактики геморрагий может потребоваться уменьшение интервалов между введениями или увеличение доз препарата.
Приготовление раствора препарата
Раствор КОЭЙТ-ДВИ готовится непосредственно перед введением. Приготовленный раствор сохраняет химическую и физическую стабильность в течение 3 часов при температуре 20°-25 °С, однако его следует использовать сразу после приготовления. За условия и длительность хранения приготовленного раствора несет ответственность пользователь. Нельзя использовать мутный раствор или раствор с включениями. Неиспользованный раствор подлежит соответствующей утилизации.
Соблюдайте правила асептики!
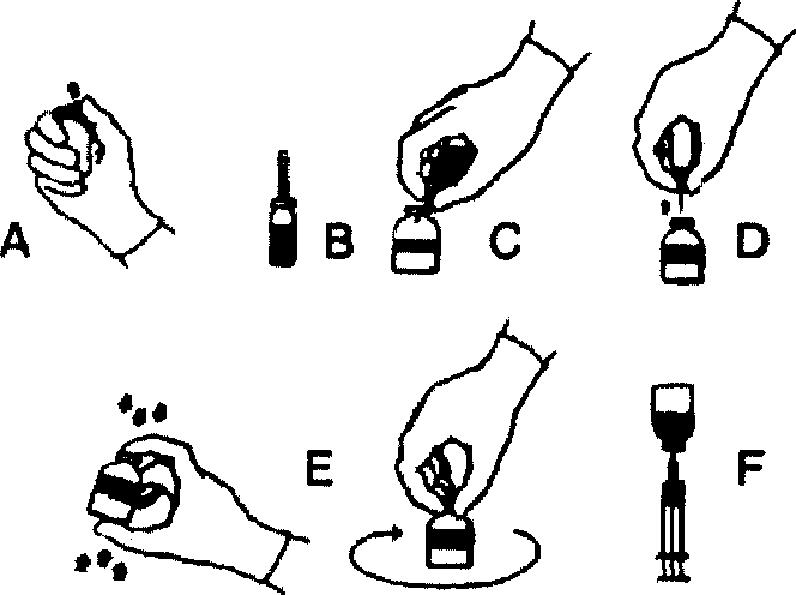
1. Нагрейте флакон с растворителем (стерильной водой для инъекций) до комнатной температуры (не выше 37°С).
2. Удалите защитные крышки с флаконов с концентратом и растворителем (рис. А) и продезинфицируйте резиновые пробки обоих флаконов.
3. Удалите защитное покрытие в виде изолирующей пленки с пластикового картриджа иглы для переноса и проткните пробку флакона с растворителем (рис. В).
4 Удалите защитный колпачок с другого конца системы для переноса. Не касайтесь обнаженного конца системы.
5 Переверните флакон с растворителем над флаконом с сухим концентратом и проткните свободным концом иглы центр пробки флакона (рис.С). За счет вакуума, растворитель перетечет во флакон с препаратом. Держите флакон с растворителем под углом по отношению к флакону с концентратом для того, чтобы направить струю растворителя на стенку флакона с концентратом. Избегайте избыточного вспенивания. Подождите примерно 1 минуту.
6. Разъедините флаконы, вытащив иглу системы для переноса из пробки флакона с препаратом (рис. D). Энергично вращайте флакон до полного растворения, не вызывая излишнего вспенивания (рис. Е).
7. После полного растворения концентрата наберите раствор в шприц через прилагающуюся иглу с фильтром (рис. F). Замените иглу с фильтром на иглу для инъекций и введите раствор внутривенно.
8. Если больному требуется ввести более одного флакона, содержимое двух флаконов может быть набрано в один шприц через разные неиспользованные иглы с фильтром перед присоединением иглы для инъекций.
Введение
Соблюдайте правила асептики!
Продолжительность введения следует определять в соответствии с индивидуальной реакцией больного, однако введение всей дозы в течение 5-10 минут в целом переносится хорошо.
Побочные эффекты:
В ответ на введение препаратов фVIII крайне редко наблюдались реакции гиперчувствительности или аллергические реакции (в том числе ангионевротический отек, чувство жжения в месте инъекции, гиперемия кожи, крапивница, зуд, озноб, головная боль, артериальная гипотензия, сонливость, тошнота, рвота, беспокойство, тахикардия, чувство сдавления в груди, стридорозное дыхание) вплоть до развития анафилактического шока.
В редких случаях возможно повышение температуры тела.
В ответ на введение высоких доз препарата у больных с группами крови А(II), В(III) или AB(IV) может отмечаться гемолиз.
Передозировка:
Симптомы передозировки препаратов фактора свертывания VIII человека неизвестны.
Взаимодействие:
Взаимодействие препаратов фVIII человека с другими лекарственными средствами неизвестно.
Перед введением КОЭЙТ-ДВИ нельзя смешивать с другими лекарственными средствами, что может ухудшить эффективность и безопасность препарата. Желательно промывать общий венозный доступ изотоническим (физиологическим) раствором хлорида натрия перед и после введения КОЭЙТ-ДВИ.
Особые указания:
Развитие аллергических реакций возможно, как и на внутривенное введение любых белковых препаратов. В этих случаях следует немедленно прекратить введение препарата и проводить лечение в зависимости от реакции и ее тяжести. При легких реакциях назначаются антигистаминные препараты, в тяжелых случаях проводится противошоковая терапия. КОЭЙТ-ДВИ производится из плазмы человека.
При использовании плазмы или продуктов, приготовленных из человеческой плазмы, нельзя полностью исключить риск передачи инфекционных агентов, в том числе пока еще не известных. Однако риск передачи инфекционных агентов максимально снижен благодаря следующим мерам:
- тщательный медицинское обследование и отбор доноров и скрининговое тестирование отдельных доз и пулов плазмы на HbsAg и антитела к ВИЧ и гепатиту С;
- исследование пулов плазмы на геномные последовательности вируса гепатита С;
- включение в процесс производства обработки три-N-бутил фосфатом/полисорбатом 80 с последующей тепловой обработкой при 80 °С в течение 72 часов с целью удаления/инактивации вирусов, эффективность которых доказана на вирусах-моделях. Подтверждена эффективность данных методов в отношении ВИЧ-1, ВИЧ-2, гепатитов С, А и В;
- конечный продукт очищается при помощи гелевой хроматографии, что обеспечивает двойной эффект: уменьшение количества три-N -бутил фосфата и полисорбата 80 и увеличение чистоты фVIII.
Используемые в процессе производства методы удаления/инактивации вирусов могут быть частично эффективны в отношении некоторых безоболочечных вирусов, таких как парвовирус В19. Инфекция, вызванная парвовирусом В 19 может привести к серьезному заболеванию у беременных женщин (инфицирование плода) и у пациентов с иммунодефицитом или повышенным распадом эритроцитов (например, при гемолитической анемии).
При лечении плазменными концентратами ф\ЧП рекомендуется соответствующая вакцинация больных (против гепатитов А и В).
При лечении больных гемофилией А возможно развитие такого осложнения, как появление нейтрализующих антител (ингибиторов) к фактору VIII. Эти ингибиторы относятся к классу иммуноглобулинов G, направлены против прокоагулянтной активности фактора VIII и измеряются в Бетезда Единицах (БЕ) на 1 мл плазмы (модифицированный Бетезда метод). Риск развития ингибиторов коррелирует с применением препаратов человеческого фVIII, наибольший риск развития ингибиторов - первые 20 дней введения препарата. Редко ингибиторы могут образовываться после первых 100 дней лечения. Для своевременного выявления ингибиторов следует проводить тщательное клиническое наблюдение и лабораторное обследование больных, находящихся на лечении концентратами человеческого фVIII.
Следует с осторожностью применять у детей до 6 лет, редко получавших лечение препаратами фVIII.
Содержание натрия в максимальной суточной дозе препарата составляет 200 мг, что следует учитывать у лиц, находящихся на гипо- и бессолевой диете.
КОЭЙТ-ДВИ содержит изоагглютинины групп крови в количестве, не являющемся клинически значимом при введении небольших объемов препарата. В случае необходимости введения больших или часто повторяемых доз у пациентов с группами крови А, В или АВ необходимо контролировать уровень гематокрита, а также прямую пробу Кумбса, для своевременного выявления признаков прогрессирующей анемии.
Влияние на способность управлять транспортными средствами и механизмами:
КОЭЙТ-ДВИ не оказывает влияния на способность управления автомобилем и выполнения работы, требующей повышенной концентрации внимания и двигательной реакции.Форма выпуска/дозировка:
Лиофилизат для приготовления раствора для внутривенного введения, 200-399 ME*, 400-799 ME*, 800-1400 ME*.
Упаковка:
· 200 ME-399 МЕ/5 мл (флакон) в комплекте с растворителем 5 мл (флакон), иглой- фильтром, двусторонней иглой и набором для вливания;
· 400 ME-799 МЕ/5 мл (флакон) в комплекте с растворителем 5 мл (флакон), иглой- фильтром, двусторонней иглой и набором для вливания;
· 800 ME-1400 МЕ/10 мл (флакон) в комплекте с растворителем 10 мл (флакон), иглой-фильтром, двусторонней иглой и набором для вливания.
Флакон с лиофилизатом, флакон с растворителем, иглы и набор для вливания помещают в картонную пачку.
Условия хранения:
При температуре от 2 до 8°С в защищенном от света месте.
Хранить в недоступном для детей месте.
Приготовленный раствор для внутривенного введения может храниться не более 3 часов.
Может храниться в течение 6 месяцев при комнатной температуре (не выше 25°С) без потери активности фактора VIII.
Следует избегать замораживания препарата, так как флакон с растворителем может лопнуть.
Срок годности:
2 года.
Не использовать по истечении срока годности.
Условия отпуска
По рецепту
Производитель
Талекрис Биотерапьютикс Инк, Р.О. Box 110526, 4101 Research Triangle Park, North Carolina 27709, USA, США
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Талекрис Биотерапьютикс Инк
Комментарии
ПРАКТИКА ПЕДИАТРА
