Апбрави - инструкция по применению
См. откуда получены инструкции МЕДИ РУ
Регистрационный номер:
ЛП-005577Торговое наименование:
Апбрави
Международное непатентованное наименование:
селексипаг
Лекарственная форма:
таблетки, покрытые плёночной оболочкой
Состав
1 таблетка 200 мкг содержит:
Ядро:
Действующее вещество: селексипаг 0,2 мг.
Вспомогательные вещества: маннитол, крахмал кукурузный, гипролоза низкозамещенная, гипролоза, магния стеарат.
Плёночная оболочка: гипромеллоза, пропиленгликоль, титана диоксид, краситель железа оксид жёлтый, воск карнаубский.
1 таблетка 800 мкг содержит:
Ядро:
Действующее вещество: селексипаг 0,8 мг.
Вспомогательные вещества: маннитол, крахмал кукурузный, гипролоза низкозамещенная, гипролоза, магния стеарат.
Плёночная оболочка: гипромеллоза, пропиленгликоль, титана диоксид, краситель железа оксид жёлтый, краситель железа оксид чёрный, воск карнаубский.
Описание
Таблетки 200 мкг: круглые двояковыпуклые таблетки, покрытые плёночной оболочкой, светло-жёлтого цвета, с тиснением “2” на одной стороне, с фаской с двух сторон, без риски.
Таблетки 800 мкг: круглые двояковыпуклые таблетки, покрытые плёночной оболочкой, тёмного серо-зелёного цвета, с тиснением “8” на одной стороне, с фаской с двух сторон, без риски.
Фармакотерапевтическая группа:
Антиагрегантное средство
Код ATX:
В01АС27
Фармакологические свойства
Механизм действия
Селексипаг является селективным агонистом простациклиновых (IP) рецепторов, отличным от простациклина и его аналогов. Селексипаг гидролизуется карбоксилэстеразами с образованием активного метаболита, активность которого примерно в 37 раз превышает активность селексипага. Селексипаг и его активный метаболит являются высокоафинными агонистами IP рецепторов с высокой чувствительностью к IP рецепторам по сравнению с другими рецепторами простаноидов (ЕР1-ЕР4, DP, FP и ТР). Селективность в отношении EP1, ЕР3, FP и ТР рецепторов важна, так как эти рецепторы отвечают за сократительную активность в желудочно-кишечном тракте и кровеносных сосудах. Селективность в отношении ЕР2, ЕР4 и DP1 рецепторов важна, так как эти рецепторы опосредуют иммуносупрессивные эффекты.
Стимулирование селексипагом и его активным метаболитом IP рецепторов приводит к вазодилятации, а также антипролиферативному и антифибротическому эффектам. Селексипаг предотвращает ремоделирование сердца и лёгких у крыс с лёгочной артериальной гипертензией (ЛАГ) и вызывает пропорциональное снижение лёгочного и периферического давления, показывая, что периферическая вазодилятация отражает фармакодинамическую эффективность в отношении лёгочных сосудов. Селексипаг не вызывает десенсибилизацию IP рецепторов in vitro и тахифилаксию у крыс.
Фармакодинамика
Электрофизиология сердца
Применение повторных доз 800 мкг и 1600 мкг селексипага дважды в день не влияло на сердечную реполяризацию (интервал QTc) или проведение (интервалы PR и QRS) и вызывало умеренное повышение частоты сердечных сокращений (ЧСС).
Факторы свёртывания крови
Наблюдалось незначительное снижение уровня фактора Виллебранда в плазме крови; уровень фактора Виллебранда при этом оставался выше нижней границы нормы.
Лёгочная гемодинамика
При совместном применении селексипага в индивидуально переносимой дозе с антагонистами эндотелиальных рецепторов (АРЭ) и/или ингибиторами фосфодиэстеразы 5-го типа (иФДЭ-5) у пациентов с ЛАГ (II-III функциональных классов (ФК) по классификации Всемирной организации здравоохранения (ВОЗ)) достоверно снижалось лёгочное сосудистое сопротивление и повышался сердечный индекс.
Фармакокинетика
Фармакокинетика селексипага и его активного метаболита, после применения однократной и повторных доз, была пропорциональной в диапазоне доз до 800 мкг для однократной дозы и до 1800 мкг два раза в день для повторных доз. После применения повторных доз равновесные состояния селексипага и активного метаболита достигаются в течение 3 дней. Кумуляция селексипага или активного метаболита в плазме крови после применения повторных доз не наблюдалась.
У здоровых добровольцев вариабельность степени воздействия (площадь под кривой «концентрация-время», AUC) между индивидуумами в равновесном состоянии составила 43% и 39% для селексипага и активного метаболита, соответственно. Индивидуальная вариабельность AUC составила 24% и 19% для селексипага и активного метаболита, соответственно.
AUC селексипага и его активного метаболита в равновесном состоянии у пациентов с ЛАГ и здоровых добровольцев была сходной. Фармакокинетика селексипага и его активного метаболита у пациентов с ЛАГ не зависела от тяжести заболевания и не изменялась с течением времени.
Абсорбция
Селексипаг быстро абсорбируется и гидролизуется карбоксилэстеразами до его активного метаболита. Максимальная концентрация селексипага и его активного метаболита в плазме крови после перорального применения достигается в течение 1-3 ч и 3-4 ч, соответственно. Абсолютная биодоступность селексипага у человека составляет около 49%. Наиболее вероятно, это является следствием эффекта первого прохождения селексипага через печень, так как концентрации активного метаболита в плазме крови являются схожими после перорального и внутривенного введения.
AUC селексипага после приёма однократной дозы 400 мкг во время еды увеличивается на 10% у представителей европеоидной расы и снижается на 15% у представителей японской нации, в то время как степень воздействия активного метаболита снижается на 27% (у представителей европеоидной расы) и 12% (у представителей японской нации). Нежелательные явления наблюдаются чаще при приёме препарата натощак по сравнению с применением во время еды.
Распределение
Селексипаг и его активный метаболит высоко связываются с белками плазмы крови (примерно 99% в сумме и в равной степени с альбумином и альфа-1 кислым гликопротеином). Объём распределения селексипага в равновесном состоянии составляет 11,7 л.
Биотрансформация
Селексипаг гидролизуется в активный метаболит карбоксилэстеразами в печени и в кишечнике. Окислительный метаболизм, катализируемый в основном изоферментом CYP2C8 и в меньшей степени изоферментом CYP3A4, приводит к образованию гидроксилированных и деалкилированных продуктов. Изоферменты UGT1A3 и UGT2B7 вовлечены в конъюгацию активного метаболита с глюкуроновой кислотой. За исключением активного метаболита, концентрация каждого метаболита в плазме крови не превышает 3% от общего содержания производных препарата. У здоровых добровольцев и у пациентов с ЛАГ после перорального приёма AUC активного метаболита в равновесном состоянии примерно в 3-4 раза выше по сравнению с неизмененным препаратом.
Выведение
Выведение селексипага осуществляется преимущественно через метаболизм со средним конечным периодом полувыведения 0,8-2,5 ч. Период полувыведения активного метаболита составляет 6,2-13,5 ч. Общий клиренс селексипага составляет 17,9 л/ч. Полное выведение наблюдается через 5 дней после приёма препарата и осуществляется преимущественно через кишечник (составляет 93% от принятой дозы) по сравнению с выведением через почки (12%).
Особые популяции пациентов
Не обнаружено клинически значимого влияния пола, расы, возраста или веса на фармакокинетику селексипага и его активного метаболита у пациентов с ЛАГ.
Пациенты с нарушением функции почек
У пациентов с тяжёлыми нарушениями функции почек (расчётная скорость клубочковой фильтрации (рСКФ) <30 мл/мин/1,73 м²) наблюдается увеличение AUC селексипага и его активного метаболита в 1,4-1,7 раза.
Пациенты с нарушением функции печени
У пациентов с нарушением функции печени лёгкой (класс А по классификации Чайлд-Пью) и средней (класс В по классификации Чайлд-Пью) степени AUC селексипага в 2 и 4 раза выше, соответственно, по сравнению со здоровыми добровольцами. AUC активного метаболита остаётся практически неизменной у пациентов с нарушением функции печени лёгкой степени и увеличивается в два раза у пациентов с нарушением функции печени средней степени. Только два пациента с нарушением функции печени тяжёлой степени (класс С по классификации Чайлд-Пью) принимали селексипаг. AUC селексипага и его активного метаболита у данных пациентов была схожей со степенью воздействия у пациентов с нарушением функции печени средней степени (класс В по классификации Чайлд-Пью).
На основании данных моделирования исследования предполагается, что AUC в равновесном состоянии у пациентов с нарушением функции печени средней степени (класс В по классификации Чайлд-Пью), принимающих препарат один раз в день, будет в два раза выше, чем у здоровых добровольцев, принимающих препарат два раза в день. AUC активного метаболита в равновесном состоянии у этих пациентов, принимающих препарат один раз в день, должна быть сходной с AUC у здоровых добровольцев, принимающих препарат два раза в день. Предполагаемая AUC в равновесном состоянии у пациентов с нарушением функции печени тяжёлой степени (класс С по классификации Чайлд-Пью) является схожей с пациентами с нарушением функции печени средней степени, принимающими препарат один раз в день.
Показания к применению
Препарат Апбрави показан для длительного лечения лёгочной артериальной гипертензии у взрослых пациентов (ЛАГ, группа I по классификации ВОЗ) II-IV ФК по классификации ВОЗ, с целью предотвращения прогрессирования заболевания. Прогрессирование заболевания может включать: смерть, госпитализацию по поводу ЛАГ, начало внутривенного или подкожного введения простаноидов, или другие случаи прогрессирования заболевания (снижение дистанции в тесте 6-минутной ходьбы, ассоциированное с ухудшением симптомов ЛАГ или необходимостью в дополнительной ЛАГ-специфической терапии).
Апбрави эффективен в комбинации с АРЭ и/или иФДЭ-5, или в составе тройной терапии с АРЭ и иФДЭ-5, или в монотерапии.
Эффективность Апбрави доказана в отношении идиопатической и наследственной ЛАГ, ЛАГ, ассоциированной с заболеваниями соединительной ткани, ЛАГ, ассоциированной с компенсированным простым врождённым пороком сердца.
Противопоказания
- Повышенная чувствительность к действующему и вспомогательным веществам
- Тяжёлая ишемическая болезнь сердца или нестабильная стенокардия
- Инфаркт миокарда, перенесённый в течение предшествующих 6 месяцев
- Декомпенсированная сердечная недостаточность при отсутствии пристального наблюдения врача
- Тяжёлые нарушения сердечного ритма
- Цереброваскулярные заболевания (например, преходящее нарушение мозгового кровообращения, инсульт), перенесённые в течение предшествующих 3 месяцев
- Врождённые или приобретённые пороки сердца с клинически значимыми нарушениями функции миокарда, не связанными с ЛАГ
- Совместное применение с мощными ингибиторами CYP2C8 (например, гемфиброзилом)
- Беременность и период грудного вскармливания
- Детский возраст до 18 лет (эффективность и безопасность не изучены)
С осторожностью
У пациентов с артериальной гипотензией, у пациентов с веноокклюзионной болезнью лёгких, при совместном применении с умеренными ингибиторами изофермента CYP2C8 (например, клопидогрелем, деферазироксом, терифлуномидом), у пациентов старше 75 лет (ограниченный опыт применения), у пациентов с нарушением функции печени тяжёлой степени (класс С по классификации Чайлд-Пью), у пациентов с нарушением функции почек тяжёлой степени (рСКФ <30 мл/мин/1,73 м²), у пациентов с гипертиреозом и у женщин детородного возраста.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Апбрави во время беременности отсутствуют. В исследованиях на животных не отмечены прямые или непрямые неблагоприятные эффекты токсического действия на репродуктивную функцию. Селексипаг и его основной метаболит показали в 20-80 раз более низкий потенциал в отношении рецепторов простациклина in vitro для видов животных, используемых при исследовании репродуктивной токсичности, по сравнению с человеческой популяцией. Следовательно, резерв безопасности для потенциальных эффектов, связанных с рецептором простациклина, по влиянию на репродуктивность соответственно ниже, чем для эффектов, не связанных с рецептором простациклина.
Апбрави не рекомендуется применять женщинам во время беременности и женщинам детородного возраста, не использующим методы контрацепции.
Период грудного вскармливания
Неизвестно, выделяется ли селексипаг или его метаболиты с грудным молоком у женщин. Поскольку доклинические исследования на крысах показали выделение селексипага или его метаболитов с грудным молоком, нельзя исключить потенциальный риск для ребёнка.
Апбрави не должен приниматься в период грудного вскармливания.
Фертильность
Данные о влиянии на фертильность человека отсутствуют.
В доклинических исследованиях на крысах селексипаг в высоких дозах вызывал кратковременное нарушение менструального цикла, которое не оказывало влияния на фертильность. Значимость этого эффекта для человека неизвестна.
Способ применения и дозы
Апбрави применяют внутрь два раза в сутки (утром и вечером), запивая необходимым количеством воды. Для улучшения переносимости рекомендовано принимать Апбрави одновременно с приёмом пищи, а также, в начале каждой фазы титрования дозы, принимать первую повышенную дозу вечером. Не следует делить, крошить или разжёвывать таблетки. Слабовидящие пациенты должны быть проинструктированы о необходимости обратиться за помощью к другому человеку на время титрования дозы Апбрави.
Титрование дозы
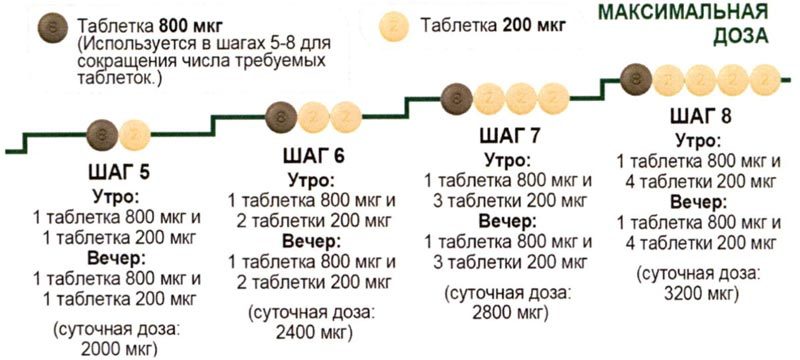
Для каждого пациента с помощью титрования дозы должна быть подобрана индивидуальная максимальная переносимая доза, в диапазоне от 200 мкг два раза в день до 1600 мкг два раза в день (индивидуальная поддерживающая доза).
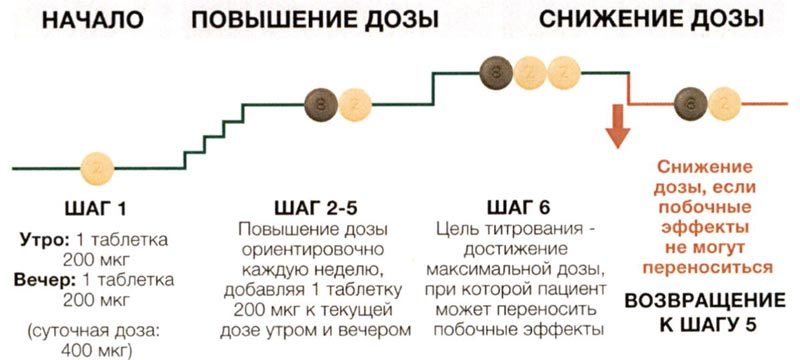
Рекомендуемая начальная доза – 200 мкг два раза в день с интервалом примерно 12 ч между приёмами. Дозу увеличивают с шагом 200 мкг два раза в день, обычно с периодичностью 1 раз в неделю. В начале терапии и в начале каждого этапа повышения дозы рекомендуется принимать первую дозу вечером.
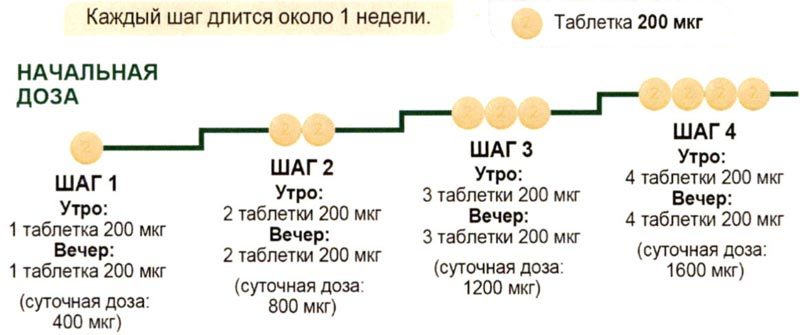
Во время титрования дозы могут возникать некоторые нежелательные реакции, связанные с механизмом действия Апбрави (такие как, головная боль, диарея, тошнота и рвота, боль в челюсти, миалгия, боль в конечностях, артралгия, приливы крови к лицу и верхней половине тела). Данные нежелательные реакции обычно являются преходящими или купируются симптоматическим лечением. Однако, если пациенту назначена доза, которую он не может переносить, она должна быть снижена до предыдущего уровня.
У пациентов, у которых титрование дозы невозможно по причинам, отличным от возникновения нежелательных реакций, обусловленных механизмом действия Апбрави, может быть предпринята вторая попытка титрования дозы до достижения индивидуальной максимальной переносимой дозы, не превышающей 1600 мкг два раза в день.
Индивидуальная поддерживающая доза
Максимальная переносимая доза, достигнутая в процессе титрования, должна приниматься на регулярной основе. Если переносимость терапии с применением данной дозы с течением времени ухудшается, может быть назначено симптоматическое лечение и/или снижение дозы до предыдущего уровня.
Прерывание применения или отмена препарата
В случае пропуска одной дозы, она должна быть принята как можно ранее. Вместе с тем, не следует принимать пропущенную дозу менее чем за 6 ч до приёма следующей дозы. Если лечение было приостановлено на 3 дня и более, приём Апбрави должен быть возобновлен с применением более низкой дозы с последующим титрованием.
Опыт резкой отмены Апбрави у пациентов с ЛАГ ограничен. Не наблюдалось случаев резкого возобновления симптомов. Однако, если было принято решение об отмене Апбрави, отмена должна осуществляться постепенно с последующим назначением альтернативной терапии.
Пожилые пациенты (старше 65 лет)
Коррекция режима дозирования препарата у пожилых пациентов не требуется (см. раздел «Фармакокинетика»). Опыт применения Апбрави у пожилых пациентов старше 75 лет ограничен, в связи с чем препарат должен применяться с осторожностью у данной группы пациентов.
Нарушение функции печени
Апбрави не должен назначаться пациентам с нарушением функции печени тяжёлой степени (класс С по классификации Чайлд-Пью). У пациентов с нарушением функции печени средней степени (класс В по классификации Чайлд-Пью) начальная доза должна составлять 200 мкг один раз в день с шагом повышения дозы 200 мкг 1 раз в день с интервалом около 1 недели до возникновения нежелательных реакций, связанных с механизмом действия селексипага, которые не могут переноситься или купироваться соответствующим лечением. Коррекция режима дозирования препарата у пациентов с нарушением функции печени лёгкой степени (класс А по классификации Чайлд-Пью) не требуется.
Нарушение функции почек
Коррекция режима дозирования препарата у пациентов с нарушением функции почек лёгкой или средней степени не требуется. Не требуется коррекция начальной дозы у пациентов с нарушением функции почек тяжёлой степени (рСКФ <30 мл/мин/1,73 м²); титрование дозы должно выполняться с осторожностью у данной группы пациентов.
Дети (до 18 лет)
Эффективность и безопасность применения Апбрави у детей до 18 лет не установлена.
Побочное действие
Обзор профиля безопасности
Наиболее часто отмечавшимися нежелательными реакциями являются головная боль, диарея, тошнота, рвота, боль в челюсти, боль в конечностях, артралгия, приливы крови к лицу и верхней половине тела. Данные реакции наиболее часто наблюдаются во время титрования дозы. Большинство данных реакций лёгкой или умеренной интенсивности.
Список нежелательных реакций
Нежелательные реакции, отмеченные в ходе применения селексипага, представлены в таблице ниже. В пределах каждой частоты нежелательные реакции перечислены в порядке уменьшения их серьёзности.
| Системы органов |
Очень часто (≥1/10) |
Часто (≥1/100 до <1/10) |
Нечасто (≥1/1000 до <1/100) |
| Нарушения со стороны крови и лимфатической системы | Анемия Снижение гемоглобина |
||
| Нарушения со стороны эндокринной системы | Гипертиреоз Снижение концентрации тиреотропного гормона (ТТГ) в крови |
||
| Нарушения со стороны обмена веществ и питания | Снижение аппетита Снижение веса |
||
| Нарушения со стороны нервной системы | Головная боль* | ||
| Нарушения со стороны сердца | Синусовая тахикардия | ||
| Сосудистые нарушения | Приливы крови к лицу и верхней половине тела | Артериальная гипотензия | |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Назофарингит (неинфекционной природы) | Заложенность носа | |
| Нарушения со стороны желудочно-кишечного тракта | Диарея* Рвота* Тошнота* |
Боль в животе | |
| Нарушения со стороны кожи и подкожных тканей | Кожная сыпь Крапивница Эритема |
||
| Нарушения со стороны скелетно-мышечной и соединительной ткани | Боль в челюсти* Миалгия* Артралгия* Боль в конечностях* |
||
| Общие расстройства и нарушения в месте введения | Боль |
*смотрите подраздел Описание отдельных нежелательных реакций
Описание отдельных нежелательных реакций
Фармакологические эффекты, связанные с режимом титрования дозы и режимом поддерживающей терапии
Нежелательные реакции, связанные с механизмом действия селексипага наблюдались часто, особенно во время индивидуального титрования дозы:
| Нежелательные реакции, связанные с аналогами простациклина |
Титрование дозы | Поддерживающая терапия | ||
| Селексипаг | Плацебо | Селексипаг | Плацебо | |
| Головная боль | 64% | 28% | 40% | 20% |
| Диарея | 36% | 12% | 30% | 13% |
| Тошнота | 29% | 13% | 20% | 10% |
| Боль в челюсти | 26% | 4% | 21% | 4% |
| Миалгия | 15% | 5% | 9% | 3% |
| Боль в конечностях | 14% | 5% | 13% | 6% |
| Рвота | 14% | 4% | 8% | 6% |
| Приливы крови к лицу и верхней половине тела | 11% | 4% | 10% | 3% |
| Артралгия | 7% | 5% | 9% | 5% |
Данные нежелательные реакции обычно являются транзиторными или купируются симптоматическим лечением. 7,5% пациентов в группе селексипага прекратили лечение вследствие нежелательных реакций. Примерная частота серьёзных нежелательных реакций в группе селексипага составила 2,3% и 0,5% в группе плацебо. В клинической практике нежелательные реакции со стороны желудочно-кишечного тракта купировались противодиарейными и противорвотными препаратами, препаратами для устранения тошноты и/или препаратами для лечения функциональных нарушений со стороны желудочно-кишечного тракта. Нежелательные реакции, связанные с болью, наиболее часто купировались анальгетиками (такими как парацетамол).
Снижение гемоглобина
В клиническом исследовании у пациентов с ЛАГ при применении селексипага среднее абсолютное изменение уровня гемоглобина по сравнению с исходным уровнем составило от -0,34 до -0,02 г/дл, снижение уровня гемоглобина ниже 10 г/дл наблюдалось у 8,6% пациентов.
Гипертиреоз
В клиническом исследовании у пациентов с ЛАГ при применении селексипага гипертиреоз наблюдался у 1,6% пациентов. Снижение медианы (до -0,3 МЕ/л по сравнению с медианой исходного уровня на момент включения в исследования 2,5 МЕ/л) ТТГ наблюдалось у пациентов в группе селексипага в большинстве регулярных визитов.
Повышение ЧСС
Транзиторное повышение среднего значения ЧСС на 3-4 уд/мин наблюдается через 2-4 ч после приёма дозы препарата.
Передозировка
Сообщалось об отдельных случаях передозировки при приёме доз до 3200 мкг, следствием которой являлась только лёгкая транзиторная тошнота. В случае передозировки, показана соответствующая поддерживающая терапия. Маловероятно, что диализ будет эффективным по причине высокой связи селексипага и его активного метаболита с белками плазмы крови.
Взаимодействие с другими лекарственными средствами
Влияние других лекарственных средств на селексипаг
Селексипаг гидролизуется до его активного метаболита карбоксилэстеразами. Селексипаг и его активный метаболит подвергаются окислительному метаболизму в основном изоферментом CYP2C8 и в меньшей степени изоферментом CYP3A4. Конъюгация активного метаболита с глюкуроновой кислотой катализируется изоферментами UGT1A3 и UGT2B7. Селексипаг и его активный метаболит являются субстратами изоферментов ОАТР1В1 и ОАТР1ВЗ. Селексипаг является слабым субстратом эффлюксного насоса Р-гликопротеина. Активный метаболит селексипага является слабым субстратом белка резистентности рака молочной железы.
Варфарин не оказывает влияния на фармакокинетику селексипага и его активного метаболита.
Ингибиторы изофермента CYP2C8
Сопутствующее применение 600 мг гемфиброзила, мощного ингибитора изофермента CYP2C8, два раза в день увеличивает AUC селексипага примерно в два раза, в то время как AUC активного метаболита, оказывающего основной фармакологический эффект, увеличивается примерно в 11 раз. Совместное применение Апбрави с мощными ингибиторами изофермента CYP2C8 (например, гемфиброзилом) противопоказано. Влияние умеренных ингибиторов изофермента CYP2C8 (например, клопидогрела, деферазирокса, терифлуномида) на степень воздействия селексипага и его активного метаболита не изучалось. Так как потенциальное фармакокинетическое взаимодействие исключить нельзя, следует рассмотреть вопрос о коррекции дозы Апбрави в случае совместного назначения с умеренным ингибитором изофермента CYP2C8 или его отмены.
Индукторы изофермента CYP2C8
Сопутствующее применение 600 мкг рифампицина, индуктора изофермента CYP2C8 (и ферментов группы УДФ-глюкуронозилтрансферазы (UGT)), один раз в день не оказывает влияния на AUC селексипага, однако приводит к снижению AUC его активного метаболита в 2 раза. Может потребоваться корректировка дозы селексипага в случае совместного применения с индукторами изофермента CYP2C8 (например, рифампицином, карбамазепином, фенитоином).
Ингибиторы изоферментов UGT1A3 и UGT2B7
Влияние мощных ингибиторов изоферментов UGT1A3 и UGT2B7 (вальпроевой кислоты, пробенецида, флуконазола) на AUC селексипага и его активного метаболита не изучалось. Так как потенциальное фармакокинетическое взаимодействие исключить нельзя, следует соблюдать осторожность при совместном применении данных лекарственных препаратов с Апбрави.
Ингибиторы и индукторы изофермента CYP3A4
Сопутствующее применение 400/100 мг лопинавира/ритонавира, мощного ингибитора CYP3A4, два раза в день увеличивает AUC селексипага примерно в два раза, в то время как AUC его активного метаболита не изменяется. Принимая во внимание то, что фармакологическая активность активного метаболита в 37 раз выше активности селексипага, данное влияние не является клинически значимым. Вследствие того, что мощный ингибитор изофермента CYP3A4 не оказывает влияния на фармакокинетику активного метаболита, показывая, что путь метаболизма с участием изофермента CYP3A4 не является ключевым в выведении активного метаболита, не ожидается влияния индукторов изофермента CYP3A4 на фармакокинетику активного метаболита.
ЛАГ-специфическая терапия
Применение селексипага в комбинации с АРЭ и иФДЭ-5 приводит к снижению AUC активного метаболита селексипага на 30%.
Ингибиторы белков-переносчиков (лопинавир/ритонавир)
Сопутствующее применение 400/100 мг лопинавира/ритонавира, мощного ингибитора транспортного полипептида органических анионов (ОАТР) (ОАТР1В1 и ОАТР1В3) и Р-гликопротеина, два раза в день увеличивает AUC селексипага примерно в два раза, в то время как AUC его активного метаболита не изменяется. Принимая во внимание то, что фармакологический эффект обусловлен в основном активным метаболитом селексипага, данное влияние не является клинически значимым.
Влияние селексипага на другие лекарственные средства
Селексипаг и его активный метаболит в клинически значимых концентрациях не ингибируют и не индуцируют ферменты цитохрома Р450 и белки-транспортёры.
Антикоагулянты и ингибиторы агрегации тромбоцитов
Селексипаг является ингибитором агрегации тромбоцитов in vitro. Повышенный риск кровотечений при приёме селексипага не наблюдается, в том числе, когда препарат принимается совместно с антикоагулянтами или ингибиторами агрегации тромбоцитов. Селексипаг в дозе 400 мкг два раза в день не изменяет AUC S-варфарина (субстрат изофермента CYP2C9) и R-варфарина (субстрат изофермента CYP3A4) после приёма однократной дозы 20 мг варфарина. Фармакодинамический эффект варфарина на международное нормализованное отношение (МНО) не изменялся при совместном применении с селексипагом.
Мидазолам
В равновесном состоянии после титрования дозы до 1600 мкг дважды в день, не наблюдается клинически значимого изменения AUC мидозалама, субстрата изофермента CYP3A4 в кишечнике и печени, или его метаболита, 1-гидроксимидазолама. Совместное применение селексипага с субстратами изофермента CYP3A4 не требует коррекции дозы.
Гормональные контрацептивы
Исследований лекарственного взаимодействия с гормональными контрацептивами не проводилось. Так как селексипаг не оказывает влияния на AUC субстратов изофермента CYP3A4 (мидазолама и R-варфарина) или субстрата изофермента CYP2C9 (S-варфарина), снижения эффективности гормональных контрацептивов при совместном применении с селексипагом не ожидается.
Особые указания
Артериальная гипотензия
Апбрави обладает вазодилатирующими свойствами, которые могут приводить к снижению давления крови в сосудах. До назначения Апбрави следует тщательно оценить, могут ли определённые патологические состояния у пациента ухудшаться вследствие вазодилатирующих эффектов селексипага (например, у пациентов, получающих антигипертензивную терапию, пациентов с артериальной гипотензией в состоянии покоя, гиповолемией, тяжёлой обструкцией выходного отдела левого желудочка или вегетативной дисфункцией).
Гипертиреоз
У некоторых пациентов, получающих Апбрави, может наблюдаться гипертиреоз. В случае появления признаков и симптомов гипертиреоза рекомендованы соответствующие исследования функции щитовидной железы.
Веноокклюзионная болезнь лёгких
Сообщалось о случаях отёка лёгких при применении вазодилятаторов (в основном производных простациклина) у пациентов с веноокклюзионной болезнью лёгких. Следовательно, в случае появления признаков отёка лёгких при приёме Апбрави у пациентов с ЛАГ, пациент должен быть обследован на предмет веноокклюзионной болезни лёгких. В случае подтверждения диагноза, лечение Апбрави должно быть прекращено.
Умеренные ингибиторы изофермента CYP2C8
Совместное применение селексипага с умеренными ингибиторами изофермента CYP2C8 (например, клопидогрелем, деферазироксом, терифлуномидом) может приводить к увеличению AUC селексипага и его активного метаболита. Следует рассмотреть вопрос о коррекции дозы селексипага в случае совместного назначения умеренного ингибитора изофермента CYP2C8 или его отмены.
Пожилые пациенты (старше 65 лет)
Опыт применения селексипага у пациентов старше 75 лет ограничен, в связи с чем Апбрави должен назначаться с осторожностью у данной группы пациентов.
Нарушение функции печени
Опыт применения селексипага у пациентов с нарушением функции печени тяжёлой степени (класс С по классификации Чайлд-Пью) отсутствует, в связи с чем Апбрави не показан для лечения данной группы пациентов. AUC селексипага и его активного метаболита увеличивается у пациентов с нарушением функции печени средней степени (класс В по классификации Чайлд-Пью). У пациентов с нарушением функции печени средней степени Апбрави должен применяться один раз в день.
Нарушение функции почек
Титрование дозы у пациентов с нарушением функции почек тяжёлой степени (рСКФ <30 мл/мин/1,73 м²) должно проводиться с осторожностью. Опыт применения Апбрави у пациентов, находящихся на гемодиализе, отсутствует, в связи с чем Апбрави не должен применяться у данной группы пациентов.
Женщины детородного возраста
Женщины детородного возраста должны применять надёжные методы контрацепции во время приёма селексипага.
Влияние на способность управлять транспортными средствами и другими механизмами
Апбрави в малой степени влияет на способность управлять транспортными средствами и механизмами. Клиническое состояние пациента и профиль нежелательных реакций селексипага (такие как головная боль или гипотензия) должны быть приняты во внимание при рассмотрении способности пациента управлять транспортными средствами или механизмами.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 200 мкг
По 10 таблеток в блистере из полиамид/алюминий/ПЭ высокой плотности/ПЭ с осушителем/ ПЭ высокой плотности, запаянном алюминиевой фольгой.
По 6 блистеров с инструкцией по медицинскому применению в картонной пачке с контролем первого вскрытия.
По 14 блистеров с инструкцией по медицинскому применению в картонной пачке с контролем первого вскрытия (упаковка для титрования дозы).
Таблетки, покрытые плёночной оболочкой, 800 мкг
По 10 таблеток в блистере из полиамид/алюминий/ПЭ высокой плотности/ПЭ с осушителем/ ПЭ высокой плотности, запаянном алюминиевой фольгой.
По 6 блистеров с инструкцией по медицинскому применению в картонной пачке с контролем первого вскрытия.
Условия хранения
При температуре не выше 30 °С.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Держатель (владелец) регистрационного удостоверения
Актелион Фармасьютикалз Лтд., Швейцария
Гевербештрассе 16, 4123 Альшвиль, Швейцария
Actelion Pharmaceuticals Ltd., Switzerland
Gewerbestrasse 16, 4123 Allschwil, Switzerland
Производитель
Экселла ГмбХ и Ко. КГ, Германия
Нюрнбергер Штрассе 12, 90537 Фойхт, Германия
Excella GmbH & Со. KG, Germany
Nuernberger Strasse 12, 90537 Feucht, Germany
Фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка)
Оллпэк Груп АГ, Швейцария
Пфеффингерштрассе 45, 4153 Райнах Базель-Ланд, Швейцария
Allpack Group AG, Switzerland
Pfeffingerstrasse 45, 4153 Reinach BL, Switzerland
Выпускающий контроль качества
Актелион Фармасьютикалз Лтд., Швейцария
Гевербештрассе 12, 4123 Альшвиль, Швейцария
Actelion Pharmaceuticals Ltd., Switzerland
Gewerbestrasse 12, 4123 Allschwil, Switzerland
Организация, уполномоченная держателем (владельцем) РУ принимать сведения о рекламациях, нежелательных лекарственных реакциях и предоставлять потребителям дополнительные данные о препарате:
ООО «Актелион Фармасьютикалз РУС», Россия,
127055, г. Москва, ул. Новослободская д. 23
Комментарии
ПРАКТИКА ПЕДИАТРА
