Сравнительное изучение эффективности и переносимости оригинального и дженерического препаратов бисопролола в виде монотерапии или комбинации с S-амлодипином и индапамидом у больных артериальной гипертонией 1-2 степени.
СтатьиС.Ю. Марцевич, С.Н. Толпыгина*, В.П. Воронина, О.В. Лерман, Ю.В. Лукина, Н.А. Дмитриева, И.В. Вашурина
ФГУ Государственный научно-исследовательский центр профилактической медицины. 101990 Москва, Петроверигский переулок, 10 Цель. Изучить клиническую эквивалентность двух препаратов бисопролола (оригинальный и дженерический) у больных АГ 1-2 степени по протоколу, рекомендованному ВНОК для проведения сравнительных исследований.
Материал и методы. Обследованы 30 пациентов с АГ 1-2 степени. Пациенты были рандомизированы в группу 1 (оригинальный бисопролол 5 мг/сут) или группу 2 (дженерический бисопролол 5 мг/сут). При недостаточном эффекте доза бисопролола увеличивалась или добавлялся S-амлодипин, а затем индапамид. После окончания 1-го этапа (8 недель) и 2-недельного периода отмены препаратов начинался 2-й аналогичный этап (прием альтернативного препарата бисопролола). Пациентам проводилась регистрация АД, ЧСС, ЭКГ, нежелательных эффектов.
Результаты. Среднее снижение АД после 8 недель терапии составило 27,2±12,2/12,0±6,1 мм рт.ст. в группе 1 и 29,9±10,5/12,5±7,2 мм рт.ст. в группе 2 (оба p<0,001), межгрупповые различия недостоверны. Целевые значения АД были достигнуты у 79,3% больных в обеих группах. Суммарное снижение ЧСС составило 11,1±12,9 в группе 1 и 8,5±8,6 уд/мин в группе 2 (оба p<0,05). Достоверной динамики интервала PQ в обеих группах не выявлено. Группы были сопоставимы по безопасности и переносимости лечения.
Заключение. Показана терапевтическая эквивалентность оригинального и дженерического препаратов бисопролола при лечении больных АГ 1-2 степени.
Ключевые слова: бета-блокаторы, бисопролол, артериальная гипертензия, оригинальный препарат, дженерик, терапевтическая эквивалентность.
A comparative study of the efficacy and tolerability of original and generic bisoprolol monotherapy or combination with S-amlodipine and indapamide in hypertensive patients 1-2 degrees. Results of clinical randomized crossover study
Martsevich S.Yu., Tolpygina S.N.*, Voronina V.P., Lerman O.V., Lukina Yu.V., Dmitrieva N.A., Vashurina I.V.
State Research Center for Preventive Medicine. Petroverigsky per. 10, Moscow, 101990 Russia Objective. To explore the clinical equivalence of two drugs bisoprolol (original and generic) in patients with Stage 1-2 degrees on the protocol recommended by the Society of Cardiology of the Russian Federation for comparative studies.
Material and Methods. 30 patients with Stage 1-2 degrees were examined. Patients were randomized to group 1 (original bisoprolol 5 mg / day) or group 2 (generic bisoprolol 5 mg/day). Dose of bisoprolol increased or added to S-amlodipine, indapamide and then with insufficient effect. 2-nd a similar stage (acceptance of alternative medicine bisoprolol) begins after the end of Step 1 (8 weeks) and 2-week period of drug withdrawal. Patients were recorded blood pressure, heart rate, ECG, adverse effects.
Results. Mean blood pressure reduction after 8 weeks of therapy was 27,2±12,2/12,0±6,1 mm Hg in group 1 and 29,9±10,5/12,5±7,2 mm Hg in group 2 (both p<0,001), betweengroup differences are insignificant. Target BP values were achieved in 79.3% of patients in both groups. The total decrease in heart rate was 11,1±12,9 in group 1 and 8,5±8,6 beats / min in group 2 (both p<0,05). Reliable dynamics of PQ interval in both groups were not found. The groups were comparable in terms of safety and tolerability of treatment.
Conclusion. The therapeutic equivalence of original and generic bisoprolol in the treatment of patients with Stage 1-2 degrees is shown.
Keywords: beta-blockers, bisoprolol, arterial hypertension, the original drug, generic, therapeutic equivalence.
Введение
Все современные рекомендации по лечению АГ определяют основную цель терапии этого заболевания как снижение смертности от сердечно-сосудистых (СС) причин [1]. Однако на достижение этой цели можно рассчитывать лишь в случае снижения артериального давления (АД) до так называемых целевых его значений (для больных с умеренным и низким СС риском ниже 140/90 мм рт.ст., а для больных высокого риска, в частности для больных с ИБС или сахарным диабетом, — до 130/80 мм рт.ст.).
Бета-адреноблокаторы (БАБ) используются для лечения артериальной гипертонии (АГ) уже более полувека. С учетом наличия мощной доказательной базы в отношении положительного влияния препаратов данной группы на прогноз [2-8] они (наряду с другими основными классами антигипертензивных препаратов) остаются препаратами первого ряда для лечения АГ, что отражено в Европейских Рекомендациях по лечению АГ [1].
Широкое использование БАБ в кардиологии привело к появлению большого количества дженериков наиболее популярных представителей этого класса, что ставит практического врача перед сложной проблемой выбора, т.к. для некоторых препаратов количество дженериков доходит до нескольких десятков. Основным преимуществом дженерика является более низкая стоимость по сравнению с оригинальным препаратом, а возможным недостатком — неполное соответствие по клиническим свойствам. Традиционно эквивалентность дженерика оригинальному препарату оценивают с помощью исследований по фармакокинетической эквивалентности (биоэквивалентности), доказательство которой считается достаточным для разрешения препарата к клиническому применению. Однако данные о сопоставимости клинического эффекта большинства дженериков и оригинального препарата обычно отсутствуют, поскольку исследования, в которых бы проводились такие сравнения, выполняются довольно редко. Данные немногочисленных клинических исследований демонстрируют весьма неоднозначную картину соответствия дженерика оригинальному препарату даже в тех случаях, когда их биоэквивалентность доказана. Если в ряде случаев наблюдалось полное или почти полное соответствие эффективности оригинального препарата и дженерика [9-11], то в других случаях такого соответствия выявить не удалось [12-15].
Недавно в России появился новый препарат-дженерик бисопролола (Кординорм®, Actavis Group hf, Исландия), исследования по биоэквивалентности которого продемонстрировали соответствие оригинальному препарату.
Целью данного исследования являлось изучение клинической эквивалентности двух препаратов бисопролола (оригинального и дженерического) у больных АГ 1-2 степени по строгому протоколу, рекомендованному ВНОК для проведения сравнительных исследований.
Материалы и методы
Пациенты. В исследование включались пациенты с АГ 1-2степени (160<САД<180 мм рт.ст. и/или 95<ДАД<110 мм рт.ст.). В исследование не включали больных со злокачественной и вторичной АГ, нестабильной стенокардией, недавно перенесенным острым инфарктом миокарда и нарушением мозгового кровообращения, сердечной недостаточностью, гемодинамически значимыми пороками сердца, нарушениями проводимости, бронхиальной астмой, тяжелыми сопутствующими заболеваниями.
Дизайн исследования: открытое перекрестное рандомизированное исследование. Схема исследования представлена на рис. 1. Каждый пациент подписывал информированное согласие на участие в исследовании.
Всем пациентам на каждом визите проводились измерение уровня АД и регистрация ЭКГ, а в части визитов (рис. 1) дополнительно и биохимический анализ крови (определение уровня глюкозы, мочевой кислоты, липидный спектр).
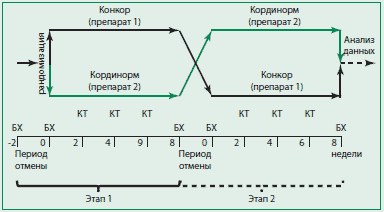
Рисунок 1. Схема наблюдения
БХ=биохимический анализ крови,
КТ=коррекция терапии
Протокол исследования. Длительность исследования для каждого пациента составила 18-20 нед: два курса активного лечения каждым препаратом продолжительностью 8 нед и два 2-недельных периода отмены терапии перед началом каждого курса. После 2-недельного периода отмены антигипертензивной терапии («период отмывания») больные были рандомизированы в группу 1, начавшую прием оригинального бисопролола (Конкор®, Мерк КГаА, Германия; препарат 1) или группу 2, начавшую прием дженерического (Кординорм®, Actavis Group hf, Исландия; препарат 2) бисопролола в суточной дозе 5 мг (однократно утром в интервале 8:00-11:00). При недостаточном гипотензивном эффекте доза препарата могла быть увеличена до 10 мг в сутки или при невозможности увеличения дозы бисопролола (ЧСС<55 уд/мин, возникновение атриовентрикулярной блокады 1-2 ст.) доза бисопролола могла быть уменьшена до 2,5 мг с или без добавления S-амлодипина 2,5 мг/сут. При необходимости доза S-амлодипина через 2 нед увеличивалась до 5 мг, а при недостижении целевого уровня АД на фоне двухкомпонентной терапии мог быть добавлен индапамид 1,5 мг/сут. Титрование дозы бисопролола или добавление S-амлодипина и индапамида проводилось после контрольного измерения уровня АД и ЧСС через 2, 4 и 6 нед после начала терапии, соответственно, с ЭКГконтролем через 2 нед после увеличения дозы бисопролола. После окончания 1-го этапа пациенту отменялись на 2 нед исследуемые препараты, после чего начинался 2-й этап исследования (прием альтернативного препарата бисопролола). Учет и регистрацию нежелательных побочных эффектов и явлений осуществляли во время каждого визита.
Оценка эффективности терапии. Гипотензивный эффект препаратов оценивали по результатам измерения АД (изменение от базового уровня через 2, 4, 6 и 8 нед терапии. Терапию считали эффективной, если достигалось снижение АД ниже уровня 140/90 мм рт.ст. у пациентов умеренного риска или 130/80 мм рт.ст. у пациентов высокого риска СС осложнений. В связи с малым количеством пациентов, имевших приступы стенокардии на момент включения в исследование, групповой анализ динамики частоты приступов стенокардии и количества принятых за неделю таблеток нитроглицерина не проводился.
Статистический анализ. Оценку данных проводили с помощью статистического пакета Statistica 6 (Statsoft Inc). Использовали как стандартные методы описательной статистики (вычисление средних, стандартных отклонений, ранговых статистик и т.д.), так и известные критерии значимости (t-критерий Стьюдента, Фишера, Манн-Уитни и т.д.) методом непараметрической статистики, т.к. имелись различия в исходной характеристике групп. Данные представлены в виде M±SD.
Результаты
Исходная характеристика пациентов. В исследование включены 30 пациентов (14 мужчин и 16 женщин) в возрасте от 44 до 81 года (средний возраст составил 61,3±9,3 лет). 8 (26,7%) больных имели АГ 1 степени и 22 (73,3%) — 2 степень. Анамнестическая длительность АГ колебалась от 1 года до 42 лет и составила в среднем 19,4±11,7 лет.
У 7 пациентов (23,3%) имелась ишемическая болезнь сердца (ИБС). Все пациенты с ИБС были в стабильном состоянии, двое из них (6,7%) имели стенокардию напряжения и принимали сублингвально нитроглицерин для купирования приступов стенокардии. 4 пациента имели в качестве сопутствующего заболевания варикозную болезнь вен нижних конечностей, 6 — язвенную болезнь или хронический гастродуоденит в анамнезе, 2 — подагру.
Факторы риска развития сердечно-сосудистых заболеваний, зарегистрированные у участников исследования, представлены в табл. 1.
До включения в исследование большинство пациентов 25 (83%) получали гипотензивную терапию, из них 5 — регулярную, 20 — нерегулярную, 4 — в неадекватных дозах. Наиболее используемыми препаратами оказались ингибиторы АПФ: их принимали 13 (43%) больных, диуретики — 9 (30%), БАБ — 8 (27%), антагонисты кальция — 8 (27%), блокаторы рецепторов к ангиотензину II — 2 (10%), комбинированную терапию — 7 (23%).
Полностью завершили участие в исследовании 29 чел., 1 пациент выбыл после первого курса из-за отклонения от графика визитов (неявка на начало второго курса). В последующий анализ были включены 29 пациентов, прошедших оба курса терапии. Представленные в табл. 2 данные отражают исходную характеристику пациентов, включенных в исследование. За исключением более высокой исходной ЧСС среди пациентов, принимавших препарат 1, достоверных различий по основным показателям между группами выявлено не было.
Таблица 1. Факторы риска развития сердечно-сосудистых заболеваний
| Фактор риска | n (%) |
|---|---|
| Основные | |
| Возраст >55 лет для мужчин и >65 лет для женщин | 16 (53,3) |
| Курение | 6 (20) |
| Гиперлипидемия (ОХС>5 ммоль/л) | 18 (60) |
| Сахарный диабет | 3 (10) |
| Семейный анамнез ранних сердечно-сосудистых заболеваний (>55 лет для мужчин и >65 лет для женщин) | 13 (43,3) |
| Дополнительные | |
| Низкий ХС ЛПВП | 11 (37) |
| Повышенный ХС ЛПНП | 24 (80) |
| НТГ | 3 (10) |
| Гиподинамия | 21 (70) |
| Ожирение | 18 (60) |
| Социально-экономические факторы | 21 (70) |
| Поражение «органов-мишеней» | |
| ГЛЖ | 13 (43,3) |
| Протеинурия | 0 |
| Повышение уровня креатинина | 0 |
| Ультразвуковые или рентгенологические признаки атеросклеротических бляшек в магистральных артериях | 12 (40) |
| 10-летний риск развития сердечнососудистых осложнений | |
| Низкий | 0 |
| Средний | 7 (23) |
| Высокий | 23 (77) |
Таблица 2. Сравнительная характеристика больных до лечения
| Изучаемый параметр | Препарат 1 (n=29) | Препарат 2 (n=29) | р |
|---|---|---|---|
| САД (мм рт.ст.) | 162,1±11,3 | 162,6±9,2 | нд |
| ДАД (мм рт.ст.) | 95,8±7,0 | 95,1±5,3 | нд |
| ЧСС клин. (уд. в мин) | 75,3±14,4 | 72,7±8,0 | 0,04 |
| PQ (мсек) | 168,3±24,4 | 167,0±23,2 | нд |
Через две недели терапии в обеих группах отмечалось достоверное снижение показателей как САД и ДАД, так и ЧСС (рис. 2 и 3). Достоверных межгрупповых различий не выявлено. Целевые значения АД через 2 нед были достигнуты у 1 (3,4%) больного, принимавшего препарат 1, и у 6 (17,2%) больных — препарат 2 (р<0,05).
После 4 нед терапии на фоне увеличения дозы бисопролола (79% — при приеме препарата 1 и 69% — при приеме препарата 2) или добавления S-амлодипина (21% — препарат 1 и 28% — препарат 2) или добавления индапамида (10% — препарат 1 и 10% — препарат 2) при невозможности увеличения дозы БАБ у пациентов, не достигших целевого уровня АД, отмечалось дальнейшее статистически достоверное снижение уровня САД и ДАД при приеме обоих препаратов (рис. 2 и 3). Достоверное снижение ЧСС отмечено только при приеме препарата 2. Межгрупповые различия были статистически недостоверны.
Целевые значения АД после 4 нед терапии были достигнуты у 9 (31%) больных, принимавших препарат 1, и у 8 (27,6%) — препарат 2.
Через 6 нед терапии после добавления S-амлодипина (45% — при приеме препарата 1 и 38% — препарата 2) или увеличения его дозы до 5мг (45% — препарат 1 и 31% — препарат 2) или добавления индапамида (25% — препарат 1 и 31% — препарат 2) у пациентов, не достигших целевого уровня АД, дальнейшее статистически достоверное снижение уровня САД и ДАД отмечено только в группе 2 (рис. 2 и 3). Достоверной динамики ЧСС и интервала PQ в обеих группах не выявлено. Межгрупповые различия были статистически недостоверны.
Целевые значения АД после 6 нед терапии были достигнуты у 19 (65,5%) больных, принимающих препарат 1, и у 19 (65,5%) — препарат 2 (различия между группами недостоверны).
Через 8 нед терапии на фоне приема увеличенной дозы бисопролола (79% при приеме препарата 1 и 76% — препарата 2) добавления S-амлодипина (69% — препарат 1 и 62% — препарат 2) и увеличения его дозы до 5мг (48% — препарат 1 и 31% — препарат 2) или добавления индапамида (21% — препарат 1 и 34% — препарат 2) у пациентов, не достигших целевого уровня АД, дальнейшее статистически достоверное снижение уровня САД отмечено при приеме препарата 1, а САД и ДАД — при приеме препарата 2 (рис. 2 и 3). Межгрупповые различия были статистически недостоверны.
Суммарное снижение САД/ДАД за 8 нед терапии составило 27,2±12,2/12,0±6,1 мм рт.ст. при приеме препарата 1 и 29,9±10,5/12,5±7,2 мм рт.ст. при приеме препарата 2 (рис. 2 и 3). Межгрупповые различия были недостоверны. Целевые значения АД после 8 нед терапии были достигнуты у 79,3% больных, принимавших препарат 1, и у 79,3% — препарат 2. Суммарное снижение ЧСС составило 11,1±12,9 уд/мин при приеме препарата 1 и 8,5±8,6 уд/мин при приеме препарата 2 (рис. 2 и 3). Среди пациентов, принимавших препарат 1, снижение ЧСС оказалось достоверно более значимым, чем при приеме препарата 2. Достоверной динамики интервала PQ за время исследования при приеме обоих препаратов не выявлено.
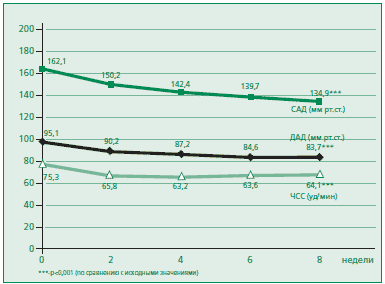
Рисунок 2. Динамика изучаемых показателей на фоне терапии препаратом 1
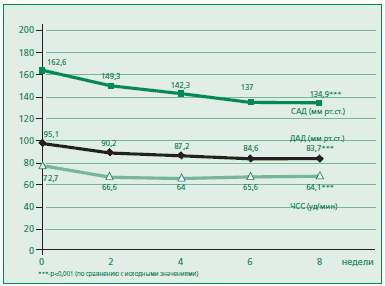
Рисунок 3. Динамика изучаемых показателей на фоне терапии препаратом 2
Целевого уровня САД и ДАД в результате 8 нед терапии при приеме обоих препаратов достигло одинаковое количество больных в обеих группах — 79,3%. Для обеспечения одинакового гипотензивного эффекта в двух группах потребовалась практически одинаковая доза бисопролола и частота назначение дополнительных препаратов (табл. 3). На монотерапии достигнут целевой уровень АД у 21% больных на фоне приема обоих препаратов, комбинированную терапию получали 79,3% в обеих группах. Из них 3-компонентную терапию получали 19% пациентов, принимавших препарат 1, и 21% — препарат 2. Различия по частоте увеличения дозы и добавления дополнительных препаратов были статистически недостоверны. Средняя доза бисопролола к концу исследования составила 8,7 мг в обеих группах, средняя доза амлодипина 2,9 мг у принимавших препарат 1 и 2,3 мг — препарат 2 (p<0,05).
Таблица 3. Распределение пациентов в зависимости от получаемой дозы бисопролола и дополнительных препаратов к концу исследования
| Компоненты терапии | Препарат 1 | Препарат 2 |
|---|---|---|
| бисопролол (2,5-5 мг/сут) | 6 (21) | 6 (21) |
| бисопролол (10 мг/сут) | 23 (79) | 23 (79) |
| S-амлодипин (2,5 мг/сут) | 6 (21) | 9 (31) |
| S-амлодипин (5 мг/сут) | 14 (48) | 9 (31) |
| Индапамид (1,5 мг/сут) | 6 (21) | 10 (34,5) |
| 1-компонентная терапия | 6 (21) | 6 (21) |
| 2-компонентная терапия | 17 (59) | 16 (57) |
| 3-компонентная терапия | 5 (19) | 6 (21) |
Анализ безопасности и переносимости терапии
При анализе динамики показателей биохимического анализа крови выявлено небольшое, но статистически достоверное увеличение уровня глюкозы крови на фоне лечения обоими препаратами (табл. 4). Остальные показатели: уровень мочевой кислоты, показатели липидного спектра — на фоне проводимой терапии достоверно не изменялись.
Таблица 4. Динамика биохимических показателей на фоне терапии
| Параметр | Препарат 1 | Препарат 2 | ||
|---|---|---|---|---|
| исходно | через 8 нед | исходно | через 8 нед | |
| Глюкоза, ммоль/л | 5,2±0,6 | 5,7±0,8* | 5,5±0,8 | 5,7±0,9* |
| Мочевая кислота, мг% | 5,5±1,4 | 5,8±1,6 | 5,7±1,3 | 5,9±1,65 |
| ОХС, ммоль/л | 5,0±1,0 | 5,0±0,9 | 5,2±1,2 | 4,8±1,0 |
| ХС ЛПНП, ммоль/л | 3,1±0,9 | 3,0±1,0 | 3,2±1,1 | 2,9±1,0 |
| ХС ЛПВП, ммоль/л | 1,25±0,3 | 1,21±0,3 | 1,25±0,3 | 1,19±0,3 |
| ТГ, ммоль/л | 1,45±0,5 | 1,49±5,2 | 1,6±0,7 | 1,5±0,6 |
За время исследования было зарегистрировано 15 нежелательных явлений (НЯ) у 8 пациентов (7 — при приеме препарата 1 и 8 — препарата 2), которые отражены в табл. 5. Все НЯ не были серьезными и не потребовали прекращения участия пациентов в исследовании. Развитие у 4 больных отеков голеней произошло на фоне приема S-амлодипина во время первого курса терапии и у двоих потребовало отказа от его назначения во время второго курса. У трех из 4 пациентов имелась в анамнезе варикозная болезнь вен нижних конечностей.
Таблица 5. Зарегистрированные нежелательные явления
| Нежелательное явление | Препарат 1 | Препарат 2 |
|---|---|---|
| Боль в эпигастрии, n | 1 | |
| Кошмарные сновидения, n | 1 | |
| Неустойчивость при ходьбе, n | 1 | |
| Отеки ног, n | 2 | 3 |
| ОРЗ, n | 1 | 2 |
| Пароксизм фибрилляции предсердий, n | 1 | |
| Экстрасистолия, n | 1 | 2 |
| Бессимптомная брадикардия, n | 5 | 5 |
| Всего, n (%) | 7(12*) | 8(13*) |
Несмотря на достоверное снижение ЧСС на фоне лечения бисопрололом, не было зарегистрировано клинически значимых нарушений проводимости. Минимальная ЧСС перед началом терапии составляла 56 уд/мин, а на фоне терапии — 48 уд/мин. Частота развития брадикардии была идентична на фоне приема обоих препаратов (у 5 пациентов), не сопровождалась клиническими симптомами и не потребовала отмены исследуемого препарата, но у двоих пациентов доза бисопролола была снижена до 2,5 мг. Таким образом, терапия бисопрололом в данном исследовании была безопасна независимо от исходной ЧСС.
У одного пациента на фоне приема препарата 2 развился пароксизм фибрилляции предсердий, купировавшийся самопроизвольно к следующему визиту. Три пациента за время исследования перенесли острые респираторные заболевания (1 на фоне приема препарата 1 и 2 во время приема препарата 2), не потребовавшие изменений в исследуемой терапии и дополнительной лекарственной терапии. У одного пациента на фоне первого этапа терапии (препарат 1) имели место боли в эпигастрии (в анамнезе — хронический гастродуоденит), кошмарные сновидения и неустойчивость при ходьбе, в связи с чем пациент самостоятельно прекратил прием исследуемого препарата (данные пациента внесены в анализ, т.к. он полностью завершил 2-й этап лечения).
Эффективность терапии, по мнению врачей и пациентов, при приеме препарата 1 была «хорошей» у 69% больных, «средней» — у 24% и «плохой» — у 7% больных, у принимавших препарат 2 «хорошей» — у 66%, «средней» — у 31% и «плохой» — у 3% больных.Переносимость терапии была «хорошей» у 93% и «средней» у 7% при приеме препарата 1 и у 91% и 9%, соответственно, при приеме препарата 2. Межгрупповые различия были недостоверны.
Обсуждение результатов
Результаты данного исследования являются одним из немногих примеров полного соответствия дженерика оригинальному препарату. Эффективность монотерапии и комбинированной терапии оригинальным и дженерическим бисопрололом, составившая 21% и 79%, соответствует обычной эффективности антигипертензивной терапии при АГ 1-2 степени у пациентов высокого риска и соответствует данным ряда крупных исследований [18-20]. Так, среднее число гипотензивных препаратов, необходимых для достижения целевых цифр АД у пациентов высокого риска, составила 3,2. Следует учитывать, что пациенты, вошедшие в исследование, имели, преимущественно, высокий риск сердечно-сосудистых осложнений, и нормализация у них уровня АД значительно улучшает прогноз жизни [2124]. Отсутствие взаимосвязи выявленных НЯ с приемом сравниваемых препаратов бисопролола и различий по частоте появления нежелательных явлений на фоне лечения свидетельствует об их одинаково хорошей переносимости. Появление наиболее частого НЯ в виде отека голеней ассоциировалось с приемом S-амлодипина в качестве дополнительного препарата у пациентов, не достигших целевых цифр АД на фоне монотерапии бисопрололом. Частота развития “амлодипиновых” отеков соответствует литературным данным — около 20% [25-26].
Отсутствие достоверного влияния проводимой терапии на показатели липидного спектра и мочевой кислоты свидетельствует о достаточной метаболической нейтральности бисопролола, а повышение уровня глюкозы крови на фоне приема обоих сравниваемых препаратов бисопролола является следствием неблагоприятных метаболических сдвигов, характерных для комбинации БАБ с диуретиками [27-29]. Последнее предположение подтверждается результатом корреляционного анализа динамики глюкозы крови с добавлением к терапии индапамида (r=0,38 p<0,01). Следует учитывать, что большинство пациентов имели избыточную массу тела и почти треть из них получала бисопролол в комбинации с тиазидным диуретиком индапамидом. Выявленная закономерность подтверждает обоснованность рекомендаций Европейского общества кардиологов избегать по возможности использования бета-блокаторов, особенно в сочетании с диуретиками, в качестве антигипертензивной терапии первой линии у пациентов с компонентами метаболического синдрома во избежание повышения у них риска развития сахарного диабета [1].
Поскольку исследование было выполнено по строгому протоколу согласно рекомендациям по Рациональной фармакотерапии ВНОК для оценки клинической эквивалентности лекарственных препаратов, то можно уверенно утверждать, что сравниваемые препараты терапевтически эквивалентны [30] и говорить о высоком качестве дженерического препарата бисопролол (Кординорм®) производства компании ACTAVIS GROUP hf, Исландия.
Заключение
Полученные данные свидетельствуют о терапевтической эквивалентности оригинального и дженерического препаратов бисопролола Конкора® и Кординорма® при лечении больных АГ 1-2 степени.
Литература
