Нефропротекция в лечении больных артериальной гипертонией (результаты исследования ИРИС)
СтатьиИ.Е.Чазова1, Л.Г.Ратова1, И.П.Колос1, Т.И.Коткина1, С.Ю.Марцевич2, О.М.Моисеева3, М.П.Козырева2, Н.А.Дмитриева2, Ю.А.Семенова2, Г.Ф.Андреева2, В.П.Воронина2, Ю.В.Лукина2, П.Ю.Иваненкова2, А.А.Серажим2, Н.А.Фельдшерова3
2ГУ ГНИЦ профилактической медицины М3 и СР РФ, Москва;
3НИИ кардиологии им. В.А.Алмазова М3 и СР РФ, Санкт-Петербург.
Проблема адекватного лечения больных артериальной гипертонией (АГ) будет оставаться актуальной еще в течение длительного времени. В последние годы основное внимание при разработке оптимальных подходов к лечению АГ сосредоточено на снижении артериального давления (АД) до целевого уровня (≥140/90 мм рт. ст. для всех категорий больных и ≥130/85 мм рт. ст. при наличии сахарного диабета - СД) и уменьшении риска развития сердечно-сосудистых осложнений [ 1 ]. При обсуждении вопроса об органопротективном эффекте антигипертензивной терапии основное внимание уделяется поражению сердца в виде диастолической дисфункции и гипертрофии миокарда левого желудочка. Способность препаратов оказывать нефропротективное действие рассматривается гораздо реже в связи с меньшим вкладом хронической почечной недостаточности (ХПН) в структуру смертности больных АГ. Исключение составляют только больные АГ и СД из-за риска более быстрого прогрессирования диабетической нефропатии. К сожалению, развитие нефроангиосклероза у больных АГ, независимо от наличия или отсутствия других факторов риска и сопутствующих заболеваний, приводит к прогрессирующему снижению функции почек вплоть до терминальной ХПН. На протяжении последнего десятилетия частота связанной с АГ терминальной почечной недостаточности неуклонно возрастает, и этот рост не имеет тенденции к замедлению в будущем [2].
Для оценки функционального состояния почек в клинической практике чаще всего применяется определение скорости клубочковой фильтрации (СКФ). В настоящее время для выявления нефропатии (любого генеза) используется определение альбумина в моче. Нефропатия диагностируется при наличии минимальной микроальбуминурии (МАУ) от 20 до 300 мг/сут, исключенном почечном генезе АГ и, что более важно, при нормальной функции почек [3—5]. Экскреция альбумина более 300 мг/сут расценивается как протеинурия. Нефропротективный эффект в виде способности уменьшать выделение альбумина с мочой у больных инсулиннезависимым СД с АГ и начальной нефропатией доказан для ингибиторов ангиотензинпревращающего фермента (ИАПФ). При этом практически не встречается работ, посвященных нефропротективному эффекту антигипертензивной терапии у больных АГ без СД. Исследование ИРИС (Ирумед и Ирузид: оценка антигипертензивной эффективности и органопротективных свойств в лечении больных ЛГ) посвящено оптимизации лечения больных АГ. включающей всебя комплексное воздействие на ключевые показатели суточного профиля АД и обеспечение органопротекции с применением современных антигипертензивных препаратов.
Цель исследования: изучить aнтигипертензивную эффективность и влияние на функцию почек терапии ИАПФ лизиноприлом (ирумед, «Belupo». Хорватия) и его фиксированной комбинацией с диуретиком гидрохлоротиазидом (ирузид, «Belupo», Хорватия) у больных АГ.
Материал и методы
В исследование включен 61 пациент с АГ, из которых за время наблюдения выбыло 3 больных: 1 из-за развития побочного явления (сухой кашель) и 2 из-за недостаточного антигипертензивного эффекта терапии. Полностью завершили исследование 58 пациентов (27 мужчин и 31 женщина). 33-75 лет (55,0±1,5 года), со средней длительностью АГ 12,3±1,4 года. У 61% больных имела место АГ I и у 39% II степеней тяжести согласно классификации ВНОК 2004 г. по уровню АД [1]. Исходно СКФ составила 98,7±4,5 (59,8-187,1) мл/мин, у 28% больных выявлена гиперфильтрация. МАУ отмечена у 12% больных, средний уровень МАУ составил 45,3±6,0 мг/сут (5-290 мг/сут). После 2 нед «отмывочного периода» среднее по г руппе систолическое АД (САД) клиническое (кл.) составило 151,2±1,2 мм рт. ст., диастолической АД (ДАД) кл. - 92,2±1,2 мм рт. ст., частота сердечных сокращений (ЧСС) - 74,2±1,2 уд/мии. Критериями исключения были: вторичные формы АГ, острое нарушение мозгового кровообращения, острый инфаркт миокарда в течение последних 6 мес. стенокардия II—III функционального класс (ФК), сердечная недостаточность, нарушения ритма сердца, функции печени и почек.
Дизайн исследования: исследование было многоцентровым, открытым, последовательным. Длительность наблюдения составила 16—18 нед Перед включением в исследование у всех больных собирали полный анамнез, проводили физикальное исследование, измеряли АД методом Короткова, после чего пациентам, предварительно соответствующим критериям включения и не имеющим критериев исключения, отменяли предшествующую антигипертензивную терапию (только для пациентов, регулярно принимающих антигипертензивные препараты). Через 2 нед «чистого фона» все больные начинали лечение препаратом "Ирумед" в дозе 10 мг в сутки однократно утром. Через 2 нед у больных, не достигших целевого уровня АД (≥140/90 мм рт. ст, а при наличии СД≥130/85 мм рт. ст.), дозу ирумеда удваивали (20 мг/сут). Если монотерапия ирумедом в дозе 10-20 мг в сутки не позволяла достичь целевого уровня АД, то к лечению добавлялся диуретик гидрохлоротиазид в виде фиксированной комбинации лизиноприла и гидрохлоротиазида (ирузид) в дозе 20/12,5 мг соответственно. Пациентам, переведенным на прием ирузида по 1 таблетке в сутки, назначали дополни тельный визит через 2 нед, на котором проводили оценку эффективности комбинированной антигипертензивной терапии по АД кл.. При недостижении целевого уровня АД на фоне терапии ирузидом его дозу увеличивали до 2 таблеток в сутки (40/25 мг лизиноприла/гидрохлоротиазида соответственно). Таким образом, через 8 нед от начала лечения заканчивалась фаза титрования доз и больные получали как монотерапию ирумедом в дозе 10 или 20 мг/сут, так и комбинированную терапию ирузидом в дозе 20/12,5 или 40/25 мг/сут. При отсутствии антигипертензивного эффекта (снижение САД и/или ДАД менее чем на 10% от исходного) на фоне терапии ирузидом по 2 таблетки в сутки (фиксированная комбинация лизиноприла и гидрохлоротиазида в дозе 40/25 мг) пациента выводили из исследования и ему давали рекомендации по дальнейшему лечению. При достижении целевого уровня АД больные продолжали то лечение, на фоне которого оно бьло достигнуто, до полного завершения исследования. В случае выявления ускользания антигипертензивного эффекта терапии пациента переводили на следующую ступень.
На всех визитах контролировали АД кл.. ЧСС, регистрировали жалобы пациентов, отмечали побочные эффекты и нежелательные явления, если таковые имелись. Биохимический аиализ крови (К, Na, креатинин, глюкоза, ACT, АЛТ), пробу Реберга для расчета СКФ, определение уровня МАУ в суточной моче проводили исходно и через 16 нед лечения. Контрольное исследование анализа крови (К. Na, креатинин) и пробу Реберга проводили через 8 нед лечения.
АД клиническое определяли как среднее 3 измерений АД ручным сфигмоманометром в положении сидя после 10-15 мин отдыха, а также стоя через 1 мин до приема препарата в день визита. За критерий эффективности антигипертензивиой терапии по АД кл. принимали снижение ДАД кл. на 10% или на 10 мм рт. ст. и САД кл. на 15 мм рт. ст. от исходного уровня. Целевым уровнем АД кл. на фоне терапии считали достижение АД≥ 140/90 мм рт. ст. [6,7].
Состояние функции почек как органа-мишени при АГ и ее динамику оценивали при помощи пробы Реберга с расчетом СКФ и определения МАУ в суточной моче. СКФ рассчитывали методом Реберга-Тареева [(С креат. мочи)/С креат. крови) минутный диурез). Нормальными значениями СКФ считали 80-120 мл/мин. СКФ>120 мл/мин расценивалась как гиперфильтрация. Для определения МАУ использовали спектрофотометрию на биохимическом анализаторе Express plus («Вауer»). Минимальная определяемая концентрация альбумина при использовании данного метода была 0,9 мг/л. Суточную экскрецию альбумина рассчитывали по формуле МАУ24=Са х Vпорц, где Са - концентрация альбумина в суточной моче (мг/л), Упорц -объем мочи за 24 ч. Критерием МАУ считали величину экскреции альбумина с мочой 20-300 мг/сут [4].
Статистический анализ проводили с использованием пакета компьютерных программ, предусматривающих возможность параметрического и непараметрического анализа. Для оценки достоверности межгрупповых различий применяли непарный непараметрический метод анализа по Манн-Уитни. Оценка динамики на фоне лечения проводилась с применением парного непараметрического метода анализа по Вилкоксону. Линейный корреляционный анализ проводили с использованием критерия Спирмана. Различия считались достоверными при p<0,05. Результаты представлены в виде М±m.
Результаты и обсуждение
На фоне монотерапии препаратом «Ирумед» в дозе 10 мг/сут в целом по группе через 2 нед терапии отмечено достоверное снижение САД и ДАД по сравнению с их исходным уровнем (рис. 1): САД кл. снизилось с 151.2±1,2 до 142,7±1,2 мм рт. ст. (Δ=-8,5±1,2; р<0,001) и ДАД кл. снизилось с 92.2±1,2 до 88,3±1.1 мм рт. ст. (Δ=-3.9±0,9; р<0,001). Целевого уровня АД достигли 18% больных, остальным пациентам дозу препарата «Ирумед» увеличили до 20 мг/сут на 2 нед От 2-й к 4-й неделе монотерапии ирумедом в дозе 10-20 мг/сут АД кл. снизилось с 142,7±1,2/88,3±1,1 до 137,2± 1,2/85,8±1,2 мм рт. ст. (Δ=-5,5±1,0/-2,5±0,8 мм рт. ст.; p<0,001). Нормализация АД кл. достигнута у 37% больных, в том числе у 55% по САД кл. и у 50% по ДАД кл. Пациенты, достигшие целевого уровня АД, приходили на следующий визит через 4 нед (8 нед от начала лечения).
Рис. 1. Динамика АД на фоне терапии препаратами «Ирумед» и «Ирузид» (n=58).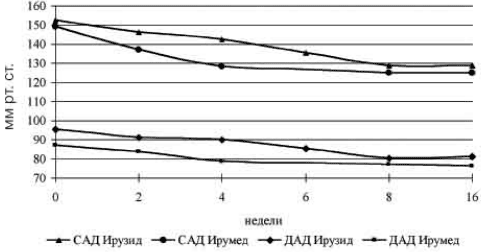
Рис. 2. Динамика МАУ на фоне терапии препаратами «Ирумед» и «Ирузид» (n=58).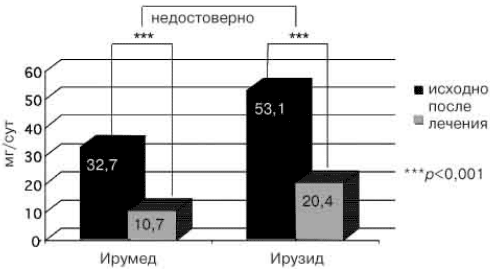
Рис. 3. Динамика СКФ в зависимости от ее исходного уровня на фоне терапии препаратами «Ирумед» и «Ирузид» (n=58).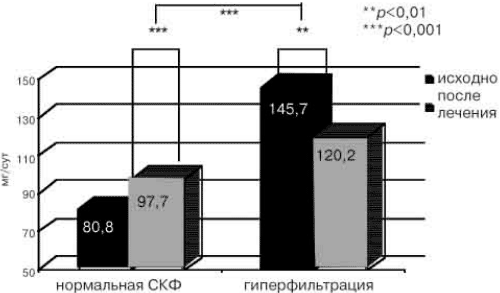
Пациенты, не достигшие целевого уровня АД на фоне монотерапии, исходно имели более высокий уровень ДАД (95,3±1.0 против 87,1 ±2,2 мм рт. ст.; р=0,01), креатинина (101,5±3,3 против 82,8±2,6 мкмоль/л; p<0,001), МАУ (53,1 ±9,2 против 32,7±4,1 мг/сут; р<0,05) и меньшую СКФ (87,4±4,2 против 117,1±8,5 мл/мин; р=0,002). Также у них наблюдали достоверно меньшее снижение АД кл. (Δ=-10,0±1,3/-5,2±1,2 против Δ=-20,6±2,2/-8,3±2,0; /КО,001/0,05).
Пациентам, не достигшим целевого уровня АД кл. на фоне монотерапии препаратом «Ирумед* (n=38), к лечению добавляли 12,5 мг гидрохлоротиазида путем перевода больных на лечение фиксированной комбинацией лизиноприла с гидрохлоротиазидом (ирузид). Этим больным назначали дополнительный визит через 2 нед От 4-й к 6-й неделе лечения у больных на фоне терапии фиксированной комбинацией (ирузид в дозе 20/12,5 мг/сут) произошло дополнительное снижение АД кл. с 142,6± 1,0/90,1 ±1,2 до 135,6±1,5/85,6±1.1 мм рт. ст., ДАД кл.=-7,0±1,3/-4,5±0,9 мм рт. ст. (p<0,001). Целевого уровня АД достигли 74% пациентов этой группы, а остальным (n=10) дозу ирузида удвоили.
За 8 нед лечения АД кл. в целом по группе снизилось с 151,2± 1,2/92,2± 1,2 до 127,3±0,9/79,1 ±0,8 мм pт. ст. (Δ=-23,9± 1,4/-13,1 ± 1,1 мм рт. ст.;p<0,001). Нормализация АД кл. к 8-й педеле терапии была достигнута у 95% больных. На этом визите из исследования выбылу 2 пациента в связи с недостаточным антигипертензивным эффектом, оставшиеся больные (n=58) продолжили подобранное лечение.
От 8-й к 16-й неделе моно- и комбинированной терапии наблюдали стабилизацию антигипертензивного эффекта. Достоверной динамики АД кл. не было (Δ=0,1 ±0,8/0,1 ±0,5 мм рт. ст. р - недостоверно). В целом 16-недельная терапия привела к достоверному снижению АД кл. с 15 1,2± 1,2/92,2± 1,2 до 127,4± 1,0/79,2±0,9 мм рт. ст. (Δ=23,8± 1,5/-13,0± 1,1 мм рт. ст.;p<0,001). Достоверной динамики ЧСС не отмечено. Целевого уровня АД кл. достигли 57 пациентов из 58 полностью завершивших исследование. Снижение АД за 16 нед лечения у пациентов, достигших целевого уровня АД на фоне моно- и комбинированной терапий, было сопоставимым.
Поскольку больных с почечной недостаточностью не включали в исследование, уровень креатинина крови у всех больных был в пределах нормальных значений 89,9±2,4 (63,7-140 мкмоль/л). СКФ колебалась от 69,8 до 187,1 (98,7±4,5) мл/мин. У 28% больных выявлена гиперфильтрация. В литературе мы не встретили работ, в которых анализировалась бы частота встречаемости гиперфильтрации у больных АГ, однако имеются указания на преобладание гиперфильтрации на ранних стадиях АГ [8]. При корреляционном анализе было подтверждено наличие возрастзависимого снижения СКФ (R=-0,38; р=0,02), показанного в фундаментальных исследованиях (8, 9). Зависимости СКФ от уровня АД кл. выявлено не было, однако имелась отрицательная корреляция с уровнем креатинина в плазме крови (R=-0,46;р<0,05), что свидетельствует о компенсаторном характере гиперфильтрации, направленном на уменьшение объема циркулирующей крови и увеличение экскреции натрия. Гиперфильтрация является основным неимунным механизмом прогрессирования гипертонической нефропатии, ведущей со временем к снижению СКФ и повышению уровня азотистых шлаков крови [10], что подтверждается наличием отрицательной корреляционной зависимости уровня креатинина в крови от СКФ.
МАУ выявлена у 12% больных. Суточная экскреция альбумина составила 45,3±6 (5-90) мг/сут. Выраженность МАУ нарастала с увеличением тяжести АГ (R=0,57;p=0,003) от 37,1±4,4 мг/сут при I степени до 58,8±13,9 мг/сут при II степени тяжести АГ (p=0,003). В нашем исследовании не было обнаружено корреляционной зависимости между МАУ и клиренсом креатинина, что соответствует данным, полученным LLozance и соавт. (1996 г.) [11], но противоречит данным G.Cerasola и соавт. (1996 г.), выявивших корреляцию МАУ и СКФ в группе больных с наиболее высоким уровнем МАУ [12].
Терапия препаратами «Ирумед» и «Ирузид» привела к снижению уровня МАУ (рис. 2) более чем в 2 раза (ΔМАУ=-28,6±3,9 мг/сут;p<0,001), а также увеличению СКФ с 80,8±2,6 до 97,7±3 мл/мин (ДСКФ=20,7±3,4 мл/мин; p<0,001) у больных с исходно нормальной и сниженной СКФ и уменьшению СКФ с 145,7±5,1 до 120,2±7,3 (ДСКФ=-26,9±7,3 мл/мин; р=0,005) при исходной гиперфильтрации (рис. 3). Разнонаправленное влияние терапии па СКФ у больных с исходно нормальной и повышенной СКФ является положительным моментом, поскольку гиперфильтрация в настоящее время рассматривается как основной неимунный механизм развития нефросклероза, что ведет к прогрессированию АГ [11] и развитию почечной недостаточности. Отсутствие снижения СКФ на фоне антигипертензивной терапии у больных без гиперфильтрации свидетельствует об отчетливом нефропротективном эффекте терапии. Реабсорбция на фоне терапии значимо не изменялась. Снижение уровня МАУ за 16 нед терапии произошло у всех больных (100%), с нормализацией у 88% больных с исходно повышенной МАУ. Считается, что наиболее эффективно способна уменьшать МАУ терапия ИА11Ф и блокаторами рецепторов ангиотензина II при сохранении или повышении исходного уровня СКФ [13-15].
В группе больных, оказавшихся «нечувствительными» к монотерапии лизиноприлом и имевших исходно достоверно более высокий уровень креатинина в крови и более низкую СКФ, терапия фиксированной комбинацией лизиноприла и гидрохлоротиазида оказывала благоприятное воздействие на функцию почек в виде статистически значимого снижения уровня МАУ с 53,1±9,2 до 20,4±5,4 мг/сут (ΔМАУ=-32,7±5,8 мг/сут; p<0,001) и увеличения СКФ с 87,4±4,2 до 113,3±3,5 мл/мин (ДСКФ=25,9±3,1 мл/мин; p<0,001). Данных о влиянии комбинированной терапии лизиноприла и гидрохлоротиазида на функцию почек в доступной нам отечественной и зарубежной литературе мы не обнаружили.
Биохимические показатели крови (калий, натрий, глюкоза, АЛТ, ACT) на фоне терапии обоими препаратами достоверно не изменялись. Переносимость терапии препаратами «Ирумед» и «Ирузид» была хорошей, различий по переносимости выявлено не было. Нежелательные явления в виде сухого кашля были у 1 больного, имели легкую степень выраженности и прошли самостоятельно после отмены препарата.
Заключение
1. Монотерапия лизиноприлом (ирумед) в дозе 10-20 мг/сут позволяет достичь и сохранить целевой уровень АД у 37% больных. При недостаточном снижении АД на фоне монотерапии лизиноприлом антигипертензивный эффект последнего может быть потенцирован добавлением малых доз (12,5-25 мг) гидрохлортиазида путем перевода больного на лечение фиксированной комбинацией (ирузид), что увеличивает число больных, достигших целевого уровня АД до 95%.
2. Больные, оказавшиеся «нечувствительными» к монотерапии лизиноприлом, характеризовались более высоким уровнем ДАД и более выраженными функциональными изменениями почек (больший уровень креатинина крови и МАУ; меньшая СКФ).
3. Монотерапия ирумедом и его фиксированной комбинацией с гидрохлоротиазидом (ирузид) оказывает нефропротективное действие, заключающееся в значимом уменьшении выраженности МАУ и корригирующем воздействии на СКФ.
4. Лечение препаратами «Ирумед» и «Ирузид» характеризуется хорошей переносимостью.
ЛИТЕРАТУРА
1. Рекомендации по профилактике, диагностике и лечению артериальной гипертензии. Российские рекомендации (второй пересмотр). Комитет экспертов Всероссийского научного общества кардиологов. Секция артериальной гипертонии ВНОК Москва 2004 г. Кардиоваскул. тер. и профилак. (Приложение).
2. Epstein М. Parving HH, Ruilop LM. Surrogat endpoints and renal pritection: focus on microalbuminuria, Blood Pressure 1997:6: 52-7.
3. Титов В.Н., Тарасов А.В. Микроальбуминурия: патофизиология, диагностическое значение и методы исследования. Тер. арх. 1988; 134-40.
4 Mogensen СE, Кеаnе WF, Bennett IH et al. Prevention of diabetic renal disease With special reference to microalbuminuria. Lancet 1995; 346: 1080-4.
5. Schlessinger SL), Tankersey MR, Crtis JJ. Clinical documentation or end-stage renal disease due to hypertension. Am J Kidney Pis 1994; 23:65 5-60.
6. Paтовa Л.Г., Дмитриев В.В., Толпыгина CН Чазова ИЕ. Суточное мониторирование артериального давления в клинической практике. Консилиум (приложение "Артериал. гипертензия"). 2001, 3-14.
7. Рогоза A.Н., Никольский B.П., Ощепкова Е.В. и др. Суточное мониторирование артериального давления (Методические вопросы). Под ред. Г.Г.Арабидзе и О.Ю.Атькова.М.17,1997.
8. Brenner В. Hemodynamicalty mediated glomerular injury and the progressive nature of kidney disease. Kidney Int 1983; 23:647-55.
9. Тиц НУ. Клиническая оценки лабораторных тестов: пер. с англ. М. Медицина. 1986.
10. Sommers SC, Melamed J. Renal pathology of essential hypertension. Am f Hypertens 1990 Jul;3 (7): 583-7.
11. Lozance I., Zafirovska K, Bogdanovska S. Renal dysfunction and early differences in 24-hour ABPM in subjects predisposed for essential bypertension. Srp Arh Celok Lek 1996; 124: 197-9.
12. Cerasola (J, Cottone S. Mule G et al. Microalbuminuria, renal dysfunction and cardiovascular complication in essential hypertension. J Hypertens 1996:14: 915-20.
13. Redon J, Mindies A, Pascual fM et al. Hyperinsulinemia as a determinant of microalbuminuria in essential hypertension.J Hypertens 1997:15: 79-86.
14 Toto R, Shultz P, Raij I. Eficacy and tolerability of losartan in hypertensive patients with renal impairment. Hypertension 1998; 31:684-91.
15. Nielsen S, Dollerup J, Nielsen В et al. Losartan reduces albuminuria in patients with essential hypertension. An enalapril controlled 3 mounths study. Nephrol Dial Transplant 1997; 12; 19-22.
