Изучение эффективности и безопасности применения лорноксикама в раннем послеоперационном периоде
Статьи| Предупреждение! Препарат рецептурного отпуска! Использовать только после назначения врача! |
"Терапевтический архив", Том 79, 8.2007
Авторы: В.В. Никода, Р.Б. Маячкин, А.В. Бондаренко
Российский научный центр хирургии им. Б. В. Петровского РАМН, Москва
Краткое содержание
Цель исследования. Сравнить качество обезболивания при использовании опиоидного препарата и анальгезии на основе нестероидных противовоспалительных препаратов у 123 больных после обширных оперативных вмешательств на легких и трахее, органах брюшной полости, нижних конечностях.
Материалы и методы. В качестве базисного препарата для лечения послеоперационного болевого синдрома в 1-й группе применяли лорноксикам, во 2-й - промедол. Оценка качества обезболивания включала визуально-аналоговую и вербальную шкалы, суточную дозу анальгетика, потребность в дополнительном назначении промедола, частоту нежелательных явлений.
Результаты. Лорноксикам в дозе 8 мг внутривенно обладает сравнимым с промедолом в дозе 20 мг анальгетическим эффектом, что позволяет применять первый в качестве базисного анальгетика для лечения острой боли после обширных хирургических вмешательств. Использование лорноксикама при лечении болевого синдрома после обширных хирургических вмешательств позволяет избежать применения опиоидов у 10-45% больных либо уменьшить их дозу на 32-65%.
Заключение. Адекватное обезболивание лорноксикамом и промедолом в раннем периоде после операций, выполненных на органах грудной и брюшной полости, магистральных сосудах нижних конечностей, имеет место у 82 и 87% больных соответственно. Введение лорноксикама методом постоянной внутривенной инфузии и контролируемой пациентом анальгезии у больных пожилого возраста позволяет в 45% случаев отказаться от использования опиоидных анальгетиков и характеризуется хорошей переносимостью.
Введение
Одним из основных принципов интенсивной терапии в послеоперационном периоде является обеспечение адекватной анальгезии. Доказано, что наличие болевого синдрома в раннем послеоперационном периоде может являться причиной развития множественных осложнений, в том числе кардиореспираторных и тромбоэмболических, нарушения функции желудочно-кишечного тракта (ЖКТ) и других органов и систем организма [1-3]. Для достижения адекватного обезболивания в настоящее время существует широкий выбор анальгетиков с различными механизмами действия. Тем не менее исследования, проведенные за последнее десятилетия, свидетельствуют, что 30% и более больных в послеоперационном периоде страдают от болей средней и сильной интенсивности из-за неадекватной анальгезии [4, 5]. Одним из основных причин этого является использование недостаточных доз опиоидных анальгетиков из-за опасности развития серьезных побочных явлений [1-3]. Так, по результатам исследований Н. А. Осиповой и соавт. [1], Р. Н. Лебедевой и В. В. Никоды [6], после обширных внутриполостных хирургических вмешательств для достижения адекватного обезболивания у ряда больных требуется использование опиоидов в дозах, вызывающих выраженную седацию, угнетение дыхания, тошноту, рвоту, парез ЖКТ, дисфункцию желче- и мочевыводящих путей. Особенно опасно это в раннем послеоперационном периоде, когда еще сохраняется реальная возможность потенцирования действия препаратов, примененных во время анестезии. Важным на правлением улучшения качества обезболивания, в том числе снижения числа нежелательных эффектов, является разработка методов комбинированного применения анальгетиков с различными механизмами действия и оптимизация способов их введения [7, 8]. В связи с этим понятен интерес клиницистов к неопиоидным обезболивающим препаратам, реализующим свой анальгетический эффект, минуя опиоидные рецепторы. Помимо этого, они обладают быстрым началом действия и эффективностью, сравнимой с опиоидами, что позволяет рассматривать их как препараты выбора для лечения острой боли [9]. Внедрение в клиническую практику инъекционных форм неопиоидных анальгетиков (кеторолака, кетопрофена, лорноксикама и парацетамола) расширяет арсенал препаратов для дифференцированного использования их при послеоперационной боли средней и сильной интенсивности.
Все вышеизложенное явилось основанием для проведения исследований, направленных на изучение эффективности и безопасности использования нестероидных противовоспалительных средств в качестве базисных анальгетиков в практике лечения острой боли после обширных оперативных вмешательств.
Цель исследования - сравнительная оценка качества обезболивания стандартной монотерапией опиоидным анальгетиком и обезболивания на основе применения нестероидного противовоспалительного препарата (НПВП).
Материалы и методы
В основу работы положен анализ результатов лечения болевого синдрома у 123 больных после обширных оперативных вмешательств на легких и трахее, сердце, органах брюшной полости, брюшной аорте и нижних конечностях (реконструктивные операции на сосудах, ампутации, реплантации, остеосинтез). В соответствии с поставленными задачами исследования больные были распределены по группам в зависимости от анальгетика, используемого в качестве основного (базисного) препарата для лечения послеоперационного болевого синдрома. 1-я группа - лорноксикам, 2-я (группа сравнения) - промедол. Для изучения безопасности применения лорноксикама у пациентов группы риска отдельно выделена подгруппа больных (n = 38) пожилого возраста, средний возраст которых составил 72 ± 4 года.
В целом между группами по характеру выполненных операций не было выявлено достоверных различий (табл. 1). Доля полостных операций, выполненных на органах грудной и брюшной полости, составила для 1-й и 2-й групп 96 и 98%, в том числе для абдоминальных операций 80 и 78% соответственно.
Таблица 1. Распределение больных по группам в зависимости от используемых анальгетиков и способов их введения при лечении послеоперационного болевого синдрома
| Группа | Число больных | Схема введения анальгетиков | базисный анальгетик | дополнительно промедол |
| 1 -я (лорноксикам; n = 68) | 17 | Лорноксикам - при болях в/в 8 мг 2 раза в сутки | При болях* | 13 | Лорноксикам - планово в/в 8 мг 2 раза в сутки | КПА | 19 | Лорноксикам - постоянная в/в инфузия до 1 мг/ч | При болях* | 19 | Лорноксикам - КПА 2-3 мг в/в болюсно | При болях* |
| 2-я (промедол; n = 55) | 24 | Промедол - при болях п/к 20 мг | - | 31 | Промедол - КПА, 3 мг в/в болюсно | - |
Больные, которым назначали НПВП, не отличались от больных контрольной группы, которым проводили монотерапию промедолом, по таким показателям, как рост и масса тела. Единственное статистически значимое различие было в подгруппе пожилых пациентов, которым назначали лорноксикам, возраст их в среднем составил 72 ± 4 года, что существенно превышало средний возраст больных во всех остальных группах (pДля проведения сравнительной оценки анальгетической эффективности, опиоидсберегающего действия и безопасности обезболивания использовались три основных способа введения препаратов: стандартная схема, когда препарат вводили по показаниям, болюсно, при жалобе пациента на появление умеренной или сильной боли; постоянная инфузия анальгетика со скоростью, рассчитанной в соответствии с назначенной суточной дозой; контролируемая пациентом анальгезия - КПА (см. табл. 1).
Если суточный лимит лорноксикама был исчерпан или препарат был недостаточно эффективен, дополнительно применяли промедол болюсно (по показаниям) или методом КПА.
Для оценки качества обезболивания использовали 4-балльную шкалу интенсивности боли; 10-сантиметровую визуально-аналоговую шкалу (ВАШ) боли; 5-балльную шкалу эффективности анальгетического действия (нет, незначительное, удовлетворительное, отличное); критерий снижения боли наполовину и более после первой инъекции анальгетика; определение длительности анальгетического действия, суточной дозы исследуемого анальгетика, потребность в дополнительном назначении промедола. При получении оценки от удовлетворительной до отличной, а также при отсутствии признаков некупированного болевого синдрома, таких как вынужденное положение больного, невозможность откашливания мокроты, негативно-депрессивное эмоциональное состояние, обезболивание считали адекватным.
В течение всего времени проведения данной обезболивающей терапии регистрировали все нежелательные явления, отмеченные пациентами и врачом.
Рутинно регистрировали системное артериальное давление, частоту сердечных сокращений, частоту дыхания, насыщение гемоглобина О2 (SpO2) до и в течение 3 ч после введения препарата.
Исследование системы гемостаза выполнено у 42 больных, получающих лорноксикам, в том числе у 18 пациентов пожилого возраста (16-24 мг/сут). Определяли концентрацию гемоглобина, количество эритроцитов, тромбоцитов, АДФ-индуцированную агрегацию тромбоцитов, активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс (ПТИ), время Р + К до начала, после 1-х суток и в день окончания обезболивания лорноксикамом. Кроме этого, рассчитывали среднюю скорость поступления отделяемого по дренажам до назначения лорноксикама, а также в течение 21 сут терапии этими анальгетиками.
У 48 больных, которым для обезболивания в послеоперационном периоде вводили лорноксикам, определяли креатинин и мочевину крови в 1-е сутки после операции до назначения НПВП, после 1-х суток, а также в день окончания терапии.
Критериями исключения больных из исследования являлись: данные анамнеза о непереносимости любого НПВП, осложненное течение послеоперационного периода (кровотечение, геморрагический синдром, шок, гиповолемия), эрозивно-язвеные поражения ЖКТ, нарушение функции почек (креатинин крови более 2 мг%), бронхиальная астма.
Для сравнительной оценки эффективности препаратов и методов их введения использовался интегральный показатель качества обезболивания, представляющий отношение количества хороших и отличных результатов обезболивания к числу нежелательных явлений. Нами был предложен относительный показатель качества обезболивания, даюший возможность сравнить действие различных препаратов и методов их введения с эффектом промедола, принятым за единицу, при его стандартном введении.
Этот показатель рассчитывался по формуле: 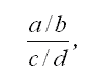
где а - количество хороших результатов обезболивания; b- количество нежелательных явлений исследуемого анальгетика; с - количество хороших результатов обезболивания; d- количество нежелательных явлений промедола.
Для определения статистической значимости различий этого показателя рассчитывали 95% доверительный интервал по формуле: 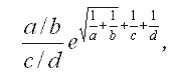
где z = 1,96 для 96% интервала.
При анализе количественных данных использовали критерий Стьюдента, однофакторный дисперсионный анализ и критерий Стьюдента с поправкой Бонферрони (при множественных сравнениях), при анализе степени снижения боли - критерии Манна-Уитни, Крускала-Уоллиса и Данна (при множественных сравнениях), для анализа побочных эффектов - критерий х2 и точный критерий Фишера. Средние величины указаны в виде средних ± стандартное отклонение.
Результаты
Сравнительная оценка анальгетической эффективности лорноксикама и промедола. У больных, у которых применяли дискретное введение разовых доз анальгетиков "при болях", не было выявлено различий в исходной интенсивности боли, которая для основной группы и группы сравнения составила 6,7 ± 1,2 и 7,0 ± 1,0 см по ВАШ соответственно.
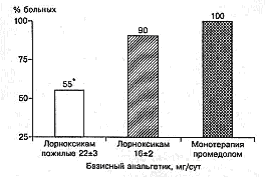
Рис. 1. Потребность в дополнительном введении промедола при обезболивании лорноксикамом в раннем послеоперационном периоде.
В динамике интенсивность боли снижалась до 4,1 ± 1,3 и 4,4 ± 1,5 см по ВАШ соответственно в группах лорноксикама и промедола по сравнению с исходными значениями (р < 0,01; критерий Стьюдента).
Частота достижения адекватного обезболивания (хорошие и удовлетворительные результаты) после первой инъекции промедола составила 87%, что достоверно не отличалось от лорноксикама (82%). При сравнительном анализе частоты хороших результатов обезболивания по критерию "снижение боли наполовину и более выявлено, что эффективность обезболивания промедолом и лорноксикамом не различалась.
Максимальный анальгетический эффект наблюдался через 1,5 ч после введения промедола и через 2 ч после инъекции лорноксикама. Длительность обезболивающего действия промедола (4,3 ± 1,7 ч) и лорноксикама (4,3 ± 1,3 ч) не различалась. Частота хороших результатов обезболивания ("снижение боли наполовину и более") при применении лорноксикама не отличалась от таковой при обезболивании промедолом (35 и 38% соответственно). Таким образом, лорноксикам в дозе 8 мг внутривенно обладает сравнимым с промедолом в дозе 20 мг анальгетическим эффектом, что позволяет применять первый в качестве базисного анальгетика для лечения острой боли после обширных хирургических вмешательств наряду с опиоидами.
Опиоидсберегающее действие. У пациентов, которым проводится комбинированное обезболивание (НПВП и опиоидами) по сравнению с контрольной группой (монотерапия опиоидами) отмечено опиоидсберегающее действие - уменьшение потребности в опиоидном анальгетике. Сокращение потребности в опиоидах оценивали по следующим двум показателям:
У больных, получающих в качестве базисного анальгетика лорноксикам, дополнительное введение промедола требовалось в 90% случаев, а у больных пожилого возраста этот показатель составил 55% (рис. 1).
У тех больных, которым требовалось дополнительное введение промедола, его средние суточные дозы были ниже, чем в группе монотерапии опиоидом (рис. 2).
Рис. 2. Потребность в дополнительном назначении промедола в зависимости от суточной дозы лорноксикама у больных среднего и пожилого возраста.
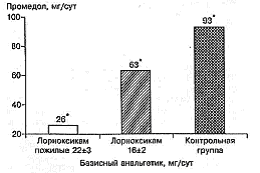
При лечении послеоперационной боли у пациентов пожилого возраста лорноксикам зарекомендовал себя как высокоэффективный анальгетик. В 1-е сутки после операции 38 пациентам в возрасте от 67 до 81 года проводилось обезболивание лорноксикамом: у 19 методом внутривенной инфузии и у 19 методом КПА. Средняя суточная доза лорноксикама составила 22 ± 3 мг. Применение лорноксикама позволило в половине случаев отказаться от введения опиоидного анальгетика (см. рис. 1), а в половине - существенно снизить его суточную дозу (см. рис. 2). Так, дополнительное введение промедола требовалось 55% больных, а его средняя суточная доза в этих случаях составила 26 ± 14 мг. Исходя из результатов наших исследований, при монотерапии промедолом методом КПА значительно повышается эффективность обезболивания по сравнению со стандартной схемой назначения (подкожно болюсно "при болях"). Частота адекватных результатов при этом увеличивалась с 83 до 97%, а хороших и отличных - с 25 до 74% (р < 0,05). При этом средние суточные дозы препарата в группах монотерапии боли промедолом достоверно не различались (рис. 3).
Рис. 3. Эффективность обезболивания в зависимости от схемы назначения промедола.
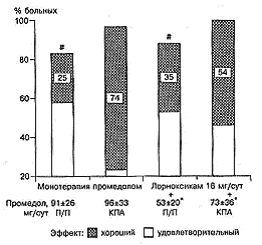
Подобная закономерность наблюдалась и при различных способах введения промедола на фоне планового (базисного) назначения лорноксикама в суточной дозе 16 мг, с той разницей, что при этом расходовались меньшие дозы промедола (р < 0,05; см. рис. 3).
Нежелательные явления. Важным направлением повышения качества послеоперационного обезболивания является снижение частоты побочных эффектов, что может быть достигнуто применением комбинаций препаратов с различными механизмами реализации анальгетического эффекта.
В целом по группе лорноксикама наиболее частыми (у 6% больных) нежелательными эффектами являлись чувство жара, повышенная потливость. Умеренная выраженность этих эффектов не требовала отмены анальгетика. Больные пожилого возраста относятся к категории пациентов, у которых проблема послеоперационного обезболивания особенно актуальна, поскольку применение опиоидов и НПВП связано с повышенным риском развития нежелательных эффектов. Назначение лорноксикама больным данной группы не сопровождалось повышением частоты и тяжести нежелательных явлений.
Таким образом, использование лорноксикама при лечении болевого синдрома после обширных хирургических вмешательств позволяет избежать применения опиоидов у 10-45% больных либо уменьшить их дозу на 32-65%. Данное обстоятельство является важным фактором в профилактике послеоперационных осложнений, связанных с угнетением сознания, дыхания, парезом ЖКТ, дисфункцией желчных и мочевыводящих путей, характерных для опиоидов. Это особенно важно в 1-е сутки после операции, когда вероятность реализации нежелательных эффектов опиоидов особенно высока.
Одним из важных вопросов использования НПВП у больных после хирургических вмешательств является их влияние на гемостаз и функцию почек. В наших исследованиях введение лорноксикама не влияло на такие показатели свертывания крови, как АЧТВ, ПТИ, число тромбоцитов. Наблюдаемое снижение количества эритроцитов в среднем на 7-14% (различия между группами статистически незначимы) к 3-4-му дню проведения терапии лорноксикамом по сравнению с исходными значениями (р < 0,05) происходило на фоне снижения скорости поступления отделяемого по дренажам и не требовало проведения заместительной или гемостатической терапии. Повышение концентрации мочевины с 27 ± 8 до 32 ± 11 мг% к 3-м суткам терапии лорноксикамом не сопровождалось повышением концентрации креатинина и олигурией. Следует добавить, что данное повышение могло быть обусловлено повышенным катаболизмом, характерным для раннего послеоперационного периода. При лечении болевого синдрома НПВП мы придерживались следующих принципов: не превышать стандартную рекомендуемую суточную дозу; не проводить терапию болевого синдрома препаратами НПВП более 5 сут; при недостаточной эффективности не увеличивать выбранную дозу НПВП, а дополнительно назначать опиоиды; не применять НПВП у больных с анамнезом язвенной болезни желудка и двенадцатиперстной кишки, с нарушением функции почек (креатинин более 2 мг%, олигурия), с осложненным течением послеоперационного периода (кровотечение, геморрагический синдром, шок, гиповолемия); профилактически применять блокаторы Н2-рецепторов; при наличии внутривенного катетера отдавать предпочтение внутривенному пути введения препаратов. Руководствуясь вышеуказанными принципами, при проведении обезболивания НПВП мы ни в одном случае не наблюдали связанных с ними послеоперационных кровотечений и язвенных поражений ЖКТ.
При использовании интегрального показателя качества обезболивания, определяющего соотношение количества хороших и отличных результатов обезболивания к числу нежелательных явлений, нами показано, что применение метода КПА промедолом повышает качество обезболивания в 3,5 раза в сравнении с обезболиванием промедолом при стандартном его назначении (табл. 2).
Таблица 2. Качество обезболивания* в зависимости от анальгетика и метода его назначения
| Анальгетик (мг/сут); метод назначения | Огносительный показатель качества обезболивания | 95% доверительный интервал |
| Промедол (91 ± 26); по показаниям | 1,0 |   |
| Промедол (96 ± 33); КПА | 3,5 | 1,1-11,7 |
| Лорноксикам (16 ± 2) | 13,0 | 2,2-77,3 |
| Лорноксикам, пожилые (22 ± 3) | 21 | 3,6-120,9 |
Выводы
1. НПВП обладают анальгетическим потенциалом, который позволяет рекомендовать их в качестве неопиоидного компонента мультимодального лечения болевого синдрома умеренной и сильной интенсивности у больных после операций, выполненных на органах грудной и брюшной полости, магистральных сосудах нижних конечностей.
2. Адекватное обезболивание в раннем послеоперационном периоде после однократного введения лорноксикама и промедола имеет место у 82 и 87% больных соответственно.
3. Применение лорноксикама в качестве базисного компонента обезболивания в раннем послеоперационном периоде в 10% случаев позволяет отказаться от назначения промедола. У ряда больных удается уменьшить его суточную дозу в среднем на 32%. Введение лорноксикама методом постоянной внутривенной инфузии и КПА у больных пожилого возраста позволяет в 45% случаев отказаться от использования опиоидных анальгетиков и характеризуется хорошей переносимостью.
4. Использование НПВП как неопиоидного компонента мультимодального обезболивания в комбинации с промедолом приводит к повышению качества обезболивания. Список литературы
1. Осипова Н.А., Береснев В.А., Абузарова Г.Р. и др. Нестероидные противовоспалительные препараты (ацелизин) в послеоперационном обезболивании и интенсивной терапии. Анестезиол. и реаниматол. 1994; 4: 41-45.
2. HugС. С. Improving analgesic therapy. Anesthesiology 1980; 53:441.
3. Smith G. Management of post-operative pain. Can. J. Anaesth. 1989; suppl. 36: 1.
4. White P. F. Patient-controlled analgesia: an update on its use in the treatment of postoperative pain. Anesth. Clin. N. Am. 1989; 7: 63.
5. Ферранте Ф.М., ВейдБонкор Т.Р. Послеоперационная боль. М.: Медицина; 1998.
6. Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. М.: Аир-Арт; 1998.
7. Brown А. К., Christo P.J., Wu С.L. Strategies for postoperative pain management. Best Pract. Res. Clin. Anaesthesiol. 2004; 18: 703-717.
8. Habib A. S., Gan T. J. Role of analgesic adjuncts in postoperative pain management. Anesth. Clin. N. Am. 2005; 23: 85-107.
9. Brown С.R., Sevelius H., Wild V. A comparison of single doses of naproxen sodium, morphin sulphat and placebo in patients with postoperative pain. Curr. Ther. Res. 1984; 35: 511-518.
