Резистентная артериальная гипертония: новое и неизменно значимое
Статьи Опубликовано в издании:
«Сердце: журнал для практикующих врачей» Том 12, № 2 (70), 2013 г.
Кобалава Ж. Д., Шаварова Е. К.
ФГБОУ ВПО «РУДН», 117198, Москва
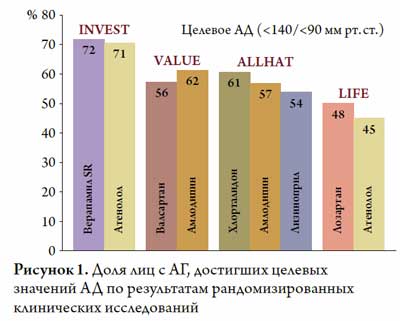
Артериальная гипертония является одним из самых распространенных хронических заболеваний, поражающих четверть взрослого населения [1], при этом неоднократно доказано наличие линейной взаимосвязи между уровнем АД и риском сердечно-сосудистых событий [2–4]. По данным ВОЗ, с недостаточным контролем АД можно определенно связать около 7,1 млн. смертей в год [5]. Несмотря на наличие современных высоко эффективных средств для лечения АГ контроль над заболеванием остается неудовлетворительным во всем мире. Крупные рандомизированные клинические исследования, в которых оценивалась эффективность того или иного режима антигипертензивной терапии у больных АГ, убедительно продемонстрировали, что у 18–55 % участников достичь целевых значений АД не удается, несмотря на прием 3-х и более антигипертензивных препаратов [6–8] (рис. 1).
Определение и распространенность резистентной АГ
Артериальная гипертензия, при которой уровень АД остается выше целевых значений, несмотря на прием 3-х и более антигипертензивных препаратов в оптимальных дозах, один из которых диуретик, называют резистентной АГ [9]. Последний согласительный документ, посвященный резистентной АГ, изданный экспертами Американской ассоциации кардиологов в 2008 году, добавляет к этому определению, что АГ, контролируемая приемом 4-х и более препаратов, также должна быть отнесена к резистентной [10]. Повышенным может быть как САД, так и ДАД, однако часто наблюдается изолированная систолическая АГ. Так, в исследовании ALLHAT, в котором наблюдались 33 тыс. пациентов с АГ, целевых значений САД достигли только 67 % участников, в то время как снижение ДАД менее 90 мм рт. ст. отмечено в 92 % случаев [11].
Распространенность резистентной АГ в общей популяции изучена крайне мало: анализ отдельных выборок пациентов, проведенный по результатам крупных исследований эффективности антигипертензивных препаратов, не вполне адекватно отражает ситуацию в общей популяции, хотя представляет ценность, поскольку протокол четко регламентирует строгий контроль приверженности к лечению и усиление антигипертензивной терапии при недостижении целевых цифр АД. К сожалению, исследования, целью которых являлось бы именно изучение распространенности резистентной АГ, практически отсутствуют. Тем не менее небольшие проекты продемонстрировали, что встречаемость резистентной АГ колеблется от 5 % среди больных в общей медицинской практике до 50 % у пациентов нефрологического профиля [12]. Среди лиц с АГ, по данным регистра NHANES (США), распространенность резистентной АГ постоянно увеличивается на протяжении последних 30 лет и в среднем составляет 8,9 %. Статистика Франции, Германии, Великобритании и Испании демонстрирует большую распространенность резистентности к лечению – от 14,6 до 17,5 % [13, 14].
Один из первых крупных проектов по изучению распространенности и прогноза резистентной АГ опубликован Daugherty с соавт. в 2012 году [15]. Проанализирован регистр, включающий 200 тыс. пациентов с впервые выявленной АГ. В течение последующего наблюдения примерно 21 % больных потребовалось назначение 3-х и более антигипертензивных препаратов, причем через 1 год после назначения третьего препарата один из 50 пациентов имел резистентность к проводимой терапии. Таким образом, распространенность резистентной АГ среди лиц с впервые выявленной АГ составляет около 2 %. Анализируя большую репрезентативную выборку больных с АГ в условиях рутинной практики, авторы предусмотрели строгий учет приверженности лечению – пациенты, получившие в аптеках менее 80 % от назначенных препаратов, исключались из анализа – что является бесспорным преимуществом данного исследования. Это позволило исключить больных с «псевдорезистентной» АГ и судить о распространенности истинной резистентности к терапии. Распространенность резистентной АГ постоянно растет в силу старения популяции, увеличения распространенности ожирения и СД, снижения физической активности, широкого употребления веществ, повышающих АД [10, 16].
Таблица 1.
Риск резистентности терапии больных АГ: калькулятор баллов
| Систолическое АД, мм рт. ст. | 125-134 | 135-144 | 145-154 | 155-164 | 165-174 | 175-184 | 185-194 | ≥195 | |
|---|---|---|---|---|---|---|---|---|---|
| +3 | +7 | +10 | +21 | +28 | +14 | +17 | +24 | +31 | |
| Индекс массы тела, кг / м2 | 21,5-26,4 | 26,5-31,4 | 31,5-36,4 | 36,5-41,4 | 41,5-46,4 | 46,5-51,4 | ≥51,5 | ||
| 0 | +2 | +4 | +6 | +8 | +10 | +12 | +14 | ||
| Глюкоза, ммоль / л | 5,6-7,6 | 7,7-9,8 | 9,9-11,9 | 12,0-14,1 | 14,2-16,2 | 16,3-18,4 | 18,5-20,5 | ≥20,5 | |
| 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |
| Возраст окончания образования, лет | ≥19 | 17-18 | 15-16 | 12-14 | |||||
| 0 | +1 | +1 | +2 | ||||||
| Раса | Белая | Африканская | Азиатская | Другая | |||||
| 0 | +1 | +5 | +7 | * -Употребление алкоголя: мужчины / женщины • низкое – 0,1–7 / 0,1–3 ед. / неделю • умеренное – 8–21 / 4–14 ед. / неделю • высокое – >21 / 14 ед. / неделю | |||||
| Употребление алкоголя* | Нет | Низкое | Умеренное | Высокое | |||||
| 0 | +1 | +2 | +4 | ||||||
| Пол | Женский | Мужской | |||||||
| 0 | +5 | ||||||||
| Сахарный диабет | Нет | Есть | |||||||
| 0 | +5 | ||||||||
| Предшествующее применение аспирина | Да | Нет | При назначении амлодипина / периндоприла: –6 от общего количества баллов. При назначении статинов: –1 от общего количества баллов. | ||||||
| 0 | +3 | ||||||||
| Гипертрофия левого желудочка | Нет | Есть | |||||||
| 0 | +2 | ||||||||
В исследовании ASCOT – одном из крупнейших исследований выживаемости пациентов с АГ в зависимости от выбора режима антигипертензивной терапии – в 2011 году был выполнен дополнительный анализ результатов, в котором проведена подробнейшая оценка детерминант развития резистентной АГ [17]. В подгруппе пациентов нелеченной АГ (n=3 666) риск развития резистентной АГ был выше у лиц с более высоким исходным САД, нарушениями углеводного обмена, повышенной массой тела, гипертрофией ЛЖ, а также у лиц, употребляющих алкоголь. В общей популяции исследования ASCOT (n=19 257) риск развития резистентной АГ был выше у пациентов, ранее получавших один или несколько антигипертензивных препаратов (увеличение риска в 1,7 и 3,9 раза соответственно), чем у пациентов с АГ, ранее не получавших лечения. Факторами, предопределяющими пониженный риск резистентности к терапии, были предшествующий прием аспирина, рандомизация в группу амлодипина ± периндоприл (Престанс, Servier) (снижение риска развития резистентной АГ на 47% в данной группе), более высокий уровень образования.
Основными детерминантами развития резистентной АГ были исходное АД и выбор антигипертензивной терапии. На основании этих данных был разработан калькулятор оценки риска развития резистентной А Г, использование которого позволяет выделить когорту пациентов, у которых вероятность неэффективности терапии выше, чем в общей популяции лиц с АГ. Используя этот калькулятор, уже при первом обращении пациента можно выделить подгруппу больных, которым потребуются более частые визиты и более строгий контроль со стороны врача (табл. 1 и 2).
Таблица 2.
Риск развития резистентности к терапии в ближайшие 5 лет у нелеченых больных АГ
| Общее число баллов | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 | 22 | 24 | 28 | 30 | 32 | 34 | 36 | 38 | 40 | 42 | 44 | 46 | 48 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 5-летний риск | 1,1 | 1,3 | 1,6 | 2,0 | 2,4 | 2,9 | 3,5 | 4,3 | 5,2 | 6,3 | 7,7 | 9,3 | 11,2 | 13,5 | 16,3 | 23,3 | 27,6 | 32,6 | 38,3 | 44,5 | 51,3 | 58,5 | 65,8 | 73,1 | 79,8 |
Для использования калькулятора нужно оценить значение систолического артериального давления, глюкозы, ИМТ, уровень образования, расу, пол, наличие сахарного диабета, гипертрофии левого желудочка, предшествующее применение аспирина, среднее потребление алкоголя в неделю, получаемые пациентом антигипертензивную и липидмодифицирующую терапию и подсчитать общее количество баллов. Затем на основании представленных выше таблиц оценивается 5-летний прогноз развития резистентности терапии нелеченных больных АГ.
Причины псевдорезистентности
Термин «резистентная АГ» не может считаться синонимом неконтролируемой А Г, к причинам которой можно отнести назначение лекарственных препаратов в неоптимальных дозах, низкую приверженность к лечению пациента, недиагностированные вторичные АГ, некорректное измерение АД, гипертонию «белого халата». Наиболее частыми ошибками в измерении АД можно считать однократные вместо 2-3-кратных измерения АД, использование манжеты недостаточного для полной руки размера, несоблюдение больным условий нахождения в покое в течение нескольких минут, курение перед измерением АД, расположение манжетки выше или ниже уровня сердца [18, 19]. У пожилых больных выраженный кальциноз препятствует полному сжатию пораженной атеросклерозом артерии, что несколько завышает истинные цифры АД [18, 19]. Эффект «белого халата», определяемый как повышенное АД при измерении в кабинете врача при нормальных значениях АД в домашних условиях, встречается достаточно часто и среди лиц с резистентной АГ, однако у 25 % этих больных удается зарегистрировать целевые значения АД при амбулаторном измерении АД [20]. Таким образом, применение методов самоконтроля АД или суточного мониторирования АД позволяет избежать гипердиагностики резистентной АГ у лиц, реагирующих на визит к врачу подъемом АД.
Между тем основной причиной псевдорезистентности к терапии остается низкая приверженность к лечению. Среди лиц с впервые выявленной АГ 40-50 %отменяют назначенное лечение в течение первого года [20-26]. Причины низкой приверженности многочисленны. Они связаны с пациентом: нездоровый образ жизни, индивидуальные социальные и культурные факторы, плохая осведомленность и недостаточное осознание рисков и осложнений АГ, социальное окружение, низкая мотивация или готовность к изменениям в поведении; с организацией здравоохранения: транспортная доступность лечебного учреждения, время, затраченное на ожидание приема врача, ограниченное время визита, неадекватное материальное обеспечение, неоптимальное ведение учета, сложная система требований и правил, система финансирования здравоохранения; с заболеванием: бессимптомное течение АГ; с лечением: сложные схемы приема препаратов, длительность, высокая цена, побочные эффекты, количество таблеток, принимаемых в день. Продемонстрировано, что от 9 до 37 % пациентов, не отвечающих на антигипер-тензивную терапию, в действительности не привержены к лечению. Приверженность пациентов с АГ к лечению в российской популяции, по данным исследований ПРИЗМА И АРГУС-2, составляет всего 20-30 % [27, 28].
С целью изучения мотивации и приверженности больных АГ к длительному лечению и возможностей их повышения в 2009 г. по инициативе Секции доказательной кардиологии ВНОК было выполнено проспективное исследование «Повышение ПРИверженности и мотивации к антигипертенЗивной терапии у больных артериальной гипертонией путем образовательных программ и рационального применения ингибитора АПФ престариуМА» (ПРИЗМА). В нем приняли участие 240 терапевтов и кардиологов поликлиник 17 регионов РФ. В течение 2 недель зарегистрированы 2 347 пациентов с известной АГ, обратившихся в поликлинику. У 1 792 (76,3 %) пациентов целевой уровень АД не достигнут, при этом 1 409 (78,6 %) пациентов оказались неприверженными к лечению (Нельзя забывать, что существуют проблемы, связанные с врачом, такие как не приверженность врача к принципам рациональной антигипертензивной терапии и терапевтическая инертность, когда сами врачи назначают антигипер-тензивные препараты в неоптимальных дозах или выбирают нерациональные комбинации.
Факторы, способствующие резистентности к антигипертензивной терапии
После исключения возможных причин псевдорезистентности должен закономерно вставать вопрос о наличии факторов, способствующих развитию резистентной АГ. Среди них можно отметить применение веществ, способствующих повышению АД, таких как некоторые лекарственные средства (нестероидные противовоспалительные средства (НПВС), анаболические стероиды, симпато-миметики, глюкокортикоиды, эритропоэтины, оральные контрацептивы, трициклические антидепрессанты, циклоспорин, такролимус, пищевые добавки (солодка, женьшень, йохимбин, померанец). Самыми часто используемыми, бесспорно, являются НПВС – средства, подавляющие продукцию простагландинов в почках, что приводит к снижению почечного кровотока, а следовательно, задержке натрия и воды, что сопровождается повышением АД в среднем на 5 мм рт. ст. [29]. Помимо этого, НПВС способны ослаблять действие иАПФ, сартанов, β-адреноблокаторов, диуретиков. В большей степени негативные эффекты НПВС отмечаются у лиц со снижением функции почек [10]. Такие вещества, как кофеин, никотин, алкоголь, кокаин, амфетамин, также способны повышать АД. Умеренное употребление алкоголя не влияет на уровень АД, в то время как употребление более трех доз алкоголя в день имеет дозозависимый эффект на уровень АД как у больных с АГ, так и у лиц без гипертонии [9]. Всем лицам с АГ следует ограничить употребление алкоголя: мужчинам – до двух, а женщинам – до одной дозы в день.
Не менее значимым фактором развития резистентности к антигипертензивной терапии является перегрузка объемом на фоне неадекватной диуретической терапии, избыточного употребления поваренной соли, задержки жидкости при патологии почек. Взаимосвязь содержания поваренной соли в пище с уровнем АД неоднократно подчеркивалась в наблюдательных исследованиях [30, 31]. Среднее содержание поваренной соли в пище больных с резистентной АГ составляет около 10 г / день, что превышает данный показатель в общей популяции [31]. В частности, в работе Pimenta E. с соавт. изучено влияние ограничения содержания поваренной соли в пище на уровень АД, измеренного как в офисе врача, так и при суточном мониторировании у лиц с резистентной АГ (n=12) [32]. В рандомизированном исследовании пациенты получали последовательно диету с низким (50 ммоль / 24 ч) и высоким (250 ммоль / 24 ч) содержанием натрия с двухнедельным интервалом в перекрестном дизайне. Помимо уровня АД оценивали содержание мозгового натрийуретического пептида, активность ренина плазмы, экскрецию альдостерона, натрия и калия, скорость распространения пульсовой волны в аорте и индекс аугментации после обоих периодов исследования.
Исходно, несмотря на прием в среднем около 3,4 антигипертензивных препаратов офисное АД составляло 145,8±10,8 / 83,9±11,2 мм рт. ст. Средняя экскреция натрия была достоверно выше в группе высокого потребления натрия по сравнению с группой низкого потребления(252,2±164,6 против 46,1±126,8 ммоль / 24). Низкое потребление соли по сравнению с высоким ассоциировалось со снижением САД на 22,7 мм рт. ст. и ДАД на 9,1 мм рт. ст. В период соблюдения диеты с низким содержанием натрия отмечалось повышение активности ренина плазмы и снижение уровня натрийуретического пептида и клиренса креатинина, что свидетельствует об уменьшении внутрисосудистого объема жидкости. Таким образом, избыточное содержание поваренной соли в пище вносит существенный вклад в формирование резистентности к антигипертензивной терапии. Снижение потребления поваренной соли с пищей должно составлять важную часть терапевтической стратегии ведения больного с резистентной АГ. Современные рекомендации предусматривают ограничение потребления поваренной соли менее 2,4 г / день для молодых здоровых лиц и менее 1,5 г / день для лиц старше 51 года или страдающих АГ, СД, хронической болезнью почек [33].
Нераспознанные вторичные АГ также представляют собой возможную причину неэффективности антигипертензивной терапии. 5–10 % лиц с резистентной АГ имеют недиагностированные вторичные причины АГ [34, 35]. Поскольку экономически нецелесообразно всем лицам с АГ исключать вторичные причины повышения АД, с особым вниманием нужно относиться к наличию клинических проявлений, подозрительных на вторичную АГ (табл. 3). Самыми частыми причинами вторичных АГ являются почечные паренхиматозные заболевания, поэтому минимальный диагностический минимум обследования больного с АГ должен включать общий анализ мочи, исследование уровня креатинина и калия сыворотки, УЗИ почек. Несвоевременная диагностика заболеваний почек при отсутствии оптимальной диуретической терапии является нередким фактором развития резистентной АГ. Сам факт наличия резистентной АГ требует дообследования пациента для исключения вторичных АГ.
Целый ряд сопутствующих состояний, таких как ожирение, СД, пожилой возраст, способствуют формированию резистентности к проводимой антигипертензивной терапии [11, 36]. Механизмы, по которым ожирение влияет на контроль АД, сложны и мало изучены, среди них обсуждаются инсулинорезистентность и гиперинсулинемия, нарушение экскреции натрия, повышение активности симпатической нервной системы, повышение чувствительности к альдостерону, развитие синдрома обструктивного ночного апноэ [37–39]. Снижение массы тела на фоне гипокалорийной диеты и повышения физических нагрузок сопровождается умеренным снижение АД [10, 18]. Распространенность резистентной АГ выше среди лиц старше 65 лет [40]. По-видимому, это связано с увеличением сосудистой жесткости, которая не только обусловливает некоторое завышение истинных цифр АД при его измерении, но и является основной причиной истинного повышения АД [9, 19].
Таблица 3.
Клинические проявления вторичных АГ
| Общие | Тяжелая неконтролируемая АГ Резкая дестабилизация ранее контролируемой АГ Дебют АГ в юношеском возрасте |
| Реноваскулярные АГ | Повышение креатинина на 30 % и более после назначения ингибиторов АПФ или блокаторов рецепторов к АII Тяжелая АГ у пациентов с распространенным атеросклерозом и асимметрия размеров почек более 1,5 см Тяжелая АГ у лиц с повторными эпизодами отека легких Шум в проекции почечных артерий |
| Почечные АГ | Повышение креатинина сыворотки Изменения мочевого осадка |
| Феохромоцитома | Пароксизмальные подъемы АД Клиническая триада симптомов (головная боль, сердцебиение, потливость) |
| Первичный гиперальдостеронизм | Гипокалиемия Мышечная слабость |
| Синдром Кушинга | Кушингоидное лицо, центральное ожирение, мышечная слабость, экхимозы Возможно – анамнез применения глюкокортикостероидов |
| Синдром обструктивного апноэ сна | Мужчины с ожирением, храпящие во сне Дневная сонливость, слабость |
| Гипотиреоз | Симптомы гипотиреоза Повышение тиреотропного гормона |
| Первичный гиперпаратиреоз | Повышения уровня кальция сыворотки |
| Коарктация аорты | Повышение АД на руках при замедлении пульса на бедренных артериях, низкое или неопределяемое АД на ногах Ослабление пульса на левой плечевой артерии при отхождении левой подключичной артерии дистальнее коарктации |
Лечение резистентной АГ Современные подходы к ведению больного АГ, не поддающейся коррекции, суммированы в таблице 4 [41]. Субоптимальные режимы дозирования и неэффективные комбинации антигипертензивных препаратов остаются основной причиной недостижения контроля над заболеванием [34, 35]. Экспертами Американской ассоциации кардиологов сформулированы следующие рекомендации по изменению режима фармакотерапии при резистентной АГ. Поскольку одной из ведущих причин резистентности АГ является скрытая задержка жидкости в организме, назначение в дозе 12,5 мг или увеличение дозы тиазидных диуретиков (гидрохлоротиазид, хлорталидон) в ряде случаев до 50 мг рассматривается в качестве первоочередной меры [18]. При снижении СКФ менее 40 мл / мин / 1,73 м2 показана терапия петлевыми диуретиками, причем короткодействующий фуросемид рекомендуется назначать дважды или даже трижды в день, поскольку однократное назначение сопровождается кратковременной стимуляцией натрийуреза с последующей стимуляцией РААС, а следовательно, задержкой натрия [18]. Альтернативой является назначение торасемида – препарата с большей длительностью действия. Существует убедительная доказательная база, подтверждающая, что изменение диуретической терапии (добавление диуретика, повышение его дозы или перевод пациента на диуретик другого класса с учетом сохранности почечной функции) позволяет более чем у 60 % пациентов достигнуть целевых значений АД [18, 30, 35, 42–44].
Таблица 4.
Современные подходы к ведению больного с АГ, не поддающейся коррекции
| 1. Активная антигипертензивная терапия в оптимальных дозах, включая назначение фиксированных комбинаций согласно современным рекомендациям |
| 2. Выявление и устранение причин псевдорезистентности: • соблюдение правил измерения АД; • исключение АГ «белого халата» при помощи самоконтроля АД и суточного мониторирования АД; • оценка приверженности лечению, при несоблюдении пациентом предписанных режимов терапии – ознакомление пациента с осложнениями неконтролируемой АГ и положительными эффектами регулярной антигипертензивной терапии для укрепления мотивации; • назначение пациентам с низкой приверженностью более частых визитов в клинику |
| 3. Выявление и устранение факторов истинной резистентности: • минимизация использования агентов, провоцирующих повышение АД; • снижение употребления алкоголя; • снижение потребления поваренной соли до 2,4 г / сутки; • снижение массы тела при наличии избыточной массы тела и ожирения; • регулярные аэробные физические нагрузки (как минимум, 30 мин / день 5 дней в неделю); • оценка СКФ и коррекция терапии при необходимости нефропротекции; • поиск возможных причин вторичных АГ и лечение (по показаниям) |
К 2010 г. был накоплен определенный опыт назначения спиронолактона в дозах от 12,5 до 50 мг / сутки в дополнение к комбинированной антигипертензивной терапии с целью достижения целевых цифр АД у больных резистентной АГ. По данным неконтролируемых наблюдательных или ретроспективных исследований, применение антагониста альдостерона сопровождалось снижением клинического САД и ДАД на 14–26 / 7–12,5 мм рт. ст. Анализ результатов рандомизированного контролируемого исследования ASCOT подтвердил, что добавление спиронолактона в средней дозе 25 мг в сутки больным с рефрактерной АГ позволяет добиться эффективного снижения как САД, так и ДАД, при этом у 6 % больных отмечаются нежелательные явления, преимущественно в виде гинекомастии или дискомфорта в грудных железах и гиперкалиемии. Требовалось дальнейшее изучение этого аспекта в контролируемом исследовании, где оценка роли спиронолактона в лечении резистентной АГ являлась бы первичной целью исследования.
Первым многоцентровым рандомизированным двойным слепым исследованием, поставившим своей основной целью оценить эффекты дополнительного назначения спиронолактона 25 мг в отношении АД у больных с резистентной АГ по сравнению с плацебо, стало исследование ASPIRNT [45]. Использовались критерии резистентности АГ Американской ассоциации кардиологов. Основными критериями исключения была III степень повышения АД, снижение азотвыделительной функции почек, гиперкалиемия и гипонатриемия. Длительность наблюдения составила 8 недель. Первичной конечной точкой была оценка степени снижения дневного АД по данным суточного мониторирования АД, вторичными конечными точками – снижение среднесуточного и клинического АД, изменения уровня натрия, калия и креатинина сыворотки, изменение массы тела, ответ на терапию спиронолактоном в зависимости от исходного уровня альдостерона и отношения альдостерон / ренин. Вторичные причины АГ выявлены у 28 пациентов (24 % от всех включенных), и их частота была сопоставима в группах спиронолактона и плацебо. Так, первичный гиперальдостеронизм выявлен в 14,5 и 16,1 % случаев, синдром обструктивного апное сна в 1,8 и 3,6 % случаев соответственно, реноваскулярная АГ в 5,4 % и нефрогенная АГ в 1,8 % случаев в обеих группах. Были достигнуты достоверные различия в снижении дневного САД по данным СМАД в группе спиронолактона по сравнению с плацебо (-5,4 мм; p=0,024). Различия по дневному ДАД были недостоверны. Целевых цифр САД через 8 недель лечения достигли 54,5 % больных группы спиронолактона и 42,9 % больных группы плацебо (p=0,257). Целевых цифр ДАД через 8 недель лечения достигли 69.1 % больных группы спиронолактона и 64,3 % больных группы плацебо (p=0,688). Исследование прекращено досрочно после промежуточного анализа 117 пациентов ввиду значительного снижения САД и меньше ожидаемого снижения ДАД в одной из групп. Таким образом, назначение спиронолактона 25 мг / сутки больным с резистентной АГ эффективно для достижения контроля САД при переносимости, сравнимой с плацебо. Единственным предиктором эффективности снижения САД и ДАД на фоне терапии спиронолактоном было исходное отношение альдостерон / активность ренина плазмы. Также была выявлена достоверная взаимосвязь исходной активности ренина плазмы и эффективности в отношении снижения среднесуточного САД. При назначении спиронолактона целесообразно регулярное мониторирование калия, с учетом возможности развития гиперкалиемии на фоне его приема. Оптимизации лечебной тактики ведения больных с резистентной АГ посвящено исследование PHARES, в котором проведено сравнение эффективности и безопасности двух режимов терапии: последовательной блокады нефрона (низкодозовая комбинация диуретиков, действующих в разных отделах нефрона с целью повышения выведения натрия) и последовательной блокады РААС (иАПФ и β-адреноблокатор), назначаемых пациентам, уже получающим ирбесартан 300 мг, гидрохлортиазид 12,5 мг и амлодипин 5 мг и не достигших целевого уровня АД [46]. Стратегия последовательной блокады нефрона подразумевала назначение спиронолактона 25 мг с последующим пошаговым добавлением 20 мг, а потом 40 мг фуросемида и амилорида 5 мг. Стратегия последовательной блокады РААС включала наращивание дозы рамиприла с 5 до 10 мг с добавлением 5 мг, а затем 10 мг бисопролола.
Выбор стратегии последовательной блокады нефрона оказывал более мощный антигипертензивный эффект у больных с резистентной АГ. Переносимость обоих режимов терапии была сопоставима. В группе последовательной блокады нефрона отмечалась несколько большая частота гиперкалиемии, повышения креатинина, гипонатриемии, эректиль-ной дисфункции, в группе последовательной блокады РААС наблюдалась большая частота развития кашля, гипокалиемии, брадикардии. У больных с резистентной АГ повышение выведения натрия путем комбинирования низких доз нескольких диуретиков приводит к более значимому и безопасному снижению АД по сравнению с блокадой РААС.
В 2011 г. британские эксперты по АГ обновили национальное методическое руководство по ведению больных с АГ, усилив позиции диуретиков [47]. Как и в предыдущей версии, в качестве препаратов первого выбора для лиц моложе 55 лет рекомендуются иАПФ или сартаны, а для лиц старше 55 лет, лиц африканского и карибского происхождения любого возраста - антагонисты кальциевых каналов. Новым является положение о том, что при непереносимости ACa2+ или развитии отеков при их приеме, а также при наличии симптомов СН или высоком риске ее развития показано назначение диуретиков. В дебюте терапии тиазидными диуретиками рекомендуется отдавать предпочтение индапамиду (1,5 мг медленного высвобождения или 2,5 мг однократно в сутки) или хлорталидону (12,5-25 мг однократно в сутки). Если же пациент уже получает терапию гидрохлортиазидом или бендрофлуметиазидом с хорошим эффектом, то замена на вышеупомянутые тиазидные диуретики не требуется. В лечении резистентной гипертонии рекомендуется усиление диуретической терапии -добавление к терапии спиронолактона в низких дозах (25 мг однократно), если уровень калия сыворотки менее или равен 4,5 ммоль / л. Особую осторожность следует проявлять при снижении скорости клубочковой фильтрации, поскольку эти пациенты имеют повышенный риск гиперкалиемии. При уровне калия более 4,5 ммоль / л следует назначать высокие дозы тиазидных диуретиков.
Применение остальных классов антигипертензивных препаратов должно основываться на современных рекомендациях. Разумно назначать 3-компонентную терапию, сочетая агенты с разным механизмом действия, например, иАПФ / сартаны, ACa2+ и тиазидный диуретик. Для повышения приверженности к лечению тройная терапия может реализоваться назначением различных фиксированных комбинаций. Назначение комбинированной терапии способствует взаимоусилению эффектов отдельных препаратов, тем самым способствуя развитию более отчетливого антигипертензивного эффекта.
В мета-анализе, выполненном Wald с соавт., сравнивалась эффективность комбинации антигипертензивных препаратов двух классов по сравнению с удвоением дозы монотерапии (42 исследования, n=10 968). Дополнительный эффект применения комбинации двух классов препаратов в отношении снижения САД примерно в 5 раз превосходит эффект удвоения дозы монотерапии [48]. Нецелесообразно комбинирование препаратов одного класса, сочетание иАПФ с сартанами, поскольку назначение данной комбинации, не обладая достаточно мощным антигипертензивным эффектом, существенно увеличивает частоту побочных эффектов [38].
Бета-адреноблокаторы являются препаратами выбора у лиц с сопутствующей ИБС и застойной СН, мощным антигипертензивным эффектом обладают α-β-адрено-блокаторы, такие как карведилол, благодаря своему двойному действию. Получены убедительные данные о преимуществах назначения недиуретических антигипертензивных препаратов на ночь или 2 раза в день, что способствует как более эффективному достижению целевых цифр АД, так и снижению риска сердечно-сосудистых осложнений [49].
Препараты центрального действия эффективны, однако обладают широким спектром побочных эффектов и скудной доказательной базой по влиянию на прогноз сердечнососудистых осложнений, поэтому их применение ограничено [9]. Тем не менее при недостижении целевых цифр АД на фоне 4-компонентной терапии их применение оправдано.
Поиск новых эффективных препаратов для лечения резистентной АГ постоянно продолжается. Синтезированы молекулы ингибитора альдостерона синтазы, антагониста эндотелина, ингибитора неприлизина, препаратов, сочетающих в себе свойства иАПФ / сартана и нейтральной эндопептидазы, последние изучаются наиболее активно. Внимание ученых приковано к этому классу препаратов, поскольку разработка одного из первых препаратов данного класса – омапатрилата, несмотря на отчетливую антигипертензивную эффективность, прекращена из-за высокой частоты развития ангионевро-тического отека. В настоящее время изучаются LCZ 696, илепатрил и даглутрил, публикации результатов исследований которых ожидаются в ближайшем будущем.
Аппаратные методы в лечении резистентной АГ
Увеличение доли лиц с резистентной АГ в последние годы послужило толчком к развитию инвазивных подходов их лечения с помощью малоинвазивных аппаратных технологий, среди которых наиболее изученными являются баро-рефлекс-активирующая терапия (БАТ) и симпатическая денервация почек. Изучению эффективности БАТ посвящены исследования PIVOTAL и DEBuT-HT [50, 51], роль симпатической денервации почек изучалась в исследованиях SIMPLICITY HTN-1 и SIMPLICITY HTN-2 [52–54].
Принимая во внимание патофизиологию АГ, предполагается, что радиочастотная эндоваскулярная денервация эфферентных симпатических нервных окончаний, уменьшая неадекватное высвобождение ренина и задержку натрия, сможет нормализовать отношение давление-натрийурез и улучшить почечный кровоток, а денервация афферентного сенсорного звена ослабит восприимчивость почек к симпатическим влияниям центральной нервной системы. Так как значимость патогенетических факторов у больных АГ изменяется с течением времени, деструкция как эфферентных, так и афферентных почечных нервов может обеспечить долгосрочный контроль АД.
Процедура симпатической денервации почек у больных с резистентной АГ предполагает радиочастотное воздействие на правую и левую почечные артерии, соответствующие определенным анатомическим требованиям: диаметр артерии ≥ 4 мм в зоне интереса, отсутствие сужений, ограничивающих почечный кровоток, отсутствие анамнеза предшествующей ангиопластики или стентирования почечных артерий и протезирования аорты.
В многоцентровом нерандомизированном исследовании Symplicity HTN-1 в ходе 36-месячного периода наблюдения после радиочастотной почечной денервации у 153 пациентов оценивались динамика офисного АД и показатели безопасности (отсутствие сосудистых изменений или стенозов в области радиочастотного воздействия). Средний возраст больных составил 58±11 лет, 39 % принадлежали женскому полу, 31 % страдали СД, 22 % – ИБС. У 4 (3 %) пациентов в раннем послеоперационном периоде были зафиксированы острые осложнения, включая псевдоаневризму бедренной артерии в 3 случаях и диссекцию почечной артерии в 1 случае, которые успешно были пролечены. Было отмечено снижение офисного АД на 20 / 10, 24 / 11, 25 / 11, 23 / 11, 26 / 14 и 32 / 14 мм рт. ст. в 1, 3, 6, 12, 18 и 24 мес соответственно после операции.
В многоцентровое рандомизированное контролируемое исследование Symplicity HTN-2 были включены 106 пациентов, у которых оценивалась эффективность и безопасность радиочастотной почечной денервации. В течение 6-месячного наблюдения у пациентов не было отмечено серьезных осложнений, связанных с инвазивной процедурой. В более длительном подисследовании Symplicity HTN-2 эффект почечной денервации оценивался у 37 больных с резистентной АГ во время теста с физической нагрузкой в сравнении с 9 больными группы контроля. Результаты этой работы впервые продемонстрировали, что радиочастотная почечная денервация достоверно снижает АД как во время нагрузки, так и в восстановительном периоде без нарушения физиологической кардиопульмональной В отдаленном периоде через 12 месяцев наблюдения реакции. В исследовании Symplicity HTN-2 снижение офисного АД в группе больных, подвергшихся почечной денервации, через 6 мес. составило 33 / 12 мм рт. ст. против 1 / 0 мм рт. ст. в группе контроля (рВ проспективном двойном слепом исследовании с применением барорефлекс-активирующей системы Rheos были рандомизированы 265 больных с резистентной АГ, средний возраст которых составил 54 года. Всем больным имплантировалась система Rheos, предназначенная для стимуляции электрическими импульсами барорецепторов каротидного синуса, от которого затем сигнал по афферентным нервам поступал в контролирующий центр головного мозга, приводя к снижению симпатических влияний на АД. В группе А, в которую был включен 181 больной, устройство активировалось спустя 1 месяц после имплантации. У остальных 84 пациентов, вошедших в группу В, система Rheos включалась только через 6 месяцев после оперативного вмешательства.
Комбинированная первичная конечная точка объединяла следующие показатели: ранний ответ на 6-месячную БАТ; отдаленный ответ на БАТ (или поддерживающий эффект БАТ); ранние осложнения, связанные с процедурой имплантации; ранние и отдаленные нежелательные явления, обусловленные БАТ. У всех пациентов, несмотря на прием в сред- нем 5,2 антигипертензивных препаратов, офисное САД превышало 160 мм рт. ст., ДАД – 80 мм рт. ст., а при суточном АД-мониторировании САД было выше 135 мм рт. ст.
Критерием эффективности раннего и отдаленного ответа на БАТ считалось снижение офисного САД более 10 мм рт. ст. Через 6 месяцев этому критерию удовлетворяло 97 (54 %) больных группы А и 38 (46 %) пациентов подгруппы B, при этом выявленные межгрупповые различия не носили достоверного характера. В отдаленном периоде через 12 месяцев наблюдения из 97 респондеров группы А в 88 % случаев БАТ была эффективной (нижняя граница ответа, при которой БАТ считалась эффективной, 65 %), однако число ответивших больных на БАТ в этой группе было достоверно выше, чем в группе В (рДополнительный анализ показал, что через 6 месяцев БАТ целевой уровень САД был достигнут у 42 % больных группы А и у 24 пациентов группы В (р=0,005), через 12 месяцев, когда система Rheos функционировала уже у больных обеих групп; суммарно 52 % больных отвечало критерию целевого САД.
Говоря об эффективности БАТ, можно отметить, что через 12 месяцев лечения у 81 % больных был отмечен устойчивый ответ с сохранением снижения САД более 10 мм рт. ст., среднее уменьшение САД у респондеров составило 44 мм рт. ст. при достижении целевого САД в 63 % случаев. Наблюдалось повышение терапевтического эффекта данного метода лечения с течением времени. Так, в группе А в среднем САД снизилось на 26 мм рт. ст. через 6 месяцев лечения, а через 12 месяцев – на 35 мм рт. ст.; по сравнению с 6 месяцами через 12 месяцев доля респондеров на БАТ увеличилась на 10 %. СПИСОК ЛИТЕРАТУРЫ 1. Wolf-Maier K, Cooper RS, Banegas JR et al. Hypertension prevalence and blood pressure levels in 6 European countries, Canada, and the United States. JAMA. 2003;289 (18):2363–2369.
2. Turnbull F, Neal B, Ninomiya T et al. Efects of diferent regimens to lower blood pressure on major cardiovascular events in older and younger adults: meta-analysis of randomised trials. BMJ. 2008;336 (7653):1121–1123.
3. Lewington S, Clarke R, Qizilbash N et al. Age-specifc relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002;360 (9349):1903–1913.
4. Adler AI, Stevens RJ, Manley SE et al. Development and progression of nephropathy in type 2 diabetes: the United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int. 2003;63 (1):225–232.
5. World Health Organization World Health Report 2002: Reducing Risks, Promoting Healthy Life, 2002 World Health Organization Geneva, Switzerland.
6. ALLHAT Ofcers and Coordinators for the ALLHAT Collaborative Research Group. Te Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Atack Trial. Major outcomes in high-risk hypertensive patients randomized to angiotensin-convert- ing enzyme inhibitor or calcium channel blocker vs diuretic: Te Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Atack Trial (ALLHAT). JAMA. 2002;288 (23):2981–2997.
7. Dahlof B, Devereux RB, Kjeldsen SE et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE) a randomised trial against atenolol. Lancet. 2002;359 (9311):995–1003.
8. Pepine CJ, Handberg EM, Rhonda M et al. A Calcium Antagonist vs a Non-Calcium Antagonist Hypertension Treatment Strategy for Patients With Coronary Artery Disease. Te International Verapamil SR / Trandolapril Study (INVEST): A Randomized Controlled Trial. JAMA 2003;21 (290):2805–2861.
9. Chobanian AV, Bakris GL, Black HR et al. Seventh report of the Joint National Commitee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension. 2003;42 (6):1206–1252.
10. Calhoun DA, Jones D, Textor S et al. Resistant hypertension: diagnosis, evaluation, and treatment. A scientifc statement from the American Heart Association Professional Education Commitee of the Council for High Blood Pressure Research. Hypertension. 2008;51 (6):1403–1419.
11. Cushman WC, Ford CE, Cutler JA et al. Success and predictors of blood pressure control in diverse North American setings: the anti-hypertensive and lipid-lowering treatment to prevent heart atack trial (ALLHAT). J Clin Hypertens (Greenwich). 2002;4 (6):393–404.
12. Kaplan NM. Resistant hypertension. J Hypertens. 2005;23 (8):1441–1444.
13. Egan BM, Zhao Y, Axon RN et al. Uncontrolled and apparent treatment resistant hypertension in the U. S. 1988–2008. Circulation. 2011;124 (9):1046–1058.
14. de la Sierra A, Segura J, Banegas JR et al. Clinical Features of 8295 Patients With Resistant Hypertension Classifed on the Basis of Ambulatory Blood Pressure Monitoring. Hypertension. 2011;57 (5):898–902.
15. Daugherty SL, Powers JD, Magid DJ et al. Incidence and prognosis of resistant hypertension in hypertensive patients. Circulation. 2012;125 (13):1635–1642.
16. Viera AJ. Resistant hypertension. J Am Board Fam Med. 2012;25 (4):487–495.
17. Gupta AK, Nasothimiou EG, Chang CL et al. Baseline predictors of resistant hypertension in the Anglo-Scandinavian Cardiac Outcome Trial (ASCOT): a risk score to identify those at high-risk. J Hypertens. 2011;29 (10):2004–2013.
18. Moser M, Setaro FJ. Resistant or Difcult-to-Control Hypertension. N Engl J Med. 2006;355 (4):385–392.
19. Sarafdis PA, Bakris GL. State of hypertension management in the United States: confuence of risk factors and the prevalence of resistant hypertension. J Clin Hypertens (Greenwich). 2008;10 (2):130–139.
20. Brown MA, Buddle ML, Martin A. Is resistant hypertension really resistant? Am J Hypertens. 2001;14 (12):1263–1269.
21. Redon J, Campos C, Narciso ML et al. Prognostic value of ambulatory blood pressure monitoring in refractory hypertension: a prospective study. Hypertension. 1998;31 (2):712–718.
22. Pierdomenico SD, Lapenna D, Bucci A et al. Cardiovascular outcome in treated hypertensive patients with responder, masked, false resistant, and true resistant hypertension. Am J Hypertens. 2005;18 (11):1422–1428.
23. Caro JJ, Salas M, Speckman JL et al. Persistence with treatment for hypertension in actual practice. CMAJ. 1999;160 (1):31–37.
24. Mazzaglia G, Mantovani LG, Sturkenboom MC et al. Paterns of persistence with antihypertensive medications in newly diagnosed hypertensive patients in Italy: a retrospective cohort study in primary care. J Hypertens. 2005;23 (11):2093–2100.
25. Van Wijk BL, Klungel OH, Heerdink ER, de Boer A. Rate and determinants of 10-year persistence with antihypertensive drugs. J Hypertens. 2005;23 (11):2101–2107.
26. Vrijens B, Vincze G, Kristanto P et al. Adherence to prescribed anti-hypertensive drug treatments: longitudinal study of electronically compiled dosing histories. BMJ. 2008;336 (7653):1114–1117.
27. Кобалава Ж. Д, Виллевальде С. В, Исикова Х. В. Повышение приверженности и мотивации к антигипертензивной терапии у больных артериальной гипертонией с помощью образовательных программ и рационального применения ингибитора анги-отензинпревращающего фермента периндоприла. Результаты исследования ПРИЗМА. Кардиология 2010;50 (11):17–26.
28. Кобалава?Ж. Д.,?Котовская?Ю. В.,?Старостина?Е. Г. , Виллевальде С. В. от имени исследователей АРГУС-2. Проблемы взаимодействия врача и пациента и контроль артериальной гипертонии в России. Основные результаты Российской научно-практической программы АРГУС-2. Кардиология. 2007;47 (3):38–47.
29. Johnson AG, Nguyen TV, Day RO. Do nonsteroidal anti-infamma-tory drugs afect blood pressure? A meta-analysis. Ann Intern Med. 1994;121 (4):289–300.
30. Graves JW, Bloomfeld RL, Buckalew VM Jr. Plasma volume in resistant hypertension: guide to pathophysiology and therapy. Am J Med Sci. 1989;298 (6):361–365.
31. Nishizaka MK, Prat-Ubunama M, Zaman MA et al. Validity of plasma aldosterone-to-renin activity ratio in African American and white subjects with resistant hypertension. Am J Hypertens. 2005;18 (6):805–812.
32. Pimenta E, Gaddam KK, Oparil S et al. Efects of dietary sodium reduction on blood pressure in subjects with resistant hypertension: results from a randomized trial. Hypertension. 2009;54 (3):475–481.
33. Dietary Guidelines for Americans, 2010. U. S. Department of Health and Human Services. Available at: htp://www.cnpp.usda.gov / DGAs2010-PolicyDocument.htm. Accessed Jan. 31, 2011.
34. Yakovlevitch M, Black HR. Resistant hypertension in a tertiary care clinic. Arch Intern Med. 1991;151 (9):1786–1792.
35. Garg JP, Elliot WJ, Folker A et al. Resistant hypertension revisited: a comparison of 2 university-based cohorts. Am J Hypertens. 2005;18 (5 Pt 1):619–626.
36. Bramlage P, Pitrow D, Witchen HU et al. Hypertension in overweight and obese primary care patients is highly prevalent and poorly controlled. Am J Hypertens. 2004;17 (10):904–910.
37. Morris MJ. Cardiovascular and metabolic efects of obesity. Clin Exp Pharmacol Physiol. 2008;35 (4):416–419.
38. Sarafdis PA. Obesity, insulin resistance and kidney disease risk: insights into the relationship. Curr Opin Nephrol Hypertens. 2008;17 (5):450–456.
39. Wong C, Marwick TH. Obesity cardiomyopathy: pathogenesis and pathophysiology. Nat Clin Pract Cardiovasc Med. 2007;4 (8):436–443.
40. Calhoun DA, Nishizaka MK, Zaman MA et al. Hyperaldosteronism among black and white subjects with resistant hypertension. Hypertension. 2002;40 (6):892–896.
41. Sarafdis PA, Bakris GL. Resistant hypertension. An overview of evaluation and treatment. J Am Coll Cardiol. 2008;52 (22):1749–1757.
42. Taler SJ, Textor SC, Augustine JE. Resistant hypertension: comparing hemody-namic management to specialist care. Hypertension. 2002;39 (5):982–988.
43. Jamerson K, Bakris GL, Dahlof B et al. Exceptional early blood pressure control rates: the ACCOMPLISH trial. Blood Press. 2007;16 (2):80–86.
44. Black HR, Elliot WJ, Grandits G et al. Principal results of the Controlled Onset Verapamil Investigation of Cardiovascular End points (CONVINCE) trial. JAMA. 2003;289 (16):2073–2082.
45. Vбclavнk J, Sedlбk R, Plachy M et al. Addition of Spironolactone in Patients With Resistant Arterial Hypertension (ASPIRNT) A Randomized, Double-Blind, Placebo-Controlled Trial. Hypertension. 2011;57 (6):1069–1075.
46. Frank M, Bobrie G, Azizi M et al. Superiority of low dose diuretics combination over renin-angiotensin blockers combination in resistant hypertension. J Hypertens. 2010;28: e276.
47. Hypertension: clinical management of primary hypertension in adults. Abailable at: www.nice.org.uk / guidance / CG127.
48. Wald DS, Law M, Morris JK et al. Combination therapy versus mono-therapy in reducing blood pressure: meta-analysis on 11,000 participants from 42 trials. Am J Med. 2009;122 (3):290–300.
49. Hermida RC, Ayala DE, Mojon A, Fernandez JR. Infuence of time of day of blood pressure-lowering treatment on cardiovascular risk in hypertensive patients with type 2 diabetes. Diabetes Care. 2011;34 (6):1270–1276.
50. Bisognano JD, Bakris G, Nadim MK et al. Barorefex activation therapy lowers blood pressure in patients with resistant hypertension: results from the double-blind, randomized, placebo-controlled rheos pivotal trial. J Am Coll Cardiol. 2011;58 (7):765–773.
51. Schefers IJ, Kroon AA, Schmidli J et al. Novel barorefex activation therapy in resistant hypertension: results of a European multi-center feasibility study. J Am Coll Cardiol. 2010;56 (15):1254–1258.
52. Krum H, Schlaich M, Whitbourn R et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicenter safety and proof-of-principle cohort study. Lancet. 2009;373 (9671):1275–1281.
53. Simplicity HTN-1 Investigators 2011. Catheter-based renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out of 24 months. Hypertension. 2011;57 (5):911–917.
54. Elser MD, Krum H, Sobotka PA et al. Symplicity HTN-2 Investigators. Renal sympathetic denervation in patients with treatment-resistant hypertension (Te Symplicity HTN-2 Trial): a randomised controlled trial. Lancet. 2010;376 (9756):1903–1909.
