Эпидемиология и патогенез нарушений углеводного обмена у женщин в климактерии
СтатьиО. Р. Григорян, Е. Н. Андреева, И. И. Дедов
Оглавление | Далее
Глава 1. Эпидемиология и патогенез нарушений углеводного обмена у женщин в климактерии
Период менопаузы – естественный биологический процесс перехода от репродуктивного периода жизни женщины к старости, который характеризуется постепенным угасанием функции яичников, снижением уровня эстрогенов, прекращением менструальной и репродуктивной функции. Средний возраст наступления менопаузы для женщин Европейского региона и РФ составляет 50–51 год. При этом в условии дефицита эстрогенов женщины живут практически 1/3 своей жизни.
По оценкам Всемирной Организации Здравоохранения более миллиарда человек на планете имеют избыточную массу тела или ожирение. При этом в странах Западной Европы от 20–25% женщин страдают ожирением. Статистические данные показывают, что избыточный вес выявляется у 54% населения России. Особенностью ожирения является то, что оно часто сочетается с тяжелыми заболеваниями, приводящими к сокращению продолжительность жизни пациентов: с сахарным диабетом 2 типа, артериальной гипертензией, дислипидемией, атеросклерозом, ишемической болезнью сердца, синдромом апноэ во сне, некоторыми видами злокачественных новообразований, нарушениями репродуктивной функции, заболеваниями опорно-двигательного аппарата. Но наиболее важным аспектом проблемы ожирения является его взаимосвязь с сахарным диабетом 2 типа.
Риск развития сахарного диабета 2 типа (СД 2 типа) значительно возрастает прямо пропорционально индексу массы тела и выраженности дислипидемии. В настоящее время численность больных СД составляет 177 млн. человек, причем 90% больных – пациенты с СД 2 типа. Практически за 20 последних лет число больных СД в мире увеличилось в 6 раз. К 2020 году прогнозируется увеличение количества больных до 300 млн. человек. В связи с тем, что в течение длительного времени СД 2 типа может быть не диагностирован, предполагается, что его фактическая распространенность в 2–3 раза больше регистрируемой. Следует отметить, что женщины старше 45 лет болеют СД в 2 раза чаще мужчин.
Статистические данные показывают, что избыточным весом страдает 61% населения в США, 54% – в России, 51% – в Великобритании и 50% в Германии. В США ожирение по данным на период 2001 года наблюдалось у 22,9 млн. женщин. Распространенность СД 2 типа в 1990 году составила 4,9%, а уже в 2001 году – 7,9%. Таким образом, в 2001 году 16,7 млн. человек взрослого населения США имели диагностированный СД 2 типа, из них 9,8 млн. составили женщины. При этом каждый «лишний» килограмм массы тела выше нормы увеличивает риск развития СД вне зависимости от пола, возраста и расовой принадлежности: при увеличении массы тела на 5 кг популяционный риск развития СД составляет 27%. Взрослые с индексом массы тела (ИМТ) ≥40 кг/м² имеют более чем семикратное увеличение риска развития нарушений углеводного обмена.
Проведенные эпидемиологические исследования показали, что менопауза увеличивает распространенность СД в женской популяции. У женщин старше 45 лет риск развития СД, сердечно-сосудистых заболеваний увеличивается в несколько раз. В Консенсусах Европейских и Российских кардиологов и гинекологов (2007, 2008 г.), на основании данных Фремингемского исследования и крупного наблюдательного исследования здоровья медсестер (Nurses Health Study), констатирован серьезный факт: у женщин с СД риск развития сердечно-сосудистых заболеваний в период пери- и постменопаузы возрастает в 3 – 7 раз по сравнению со здоровыми женщинами того же возраста.
К сожалению, наступление постменопаузы у женщин очень часто сопровождается увеличением массы тела и/или показателей объема талии и коэффициента объема талии / объема бедер. Ошибочно это связывают с применением гормональной заместительной терапии (ГЗТ) в данный период, ссылаясь на данные некоторых исследований, где у женщин, использующих ЗГТ, была выявлена масса тела выше, чем у женщин, не применяющих данный вид терапии.
Женщины с СД, как и женщины общей популяции, имеют те же показания к назначению ГЗТ. Однако процент использования ГЗТ у женщин, с СД и без него различны и составляют 17% и 39%, соответственно.
В период менопаузы у женщин с СД возрастает риск возникновения патологии эндометрия. СД, избыточная масса тела/ожирение, артериальная гипертензия (АГ) – триада, повышающая риск возникновения рака эндометрия на 50%.
Известно, что женские половые гормоны контролируют обмен жиров и углеводов в организме, ускоряя расщепление жиров и подавляя синтез липидных фракций, способствующих развитию атеросклероза. Доказано, что не только гиперлипидемия, но и нарушение соотношения между отдельными фракциями липидов (дислипопротеинемия) играют важную роль в патогенезе ишемической болезни сердца и развитии системного атероклероза. Установлены следующие критические показатели уровня липидов сыворотки крови, повышающие риск развития ишемической болезни сердца (ИБС): общий холестерин (ОХС) более 240 мг/дл; липопротеиды высокой плотности (ЛПВП) менее 35 мг/дл; липопротеиды низкой плотности (ЛПНП) более 160 мг/дл; триглицериды (ТГ) более 500 мг/дл. Механизм влияния половых стероидов на липидный спектр крови сложен. Полагают, что гормоны действуют на катаболизм ЛПВП в основном посредством изменения активности печеночной липопротеинлипазы. Постепенное снижение уровня эстрогенов в перименопаузе приводит к нарушению липидного обмена и формированию инсулинорезистентности, что и обусловливает склонность к увеличению массы тела в данный возрастной период. В жировой ткани происходит активный синтез женских половых гормонов (внегонадный синтез эстрогенов): эстрона из андростендиона и эстрадиола из тестостерона. При избытке жировой ткани этот координированный процесс может нарушаться, а в период окончания менструальной функции усугубляться. Важно и то, что ожирение характеризуется значительным преобладанием количества жировой ткани над мышечной и, наиболее часто встречается у женщин между 30 и 70 годами. Преобладание мышечной ткани над жировой косвенно подтверждает наличие гиперандрогении у женщин в период менопаузы и, естественно не зависит от индекса массы тела: то есть может встречаться как у женщин с нормальной массой тела, так и ожирением. При этом висцеральное ожирение также напрямую связано с состоянием инсулинорезистентности. Висцеральная жировая ткань оказывает непосредственное влияние на печень и является метаболически более активной, чем подкожная жировая клетчатка. Увеличение количества висцерального жира с возрастом связано как с физиологическими изменениями в организме женщины, так и с изменениями образа жизни. Однако не исключена и генетическая предрасположенность по аутосомно-рецессивному типу.
Нарушения в системе гемокоагуляции и фибринолиза также очевидны и проявляются в виде снижения фибринолитической активности, вызываемое увеличением содержания ингибитора активатора плазминогена-1, а также повышением уровня фибриногена. Естественно, что вышеуказанное приводит к преобладанию процессов тромбообразования и гиперкоагуляции над процессами фибринолиза, часто встречающимися у пациенток с гиперпластическими процессами эндометрия.
У женщин с СД также происходит усиление стимуляции глюкокортикоидов. Это увеличивает размеры абдоминальных адипоцитов и приводит к абдоминальному перераспределению жира. Во многих исследованиях установлено, что уровень тестостерона в крови положительно коррелирует с количеством абдоминального жира. У женщин в период перименопаузы снижается уровень полового секс-стероид связывающего глобулина (ПССГ), что приводит к повышению концентрации свободного тестостерона, гиперандрогении и способствует формированию абдоминального ожирения. А адипоциты запускают каскад внегонадного синтеза половых стероидов. Сама же по себе гиперандрогения, подтвержденная низкими значениями ПССГ, является сильным и независимым фактором риска развития СД 2 типа, болезней сердечно-сосудистой системы, в частности артериальной гипертензии, повышая частоту показателя общей смертности. Низкий уровень ССГ ассоциируется с накоплением висцерального жира. Женщины с таким типом распределения жира имеют низкий уровень ССГ, и повышение содержания свободного тестостерона в сыворотке крови происходит параллельно нарастанию инсулинорезистентности. При этом гиперандрогения у женщин в данный возрастной период может сама по себе способствовать развитию инсулинорезистентности, а инсулинорезистентность, в свою очередь, может привести к гиперандрогении за счет продукции андрогенов тека-клетками яичников и снижения выработки ССГ печенью на фоне гиперинсулинемии.
По данным исследований, проведенных в ФГУ ЭНЦ, у женщин с менопаузальным метаболическим синдромом выявляется более низкий уровень ПССГ в сыворотке крови, а также повышенный уровень свободного тестостерона по сравнению с их здоровыми сверстницами. Кроме того, низкие концентрации ПССГ и висцеральное ожирение также могут оказывать неблагоприятное влияние на прогрессирование инсулинорезистентности. Порочный круг замыкается избыточной секрецией эстрона из андростендиона и эстрадиола из тестостерона, которые включаются в механизмы рецепторной чувствительности органов мишеней (за счёт белковой субстанции инсулиноподобного фактора роста-1, имеющегося в частности в эндометрии, и вызывая в нём развитие гиперпластических процессов).
В настоящее время численность больных сахарным диабетом составляет 177 млн. человек. Причем основная часть больных (90%) – пациенты с сахарным диабетом 2 типа. Немногим менее чем за 20 лет число больных СД в мире увеличилось в 6 раз. Согласно прогнозам, при сохранении таких темпов роста к 2010 году численность больных сахарным диабетом на планете достигнет 221 млн. человек; а к 2025 году СД предположительно будут иметь уже более 300 млн. человек. Это означает, что в 2025 году распространенность сахарного диабета в экономически развитых странах составит 7,6%; в развивающихся – 4,9%. На современном этапе, в большинстве развитых стран мира, сахарный диабет занимает 3–4 место в общей структуре смертности, и является ведущей причиной слепоты и нарушений зрения у взрослого населения.
Однако важно отметить то, что к моменту клинической манифестации СД 2 типа около 50% больных уже имеют различные макрососудистые осложнения. Как показало проспективное исследование UKPDS (UK prospective Diabetes Study) – pетинопатию, периферическую нейропатию и протеинурию имеют соответственно 35%, 12% и 2% больных с вновь выявленным сахарным диабетом 2 типа.
В связи с тем, что в течение длительного времени сахарный диабет 2 типа может быть не диагностирован, предполагается, что его фактическая распространенность в 2–3 раза превышает регистрируемую. Так в исследовании Australian Diabetes, Obesity and Lifestyle Study (AusDiab) было показано, что на каждый диагностированный случай СД 2 типа приходится один недиагностированный. Третье национальное исследование здоровья и питания (NHANES 3), проведенное в США, также выявило высокий уровень распространенности недиагностированного СД 2 типа среди населения, составившее в среднем – 2,7%. При этом на мужчин и женщин в возрасте 50–59-ти лет приходилось – 3,3% и 5,8%, соответственно.
В развитии СД 2 типа ведущую роль играют инсулинорезистентность (ИР) и недостаточная секреция инсулина. Предполагается, что вначале у генетически предрасположенных лиц развивается и прогрессирует инсулинорезистентность. В условиях ИР происходит снижение поступления глюкозы в инсулинзависимые ткани (мышечную, жировую), повышение продукции глюкозы печенью, способствуя развитию гипергликемии. При адекватной способности b-клеток компенсировать повышение уровня глюкозы избыточной продукцией инсулина сохраняется состояние нормогликемии. Однако впоследствии, при нарастании выраженности ИР, происходит истощение инсулинсекреторной способности b-клеток и они перестают справляться с увеличивающейся нагрузкой глюкозой. Вначале это проявляется развитием гипергликемии в постпрандиальный период. Так, примером постпрандиальной гипергликемии является нарушенная толерантность к глюкозе (НТГ), диагностируемая с помощью перорального глюкозотолерантного теста (критериями диагностики НТГ являются: гликемия натощак (капиллярная кровь) Распространенность НТГ в мире также довольно велика – нарушенную толерантность к глюкозе имеют около 314 млн. человек, при этом к 2025 году прогнозируется увеличение до 472 млн. По данным Zimmet P. (2000 г.) около четверти населения стран Западной Европы имеют нарушенную толерантность к глюкозе или метаболический синдром. Известно, что в механизмах развития метаболического синдрома ведущую роль играет инсулинорезистентность. Основными клиническими проявлениями метаболического синдрома являются сахарный диабет 2 типа, коронарная болезнь сердца или другие проявления атеросклероза, рассматривая данное заболевание как «прелюдию» сахарного диабета.
В общей популяции распространенность метаболического синдрома достаточно высока и колеблется от 14% до 24%. Лидируют по его распространенности Соединенные Штаты Америки. По результатам исследования, проведенного в Финляндии и Швеции, метаболический синдром (при отсутствии нарушений углеводного обмена) имеют 10% женщин и 15% мужчин; при повышенной гликемии натощак и/или НТГ – 42% и 64%; а при сахарном диабете –78% и 84%, соответственно.
Как показали эпидемиологические исследования, уже при НТГ частота развития ИБС в 2 раза, а смертность от сердечно-сосудистых заболеваний в 1,5 раза выше, чем без нарушений углеводного обмена. Нарушение толерантности к глюкозе является независимым фактором риска преждевременной смертности от сердечно-сосудистых заболеваний. А при наличии метаболического синдрома риск развития коронарной болезни сердца и инсульта в 3 раза выше, чем без него.
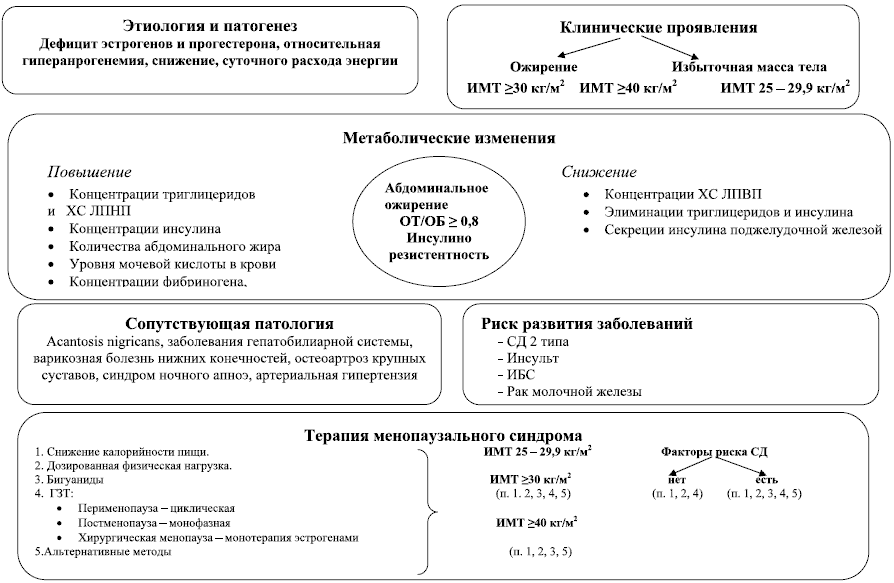
Одной из причин половых различий при ожирении является прибавка массы тела после менопаузы, отмечаемая более чем у половины женщин старшей возрастной группы. Увеличение массы тела в климактерии приводит к формированию менопаузального метаболического синдрома (ММС), основными проявлениями которого являются абдоминальное ожирение, дислипидемия и нарушения углеводного обмена.
Одним из звеньев патогенеза ожирения при ММС является замедление базального метаболизма (расхода энергии) на фоне дефицита половых стероидов (схема 1). Так, снижение скорости базального метаболизма у женщин в период постменопаузы способствует прибавке массы тела на 3–4 кг в год. По данным Healthy Women’s Study, в первые три года после менопаузы масса тела в среднем увеличивается на 2,3 кг; а через 8 лет – на 5,5 кг.
Схема 1. Менопаузальный синдром у женщин с ожирением
Шестакова И. Г. (2003 г.), в модификации Андреевой Н. Н., Григорян О. Р., 2010 г.
В последние годы появились сообщения, что МС рассматривается как состояние, характеризующееся хроническим вялотекущим иммунным воспалением. Повышение уровня С-реактивного белка выше 3 мг/л является независимым предиктором развития сердечно-сосудистой заболеваемости и используется как один из критериев Американской национальной образовательной программы по контролю за уровнем холестерина в крови (NCEP).
Современные представления об ожирении свидетельствуют о том, что данное заболевание возникает вследствие неадекватного баланса между поступлением и тратой энергии на фоне нарушений пищевого поведения, генетической предрасположенности или гормональных нарушений, характерных для периода климактерия. В настоящее время известно, что женские половые гормоны контролируют обмен жиров и углеводов в организме. Эстрогены ускоряют процессы расщепления жиров и подавляют синтез липидных фракций, способствующих развитию атеросклероза. Постепенное снижение уровня эстрогенов в перименопаузе приводит к нарушениям липидного обмена, а также развитию инсулинорезистентности, что и обуславливает склонность к увеличению массы тела в климактерический период.
Жировая ткань является местом, где активно осуществляется синтез женских половых стероидов. При избытке жировой ткани этот координированный процесс может нарушаться еще до наступления менопаузы, а в период окончания менструальной функции – усугубляться.
Важным является и то, что ожирение характеризуется значительным преобладанием количества жировой ткани над количеством мышечной ткани и наиболее часто встречается у женщин между 30 и 70 годами. После же 70-ти лет количество жировой массы может увеличиться, либо остаться неизменным, либо уменьшиться.
Увеличение количества висцерального жира является обычным и типичным изменением в композиционном строении тела (в плане его количественного состава) у женщин старше 50-ти лет. Самым распространенным эпидемиологическим методом диагностики верхнего типа ожирения является измерение окружности талии. Окружность талии не должна превышать 94 см. у мужчин и 80 см. у женщин. Если у женщины отношение окружности талии к окружности бедер выше или равно 0,80, то такое распределение жировой ткани явяляется неблагоприятным для организма. Если данный показатель больше 0,80, а избыток жировой ткани откладывается в области живота, то риск возникновения сердечно-сосудистых заболеваний и сахарного диабета существенно повышается даже на фоне нормальной массы тела.
Данные компьютерной томографии (КТ) как у мужчин, так и женщин старше 50-ти лет показывают наличие обратной корреляционной зависимости между соотношением подкожного жира к висцеральному и возрастом; а также повышенным отложением жира в межмышечном пространстве передней брюшной стенки (чем старше возраст, тем менее выражено соотношение подкожного жира к висцеральному). При этом соотношение окружность талии/объем бедер возрастает вне зависимости от индекса массы тела как у мужчин, так и женщин старше 50-ти лет.
Преобладание мышечной ткани над жировой косвенно подтверждает наличие гиперандрогении у женщин периода постменопаузы. Висцеральное же ожирение напрямую взаимосвязано с состоянием инсулинорезистентности. Висцеральное ожирение представляет собой состояние, при котором интраперитонеальный жир оказывает прямое влияние на печень, а сама висцеральная жировая ткань является более метаболически активной, чем подкожная клетчатка.
Прямое поступление свободных жирных кислот, а также других биологически активных субстанций, секретируемых висцеральной жировой тканью в печень, по мнению ряда зарубежных исследователей, и представляет собой один из патогенетических механизмов развития инсулинорезистентности.
Увеличение количества висцерального жира с увеличением возраста связано как с физиологическими изменениями в менопаузе, так и с изменениями образа жизни. Однако не исключена и генетическая предрасположенность по аутосомно-рецессивному типу. По данным некоторых исследований проведение заместительной гормональной терапии половыми стероидами в период пери- и постменопаузы, наряду с увеличением физической активности способствует снижению количества висцерального жира. При этом изменение в окружности талии является лучшим маркером (в сравнении с ИМТ) при оценке степени риска смертности у женщин старшей возрастной группы.
Что касается уровня лептина при старении, то он изменяется по принципу pari passu (снижение параллельно увеличению возраста). У женщин постменопаузального периода пропуск планового приема пищи подавляет секрецию лептина и стимулирует выделение гипоталамического нейропептида Y менее активно, в сравнении с женщинами репродуктивного возраста. В экспериментальных исследованиях было показано, что введение лептина женщинам старше 50-ти лет не приводит к стимуляции расходования энергии, что и делает возможным предположить наличие «дефекта» как в рецепторной функции лептина, так и в его действии.
Ежедневный расход энергии на две трети состоит из базального метаболизма, который используется организмом для поддержания температуры тела, ионного градиента через клеточные мембраны, сокращения гладкой мускулатуры для работы сердца и кишечника и осуществления других метаболических процессов, то есть для обеспечения физиологических функций организма. Для расхода энергии характерна и наследственная предрасположенность, а низкая скорость базального метаболизма может предопределять развитие ожирения. Физическая же активность составляет примерно 25% в ежедневном расходе энергии.
Поскольку базальный метаболизм является частью ежедневного расхода энергии, даже небольшие изменения этого компонента чрезвычайно важны в регуляции массы тела у женщин в климактерии. Установлено, что после менопаузы скорость базального метаболизма замедляется. Так по данным некоторых исследователей не было зафиксировано связанных с возрастом изменений скорости базального метаболизма у здоровых женщин в возрасте до 48 лет, тогда как в группе женщин старше 48 лет было отмечено значительное снижение скорости обменных процессов на 4–5% за каждое десятилетие. Снижение скорости базального метаболизма в период постменопаузы также связывают с уменьшением массы метаболически активных тканей, в основном мышечной, так как после менопаузы масса тканей, не содержащих жир, уменьшается примерно на 3 кг.
Помимо вышеперечисленного предполагается, что в период постменопаузы происходит усиление и глюкокортикостероидной стимуляции, увеличивая размеры абдоминальных адипоцитов и приводя к абдоминальному перераспределению жира. То есть менопауза рассматривается как своеобразный стресс для организма женщины. Влияние же эстрогенов на симпатическую нервную систему также подтверждается доказательствами подавления тирозин-гидроксилазы – фермента, участвующего в синтезе катехоламинов (эстрогены увеличивают плотность и функцию a2-адренорецепторов). Показано, что у женщин в постменопаузе, по сравнению с пациентками репродуктивного возраста, выявляются повышенные уровни норадреналина в крови, кроме того, у первых более выражено стрессиндуцированное повышение концентраций норадреналина, нивелируемое на фоне лечения эстрадиолом.
Во многих исследованиях было показано, что уровни тестостерона в крови положительно коррелируют с количеством абдоминального жира. У женщин в постменопаузе снижаются уровни белка, связывающего половые стероиды, приводя к повышению концентрации свободного тестостеронаи и, соответственно, гиперандрогении, способствуя формированию абдоминального ожирения. Сама же по себе гиперандрогения, подтвержденная низкими значениями полового стероид связывающего глобулина (ПССГ), является сильным и независимым фактором, риска развития СД 2 типа, артериальной гипертензии, болезней сердечно-сосудистой системы и общей смертности. А низкий уровень ПССГ ассоциируется с висцеральным ожирением. Женщины с центральным типом распределения жира имеют низкий уровень ПССГ, и повышение свободного тестостерона в сыворотке крови параллельно с инсулинорезистентностью. При этом гиперандрогения у женщин в данный возрастной период может самостоятельно способствовать развитию инсулинорезистентности, а инсулинорезистентность в свою очередь может привести к гиперандрогении, за счет продукции андрогенов яичниками и снижения выработки ПССГ печенью на фоне гиперинсулинемии.
По данным исследований, проведенных в ФГУ ЭНЦ (дир. – акад. РАН и РАМН, проф. Дедов И.И.) женщины с СД 2 типа имеют более низкий уровень ПССГ в сыворотке крови и повышенный уровень свободного Т параллельно с инсулинорезистентностью, в сравнении с их здоровыми сверстницами (Григорян О. Р., 2004). Кроме того, низкие концентрации ПССГ и висцеральное ожирение также могут оказывать неблагоприятное влияние на прогрессирование инсулинорезистентности. Практически все метаболические нарушения, возникающие после менопаузы, взаимосвязаны между собой и еще более усугубляют неблагоприятное влияние дефицита половых стероидов на сердечнососудистую систему. Особенно это касается инсулинорезистентности, которая считается ключевым признаком ММС и практически всегда сочетается с абдоминальным ожирением.
Повышение уровня инсулина в плазме крови натощак является изолированным фактором риска ишемической болезни сердца. По данным статистики, у женщин в период постменопаузы относительный риск ишемической болезни сердца (ИБС) почти в 2,7 раз выше, чем у женщин того же возраста, но с сохраненной функцией яичников. А абдоминальное ожирение часто сочетается с инсулинорезистентностью («синдром Х»: инсулинорезистентность в сочетании с ожирением, дислипидемией, гиперурикемией, артериальной гипертенизией). Поэтому увеличение массы жировой ткани у женщин в период постменопаузы является важным фактором, приводящим к развитию инсулинорезистентности и, соответственно, к возникновению гиперинсулинемии.
Известно, например, что в норме инсулин оказывает положительное влияние на метаболизм липидов, подавляя липолиз в жировой ткани и стимулируя ее основной фермент липопротеиновую липазу. При наличии инсулинорезистентности реализация этих эффектов нарушается, что приводит к повышению потока свободных жирных кислот, синтезу триглицеридов и снижению антиатерогенных фракций липопротеидов. Вазодилатация, стимулируемая инсулином в норме, нарушается при инсулинорезистентности, подтверждая положительную связь между гиперинсулинемией и артериальной гипертензией. Все компоненты метаболического синдрома: инсулинорезистентность, дислипидемия, гиперактивность симпатической нервной системы, повышенное артериальное давление (АД) связаны с повышением массы абдоминального или висцерального жира, который сам является источником свободных жирных кислот и способствует повышению синтеза триглицеридов в печени. Кроме того, абдоминальное и особенно висцеральное ожирение связано со снижением чувствительности тканей к инсулину и гиперинсулинемией, а также с нарушением метаболизма липидов и липопротеидов, на основании чего ожирение считается ключевым признаком метаболического синдрома. Таким образом, постменопауза является инсулинорезистентным состоянием, а период климактерия ассоциируется со значительным повышением риска развития ишемической болезни сердца и других макроангиопатий, способствуя снижению продолжительности жизни женщины.
