Влияние иммуномодулятора на синтез интерферонов
СтатьиОпубликовано в журнале:
«ЛЕЧАЩИЙ ВРАЧ»,НОЯБРЬ 2010, № 10, с. 88-91
Б. В. Пинегин, доктор медицинских наук, профессор
М. И. Варфоломеева, кандидат медицинских наук
ФГБУ ГНЦ «Институт иммунологии» ФМБА России, Москва
Ключевые слова: интерферон, Полиоксидоний, иммунитет, часто болеющие люди, респираторные заболевания.
Отечественный иммуномодулятор Полиоксидоний (ПО) является физиологически активным соединением. ПО — это линейный полимер, на поверхности которого имеется большое количество активных группировок [8]. В силу особенностей химической структуры ПО обладает не только иммуномодулирую-щими, но и мощными антитоксическими свойствами: он сорбирует на своей поверхности различные токсические вещества и выводит их из организма. В частности, при ожоговой болезни ПО существенно понижает в крови уровень липополисахарида (ЛПС) энтеробактерий, являющегося одной из главных причин смертности при этом заболевании. ПО обладает выраженными антиоксидантными свойствами. Он удаляет из организма активные радикалы кислорода и перекисного окисления липидов. Обладает способностью ингибировать свободно-радикальные реакции, что проявляется в хелатировании и окислении каталитически активного двухвалентного железа, играющего важную роль в воспалительных процессах. Совокупность иммуномодулирующих, детоксикационных и антиоксидантных свойств делает ПО мощным противовоспалительным средством. Кроме того, ПО обладает энергосберегающими и мембранопротекторными свойствами [9, 10].
Иммуномодулирующий эффект ПО связан с его влиянием на клетки врожденного иммунитета: неитрофилы, моноциты/макрофаги и естественные киллеры и опосредованно — на клетки адаптивного иммунитета: В- и Т-лимфоциты [1-4]. Следствием этого является усиление способности фагоцитов (нейтрофилов, моноцитов и макрофагов) поглощать и убивать бактерии; усиление функциональных свойств естественных киллеров, осуществляющих элиминацию в организме чужеродных клеток, в частности вирусинфицированных; усиление синтеза моноцитами и лимфоцитами ряда цитокинов, повышающих продукцию В-лимфоцитами антител и повышающих функциональную активность Т-клеток.
ПО показал высокую клиническую эффективность в комплексном лечении хирургических инфекций, пиодермии и других гнойно-воспалительных процессов кожи и мягких тканей, рецидивирующего герпеса, хронических урогенитальных инфекций, хронических заболеваний бронхолегочного аппарата, туберкулеза, бронхиальной астмы, осложненной вторичной иммунологической недостаточностью, ревматоидного артрита, леченного цитостатическими препаратами. Показана эффективность ПО и при комплексном лечении злокачественных заболеваний с целью восстановления кроветворения и иммунной системы, страдающих от цитостатических противораковых препаратов [10].
Целью настоящего обзора является анализ собственных данных и данных литературы о влиянии ПО на синтез интерферонов (ИНФ).
1. Клинико-иммунологические исследования влияния ПО на синтез ИФН
В Ростовском ГМУ проф. Сизякиной Л. П. и соавт. проведено исследование влияния ПО суппозиториев 6 мг на систему ИФН у больных хроническим герпетическим простатитом и у больных поллинозом, осложненным вторичной иммунологической недостаточностью (ВИН).
В сыворотке крови и в супернатантах стимулированных мононуклеаров периферической крови (МНПК) с помощью иммуноферментного анализа определяли уровень ИФН-альфа. В популяции МНПК с помощью проточной лазерной цитометрии и моноклональных антител определяли процент CD4+ Т-клеток, синтезирующих ИФН-гамма (так называемые Th1-клетки).
Было показано, что включение ПО в комплексную терапию имело хороший клинический эффект, значимо повышало уровень ИФН-альфа в сыворотке крови больных герпетическим простатитом (табл. 1). По всей видимости, этот результат был следствием активации под влиянием ПО функциональной активности моноцитов, единственный возможный источник синтеза ИФН-альфа в популяции МНПК. Доказательством этого положения является повышенная способность как нестимулированных, так и стимулированных МНПК синтезировать ИФН-альфа. Под влиянием стандартной этиотропной терапии способность МНПК синтезировать ИФН-альфа не изменялась.
Таблица 1. Влияние ПО на синтез ИФН-альфа (пкг/мл) МНПК больных хроническим герпетическим простатитом
| Содержание ИФН-альфа | До терапии | Этиотропная терапия | Этиотропная терапия + ПО |
| В сыворотке | 5,83 ±1,33 | 6,14 ±2,11 | 12,18 ± 1,87* |
| В супернатантах нестимулированных МНПК | 12,14 ±1,18 | 15,6 ± 1,19 | 25,15 ± 1,22* |
| В супернатантах фитогемагглютинин-стимулированных МНПК | 254,9 ±68,18 | 298,6 ± 72,28 | 628,75 ±51,36* |
| * р < 0,05, при сравнении с показателями до лечения. | |||
У больных с поллинозом с сопутствующим синдромом вторичной иммунной недостаточности (ВИН) изучали продукцию ИФН-гамма (табл. 2). Было показано: ПО стимулирует синтез этого интерферона, что проявляется в увеличении его количества в сыворотке крови и в увеличении числа Thl-клеток, являющихся главными продуцентами ИФН-гамма при развитии адаптивного иммунного ответа. Это увеличение сопровождалось существенным улучшением клинической картины больных, что позволило успешно провести аллергенспецифическую иммунотерапию (АСИТ).
Таблица 2. Влияние ПО на синтез ИФН-гамма у больных поллинозом
| Показатели | До терапии | После 1-го курса | После 2-го курса |
| Th1, % | 5,06 ± 1,04 | 6,09 ± 0,17 | 10,03 ±1,22* |
| Содержание ИФН-гамма в сыворотке, пг/мл | 6,9 ±1,3 | 12,9 ±0,8* | 18,5 ±2,4* |
| * р < 0,05, при сравнении с показателями до лечения. | |||
Общеизвестно, что поллиноз является Тh2-опосредованным заболеванием и цитокины IL-4, IL-13, синтезируемые этими клетками, стимулируют синтез lgE-антител, участвующих в развитии патологического процесса. ИФН-гамма, синтезируемый Th1-клетками, подавляет функциональную активность Тh2-клеток и, следовательно, образование lgE-антител. Следствием этого и является наблюдаемый хороший клинический эффект при применении ПО и успешное проведение АСИТ.
На кафедре туберкулеза РГМУ (проф. Стаханов В. А.) был изучен синтез ИФН-гамма у больных инфильтративным туберкулезом легких. Такой выбор ИФН был обусловлен тем, что туберкулез является микобактериальной инфекцией, в естественной защите от которой ИФН-гамма в комплексе с фактором некроза опухолей-альфа (ФНО-альфа) принадлежит ведущая роль.
Больные основной группы получали стандартную антимикобактериальную терапию и ПО. Больные контрольной группы получали только стандартную терапию. ПО вводили по 6 мг, внутримышечно, через день, № 10. В супернатантах стимулированных культур МНПК определяли уровень ИФН-гамма, в популяции МНПК определяли процент CD3+-клеток, синтезирующих ИФН-гамма (табл. 3). Анализ результатов осуществляли раздельно в группе больных с исходно высоким и исходно низким уровнем синтеза ИФН-гамма.
Таблица 3. Влияние ПО на синтез ИФН-гамма (пкг/мл) МНПК и содержание CD3+ИФН-гамма+-лимфоцитов у больных инфильтративным туберкулезом легких
| Показатель | Основная группа, n = 40 | Контрольная группа , n = 40 | ||||||
| До лечения | Через 10 дней | Через 3 месяца | До лечения | Через 10 дней | Через 3 месяца | |||
| ИФН-гамма | ФГА | ↓ | 841 ± 430 | 1814 ±538** | 1529 ±522* | 809 ± 371 | 1072 ± 228 | 1217 ±193 |
| ↑ | 1260 ± 367 | 1968 ±504 | 1794 ± 397 | 1325 ±241 | 1107±184 | 1542 ±396 | ||
| PPD | ↓ | 493 ± 299 | 747 ± 379* | 542 ± 249 | 515 ±187 | 418 ±223 | 683 ±315 | |
| ↑ | 810 ±43 | 999 ±410 | 1028 ±445 | 749 ±142 | 697 ± 292 | 983 ±193 | ||
| CD3+ИФН-гамма+-клетки (%) | 13,0 ± 7,7 | 20,0 ± 7,2 * | 19,0 + 6,7 | 10,0 ±3,0 | 11,5 ±2,5 | 13,5 ±4,2 | ||
| * p < 0,01, ** p < 0,005 — достоверное отличие от показателей до лечения. | ||||||||
Результаты исследований показали, что на 10-й день после окончания лечения ПО как поликлональный, так и специфический стимулятор в опытной группе вызывает статистически значимое усиление синтеза ИФН-гамма в группе с исходно низким его уровнем (табл. 3). Через три месяца после окончания лечения ПО уровень ИФН-гамма продолжал оставаться более высоким, чем до лечения, хотя имел отчетливую тенденцию к снижению. Важно отметить, что у больных с исходно высоким уровнем синтез ИФН-гамма под влиянием ПО практически не повышался. В контрольной группе больных, получавших стандартное лечение, существенных колебаний в уровне ИФН-гамма не наблюдалось.
У больных инфильтративным туберкулезом легких, получавших ПО, наблюдалось увеличение процента СD3+-клеток, продуцирующих ИФН-гамма, что могло быть одной из причин повышенного его синтеза в культуре МНПК (табл. 4). Другой причиной могло быть усиление функциональной активности СD3+-лимфоцитов и ускорения синтеза этого цитокина. В контрольной группе увеличения процента С03+-клеток, продуцирующих ИФН-гамма, не наблюдалось.
Включение ПО в комплексное лечение больных туберкулезом дало значительный клинический эффект. Происходило более быстрое рассасывание инфильтратов, быстрее исчезала интоксикация, прекращалось бактериовыделение.
2. Исследование влияния ПО на частоту развития гриппа и острых респираторных заболеваний (ОРЗ) в группе часто и длительно болеющих людей
В трех различных регионах России были проведены ограниченные иммуноэпидемиологические испытания с целью снижения сезонной заболеваемости гриппом и ОРЗ в группе часто и длительно болеющих (ЧДБ) людей. Был использован ПО, таблетки 12 мг.
Первое исследование было проведено в г. Нижний Тагил (Серков И. Л.). По особенностям промышленного производства Нижний Тагил относится к зоне экологического бедствия. ПО применялся перорально, курсовая доза 0,24 г. Испытуемые находились под наблюдением с февраля по декабрь. У них фиксировалось появление клинических признаков гриппа или ОРЗ.
По результатам клинических наблюдений выявлено достоверное снижение уровня сезонной заболеваемости гриппом и ОРЗ. У 53% пациентов, принимавших ПО, не было выявлено простудных заболеваний за период наблюдения. У 43% наблюдаемых отмечались рецидивы, но, по оценкам испытуемых, частота и длительность заболеваний существенно уменьшились. Кроме того, у данной группы пациентов не было отмечено серьезных осложнений после перенесенных ОРЗ. У 10 человек до начала приема и через 15-20 дней после окончания приема ПО была взята кровь для определения в сыворотке уровня ИФН-альфа. Было установлено, что до приема ПО уровень ИФН-альфа составил 7,18 ± 2,34, после приема 14,09 ± 2,43 пкг/мл (р Второе исследование было проведено в Тверском ГМУ (проф. Михайленко А. А.) на базе Торжокской ЦРБ и в Тверском иммунологическом центре. В исследовании принимали участие иммунокомпрометированные дети в возрасте 12-16 лет. Дети болели ОРЗ четыре раза и более в год. Заболевания, как правило, характеризовались длительным, торпидным течением с наличием ряда постинфекционных осложнений. Практически у всех детей имелись заболевания ЛОР-органов.
Для профилактики гриппа и ОРЗ использовали таблетки ПО (12 мг) в комплексе с поливитаминами Ревит. Таблетки ПО дети принимали сублингвально. Было сформировано две группы.
Первая опытная группа, 22 человека, получала поливитамины по 3 драже в день 17 дней, ПО по 1 таблетке 2 раза в сутки 10 дней.
Вторая опытная группа, 16 человек, получала Ревит по 3 драже в день 17 дней и ПО по 1 таблетке 1 раз в сутки 10 дней.
По результатам клинических наблюдений частота гриппа и ОРЗ в первой опытной группе снизилась почти в три раза по сравнению с контрольной. Заболевания ЛОР-органов, бронхиты, пневмонии, острые кишечные инфекции у детей этой группы также зарегистрированы несколько реже. По мнению родителей у 45,5% детей из первой опытной группы общее состояние здоровья существенно улучшилось. Во второй опытной группе наблюдалась тенденция снижения частоты гриппа и ОРЗ, но в значительно меньшей степени по сравнению с первой опытной группой. Улучшение здоровья родители отметили только у 25% детей. Таким образом, сублингвальное ежедневное применение ПО в дозе 24 мг/сутки дает существенное снижение заболеваемости гриппом и ОРЗ у иммунокомпрометированных детей.
В исследовании, проводившемся на базе Тверского иммунологического центра, была отработана оптимальная схема профилактики гриппа и ОРЗ у иммунокомпрометированных детей.
1-я опытная группа, 36 человек, получала по одной таблетке ПО 2 раза в день: утром и вечером (итого 24 мг/сутки).
2-я опытная группа, 33 человека, получала по одной таблетке ПО 3 раза в день: утром, днем и вечером (итого 36 мг/сутки).
3-я опытная группа, 28 человек, получала по 2 таблетки ПО утром и по одной таблетке ПО днем и вечером (итого 48 мг/сутки).
4-я группа, контрольная, 50 человек, не получала ПО.
Через 8 месяцев после проведенной иммунокоррекции по результатам клинических исследований во всех опытных группах отмечалась четкая положительная динамика в частоте гриппа и ОРЗ. 79% детей и более выходили из состояния ЧДБ. Статистически достоверных различий между опытными группами не было, что свидетельствует о том, что минимальная терапевтическая концентрация препарата была достигнута уже в первой опытной группе: ПО таблетки 12 мг 2 раза в день (утром и вечером).
У детей всех групп были исследованы уровень иммуноглобулинов и функциональная активность фагоцитов, а также у 10 человек каждой группы был определен уровень ИФН-альфа в сыворотке крови. Обнаружено, что ПО ликвидирует состояние дисгаммаглобулинемии и несколько снижает повышенную функциональную активность лейкоцитов, что характерно для детей группы ЧДБ. До начала иммунокоррекции в сыворотках крови детей 1-й и 2-й опытных групп ИФН-альфа не определялся. На 15-й день после окончания курса иммунокоррекции уровень ИФН-альфа составил 8,4 ± 1,75 и 10,7 ± 2,65 соответственно. Это повышение находится в пределах нормальных колебаний ИФН-альфа.
Третье исследование было проведено в Оренбургской ГМА (проф. Скачков М. В.). Проведено открытое контролируемое рандомизированное исследование, в которое было включено 360 амбулаторных, часто болеющих ОРЗ, больных обоего пола в возрасте 18-60 лет. Одна группа контрольная и три группы опытных. Больные контрольной группы получали поливитамины Ундевит. Больные 1-й, 2-й и 3-й опытных групп получали соответственно 24 мг/сутки, 36 мг/сутки и 48 мг/сутки ПО, сублингвально, в течение 10 дней, по схеме, идентичной исследованию Тверского иммунологического центра. Последующее наблюдение за больными проводилось в течение 6 месяцев.
Наибольшая эффективность была выявлена при использовании дозы 24 мг в сутки. В этой группе индекс эффективности профилактики ОРЗ составил 4,11; показатель защищенности — 75,75%. Таким образом, иммуно-эпидемиологические исследования кафедры эпидемиологии Оренбургской медицинской академии показали высокую эффективность ПО в профилактике ОРЗ.
Изучение влияния ПО на антигенпрезентирующие клетки
Способность ПО стимулировать образование ИФН может быть связана с его способностью оказывать эффект на антигенпрезентирующие клетки: макрофаги и дендритные клетки (ДК) (ПащенковаМ.В., ФГБУ ГНЦ «Институт иммунологии» ФМБА). Было обнаружено, что при совместном культивировании ПО усиливает экспрессию на мембране ДК костимулирующих молекул CD80+ и CD86+ (рис. 1), играющих исключительно важную роль в образовании иммунологического синапса с Т- и В-лимфоцитами. Этот процесс является основным в инициации адаптивного иммунного ответа и индукции синтеза цитокинов.
Рис. 1. Экспрессия молекул костимуляции Д К под действием ПО
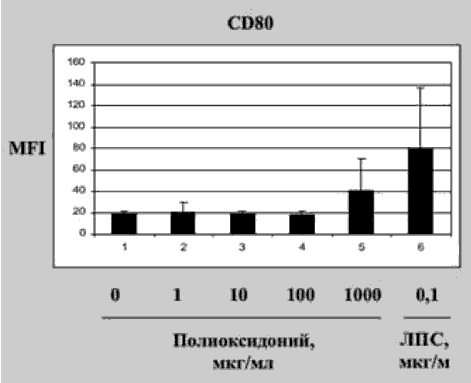
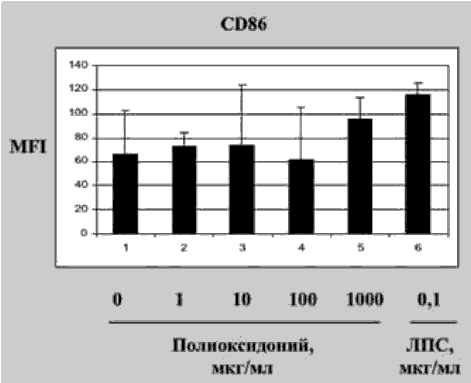
ПО стимулирует процесс презентации ДК специфических антигенов Т-клеткам, что проявляется в повышенной их пролиферации и синтезе ИФН-гамма.
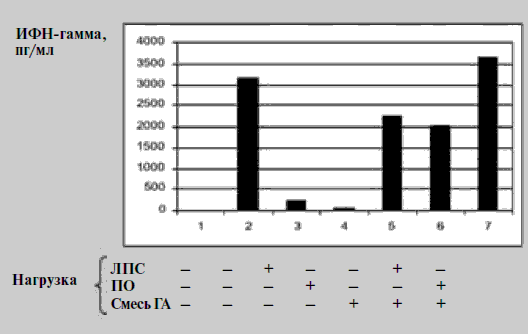
ДК, нагруженные смесью гемагглютининов и ПО, обладали способностью стимулировать пролиферацию аутологичных CD4+ Т-клеток (рис. 2) и индуцировать синтез CD4+ Т-клетками ИФН-гамма (рис. 3). Причем в последнем случае продукция этого цитокина было более интенсивной, чем при активации ДК смесью гемагглютининов и ЛПС. Как известно, ЛПС является одним из наиболее сильных стимуляторов системы интерферонов.
Рис. 2. Влияние ПО на представление гемагглютининов вируса гриппа ДК аутологичным Т-хелперам (по пролиферативной активности)
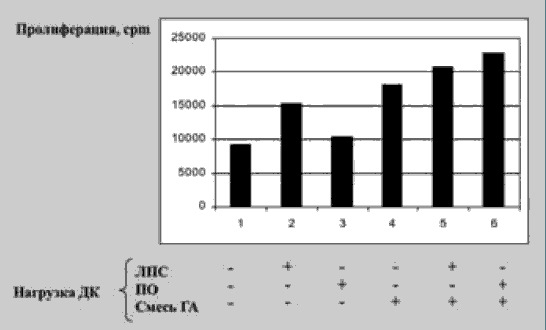
Рис. 3. Влияние ПО на представление гемагглютининов вируса гриппа ДК аутологичным Т-хелперам (по продукции ИФН-гамма)
Заключение
ПО является уникальной молекулой с многогранным комплексом полезных воздействий на организм человека. Вероятно, многогранность действия ПО на организм человека и определяет его высокую клиническую эффективность в лечении ряда заболеваний человека.
Анализ собственных данных и данных литературы показывает, что ПО обладает способностью стимулировать синтез ИФН-альфа и ИФН-гамма в культуре МНПК человека, а также при введении его больным с различными нарушениями иммунной системы. В отношении ИФН-гамма этот эффект может быть связан со способностью ПО индуцировать в культуре мононуклеаров образование СDЗ+ИФН-гамма+-клеток. Одним из механизмов может быть выявленная нами активация ПО дендритных клеток, проявляющаяся в повышении их способности стимулировать Т-хелперы, синтезировать ИФН-гамма и пролиферировать под влиянием специфического антигена. В целом же в основе стимуляции ПО синтеза интерферонов лежит его способность оказывать комплексный эффект на клетки иммунной системы, что, вероятно, заключается в его способности активировать соответствующие сигнальные пути, ответственные за синтез этих цитокинов. Изучение активации этих сигнальных путей под влиянием ПО представляет важную задачу для клинической иммунологии.
Таким образом, проанализированные нами данные позволяют сделать вывод, что к иммуномодулирующим, антиоксидантным, детоксицирующим, мембранопротекторным и энергосберегающим эффектам можно добавить интерферониндуцирующие свойства ПО, что дает нам основание рекомендовать ПО для профилактики гриппа и ОРЗ.
ЛИТЕРАТУРА
1. Дамбаева С. В., Мазуров Д. В., Голубева Н. М., Дьяконова В.А., Пинегин Б.В., Хаитов P.M. Действие полиоксидония на фагоцитарную активность лейкоцитов периферической крови человека//Russ. J.Immunol. 2003,8, 53-60.
2. Dambaeva S. V., Mazurov D. M., Golubeva N. M. et al. The effect of polyoxidonium on the phagocytic activity of human peripheral bloo leukocytes // Centr. Eur. J. Immunol. 2003, 28, 47-53.
З. Дьяконова В. А., Климова СВ., Кулаков В. В., Савинова И. В., Пинегин Б. В. Изучение взаимодействия полиоксидония с клетками иммунной системы с помощью проточной цитометрии // Иммунология. 2002, № 6, 334-337.
4. Dyakonova V. A., Dambaeva S. V., Pinegin В. V., KhaitovP.M. Study of interaction between the polyoxidonium immunomodulator and the human immune system cells. International // Immunopharmacology. 2004, 4, 16150-16153.
5. Клебанов Г.И., Любицкий О.Б., Дьяконова В. А. Изучение антитоксических свойств иммуномодулятора полиоксидония.
6. Комогорова Е.Э., Косенко Е.В., Стаханов В. А. и др. Уровень СОЗ+-лимфоцитов, содержащих интерферон-гамма, у больных туберкулезом легких и его изменение после включения в комплексную терапию полиоксидония // Иммунология. 2004, 4, 210-213.
7. МихайленкоА.А., Макаренко О. С, Самошин О. А., Сизякова Р.И. Профилактика гриппа и ОРЗ с помощью сублингвального применения полиоксидония // Иммунология. 2005, 4, 215-217.
8. Некрасов А. В., Пучкова Н.Г. Основы синтеза и свойства // Иммунология. 2002, 6. 329-333.
9. Петров Р. В., Хаитов Р. М., Некрасов А. В. и др. Полиоксидоний — препарат нового поколения с известной структурой и механизмом действия // Иммунология. 2000, № 5, 24-28.
10. Пинегин Б.В., Некрасов А.В., Хаитов P.M. Механизм действия и клинические аспекты применения иммуномодулятора полиоксидония. Современные проблемы аллергологии, иммунологии и иммунофармакологии. 4-й конгресс Российской ассоциации аллергологов и клинических иммунологов (РААКИ). Сб. тр. Т. I, 334-348.
Комментарии
ПРАКТИКА ПЕДИАТРА
