Действие видимого света на некоторые клеточные и иммунные параметры
Статьи Опубликовано в журнале:Immunology and Cell Biology (1995) 73, 239-244
ТАМАRА KUBASOVА, 1 MAGDOLNA HORVATH, 1 KATALIN KOCSIS1, MARTA FENYO 2
1Frederic Joliot-Curie National Research Institute for Radiobiology and Radiohygiene and
2Bioptron Health Centre Ltd, Budapest, Hungary.
Резюме. В этой работе рассматривается биологическое действие света видимого спектра с низкой плотностью энергии. Сравниваются воздействия диффузного (ДС) и линейно поляризованного (ЛПС) света на моделях in vitro и in vivo.
Эксперименты in vitro проводились на человеческих лимфоцитах с целью изучения их способности к бласттрансформации и образованию розеток. Воздействие ДС, и ЛПС приводило к увеличению количества бласттрансформированных клеток даже в лимфоцитарной культуре без фитогемагглютинина и уменьшению образования розеток Т-лимфоцитов. Более выраженный эффект имел место при воздействии ЛПС.
При воздействии ДС и ЛПС на селезенку мышей, имеющих опухоль in vivo, было обнаружено в их сыворотке появление фактора(ов), тормозящих in vitro включение [3H]-тимидина в опухолевые клетки, взятые у животных, не подвергавшихся воздействию видимого света. В других сериях экспериментов образцы сыворотки брали у животных, имеющих опухоль, после обработки их селезенки ЛПС. Вслед за ежедневным применением этих сывороток у другой группы необлученных мышей, имеющих опухоль, наблюдалась тенденция к уменьшению митотической активности опухоли, вызвавшей асцит.
Предлагается применение видимого (предпочтительно линейно поляризованного) света для стимуляции человеческих иммуннокомпетентных клеток, а также предлагаются клинические испытания с экстракорпоральным облучением крови для активизации естественной защиты организма с ослабленным иммунитетом.
Ключевые слова: [3H]-тимидин, асцитическая опухоль, бласттрансформация, человеческие лимфоциты, митотический индекс, образование розетковидных структур, сывороточное лечение, облучение селезенки, видимый свет.
Введение
В начале 1980-х гипотетически было высказано предположение о том, что изменения в клеточной мембране, индуцированные лазерным излучением видимого спектра, играют важную роль в ускорении заживления ран. 1 Это биостимулирующее действие лазера обусловлено его поляризованной природой. Подобный же уровень биостимуляции был достигнут при использовании поляризованного света. Например, ускоренное заживление ран при использовании поляризованного света объяснялось увеличением количества иммунных протеинов в экссудате ран. 2 Благоприятное биологическое действие видимого света было опытным путем доказано в хирургии, гинекологической, ревматологической и дерматологической практике. 3-5
В течение последнего десятилетия собирались данные о биологическом действии видимого света на клеточном уровне. 6-12 Проводились также наблюдения за изменениями на поверхности клетки после воздействия на культивируемые человеческие фибробласты лазером, диффузным или поляризованным светом, вызывающих аккумуляцию негативных изменений, выраженную в различных пределах. 13, 14
Однако некоторые результаты противоречат друг другу, выявляя противоположные тенденции. Одни авторы обнаружили, что видимый свет оказывает замедляющее действие на рост клеток 7, 12 и стимуляцию человеческих лимфоцитов 9. Другие указывают на эффект биостимуляции, вызываемый видимым светом низкой интенсивности и выражающийся в пролиферации клеток HeLa, 8 клеток китайского хомячка 6 или увеличении роста опухоли Эрлиха. 11 В различных опухолевых клетках было также обнаружено увеличение способности к образованию колоний in vitro. Эти факты подготовили почву для продолжения изучения ответной реакции на облучение светом клеток, включая и иммунокомпетентные клетки.
Целью наших экспериментов было дать ответ на вопрос, приводит ли облучение светом иммунокомпетентных клеток к изменению их функционального состояния, а следовательно к стимулированию иммунной системы, выражающемуся в увеличении защитной спо-собности организма. Биостимуляция этим физическим фактором была бы особенно эффективна на практике в случаях ослабленной иммунной системы (злокачествен-ные процессы, радиотерапия и т.д.). В литературе сообщается о подобных опытах, дающих обещающие результаты, с лазером 2, 10, а также с УФ излучением 16-19. В связи с этим в одной серии наших экспериментов изучалось действие диффузного (ДС) и линейно поляризованного света (ЛПС) с плотностью энергии 4 Дж/см 2 на функциональное состояние человеческих лимфоцитов.
Другая серия включала эксперименты in vitro и in vivo на мышах, имеющих опухоль, селезенки которых были облучены ДС и ЛПС. Параметры пролиферации опухоли, вызвавшей асцит, определялись на другой группе мышей после применения сыворотки, взятой у предыдущей группы.
Материалы и методы
Разделение человеческих лимфоцитов
Было изучено in vitro функциональное состояние не обработанных (контрольных) и обработанных светом человеческих лимфоцитов. При этом была исследована способность клеток к бласттрансформации в соответствии с морфологическими критериями. Изменения на поверхности Т-лимфоцитов определялись с помощью теста на образование розетковидных структур.
Производился забор образцов гепаринизированной крови у здоровых доноров и пациентов с легочной мелкоклеточной карциномой. Лимфоциты были отделены путем центрифугирования образцов крови на градиенте Ficoll-Urmiro плотностью 1,077 г/мл. Градиент был приготовлен путем смешивания Ficoll 400 (Pharmacia, Упсала, Швеция) и Uromiro 60% (Bracco, Милан, Италия) для получения раствора плотностью 1,120 г/мл. Краткое описание метода: 33,7 г Ficoll 400 были растворены в 250 мл теплой (50-600С) дистиллированной воды, затем были добавлены 88,3 мл Uromiro 60%. Оконча-тельный объем 340 мл был получен при добавлении дистиллированной воды.
Для проведения экспериментов градиент был разбавлен до плотности 1,077 г/мл. Лимфоциты были отделены при изоосмотических условиях и рН 7,2-7,3. После тройного промывания клетки были повторно переведены во взвешенное состояние в среде Parker 199 (Национальный институт гигиены, Будапешт, Венгрия) и использованы в тестах по бласттрансформации и образованию розеток.
Обработка светом человеческих лимфоцитов
Клетки подвергались обработке ДС и ЛПС с использованием галогенного источника света, произведенного для проведения испытаний (Bild-system AB, Мальмо, Швеция), испускающего широкий спектр от 400 до 800 нм. ЛПС был получен при использовании поляризационного фильтра (Тип HN 38 согласно Е. Kasemann; дихроический поляризатор произведен в Швеции). Потеря плотности энергии на фильтре выравнивалась с помощью электронного управления. Поэтому плотность энергии как ДС, так и ЛПС была одинаковой. Клеточные суспензии объемом 1 мл (1х10 7 клеток/мл) были подвергнуты облучению в чашках Петри 3,5 см диаметром при расстоянии 6,5 см между поляризационным фильтром и дном чашек. 14 Благодаря этому вся поверхность чашки Петри была подвержена облучению поляризованным или диффузным светом. Высота питательного раствора составляла 2,5 мм. Во время облучения крышки были удалены. Время экспозиции составило 7 мин. Мощность измерялась внизу чашки Петри измерителем мощности (Quantronix Model 502, Смиттаун, Нью-Йорк, США), и полученные значения были разделены на поверхность обработанной площади для получения плотности энергии. Плотность энергии была рассчитана, принимая во внимание продолжительность экспозиции. При этих условиях она была равна 4 Дж/см 2. 20
Определение способности к бласттрансформации человеческих лимфоцитов
В тестах по бласттрансформации были исследованы лимфоциты трех здоровых людей. Донорами были юноши (21-23 года). Суспензии с лимфоцитами, обработанные и необработанные ДС и ЛПС, были инкубированы при 370С, 5% СО 2 в 5 мл среды Eagle MEM с добавлением 10% аутологичной сыворотки, 2 моль/л L-глютамина, 100 МЕ/мл пенициллина и 100 мг/мл стрептомицина. Одна часть клеточных суспензий была простимулирована 100 мг/мл фитогемагглютинина (Difco, Детройт, Мичиган, США), другая часть культивировалась без фитогемагглютинина. Бласттрансформация лимфоцитов была оценена в соответствии с морфологическими критериями при оптической микроскопии. Для каждого случая определения проводились параллельно.
Для каждой временной точки было исследовано 500 клеток. Соответствующие результаты были суммированы и проанализированы статистически (Таблица 3).
Тест на образование розеток человеческими Т- лимфоцитами
В тесте образования розеток были изучены Т- лимфоциты четырех здоровых людей и четырех пациентов с легочными опухолями. Все здоровые доноры и онкологические пациенты были мужчинами среднего возраста от 47 до 65 лет.
Способность человеческих Т- лимфоцитов образовывать розетки с овечьими эритроцитами определялась при использовании уже описанного метода. 21 В нашем случае розеткой считался лимфоцит, связывающий, по крайней мере три эритроцита. Все измерения проводились параллельно по трем, четырем рядам. По каждому варианту и каждой временной точке было посчитано 500 клеток, и была определена пропорция клеток, образующих розетки. Соответствующие результаты были суммированы и проанализированы статистически (Таблица 4).
Исследование in vitro действия сыворотки на включение [3H]-TdR
Взрослые мыши линии DBA2 мужского пола (LATI, Годолло, Венгрия) весом 22-25 г были разделены на шесть групп по 10-12 животных в каждой (Таблица 1). Мыши в группе II-V были прооперированны для получения селезенки. Образцы сывороток были собраны из групп I-V и объединены на 1-й, 3-й и 7-й день после операции. Это означает, что от трех до четырех животных забивалось в каждый из этих временных периодов, а их сыворотки объединялись. Клетки опухоли, вызвавшей асцит были взяты у животных VI группы. [3H]-TdR (Amersham, Букингемшир, Великобритания) был включен in vitro в эти клетки в присутствии соответствующих образцов сывороток.
Таблица 1. Группы мышей при исследовании на включения [3H]- TdR
| Способ воздействия | |||||
| № группы | Опухоль* | Операция** | ЛПС*** | ДС*** | Комментарии |
| I | + |   |   |   | Донор сыворотки |
| II | + | + |   |   | Донор сыворотки |
| III | + | + | + |   | Донор сыворотки |
| IV | + | + |   | + | Донор сыворотки |
| V |   | + |   |   | Донор сыворотки |
| VI | + |   |   |   | Донор опухолевых клеток |
* интраперитонеальная инокуляция мышиной асцитической опухоли, P 388 (4х106 живых клеток в 0,5 мл физиологического раствора)
** операция по получению селезенки осуществлялась под наркозом на следующий день после инокуляции опу-холи
*** Облучение селезенки ДС и ЛПС с плотностью энергии 4 Дж/см 2.
Пять дней спустя были использованы старые клетки опухоли, вызвавшей асцит, Р 388 в концентрации 0,5х10 6 клеток/мл в среде Parker 199. Окончательное разведение сыворотки составило 1:10. Маркирование предшественником ДНК (1 мCi/мл при 370 С, 5% СО2) длилось 6 ч. После промывки несвязанного [3H]- TdR, в жидком сцинтилляционном спектрометре измерялся уровень радиоактивности облученных опухолевых клеток. Результаты выражались в процентном отношении к значению группы V , среднее значение s.d. (средняя ошибка). Группа V выступала в качестве контрольной группы. В этой группе все животные были прооперированы.
Исследование in vivo эффекта сыворотки на митотическую кинетику
Образцы сыворотки, собранные на 7-ой день после операции у 10 мышей групп I и II, были объединены и хранились при -20 С перед тем, как были использованы (Таблица 2). Это время было выбрано на основе наших ран-них экспериментов in vitro, демонстрирующих самые высокие показатели замедления включения [3H]- TdR при использовании семидневной сыворотки (Рис. 1). Клетки опухоли, вызвавшей асцит Р 388 (4х106 клеток/мл) были преинкубированы при 37 С, 5% СО2 с сыворотками групп I и II (окончательный раствор 1:10). Затем инокулированы интраперитонеально в объеме 0,5 мл мышам группы IVA и IVB. Соответственно, группа IVC получила только опухолевые клетки группы III без обработки сывороткой. Мыши, имеющие опухоль, и мыши, получившие сыворотку, были убиты на 1-й, 3-й и 7-й день. Таким образом, от трех до четырех животных были определены в одну подгруппу по каждому способу обработки и временному периоду. Мазки опухоли, вызвавшей асцит, были получены, зафиксированы и окрашены в соответствии с методом May-Grunwald-Giemsa. При визуальном просмотре в оптическом микроскопе было сосчитано 1500 опухолевых клеток в митозе (профаза, метафаза, анафаза и телофаза), были определены средние значения ± s.d. и выражены в процентах.
Таблица 2. Группы мышей в тесте на митотическую кинетику
| Способ воздействия | ||||
| № группы | Опухоль | Операция | ЛПС | Комментарии |
| I |   | + |   | Донор сыворотки А |
| II | + | + | + | Донор сыворотки В |
| III | + |   |   | Донор опухолевых клеток |
| IVA | + |   |   | Реципиент А |
| IVB | + |   |   | Реципиент В |
| IVC | + |   |   | Реципиент С* |
Рис. 1 Действие сывороток, полученных на 1, 3 и 7 дни после лечения различных групп мышей при включении in vitro [3H]-тимидина в опухолевые клетки не леченных животных. Ингибиторное действие образцов сыворотки выражается в процент-ном отношении к контрольным образцам.
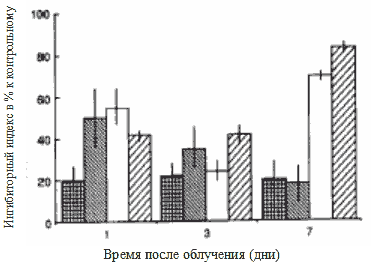
Поскольку эффективность ЛПС в сравнении с ДС была значительно выше 14, то в наших экспери-ментах на мышах с опухолью in vivo для лечения применялся ЛПС.
Результаты
Определение бласттрансформации человеческих лимфоцитов
В таблице 3 суммированы результаты морфологической оценки культивируемых человеческих лимфоцитов, обработанных ДС и ЛПС. Полученные данные показывают, что в присутствии фитогемагглютинина существует разница между способностью к бласттрансформации лимфоцитов в контрольной и обработанной ЛПС культурах, как обнаруже-но на 8 и 24 часовых временных точках. Усиливающее действие ЛПС (0,35) и ДС (0,23) наблюдалось после 24 часов для образцов, культивируемых без фитогемагглютинина по срав-нению с соответствующим контрольным образцом (0,15). Действие продолжалось в течение 48 часов, в то время как контрольные значения оставались без изменения.
Таблица 3 Бласттрансформация человеческих лимфоцитов, обработанных светом
| Время культивирования (ч) | Способ обработки | Пропорция (р) бласттрансформированных клеток в присутствии фитогемагглютинина | Расчетная |z| статистика | Значение Р от α для средней ошибки (*) между соответствующими пропорциями | Пропорция (р) бласттрансформированных клеток в отсутствии фитогемагглютинина | Расчетная |z| статистика | Значение Р от α для средней ошибки (*) между соответствующими пропорциями |
| 8 | Нет (контрольная) | 0,17 |   |   | 0,13 |   |   |
| ЛПС | 0,20 | 2,12 | *Р=0,042 | 0,20 |   | * | |
| ДС | 0,19 | 1,43 | Р=0,144 | 0,15 | 1,58 | Р=0,115 | |
| 24 | Нет (контрольная) | 0,27 |   |   | 0,15 |   |   |
| ЛПС | 0,34 | 4,17 | *Р=0,0001 | 0,35 |   | * | |
| ДС | 0,27 |   |   | 0,23 |   | * | |
| 48 | Нет (контрольная) | 0,47 |   |   | 0,15 |   |   |
| ЛПС | 0,46 |   |   | 0,38 |   | * | |
| ДС | 0,44 | 1,67 | Р=0,099 | 0,35 |   | * |
Тест образования розеток человеческими Т-лимфоцитами
После облучения клеток ДС и ЛПС была изучена способность человеческих Т-лимфоцитов образовывать розетки с овечьими эритроцитами.
Клетки брали у здоровых людей и пациентов, страдающих легочной карциномой (Таблица 4). Было обнаружено, что оба типа видимого света уменьшают количество лимфоцитов, образующих розетковидные структуры. Соотношение ЛПС и ДС составило 0,51 и 0,55 соответственно, в то время как в контрольном образце это значение составило 0,72. Подобная тенденция была обнаружена для онкологических пациентов: соотношение клеток, образующих розетковидные структуры для ЛПС и ДС составило 0,52 и 0,60 соответственно по сравнению с контрольным значением 0,68.
Таблица 4 Тест на образование розеток человеческими Т-лимфоцитами
| Способ обработки | Пропорция клеток, образующих розетки | Расчетная |z| статистика | Значение Р от α для средней ошибки (*) между соответствующими пропорциями | |
| Здоровые люди | Пациенты с легочной опухолью | Пациенты с легочной опухолью | Пациенты с легочной опухолью | |
| Нет (контрольная) | 0,72 | 0,68 |   |   |
| ЛПС | 0,51 | 0,52 |   |   |
| ДС | 0,55 | 0,60 | 5,27 | Р<0.0001 |
Включение [3H]-TdR в опухолевые клетки
На 1-й, 3-й и 7-й день после обработки светом (таблица 1) были собраны образцы сывороток. Мы исследовали действие сывороток на включение in vitro [3H]-TdR в опухолевые клетки мышей, не прошедших обработку светом (Рис. 1). Наши результаты показывают, что сыворотки, взятые у группы I, вызывают тормозящее действие 20-25% в течение всего периода наблюдения. Образцы сыворотки 1-го дня, взятые у других трех групп, задерживали включение предшественника ДНК в большей степени: ингибиторный индекс варьировал от 42 до 52%. Практически нет существенной разницы между действием сывороток 3-го дня всех групп: измеренное среднее значение варьировало между 27 и 40%. Относительно образцов сыворотки 7-го дня ингибиторное действие сывороток, взятых у групп I и II, было похожим, что означает, что значения составили приблизительно 20%. Однако значительное торможение было обнаружено в группе III и IV (70-80%). Действие ДС оказалось более выраженным.
Митотическая кинетика
Образцы сывороток были собраны на 7-й день после операции у группы I и II (Таблица 2). Опухолевые клетки Р388, взятые у группы III, были преинкубированы с этими образцами сывороток 30 минут при 37 С, 5% СО2. Преинкубированные клетки были инокулированы интраперитонеально в группу IVA и IVB. В последующие 5 дней группы IVA и IVB получали 0,1 мл соответствующей сыворотки каждый день.
Данные этих отдельных экспериментов, каждый из которых содержал наблюдения за 500 клетками, были объединены. Предполагаемая разница между значениями контрольной и облученной популяциями была проверена на значимость при помощи обычных статистических распределительных методов z, т.е. при помощи показателя ^Р контрольное - ^ Р облученное и среднеквадратич-ного отклонения разницы биноминальной пропорции. Статическое заключение было сделано при α = 0,005 уровня.
Данные по четырем отдельным экспериментам, каждый из которых содержал наблюдения за 500 клетками, были объединены. Условия и критерии статистического анализа см. в примечании к Таблице 3.
Группа IVC не получала сыворотки. Митотические индексы растущих опухолей были определены на мазках, полученных на 1-й, 3-й и 7-й дни (Рис. 2). На 1-й день значения, полученные для групп IVA и IVC, были одинаковыми (около 21%). На 3-й и 7-й дни митотические индексы постепенно снизились до 14 и 11%, соответственно. Понижение митотических индексов в группе IVB относительно групп IVA и IVC наблюдалось в течение всего периода, а именно 17, 11 и 8,5% в 1-й, 3-й и 7-й день соответственно.
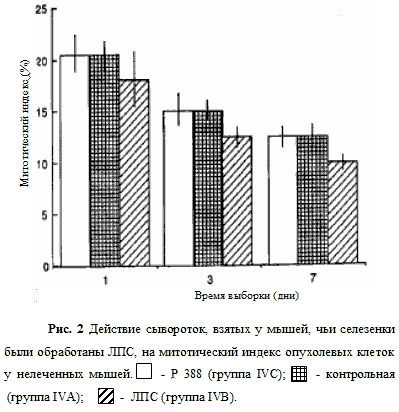
Сыворотки собирались на 7-й день после операции (см. Таблицу 2: донор сыворотки В, реципиент В). Соотношение делящихся клеточных форм определялось на 1, 3, 7 дни; они сравнивались с митотическими индексами, измеренными после применения контрольных сывороток (см. Таблица 2: донор сыворотки А, реципи-ент А), и с теми, которые не были подвержены обработке сывороткой (см. Таблицу 2: реципиент С). Среднее значение для трех мышей + среднее отклонение.
Обсуждение
Благоприятное действие видимого света на лечение ран было уже описано в литературе. 3, 22 В настоящих экспериментах плотность энергии используемого света составила 4 Дж/см2, так как в сегодняшней клинической практике используется такое же значение энергии для процессов лечения ран, язвенных (ulcera cruris) и других хронических эпителиальных повреждений.
Наши результаты демонстрируют, что клетки, принимающие участие в развитии иммунного ответа организма, могут быть также подвержены влиянию видимого света при обработке in vitro. В связи с этим способность к бластной трансформации человеческих лимфоцитов увеличивается, подтверждением чему служат морфологические исследования культур, инкубированных без фитогемагглютинина. Торможение способности лимфоцитов к индукции при помощи митогенов также описано в литературе. 9 Разногласие между результатами экспериментов, возможно, относится к возрасту культур во время осмотра. Результаты также показывают, что обработка ЛПС вызывает более выраженный стимулирующий эффект, чем ДС.
Ответная реакция лимфоцитов на ЛПС и ДС может быть также измерена методом образования розеток с помощью овечьих эритроцитов. Мы полагаем, что причиной этого явления служит индуцируемое светом аккумулирование отрицательных зарядов на поверхности лимфоцитов14, что препятствует связыванию отрицательно заряженных красных кровяных клеток.
Селезенка играет важную роль в иммунной системе. Облучение светом селезенки мышей in vivo вызвало высвобождение медиатора (-ов) в сыворотку, что замедляло включение [3H] - TdR in vitro в клетки опухоли мышей, взятые у необработанных светом животных. При предварительной оценке TNF-α (фактор некроза опухоли) был исключен в качестве возможного ингибирующего фактора.
Следующая серия экспериментов показала, что среднее значение митотического индекса ниже в опухолях, обработанных сывороткой ЛПС относительно необработанной светом сыворотки и необработанных опухолей.
Другие авторы указывают на высвобождение биологически активных веществ из человеческих лимфоцитов при УФ излучении с длиной волны 254 нм. 16 Для изучения возможного механизма стимулирующего воздействия плазма, обогащенная лейкоцитами и облученная УФ светом, была добавлена к клеткам костного мозга. Авторы наблюдали увеличение колониеобразующей активности 18 и стимулирование фагоцитарной деятельности моноцитов и гранулоцитов во всем объеме смешанной крови, полученной из образца, облученного УФ светом, и необлученной крови того же донора. 17
УФ облучение крови in vitro с повторным обратным вливанием для стимулирования регенеративных процессов уже применяется в клинической практике при различных патологических случаях. 19, 23-25 Вместе с успешным опытом при лечении также было описано подавление активности естественных клеток-киллеров. 26 На основе экспериментов in vivo с УФ, видимым и инфракрасным излучением другие авторы высказывают предположение о том, что медиаторы должны играть решающую роль в передачи сигнала от кожи к клеткам периферической крови. 27 Наиболее вероятные кандидаты на роль подобных соединительных звеньев - IFN-γ ( гамма-интерферон), гранулоцит-моноцит-CSF (цереброспинальной жидкости) и TNF (фактор некроза опухолей). После облучения гелий-неоновым лазером культуры мононуклеаров человеческой периферической крови также можно увидеть и измерить in vitro кратковременное повышение уровня различных цитокинов.28
В наших экспериментах мы показали, что действие ЛПС на некоторые исследуемые параметры более выражено, чем ДС. На основе полученных данных, опубликованных ранее, и наших собственных материалов мы выдвигаем предположение о том, что видимый свет вызывает высвобождение некоторых биологических медиаторов (цитокинов) из иммуно-компетентных клеток, и таким способом стимулирует естественную сопротивляемость организма. Таким образом, применение видимого света, предпочтительно ЛПС, может быть применено подобно УФ излучению для экстракорпорального облучения человеческой крови, и при этом, без отрицательного эффекта подавления деятельности естественных клеток-киллеров.
Благодарность
Наши исследования координировались и направлялись Marta Fenyo, которая предложила гипоте-тическую модель биостимуляции ЛПС в 1982 году. Финансирование осуществлялось Венгерским Фондом по лечению иммунных болезней светом. Мы также признательны за помощь Ivan Bojtor, который осуществил статистический анализ экспериментальных данных.
Литература
Комментарии
ПРАКТИКА ПЕДИАТРА
