ХОБЛ: комплексное заболевание: Фенотипы хронической обструктивной болезни легких
СтатьиПредыдущая статья | Оглавление | Следующая статья
Фенотипы хронической обструктивной болезни легких
Massimo Pistolesi, Francesca Bigazzi, Lucia Cestelli, Matteo Paoletti, Gianna Camiciottoli
Реферат
Неполностью обратимое нарушение легочной вентиляции, выявляемое при спирометрии как снижение объема форсированного выдоха за 1-ю секунду (ОФВ1), - следствие патологий различного генеза, совокупно обозначаемых как хроническая обструктивная болезнь легких (ХОБЛ). Ряд наблюдений прошлых лет, подтвержденных в работах последнего времени, показывает, что для ХОБЛ характерна неоднородность клинических, функциональных, рентгенологических и патоморфологических признаков, отражающих разные патофизиологические механизмы экспираторной обструкции. Компьютерная томография у больных ХОБЛ позволяет обнаружить in vivo разнообразные патологические изменения и дифференцировать нарушения с преобладающей респираторной обструкцией от нарушений с преобладающей эмфизематозной деструкцией. Для понимания результатов клинических исследований, обоснования подходов к клиническому ведению больных и развития знаний о ходе заболевания большое значение имеет разработка стандартной классификации нозологических единиц ХОБЛ.
Состояние и история вопроса
В 2010 г. приоритетным направлением развития респираторной медицины провозглашено изучение клинических нозологических единиц ХОБЛ и выработка определений, позволяющих их идентифицировать [1]. Вместе с тем, гетерогенная природа ХОБЛ в различных аспектах - клиническом, функциональном, патоморфологическом - уже хорошо известна из работ как минувшего столетия, так и последних лет.
В 1966 г. Бенджамином Барроузом с соавт.[2] описаны клинические, функциональные и рентгенологические особенности, позволяющие проводить прижизненную дифференциацию больных ХОБЛ, у которых на вскрытии обнаруживаются характерные признаки деструкции легочной паренхимы, от тех, у кого выявляемые посмертно изменения локализуются в дыхательных путях. Степень посмертной паренхиматозной деструкции положительно коррелирует с рентгенологической картиной эмфиземы, показателем общей емкости легких и возрастом. И наоборот, тяжесть деструкции легочной паренхимы отрицательно коррелирует с рентгенологическими признаками легочного воспаления, количеством отделяемой мокроты, содержанием двуокиси углерода (С02) в артериальной крови и величиной диффузионной способности легких по монооксиду углерода (СО) [2]. У всех больных при жизни наблюдалась выраженная необратимая обструкция дыхательных путей, а смерть наступала от дыхательной недостаточности, однако статистически значимая корреляция между объемом форсированного выдоха за 1-ю секунду (ОФВ1) и (при вскрытии) тяжестью и распространением эмфиземы отсутствовала [2].
По данным этих авторов, среди больных ХОБЛ можно выделить худых пациентов с бочкообразной грудной клеткой и гипертрофией вспомогательной дыхательной мускулатуры, выдыхающих через сжатые губы. У таких больных отсутствует хронический кашель с гнойной мокротой, а газы артериальной крови свидетельствуют об умеренной гипоксемии в покое и нормальном или несколько повышенном содержании С02. Прогрессирование дыхательной недостаточности у них не приводит к нарушениям функции правых камер сердца вплоть до терминальной стадии заболевания и, соответственно, у таких больных редко образуются гравитационные отеки. Напротив, у других пациентов отмечали частые обострения с выделением гнойной мокроты, тяжелой гипоксемией в сопровождении цианоза и более высоким содержанием С02. В этом случае развивались легочная гипертензия и хроническое легочное сердце без выраженных отклонений статических дыхательных объемов и диффузионной способности.
Термины «тип А» (так называемые «розовые пыхтельщики») и «тип В» («синие отечники») предложены Burrows с соавт. с тем, чтобы в когорте больных с хронической дыхательной обструкцией вариант с преобладающей эмфиземой отличать от варианта с преобладающим хроническим бронхитом (ХБ) [2]. В дальнейшем они утратили свою нозологическую ценность и без серьезного анализа были полностью забыты. Тот факт, что у одного и того же пациента нередко присутствуют и хронический обструктивный бронхиолит и деструкция легочной паренхимы, способствовало появлению и введению в практику термина «ХОБЛ», который стали распространять на всю совокупность больных с хронической необратимой бронхиальной обструкцией [3]. Этот термин позволил ученым говорить на одном языке и сформировать более ясное представление в обществе и государстве об одном из главных сегодняшних и будущих факторов заболеваемости и смертности. Вместе с тем, широко принятая практика диагностики, классификации и оценки прогрессирования заболевания, опираясь на данные одной лишь спирометрии (ОФВ1, форсированной жизненной емкости легких - ФЖЕЛ), как это предусмотрено последними рекомендациями, не позволяет охватить все разнообразие форм ХОБЛ [4-6]. Совокупность механизмов патогенеза ХОБЛ принято обозначать как нарушение легочной вентиляции. Эта формулировка отражает существующую неточность в дифференциации (по клиническим, функциональным и рентгенологическим признакам) характерного для ХБ возрастания бронхиального сопротивления, вызванного воспалением и склерозированием бронхов, от повышения легочной растяжимости, характерной для эмфиземы и обусловленной деструкцией паренхимы [6]. В зависимости от патогенеза бронхиальная обструкция при ХОБЛ по-разному реагирует на терапию, что, по-видимому, объясняет путаницу в результатах последних клинических исследований [7,8].
Функциональная и патоморфологическая неоднородность
Kim с соавт. [9] показали, что при панлобулярной эмфиземе наблюдаются более высокие показатели растяжимости легкого, чем при центролобулярной. По данным Saetta с соавт. [10], панлобулярная и центролобулярная эмфизема могут присутствовать изолированно или соседствовать у одного и того же больного. Вместе с тем, даже при наличии сразу двух вариантов поражения легочной паренхимы один из видов эмфиземы всегда преобладает. Механические свойства легкого меняются в зависимости от того, какой из двух типов эмфиземы является доминирующим. Показано, что снижение эластической тяги легкого, отмечаемое у больных эмфиземой, возрастает по мере распространения панлобулярной, но не центролобулярной эмфиземы. Кроме того, наличие панлобулярной эмфиземы и воспалительных изменений бронхиол, характерных для больных с преобладанием ХБ, находится в обратной зависимости [10].
Неоднородность картины поражения легочных сосудов
При различных вариантах нарушения легочной вентиляции наблюдается разная картина вовлечения легочных сосудов. Принято считать, что хроническое легочное сердце чаще встречается у больных с клинической картиной ХБ, чем эмфиземы [2]. Как показывают исследования Hale с соавт. [11], в легких курильщиков происходит увеличение числа и толщины артерий мышечного типа диаметром менее 200 микрон. Увеличение толщины объясняется гипертрофией мускулатуры медии и фиброзом интимы. Эти изменения отмечались только в тех областях легких, где имелись признаки патологии дыхательных путей и центролобулярной эмфиземы, и, напротив, отсутствовали в области панлобулярной эмфиземы [11].
Как показывают данные исследования Andoh с соавт. [12] у больных, скончавшихся от хронического легочного сердца, если при жизни в клинической картине преобладал ХБ, то при вскрытии у таких больных обнаруживали перибронхиолярный и периваскулярный фиброз. Напротив, в случае эмфиземы степень перибронховаскулярного фиброза не отличалась от таковой у лиц с нормальной легочной функцией, умерших от случайных причин [12]. Периваскулярный фиброз у больных ХБ пространственно совмещался с перибронхиальным и поражал только сосуды, прилегающие к окруженным фиброзной тканью бронхиолам [12]. Эти данные могут указывать на то, что хроническое воспаление способно напрямую распространяться от бронхиол к прилегающим артериолам, а легочная гипертензия и, как следствие, хроническое легочное сердце у больных с преобладающим ХБ, возможно, являются результатом этих процессов. У пациентов с преобладающей эмфиземой развитие хронического легочного сердца на поздних стадиях болезни можно объяснить прогрессирующим разрушением капилляров межальвеолярных перегородок в сочетании с тяжелой гипоксией.
С такими представлениями согласуются данные Schulman и соавт. [13], согласно которым у больных с изолированными формами эмфиземы возрастание легочного сосудистого сопротивления тесно коррелирует со снижением диффузионной способности легких - самым точным функциональным показателем, позволяющим в прижизненном тесте определить степень анатомической деструкции легочного микрососудистого русла.
В целом, как показывают результаты упомянутых исследований, у больных с преобладанием ХБ преимущественным типом структурных поражений сосудов являются фиброз интимы, гипертрофия медии, воспалительная инфильтрация и периваскулярный фиброз, а у пациентов с преобладанием эмфиземы среди анатомических поражений главенствует деградация сосудистого русла. Патологические изменения легочных сосудов функционально отражаются в тех или иных отклонениях показателя диффузионной способности, всегда ярче выраженных у пациентов с преобладанием эмфиземы, а рентгенологически - в разнообразных изменениях легочного сосудистого рисунка. Рентгеновские данные в сочетании с оценкой состояния сердца, дыхательных путей, объема и плотности легких способны существенно прояснить основной механизм патогенеза, приведший к формированию хронической дыхательной обструкции [14].
Данные современных источников
Определение фенотипа хронической обструктивной болезни легких методом компьютерной томографии
Компьютерная томография (КТ) позволяет in vivo получить точную информацию о лежащих в основе ХОБЛ патологических изменениях в легких и их влиянии на легочную функцию [15-17]. Гетерогенность изменений при ХОБЛ показана на большой выборке больных, которым после обострения ХОБЛ была выполнена КТ [18]. Данные других исследований, проведенных на меньших выборках, показывают, что среди страдающих ХОБЛ пациентов степень бронхиальной обструкции, гиперинфляции и снижения диффузионной способности выше у лиц с подтвержденной КТ эмфиземой [19,20]. При этом выраженность в баллах хронических воспалительных изменений по данным рентгенографии грудной клетки отрицательно коррелирует с распространением и тяжестью эмфиземы по данным КТ [19]. Таким образом, в отсутствие эмфиземы преобладающим типом поражения может являться воспаление дыхательных путей. С этим согласуются данные O’Donnell с соавт. [21], обнаруживших, что у больных ХОБЛ число нейтрофилов в индуцированной мокроте тесно коррелирует со степенью дыхательной обструкции, но не с тяжестью эмфиземы, определяемой по величине диффузионной способности и по данным КТ.
Большая часть исследований ХОБЛ на материале КТ посвящена тяжести и распространению эмфиземы, а не процессам воспаления и склерозирования дыхательных путей. Показано, что количественное измерение утолщения бронхиальной стенки в сочетании с данными о распространении эмфиземы позволяет дифференцировать пациентов с преобладающей деструкцией паренхимы от тех, у кого преобладает поражение дыхательных путей [15,22-25]. В целом, данные указывают на то, что у больных с клинической и функциональной картиной ХБ нарушение легочной вентиляции связано с бронхиальным воспалением и склерозированием, о чем свидетельствует заметное на КТ утолщение стенки бронхов. Напротив, у лиц с клинической и функциональной картиной эмфиземы оно сопряжено с деструкцией легочной паренхимы, что определяется на КТ как процентная доля областей ослабленной васкуляризации. Показано также, что вклады утолщения бронхиальной стенки и распространения эмфиземы в ограничение вентиляции независимы друг от друга. Эти два самостоятельных КТ-фенотипа ХОБЛ так же независимо группируются и в семейном анамнезе, что указывает на неоднородность влияющих на них генетических факторов [25].
В последнее время Ogawa с соавт. [26] показано, что больные ХОБЛ со сниженной на КТ плотностью легочной паренхимы, характерной для эмфизематозной деструкции, имеют меньшую массу тела по сравнению с теми, у кого отмечается возрастание толщины бронхиальной стенки, характерное для воспалительных поражений дыхательных путей. Наблюдается обратная зависимость между индексом массы тела (ИМТ) и распространением эмфиземы на КТ [26]. Эти данные лишний раз подтверждают, что разнообразие клинической картины при ХОБЛ отражает гетерогенность патогенетических механизмов нарушения вентиляции.
Клиническое определение преобладающего фенотипа
Приведенные литературные данные о сложности и неоднородности клинических, функциональных, рентгенологических и патоморфологических аспектов ХОБЛ объясняют, почему единое, основанное на спирометрии определение ХОБЛ как неполностью обратимого нарушения легочной вентиляции не позволяет устанавливать механизм патогенеза ХОБЛ у конкретного больного. В последнее время несколькими группами исследователей предложены новые подходы к дифференциации подгрупп больных ХОБЛ с характерным для каждой подгруппы фенотипом заболевания [27-33].
Используя КТ как эталонный стандарт и как клиническую, функциональную и рентгенологическую переменную первого уровня, можно разработать многомерную модель, которая позволит идентифицировать преобладающий фенотип ХОБЛ на основании ограниченного набора признаков, измеренных на большой выборке пациентов. Методами многомерного шкалирования и кластерного анализа отобрано 9 из 38 признаков, включающих в себя клинические, функциональные и рентгенологические данные, полученные на выборке 322 амбулаторных больных ХОБЛ в клинически стабильном состоянии [29]. Полученная модель, построенная на 9 признаках - данных клинического анамнеза (характер кашля и мокротоотделения), физикального осмотра (наличие шумов, гиперрезонанс), тестов легочной функции (индекс ОФВ1/жизненная емкость легких (ЖЕЛ)) и рутинной рентгенографии грудной клетки (усиление сосудистого рисунка, утолщение бронхиальной стенки, увеличение объема легких, снижение плотности легочной паренхимы) - позволила проспективно разбить валидационную группу 93 пациентов на две подгруппы, чьи клинические, функциональные характеристики и данные рентгенографии грудной клетки и КТ отвечали одному из двух фенотипов: обструкции дыхательных путей либо деструкции паренхимы [29].
Примеры использования прогностической модели даны на Рис. 1 и 2. На Рис. 1 показаны данные рентгенографии грудной полости у 3 больных ХОБЛ с бронхитическим фенотипом, у которых, в соответствии с рекомендациями Международной инициативной группы по проблемам хронических обструктивных заболеваний легких (GOLD), были определены стадии заболевания GOLD II (Рис. 1А), GOLD III (Рис. 1В) и GOLD IV (рис. 1C). У трех других больных с эмфизематозным фенотипом стадия заболевания определена спирометрически как GOLD II, III и IV (соответственно Рис. 2А, 2В и 2С). Сравнивая данные рентгенографии у пациентов одной степени тяжести по GOLD, но с разными фенотипами, можно видеть четкие различия клинических проявлений. Очевидно также, что применять одинаковую терапию к двум пациентам на Рис. 1C и 2С, как это предусмотрено рекомендациями GOLD, нецелесообразно. Таким образом, выбор терапии должен исходить не из величины ОФВ1, а из клинической формы ХОБЛ. Исходя из того, что бронходилататоры, по-видимому, показаны всем пациенты сХОБЛ, можно предполагать, что больным с бронхитическим фенотипом также показаны ингаляционные кортикостероиды, несмотря на то, что ОФВ1 у них не опускается до значений, при которых рекомендациями GOLD предусмотрено начало ингаляционной стероидной терапии (пациент на рис. 1А). И наоборот, ингаляционные кортикостероиды могут быть противопоказаны больным с эмфизематозным фенотипом, даже если ОФВ1 значительно ниже предусмотренного GOLD порога (пациент на Рис. 2С).
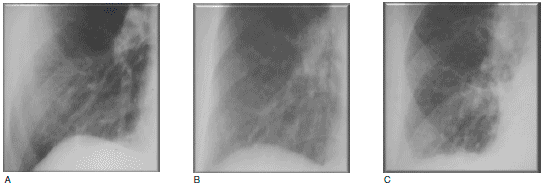
Рис. 1. Рентгенография грудной клетки при хронической обструктивной болезни легких (ХОБЛ) у пациентов с бронхитическим фенотипом II (А), III (В) и IV (С) степени тяжести по данным спирометрии согласно классификации Международной инициативной группы по проблемам хронических обструктивных заболеваний легких (GOLD). От А к С заметно усиление легочного сосудистого рисунка по сравнению с нормой, ухудшение его четкости, появление извилистости и невозможность проследить ход сосудов от центра к периферии.
Таким образом, представляется, что при всех индивидуальных особенностях, в которых у конкретного больного реализуется широкая непрерывная гамма патологических изменений, приводящих к нарушению вентиляции, каждого пациента можно отнести к одному из двух типов заболевания, при котором преобладающим является либо поражение дыхательных путей, либо деструкция паренхимы. Очевидно, для характеристики данного гетерогенного заболевания более информативна не спирометрия, а определение преобладающего фенотипа ХОБЛ по избранным клиническим и функциональным показателям, а также по данным, полученным путем стандартизованного описания рутинных рентгеновских снимков. Такой подход способен существенно повлиять на интерпретацию результатов клинических исследований, пути клинического ведения больных и глубину понимания течения ХОБЛ.
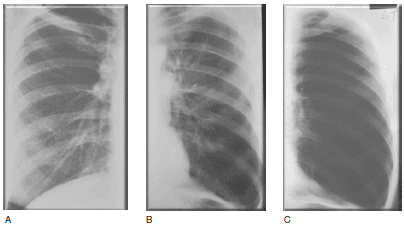
Рис. 2. Рентгенография грудной клетки при хронической обструктивной болезни легких у пациентов с эмфизематозным фенотипом II (А), III (В) и IV (С) степени тяжести по данным спирометрии согласно классификации Международной инициативной группы по проблемам хронических обструктивных заболеваний легких (GOLD). От А к С заметна прогрессирующая утрата легочных сосудов. Можно видеть постепенное увеличение объема легочной паренхимы и уменьшение ее плотности.
ЛИТЕРАТУРА
1. Han МК, Agusti A, Calverley PM, et al. Chronic obstructive pulmonary disease phenotypes: the future of COPD. Am J Resplr Crit Care Med 2010;182(5):598-604.
2. Burrows B, Fletcher CM, Heard BE, Jones NL, Wootliff JS. The emphysematous and bronchial types of chronic airways obstruction. A clinicopathological study of patients in London and Chicago. Lancet 1966;87:830-835.
3. Thurlbeck WM. Chronic bronchitis and emphysema. Med Clin North Am 1973;57:651-668.
4. Gelb AF, Hogg JC, Muller NL, et al. Contribution of emphysema and small airways in COPD. Chest 1996;109:353-359.
5. Friedlander AL, Lynch D, Dyar LA, Bowler RP. Phenotypes of chronic obstructive pulmonary disease. COPD 2007;4:355-384.
6. Pistolesi M. Beyond airflow limitation: another look at COPD. Thorax 2009;64:2-4.
7. Calverley PM, Anderson JA, Celli B, et al; TORCH investigators. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356:775-789.
8. Tashkin DP, Celli B, Senn S, et al; UPLIFT Study Investigators. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008;359:1553-1554.
9. Kim WD, Eidelman DH, Izquierdo JL, Ghezzo H, Saetta MR Cosio MG. Centrilobular and panlobular emphysema in smokers. Two distinct morphologic and functional entities. Am Rev Respir Dis 1991 ;144:1385-1390.
10. Saetta M, Kim WD, Izquierdo JL, Ghezzo H, Cosio MG. Extent of centrilobular and panacinar emphysema in smokers’ lungs: pathological and mechanical implications. Eur Respir J 1994;7:664-671.
11. Hale KA, Niewoehner DE, Cosio MG. Morphologic changes in the muscular pulmonary arteries: relationship to cigarette smoking, airway disease, and emphysema. Am Rev Respir Dis 1980;122:273-278.
12. Andoh Y, Shimura S, Aikawa T, Sasaki H, Takishima T. Perivascular fibrosis of muscular pulmonary arteries in chronic obstructive pulmonary disease. Chest 1992;102:1645-1650.
13. Schulman LL, Lennon PF, Wood JA, Enson Y. Pulmonary vascular resistance in emphysema. Chest 1994;105:798-805.
14. Milne EN, Pistolesi M. Reading the Chest Radiograph. A Physiologic Approach. St. Louis, Mo: Mosby-Year Book; 1993.
15. Nakano Y, Muro S, Sakai H, et al. Computed tomographic measurements of airway dimensions and emphysema in smokers. Correlation with lung function. Am J Respir Crit Care Med 2000;162:1102-1108.
16. Nakano Y, Muller NL, King GG, et al. Quantitative assessment of airway remodeling using high-resolution CT. Chest 2002;122(Suppl):271S-275S.
17. Camiciottoli G, Bartolucci M, Maluccio NM, et al. Spirometrically gated high-resolution CT findings in COPD. Lung attenuation vs lung function and dyspnea severity. Chest 2006;129:558-564.
18. O’Brien C, Guest PJ, Hill SL, Stockley RA. Physiological and radiological characterisation of patients diagnosed with chronic obstructive pulmonary disease in primary care. Thorax 2000;55:635-642.
19. Boschetto P, Miniati M, Miotto D, et al. Predominant emphysema phenotype in chronic obstructive pulmonary disease. Eur Respir J 2003;21:450-454.
20. Boschetto P, Quintavalle S, Zeni E, et al. Association between markers of emphysema and more severe chronic obstructive pulmonary disease. Thorax 2006;61:1037-1042.
21. O’Donnell RA, Peebles C, Ward JA, et al. Relationship between peripheral airway dysfunction, airway obstruction, and neutrophilic inflammation in COPD. Thorax 2004;59:837-842.
22. Aziz ZA, Wells AU, Desai SR, et al. Functional impairment in emphysema: contribution of airway abnormalities and distribution of parenchymal disease. AJR Am J Roentgenol 2005; 185:1509-1515.
23. Orlandi I, Moroni C, Camiciottoli G, et al. Chronic obstructive pulmonary disease: thin-section CT measurement of airway wall thickness and lung attenuation. Radiology 2005;234:604-610.
24. Kitaguchi Y, Fujimoto K, Kubo K, Honda T. Characteristics of COPD phenotypes classified according to the findings of HRCT. Respir Med 2006;100:1742-1752.
25. Patel BD, Coxson HO, Pillai SG, et al; International COPD Genetics Network. Airway wall thickening and emphysema show independent familial aggregation in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2008;178:500-505.
26. Ogawa E, Nakano Y, Ohara T, et al. Body mass index in male patients with COPD: correlation with low attenuation areas on CT. Thorax 2009;64:20-25.
27. Makita H, Nasuhara Y, Nagai K, et al. Characterisation of phenotypes based on severity of emphysema in chronic obstructive pulmonary disease. Thorax 2007;62:932-937.
28. Lee YK, Oh YM, Lee JH, et al. Quantitative assessment of emphysema, air trapping, and airway thickening on computed tomography. Lung 2008;186:157-165.
29. Pistolesi M, Camiciottoli G, Paoletti M, et al. Identification of a predominant COPD phenotype in clinical practice. Respir Med 2008;102:367-376.
30. Kim WJ, Oh YM, Sung J, et al. CT scanning-based phenotypes vary with ADRB2 polymorphisms in chronic obstructive pulmonary disease. Respir Med 2009;103:98-103.
31. Roy K, Smith J, Kolsum U, Borrill Z, Vestbo J, Singh D. COPD phenotype description using principal components analysis. Respir Res 2009;10:41.
32. Weatherall M, Travers J, Shirtcliffe PM, et al. Distinct clinical phenotypes of airways disease defined by cluster analysis. Eur Respir J 2009:34:812-818.
33. Paoletti M, Camiciottoli G, Meoni E, et al. Explorative data analysis techniques and unsupervised clustering methods to support clinical assessment of chronic obstructive pulmonary disease (COPD) phenotypes. J Biomed Inform 2009;42:1013-1021.
Предыдущая статья | Оглавление | Следующая статья
Комментарии
ПРАКТИКА ПЕДИАТРА
