К вопросу о месте блокаторов рецепторов ангиотензина II в лечении артериальной гипертензии
Статьи Опубликовано в журнале:Рациональная Фармакотерапия в Кардиологии 2008; №4
С.А. Бойцов, И.П. Колос
Российский кардиологический научно-производственный комплекс Росмедтехнологий, 121552 Москва, 3-я Черепковская 15а
В последние годы блокаторы рецепторов ангиотензина II (БРА) существенно упрочили свои позиции в плане расширения показаний дополнительно к лечению артериальной гипертензии (АГ). Появились такие новые показания, как хроническая сердечная недостаточность, перенесенный инфаркт миокарда, фибрилляция предсердий и метаболический синдром. В статье проведен анализ имеющейся доказательной базы, в том числе с учетом опубликованных недавно результатов крупнейших международных исследований, свидетельствующий о том, что БРА могут безопасно и эффективно применяться в широкой клинической практике для увеличения продолжительности и качества жизни у пациентов с АГ
Ключевые слова: блокаторы рецепторов ангиотензина, ингибиторы АПФ, артериальная гипертензия, инфаркт миокарда, мерцательная аритмия.
Place of angiotensin II receptor antagonists in arterial hypertension therapy
Angiotensin II receptor antagonists (ARA) established their position recently duet to new indications above arterial hypertension (HT). These are chronic heart failure, history of myocardial infarction, atrial fibrillation and metabolic syndrome. Analysis of evidence basis, including recently published biggest international clinical studies, was performed in the article. Data demonstrate that ARA can be effectively and safely used in wide clinical practice for improvement of life quality and life prolongation in patients with HT.
Key words: angiotensin II receptor antagonists, ACE inhibitors, arterial hypertension, myocardial infarction, atrial fibrillation.
Что послужило основанием для написания статьи
На первый взгляд, тема статьи неожиданна и даже несколько надуманна. Действительно, в течение последних лет блокаторы рецепторов ангиотензина II (БРА) существенно упрочили свои позиции в плане расширения показаний при лечении артериальной гипертензии (АГ). Так, в Рекомендациях Европейского общества артериальной гипертензии/Европейского общества кардиологов 2007 года [1] в сравнении с версией данного документа от 2003 года количество конкретных клинических ситуаций, которые могут рассматриваться как специальные показания к назначению, увеличилось с четырех до восьми (табл. 1). Появились такие новые показания, как хроническая сердечная недостаточность, перенесенный инфаркт миокарда, фибрилляция предсердий и метаболический синдром. При сравнении перечня показаний к назначению БРА при специальных клинических ситуациях с таковым для ингибиторов ангиотензинпревращающего фермента (ИАПФ) очевидно, что у последних осталось преимущество только по трем позициям: дисфункция левого желудочка, недиабетическая нефропатия и каротидный атеросклероз. Кроме того, у БРА есть собственное очень значимое достоинство - существенно лучшая переносимость, главным образом в том, что они в отличие от ИАПФ не вызывают кашель. Это свойство - важнейшее условие повышения приверженности к терапии, которая, как известно, при применении БРА является наилучшей среди всех антигипертензивных препаратов. Таким образом, в настоящее время БРА наряду с ИАПФ - классы антигипертензивных препаратов с наибольшим перечнем показаний. Более того, результаты исследования JIKEY HEART study [2], где было показано, что валсартан среди прочих фактов успешного влияния на вторичные точки снижает вероятность госпитализаций по поводу стенокардии и хронической сердечной недостаточности (ХСН), а также уменьшает вероятность расслоения аорты, позволяют полагать, что есть основание для проведения исследований по изучению перспективы дальнейшего расширения перечня показаний для данного класса препаратов.
Таблица 1. Показания к назначению ИАПФ и БРА при лечении АГ
| ИАПФ | БРА | ||
| 1. | ХСН | 1. | ХСН |
| 2. | Дисфункция ЛЖ | 2. | Перенесенный ИМ |
| 3. | Перенесенный ИМ | 3. | Диабетическая нефропатия |
| 4. | Диабетическая нефропатия | 4. | МАУ/протеинурия |
| 5. | Недиабетическая нефропатия | 5. | ГЛЖ |
| 6. | ГЛЖ | 6. | Фибрилляция предсердий |
| 7. | Каротидный атеросклероз | 7. | Метаболический синдром |
| 8. | МАУ/протеинурия | 8. | Кашель при приеме ИАПФ |
| 9. | Фибрилляция предсердий |   |   |
| 10. | Метаболический синдром |   |   |
Вместе с тем, недавно опубликованные результаты двух крупных исследований TRANSCEND [3] и PRoFESS [4] по изучению эффективности БРА в сравнении с плацебо послужили причиной обсуждения вопроса об их месте в перечне антигипертензивных средств, применяемых для терапии пациентов с высоким риском сердечно-сосудистых заболеваний и осложнений. Кроме того, поскольку перечень показаний для назначения БРА фактически полностью входит в таковой для ИАПФ, нередко поднимается вопрос об их сравнительной эффективности - действительно ли это равнозначные препараты или какой-то класс имеет большие преимущества? Это важно еще и потому, что в Европейских Рекомендациях 2007 года в силу отсутствия на момент их выхода в свет доказательной базы проведен анализ сравнения эффективности БРА с другими классами антигипертензивных средств, но не с ИАПФ. Безусловно, необходимо провести сопоставление эффективности БРА и с другими классами антигипертензивных препаратов.
В 2004 году в редакционной статье в BMJ S. Verma и M. Strauss [5] впервые был поднят вопрос о возможно меньшей эффективности БРА по сравнению с другими классами антигипертензивных препаратов в плане профилактики инфарктов миокарда. В дальнейшем тщательный анализ показал несостоятельность данного утверждения, о чем было совершенно определенно заявлено в Европейских Рекомендациях по АГ 2007 года. Тем не менее, публикация [5] имела известный резонанс, поэтому в задачи данной статьи входит обсуждение и этого вопроса.
И, наконец, в статье планируется проанализировать еще один вопрос. Каким образом блокада компонентов ренин-ангиотензин-альдостероновой системы с помощью БРА и ИАПФ позволяет снижать вероятность развития первых и повторных эпизодов мерцательной аритмии даже с большей эффективностью, чем с помощью бета-адреноблокаторов, относящихся к IV классу антиаритмических препаратов, как это было показано в отношении БРА лозартана в исследовании LIFE?
БРА против плацебо
В первую очередь, необходимо в очередной раз представить результаты хорошо известного исследования SCOPE, в котором у пожилых пациентов (возраст более 70 лет) с АД более 160/90 мм рт.ст. к базовой терапии (гидрохлортиазид 1 2,5 мг) после рандомизации добавлялись БРА кандесартан или плацебо [6]. На фоне терапии кандесартаном происходило более выраженное снижение АД по сравнению с плацебо, что сопровождалось достоверным уменьшением частоты нефатальных инсультов. В среднем, снижение АД на 22/6 мм рт.ст. на фоне терапии, включающей БРА и на 20/5 мм рт.ст. на фоне базовой гипотензивной терапии (гидрохлортиазид 1 2,5 мг) плюс плацебо, число фатальных/нефатальных инсультов составило 20 и 35 в группе кандесартана и в группе плацебо, соответственно (относительный риск 0,58, 95% ДИ 0,33-1,0, р=0,05). Строго говоря, в этом исследовании не было прямого сравнения БРА с плацебо, так как пациенты обеих групп принимали другие антигипертензивные препараты в качестве базисного лечения. Тем не менее, безусловно, фактор подключения к терапии БРА позволял достоверно повысить гемодинамическую и клиническую эффективность лечения.
Результаты исследования TRANSCEND, включавшего 5 926 человек с высоким риском развития сердечно-сосудистых осложнений и не переносящих ИАПФ (кашель), были представлены совсем недавно - в начале осени 2008 года [3]. В данном исследовании пациенты были рандомизированы в группы телмисартана в суточной дозе 80 мг (N=2954) или плацебо (N=2972). АГ страдали около 76% всех включенных в исследование пациентов, у 45,8% больных в анамнезе были указания на перенесенный инфаркт миокарда, 35,6% - страдали сахарным диабетом. Важно отметить, что телмисартан или плацебо присоединялись к базовой терапии бета-адреноблокаторами (59,3% и 57,2%, соответственно), диуретиками (33,2% и 33,8%, соответственно), антагонистами кальциевых каналов (39,9% и 40,4%, соответственно), антитромбоцитарными препаратами (79,8% и 79%, соответственно) и статинами (55,7% и 54,7%, соответственно). Через 56 месяцев лечения средние значения систолического и диастолического АД были ниже в группе телмисартана в сравнении с группой плацебо (на 4,0 и 2,2 мм рт.ст., соответственно). Тем не менее, сердечнососудистая смертность, число инфарктов миокарда, инсультов и частота госпитализации по поводу сердечной недостаточности (первичная конечная точка) встречались примерно с равной вероятностью в обеих группах: в 465 случаях (15,7%) в группе телмисартана и в 504 случаях (17%) в группе плацебо (hazard ratio 0,92, 95% ДИ 0,81-1,05, р=0,216). После удаления из структуры данной точки компонента "частота госпитализаций по поводу сердечной недостаточности" величина hazard ratio заметно снижалась, но все-таки не достигала уровня статистической значимости. Так, сердечно-сосудистая смертность, число инфарктов миокарда и инсультов (вторичная конечная точка) отмечались у 384 пациентов (13%) в группе телмисартана и 440 (14,8%) в группе плацебо (hazard ratio 0,87, 95% ДИ 0,76-1,00, р=0,065). Телмисартан по сравнению с плацебо достоверно снижал лишь частоту госпитализаций по поводу сердечно-сосудистых заболеваний (30,3% против 33% соответственно, hazard ratio 0,92, 95% ДИ 0,85-0,99, р=0,025).
Почему же исследование TRANSCEND оказалось не таким успешным, как исследование SCOPE? Во-первых, надо отметить, что в этих исследованиях различались первичные конечные точки. Задачи TRANSCEND предполагали изучение влияния на комбинированную точку, а SCOPE - только на вероятность развития инсультов. Во-вторых, в исследовании TRANSCEND 24% больных не имели АГ, и в этом случае речь шла не об антигипертензивной терапии, а скорее о регулировании уровня АД и об органопротекции. В этой части идеология TRANSCEND напоминает концепцию успешных исследований HOPE и EUROPA, в которых, безусловно, было большее число лиц с нормальным АД (около 53 % пациентов в HOPE и около 73% пациентов в исследовании EUROPA) и включение больных, главным образом, происходило по принципу наличия высокого сердечно-сосудистого риска. В связи с этим можно сказать, что итоги TRANSCEND пока не подтверждают наличие у БРА телмисартана способности по снижению вероятности сердечно-сосудистых осложнений у больных с высоким риском без АГ, сопоставимой с ИАПФ рамиприлом и периндоприлом. Хотя это только предположение и для более точного суждения требуется детальный анализ результатов указанных исследований или, еще лучше, организация специальных исследований. И, наконец, третье, и самое главное. Практически все больные в исследовании TRANSCEND до его начала получали современную полноценную кардио- и церебропротективную терапию, тогда как в исследовании SCOPE основу терапии до его старта составляли, главным образом, диуретики и бета-адреноблокаторы. То есть задача TRANSCEND была существенно сложнее: получить дополнительный эффект на фоне практически полноценной современной терапии. Кстати, подобная ситуация наблюдается в целом ряде исследований, заканчивающихся в последнее время.
В ещё одном недавно закончившемся исследовании (PRoFESS) изучалось влияние этого же БРА телмисартана на частоту повторных острых нарушений мозгового кровообращения (ОНМК) [4]. Более 20 000 пациентов с недавно перенесенным ишемическим ОНМК были рандомизированы в группы телмисартана (80 мг/сутки, N=10146) или плацебо (N = 10186). Так же, как и в исследовании TRANSCEND, АГ имела место у трех четвертей (74%) пациентов. Сахарным диабетом 2-го типа страдали 28,5% пациентов, у 20,2% имел место атеросклероз различных локализаций. Больные в группе плацебо не получали ни ИАПФ, ни БРА. Средний период времени от развития ОНМК до рандомизации составил 15 дней, длительность лечения -2,5 года. АД в группе телмисартана в конце исследования оказалось на 3,8/2,0 мм рт. ст. ниже, чем в группе плацебо. При этом повторный инсульт был зарегистрирован у 880 пациентов (8,7%) в группе телмисартана и 934 пациентов (9,2%) в группе плацебо (ОШ 0,95, 95% ДИ 0,86-1,04, р=0,23). Главные сердечнососудистые события, такие как сердечно-сосудистая смертность, повторный ОНМК, инфаркт миокарда (ИМ), возникновение или прогрессирование ХСН (комбинированная вторичная конечная точка), возникали у 1 367 (13,5%) в группе телмисартана и у 1 463 (14,4%) в группе плацебо (ОШ 0,94, 95% ДИ 0,871,01, р=0,11). Логика рассуждений по поводу сравнения итогов PRoFESS и SCOPE аналогична таковой в отношении сопоставления TRANSCEND и SCOPE.
Нарушая хронологию окончания исследований, далее целесообразно проанализировать итоги исследований RENAAL [7] и IDNT [8]. В этих плацебоконтролируемых исследованиях у пациентов с АГ в сочетании с сахарным диабетом 2-го типа, имеющих проявления нефропатии, присоединение к многокомпонентной терапии, соответственно, лозартана и ирбесартана замедлило прогрессирование почечной недостаточности (первичная конечная точка). В то же время в ходе данных исследований не было получено статистически значимого снижения числа сердечно-сосудистых осложнений (вторичные конечные точки). Справедливости ради необходимо отметить, что эти исследования не включали необходимого числа больных, чтобы получить в заданные временные интервалы достоверные различия, то есть не были для этого достаточно "мощными". Тем не менее, когда эти две работы были проанализированы совместно в рамках мета-анализа, было обнаружено достоверное снижение сердечнососудистой смертности в группах БРА.
Таким образом, можно заключить, что результаты SCOPE в отношении предупреждения развития инсультов, RENAAL и IDNT в плане нефропротекции, а совокупность результатов двух последних исследований и в отношении снижения вероятности сердечнососудистой смертности, безусловно, свидетельствуют о преимуществе БРА над плацебо. И даже итоги TRANSCEND и PRoFESS, несмотря на их, казалось бы, отрицательные результаты, все-таки не позволяют безапелляционно заявлять, что БРА не превышают по своей эффективности плацебо в плане влияния на значительные сердечно-сосудистые осложнения.
БРА против ИАПФ
Наиболее крупным исследованием, где осуществлялось прямое сопоставление эффектов ИАПФ и БРА у больных АГ, является исследование ONTARGET [9]. В ONTARGET были включены пациенты с высоким риском развития сердечно-сосудистых заболеваний, которые после рандомизации были разделены на три группы: 8 576 получали 10 мг/сут рамиприла, 8 542 - 80 мг/сут телмисартана и 8 501 - оба препарата. В результате исследования АД в группе талмисартана было на 0,9/0,6 мм рт.ст. ниже, чем в группе рамиприла, и на 2,4/1,4 мм рт.ст. ниже, чем в группе комбинированного лечения. Первичная конечная точка (сердечно-сосудистая смертность, инфаркт миокарда, инсульт и госпитализация по поводу сердечной недостаточности) через 56 месяцев лечения зарегистрирована у 16,5% пациентов в группе рамиприла, 16,7% в группе телмисартана и 16,7% в группе комбинированного лечения (отношение шансов 1,01, 95% ДИ 0,94-1,09). В группе комбинированного лечения по сравнению с группой рамиприла достоверно чаще отмечались симптомы гипотонии (4,8% против 1,7%, р<0.001), синкопальные состояния (0,3% против 0,2%, р=0,03) и нарушения функции почек (13,5% против 10,2%, р<0.001). Авторы делают вывод о равной эффективности телмисартана и рамиприла и отсутствии преимуществ комбинированной терапии.
В части мета-анализа BPLTTC (Blood Pressure Lowering Treatment Trialists collaboration) 2005 г., посвященной непрямому сравнению эффектов ИАПФ и БРА у больных АГ, использовались результаты 16 исследований, где изучались иАПФ (AASK, ABCD (H), ABCD (N), ALL-HAT, ANBP2, CAPPP, DIAB-HYCAR, EUROPA, HOPE, JMIC-B, PART2, PEACE, PROGRESS, SCAT, STOP-2, UKPDS-HDS, всего 104 933 больных), и 5 исследований, где изучались БРА (IDNT, LIFE, RENAAL, SCOPE, VALUE, всего 32603 больных) [10]. Согласно результатам этого мета-анализа, при использовании ИАПФ и БРА наблюдается равная возможность предупреждения инсультов (р = 0,6) и профилактики ХСН (р = 0,9). По данным BPLTTC-2005, БРА достоверно уступают ИАПФ в плане профилактики развития осложнений ИБС (р =0,001) [10].
Результаты ряда крупных международных недавно опубликованных исследований по сравнительному изучению влияния БРА против ИАПФ на риск инфаркта миокарда, инсульта, сердечно-сосудистую и общую смертность легли в основу опубликованного летом 2008 года мета-анализа G. Reboldi et al. [11]. Авторы включили в анализ 6 крупных исследований, объединивших базы более 49 900 пациентов, среди которых были DETAIL, ELITE, ELITE-II, ONTARGET, OPTIMAAL и VALIANT. Не было обнаружено достоверных различий между БРА и ИАПФ по риску ИМ (ОШ 1,01, 95% ДИ 0,95-1,07, р=0,75), сердечно-сосудистой смертности (ОШ 1,03, 95% ДИ 0,98-1,08. р=0,23) и общей смертности (ОШ 1,03, 95% ДИ 0,97-1,1, р=0,20). Относительный риск развития ОНМК был достоверно ниже в группе БРА (ОШ 0,92, 95% ДИ 0,85-0,99, р=0,037).
В итоге авторы мета-анализа делают обоснованный вывод о сопоставимой эффективности БРА и ИАПФ по влиянию на риск возникновения ИМ, сердечно-сосудистой и общей смертности и о большей эффективности БРА по сравнению с ИАПФ в плане влияния на риск возникновения ОНМК [11]. Важно отметить то, что эффективность БРА по предупреждению повторных инсультов была доказана и при сравнении с другими классами антигипертензивных средств.
БРА против других антигипертензивных препаратов
Одним из важнейших исследований, обеспечивших доказательную базу БРА по их месту в антигипертензивной терапии, является исследование LIFE [1 2]. В LIFE было проведено прямое сравнение эффективности БРА с бета-адреноблокатором атенололом, то есть представителем того класса препаратов, которые вместе с диуретиками к моменту начала исследования обеспечивали доказательную базу эффективности антигипертензивной терапии в целом. В данном исследовании, включавшем более чем 9 000 пациентов с АГ и ЭКГ-критериями гипертрофии миокарда левого желудочка (ГЛЖ), среднее АД было снижено одинаково как в группе лозартана, так и в группе атенолола. Через 5 лет лечения лозартаном было отмечено достоверное (на 13%) снижение числа главных сердечно-сосудистых событий (первичная конечная точка), при этом количество ИМ значимо между группами не отличалось, тогда как число инсультов было на 25% ниже в группе лозартана.
В исследовании MOSES [13] у 1 500 пациентов с АГ было проведено сравнение между эпросартаном и блокатором кальциевых каналов (БКК) нитрендипином. Через 2,5 года лечения при сопоставимом, как и в исследовании LIFE, снижении АД сердечно-сосудистые события возникали достоверно реже в группе эпросартана, при этом частота инсультов снижалась в основном за счет повторных ОНМК.
Наиболее крупным исследованием по прямому сравнению БРА (валсартана) с другим антигипертензивным препаратом (БКК амлодипин) у пациентов с АГ и высоким риском сердечно-сосудистых осложнений является двойное слепое рандомизированное исследование VALUE, включавшее более 1 5 000 пациентов [14]. Через 5 лет лечения различий по первичной точке - эффективности предупреждения сердечно-сосудистой заболеваемости и смертности - получено не было. При этом вероятность фатальных и нефатальных кардиальных событий в группе БРА в случае достижения целевого уровня АД в сравнении с больными, у которых не был достигнут целевой уровень, АД снизилось на 24% (р<0,01) и на 27% в группе БКК (р<0,01), фатального и нефатального инсульта - на 40% в группе
БРА (р<0,01) и на 50% в группе БКК (р<0,01), госпитализации по поводу ХСН - на 38% в группе БРА (р<0,01) и на 36% в группе БКК (р<0,01), риск смерти от любой причины уменьшился в равной степени в обеих группах - на 21% (р<0,01). Ни БРА, ни БКК не показали достоверной способности снижать риск инфаркта миокарда [14].
Таким образом, прямое сопоставление БРА лозартана с бета-блокатором атенололом и БРА эпросартана с БКК нитрендепином при равной степени снижения АД продемонстрировало их убедительное преимущество в плане достижения клинических эффектов. Сравнение БРА валсартана с другим БКК - амлодипином - показало практически одинаковую гемодинамическую и клиническую эффективность.
В исследованиях SCOPE, IDNT и JIKEY HEART БРА сравниваются с произвольными вариантами антигипертензивной терапии. При этом, поскольку SCOPE и IDNT являются плацебоконтролируемыми исследованиями, они уже были подвергнуты анализу в соответствующем разделе данной статьи (см.выше).
В исследовании JIKEY HEART у более чем 3000 жителей Японии с АГ и высоким риском сердечно-сосудистых осложнений (ИБС, сердечная недостаточность, сахарный диабет или множественные факторы риска) наличие в программе лечения БРА валсартана привело к снижению АД на 8,2/4,7 мм рт.ст., тогда как при произвольной антигипертензивной терапии без подключения валсартана - на 7,2/3,7 мм рт.ст. [2]. Через 3 года лечения отмечено снижение вероятности развития сердечно-сосудистой заболеваемости и смертности (первичная точка) на 39% (р=0,0002). Кроме того, в пользу валсартана говорят обнаруженные достоверные преимущества по нескольким вторичным точкам: значимое снижение частоты первичных и повторных инсультов (- 40%, р=0,028), госпитализации по причине ХСН (- 47%, р=0,029), госпитализации по причине стенокардии (- 65%, р=0,0001), случаев расслоения аорты (- 81%, р=0,034).
БРА и риск инфаркта миокарда
Как уже говорилось, впервые вопрос об увеличении риска развития инфаркта миокарда при применении БРА был поставлен в 2004 году в статье S. Verma и M. Strauss [5]. В данной статье, которая носит аналитический характер, но, строго говоря, не является мета-анализом, используются результаты таких исследований, как VALUE, CHARM, SCOPE, LIFE, RENAAL и IDNT. При этом, собственно об ИМ там идет речь только в трех первых исследованиях, поскольку по поводу RENAAL и IDNT говорится то, что БРА (соответственно, лозартан и ирбесартан) не способствовали снижению частоты не только ИМ, но и сердечно-сосудистой смертности в целом. Хотя, как уже обсуждалось выше, анализ объединенных результатов двух этих исследований показал позитивное влияние плацебоконтролируемой терапии БРА в сравнении с терапией АГ без БРА в отношении снижения сердечно-сосудистого риска.
В отношении крупного исследования LIFE S. Verma и M. Strauss [5] указывают, что БРА лозартан в сравнении с бета-блокатором атенололом не уменьшал риск ИМ, несмотря на большее (на 1,7 мм рт.ст.) снижение систолического АД.
По поводу итогов исследования SCOPE авторы данной статьи вполне справедливо отмечают, что при терапии кандесартаном плюс 12,5 мг гидрохлортиазида достоверно в большей степени по сравнению с плацебо плюс 1 2,5 мг гидрохлортиазида происходило снижение АД (- 3,2/1,6 мм рт.ст.), но при этом в группе, получающей БРА, наблюдалось большее количество ИМ (+10%), однако эта разница не была достоверной (р>0,05). Однако в отношении результатов программы CHARM выводы S. Verma и M. Strauss о том, что терапия БРА кандесартаном повышает риск развития ИМ в полной мере справедливыми назвать нельзя [5].
Дело в том, что рандомизированное двойное слепое плацебоконтролируемое исследование CHARM-Alternative (2 028 больных), проводимое в рамках программы CHARM, своей целью ставило изучение эффективности БРА кандесартана в отношении влияния на сердечно-сосудистую смертность и необходимость госпитализаций по поводу сердечной недостаточности у больных с ХСН функционального класса (средняя величина фракции выброса составила 30%), ранее не получавших ИАПФ. Больных с АГ в данном исследовании было 50%, при этом 61 % пациентов ранее уже перенесли ИМ. На фоне терапии кандесартаном , действительно, наблюдалось большее количество ИМ (+36%), но при этом происходило высокодостоверное снижение вероятности сердечно-сосудистой смерти и необходимости госпитализаций по поводу ХСН на 23% (р<0,0004). Но главное то, что, в целом, в рамках программы CHARM (7 599 больных), в которую входили также исследования CHARM-Preserved (2 548 больных с сохраненной систолической функцией левого желудочка) и CHARM-Added (3 023 больных с фракцией выброса левого желудочка 28%, одновременно получавших БРА+ИАПФ), было зафиксировано 176 случаев ИМ на фоне терапии кандесартаном и 190 на фоне плацебо (разница 8%).
Наконец, комментарии по поводу первого аргумента, который S. Verma и M. Strauss используют в своей статье об исследовании VALUE. Авторы отмечают, что на фоне применения БРА валсартана фатальный и нефатальный ИМ развивались достоверно чаще (на 19%), чем на фоне терапии амлодипином. Но при этом не указывается, что в случае достижения целевого уровня АД валсартан снижал вероятность ИМ на 17%, а амлодипин - только на 9% [14].
К сожалению, несмотря на явную недостаточность фактов, S. Verma и M. Strauss делают вывод об увеличении риска ИМ на фоне терапии БРА [5]. Неслучайно в следующем году (2005) в том же журнале был опубликован комментарий J. McMurray, название которого в переводе звучало буквально следующим образом: "БРА и инфаркт миокарда: анализ доказательной базы неполный и неточный" [15]. В качестве аргументов J. McMurray, анализируя статью S. Verma и M. Strauss, приводит целый ряд доводов. В частности, он указывает, что авторы не включили в свой анализ данные исследований, в которых было зафиксировано наибольшее количество случаев развития ИМ - OPTIMAAL (379 случаев на фоне терапии каптоприлом и 384 на фоне лозартана, разница 1,3%) и VALIANT (559 на фоне каптоприла и 587 на фоне валсартана, разница 5%). Кроме того, J. McMurray обращает внимание, что S. Verma и M. Strauss, упоминая в своей статье исследование RENAAL, не указывают, что на фоне приема лозартана количество ИМ имело место у 50 больных, а на фоне плацебо - у 68 (разница 36%).
И, наконец, в том же 2005 году и опять в BMJ был опубликован систематический обзор, в котором M. McDonald et al. [16] убедительно показали отсутствие повышения риска ИМ на фоне БРА. Выводы этих авторов опираются не на обсуждение результатов отдельных исследований, а на результаты большого мета-анализа. Анализ включил все исследования по изучению эффективности БРА, где они применялись хотя бы в одной их ветви и где оценивалась вероятность развития ИМ в качестве конечной точки или побочных эффектов в сравнении с плацебо или с ИАПФ. Авторы анализировали следующие исследования: SCOPE (кандесартан), RENAAL (лозартан), IDNT (ирбесартан), DETAIL (телмисартан), ARCH-J (кандесартан), CHARM (кандесартан), SPICE (кандесартан), Val-HeFT (валсартан), ELITE (лозартан), HEAVEN (валсартан), REPLACE, OPTIMAAL (лозартан). Принципиальная особенность данного систематического обзора и разница с публикацией S. Verma и M. Strauss состоит в том, что M. McDonald et al. не включили в свой анализ такие исследования, как LIFE и VALUE, в связи с отсутствием в этих работах плацебо или ИАПФ в качестве группы сравнения.
В рамках изучения способности БРА и плацебо влиять на вероятность ИМ был проведен анализ двух исследований у пациентов с АГ, трех исследований у пациентов с сахарным диабетом и нефропатией и шести с ХСН (10 656 пациентов получали БРА и 10 406 - плацебо). Было обнаружено, что ИМ развивался у 436 пациентов (4,09%) в группе БРА и 450 (4,32%) - в группе плацебо (отношение шансов 0,94, 95% ДИ 0,75-1,16). Авторами также был проведен сравнительный анализ по влиянию БРА на риск развития ИМ по сравнению с ИАПФ в одном исследовании по АГ, в одном - с сахарным диабетом и нефропатией и в четырех - с ХСН. Среди 5 406 пациентов в группе БРА инфаркт миокарда развился у 435 (8,05%), тогда как в группе ИАПФ (5 219 пациентов) ИМ развился в 433 (8,3%), ОШ 1,01, 95% ДИ 0,87-1,16. В конце статьи M. McDonald et al. делают совершенно обоснованный вывод о том, что применение БРА не увеличивает риск возникновения инфаркта миокарда, и таким образом ставят точку в данном вопросе [16].
К самым последним данным можно отнести результаты исследования TRANSCEND [3], где было показано, что на фоне применения БРА телмисартана в сравнении с плацебо снижается риск развития ИМ на 21% (р=0,059).
БРА и риск развитии мерцательной аритмии
В 2005 году был опубликован мета-анализ рандомизированных клинических исследований, задачей которого было определение влияния ИАПФ и БРА на частоту возникновения пароксизмов мерцательной аритмии (МА) [17]. В анализ вошло одиннадцать исследований, включавших 56 308 пациентов: четыре исследования по поводу лечения ХСН, три по АГ, два у пациентов после кардиоверсии по поводу МА и два по поводу терапии ИМ. В целом, ИАПФ и БРА снижали относительный риск МА на 28% (95% ДИ 15%-40%, р=0,0002). Уменьшение частоты МА было сходным между двумя группами препаратов (ИАПФ: 28%, р=0,01; БРА: 29%, р=0,00002) и было наибольшим в исследованиях с кардиоверсией (снижение относительного риска на 48% (95% ДИ 21 %-65%) и у пациентов с ХСН (снижение относительного риска = 44%, р=0,007).
Интересно то, что достоверного снижения частоты МА у пациентов с АГ при применении ИАПФ и БРА в целом обнаружено не было (снижение относительного риска =1 2%, р=0,4). Эффективность ИАПФ и БРА у больных АГ изучалась в исследованиях CAPPP (каптоприл, - 13%, р>0,05), STOP-H2 (эналаприл, + 1 2%, р>0,05) и LIFE (лозартан). LIFE оказалось единственным исследованием, где было обнаружено снижение риска МА у пациентов с АГ (все они имели гипертрофию миокарда левого желудочка) на фоне терапии БРА лозартаном. Важно то, что лозартан оказался эффективнее в сравнении с антиаритмиком, бета-блокатором атенололом: вероятность МА на фоне терапии БРА снижалась на 29% (р<0,001).
Кроме исследования LIFE, эффективность БРА в плане предупреждения МА изучалась еще в трех исследованиях. В программе CHARM кандесартан у больных с ХСН показал достоверное снижение вероятности МА у больных с ХСН на 18% [18], в исследовании ValHeFT валсартан у больных с ХСН продемонстрировал высокодостоверное уменьшение риска МА тоже у больных с ХСН на 33% [19]. И, наконец, в небольшом исследовании, включавшем 154 больных с персистирующей формой МА, применение ирбесартана достоверно способствовало повышению эффективности поддержания синусового ритма на 61% [20].
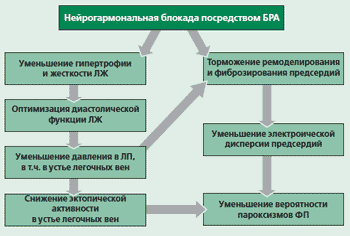
На первый взгляд, способность БРА лозартана снижать риск развития МА у больных АГ не очень понятна. Но с учетом современных представлений о патогенезе МА многое становится достаточно очевидным. На рис. 1 представлены возможные механизмы предотвращения развития МА на фоне применения БРА у больных АГ Хорошо доказано, что гипертрофия левого желудочка (ГЛЖ), как и увеличенные размеры левого предсердия, является прямым независимым фактором развития МА. Торможение или, тем более, уменьшение выраженности ГЛЖ на фоне терапии БРА и ИАПФ способствует оптимизации диастолической функции левого желудочка и вторично снижению давления в устье легочных вен, что. в свою очередь, возможно, уменьшает вероятность повышения там эктопической электрической активности, которая, как известно, выступает высоко значимым фактором провокации МА. Кроме того, и снижение давления в левом предсердии, и прямое торможение его геометрического и электрического ремоделирования на фоне терапии БРА и ИАПФ способствуют уменьшению в нем электрической дисперсии и уменьшению вероятности развития МА.
Рис.1. Возможные механизмы предотвращения развития мерцательной аритмии на фоне применения БРА при АГ
Заключение
Как известно, современный антигипертензивный препарат должен не только снижать уровень АД, но и положительно влиять на поражение органов-мишеней, а главное - снижать вероятность развития инсультов, инфаркта миокарда, сердечно-сосудистой смерти и смерти от всех причин. Анализ имеющейся доказательной базы, в том числе с учетом опубликованных недавно результатов крупнейших международных исследований, свидетельствует, что БРА может безопасно и эффективно применяться в широкой клинической практике для увеличения продолжительности и качества жизни у пациентов с АГ. Литература
1. ManciaG, De Backer G, Dominiczak A, et al. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007;25:1 105-87.
2. Mochizuki S, Dahl f B, Shimizu M, et al. Valsartan in a Japanese population with hypertension and other cardiovascular disease (Jikei Heart Study): a randomised, open-label, blinded endpoint morbidity-mortality study. Lancet 2007;369:1431 -9.
3. The Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial. Lancet 2008;372:1174-83.
4. Yusuf S, Diener HC, Sacco RL, et al. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008;359:1225-37.
5. Verma S, Strauss M. Angiotensin receptor blockers and myocardial infarction. BMJ 2004;329:1248- 9.
6. Papademetriou V, Farsang C, Elmfeldt D, et al. Stroke prevention with the angiotensin II type 1 -receptor blocker candesartan in elderly patients with isolated systolic hypertension: the Study on Cognition and Prognosis in the Elderly (SCOPE). J Am Coll Cardiol. 2004;44(6):1175-80.
7. Brenner BM, Cooper ME, de Zeeuw D, et al. RENAAL Study Investigators. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001;345:861-9.
8. Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001;345:851- 60.
9. ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med. 2008;358(15):1547-59.
10. Turnbull F, Neal B, Algert C, et al. Blood Pressure Lowering Treatment Trialists' Collaboration. Effects of different blood pressure-lowering regimens on major cardiovascular events in individuals with and without diabetes mellitus: results of prospectively designed overviews of randomized trials. Arch Intern Med. 2005;165(12):1410-9.
11. Reboldi G, Angeli F, Cavallini C, et al. Comparison between angiotensin-converting enzyme inhibitors and angiotensin receptors blockers on the risk of myocardial infarction, stroke and death: a meta-analysis. J Hypertens 2008,26:1282-9.
12. Dahlof B, Devereux RB, Kjeldsen SE, et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002;359:995-1003.
13. Schrader J, L ders S, Kulschewski A, et al. Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention: principal results of a prospective randomized controlled study (MOSES). Stroke 2005;36:1218-26.
14. Julius S, Kjeldsen SE, Weber M et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimes based on valsartan or amlodipine: the VALUE randomized trial. Lancet 2004;363:2022-31.
15. McMurray J. Angiotensin receptor blockers and myocardial infarction: analysis of evidence is incomplete and inaccurate [letter]. BMJ 2005;330;1269.
16. McDonald MA, Simpson SH, Ezekowitz JA, et al. Angiotensin receptor blockers and risk of myocardial infarction: systematic review. BMJ 2005;331;873-9.
17. Healey JS, Baranchuk A, Crystal E, et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005;45:1832-9.
18. Ducharme A, Swedberg K, Pfeffer MA, et al. Prevention of atrial fibrillation in patients with symptomatic chronic heart failure by candesartan in the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) program. Am Heart J. 2006;152(1):86-92.
19. Maggioni AP, Latini R, Carson PE, et al. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val-HeFT). Am Heart J. 2005;149(3):548-57.
20. Madrid AH, Bueno MG, Rebollo JM, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002;106:331-6.
