Возможности применения комплексных пробиотических препаратов для профилактики диареи, связанной с приемом антибиотиков
Статьи Опубликовано в журнале:Архивъ внутренней медицины Friedrich C. Lang*
Отделение хирургии регионального госпиталя Терменрегиона, округ Нойнкирхен, Австрия
Перевод под редакцией Ю.Б. Белоусова
Резюме
К проблеме предупреждения и коррекции нежелательных явлений антибиотикотерапии обращено внимание исследователей всего мира. Особое значение имеет выбор препарата для поддержания и восстановления нормального состава кишечной микрофлоры. Так, одно из последних исследований показало эффективность пробиотика, состоящего из 9 видов бактерий (B. bifidum W23, B. lactis W51, ранее известные как Bifidobacterium longum и Bifidobacterium lactis соответственно, E. faecium W54, L. acidophilus W37 и W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71, L. salivarius W24), 8 из которых входят в состав препарата РиоФлора Баланс (за исключением E. faecium). Применение пробиотика приводило к уменьшению частоты развития диареи у пациентов, принимавших антибиотики, до 0,5% (1 случай из 199 испытуемых). Комплексные пробиотики могут использоваться для первичной профилактики антибиотик-ассоциированной диареи, что существенно снижает затраты на лечение.
Ключевые слова: антибиотики, микрофлора кишечника, комплексные пробиотики, РиоФлора Баланс.
Антибактериальные препараты на современном этапе широко востребованы и используются в клинической практике. С открытием антибиотиков медицина получила новое мощное оружие для эффективной борьбы с ранее весьма опасными для жизни и здоровья заболеваниями. Однако для безопасного использования этого сильного арсенала от клинициста требуются дополнительные знания. Так, одним из часто встречающихся осложнений антибактериальной терапии является диарея, ассоциированная с нарушением баланса микрофлоры кишечника.
Микрофлора кишечника в норме и при антибиотикотерапии
Микробный пейзаж кишечника представляет собой сложную экосистему, представленную целым рядом видов бактерий, играющих важнейшую роль в поддержании здоровья. В частности, кишечная нормофлора подавляет рост патогенных микроорганизмов, участвует в синтезе ряда витаминов, поддерживает местный иммунитет и т.д. Состав микрофлоры кишечника каждого человека уникален и может рассматриваться как отличительный признак, обусловленный генетически, однако у одного и того же индивида в норме он остается относительно постоянным в течение всей жизни [1]. Определенные изменения могут происходить под влиянием изменения рациона, смены климатических поясов, стрессорных воздействий и, как известно, антибактериальной терапии, а также других факторов [2]. Это может приводить к снижению способности нормофлоры подавлять колонизацию патогенов [3] и активизации роста болезнетворных агентов [4].
Антибиотики оказывают воздействие не только на возбудителей, против которых направлена терапия, но и на нормальную эндогенную флору. В ряде случаев это приводит к развитию у пациентов антибиотик-ассоциированной диареи (ААД). Она может появляться как непосредственно на фоне приема антибиотика, так и отсрочено (вплоть до 8 недель после окончания лечения) [5, 6]. По имеющимся литературным данным, ААД регистрируется в 5-49% случаев в зависимости от разновидности назначенного антибиотика, качества диагностики и особенностей состояния пациента. По данным отдельных авторов, наиболее часто ААД отмечается при применении клиндамицина и цефалоспоринов, чуть реже — амоксициллина/клавуланата и прочих препаратов пенициллинового ряда [6]. При этом ААД регистрируется как в форме легкой диареи, так и в тяжелых клинических формах, например псевдомембранозного колита, вызванного Clostridium difficile. Считается, что ААД средней степени тяжести допустима в качестве нежелательного явления, лечения не требует и после отмены антибиотика исчезает самостоятельно. При этом нарушение экологии кишечника рассматривается как транзиторное явление.
Однако следует упомянуть, что в литературе также описаны случаи развития стойкого дисбаланса микробного пейзажа кишечника на фоне приема антибиотиков [7]. На необходимость учета возможности развития ААД также указывают данные, демонстрирующие в отдельных случаях появление риска развития госпитальных инфекций, ведущих к повышению заболеваемости и смертности, удлинению сроков госпитализации, а значит, и увеличению затрат на лечение пациентов [6]. Антибиотик-ассоциированный дисбиоз кишечника также повышает вероятность развития воспалительных заболеваний кишечника и истощения ресурсов иммунной системы в результате суперинфекции. Поэтому сохранение и восстановление нормофлоры сегодня является одной из приоритетных междисциплинарных задач практического здравоохранения. Приведены убедительные доказательства: пробиотики действительно восстанавливают нарушенный микробный пейзаж кишечника за счет пополнения его представителями нормальной кишечной флоры. Это, в свою очередь, способствует укреплению местного иммунитета [9-12]. Ряд метаанализов указывает на неоспоримые преимущества и необходимость назначения пробиотических препаратов совместно с антибиотиками (табл. 1) [21]. Однако большое значение имеет выбор конкретного препарата: как известно, пробиотики различаются своим составом. Есть данные, свидетельствующие о максимальной эффективности комбинированных пробиотических препаратов [22-24].
Эффективность комплексных пробиотиков
Особый интерес вызывает исследование эффективности комплексного пробиотика, проведенное в Австрии. Поводом к инициированию исследования послужил тот факт, что в последние годы в отделении общей хирургии Landesklinikum Thermenregion Neunkirchen (Австрия) наблюдали повышение частоты ААД. Степень тяжести ААД у пациентов была различной: от легкой до псевдомембранозного колита, спровоцированного Clostridium difficile. Кроме того, за последние годы возросла частота регистрации чрезвычайно тяжелых острых случаев ААД, которые в отдельных наблюдениях могут приводить к развитию мегаколон и перфорации кишечной стенки, что требует экстренного оперативного вмешательства. С повышением частоты случаев ААД увеличивались такие показатели, как:
В исследование были включены 199 пациентов (104 женщины и 95 мужчин), средний возраст участников испытания составлял 68 (20-98) лет. Продолжительность их стационарного лечения составляла от 2 до 56 дней (в среднем 13,9 дня). В течение периода наблюдения антибиотики назначались по следующим показаниям (инфекционные процессы): энтерит, колит, дивертикулит, холецистит, перитонит, пневмония, панкреатит, флегмонозный аппендицит, бронхит, абсцесс печени, холангит, рожистое воспаление, гангрена нижних конечностей на фоне сахарного диабета, хеликобактерный гастрит, инфекции мочевыводящего тракта, инфицированные трофические язвы, абсцессы, флегмона. Антибиотики применялись как в режиме монотерапии, так и в составе комбинированного лечения. Международные наименования (МНН) антибактериальных препаратов, которые назначались участникам исследования, приведены в табл. 2. Средняя продолжительность антибиотикотерапии (как энтеральной, так и парентеральной) составила 9,05 дня (2-33 дня).
Таблица 1
Данные метаанализов, свидетельствующие об эффективности пробиотиков для лечения и профилактики ААД
| Автор и год публикации | Масштаб | Выводы |
| Cremonini et al. 2002 [13] | 22 плацебо-контролируемых исследования | На гетерогенной выборке убедительно показано, что применение пробиотиков эффективно при ААД |
| D'Souza et al. 2002 [14] | 38 исследований | Показано профилактическое действие пробиотиков — эти препараты эффективно снижают риск развития ААД |
| Huang et al. 2002 [15] | 18 исследований (дети) | Применение пробиотиков приводит к снижению продолжительности острой диареи до 0,8 дня (р < 0,001) |
| Van Niel et al. 2002 [16] | 26 контролируемых исследований (дети) | Назначение пробиотиков приводит к снижению продолжительности острого периода ААД до 0,7 дня. Частота стула снижается до 1,6 раза в сутки уже на 2-й день терапии |
| Johnston et al. 2006 [17] | 6 исследований, 707 участников (дети) | Пробиотики существенно снижают риск развития ААД |
| Sazawal et al. 2006 [18] | 34 слепых рандомизированных плацебо-контролируемых исследования | Показан профилактический и лечебный эффект пробиотиков в отношении ААД. Авторы указывают, что назначение пробиотиков рекомендуется в самом начале антибактериальной терапии |
| Szajewska et al. 2006 [19] | 6 плацебо-контролируемых рандомизированных исследований, 766 участников (дети) | Авторы констатируют, что применение пробиотиков снижает частоту ААД на 52% в сравнении с плацебо |
| McFarland et al. 2006 [20] | 25 рандомизированных контролируемых исследований | Показано профилактическое действие пробиотиков в отношении развития ААД. Наилучшие результаты достигаются при использовании комплексных пробиотических препаратов |
Таблица 2
Распределение участников исследования в зависимости от вида назначенного антибиотика
| МНН антибиотика | Количество пациентов |
| Метронидазол | 67 |
| Цефуроксим | 31 |
| Фосфомицин | 27 |
| Цефтриаксон | 25 |
| Ампициллин + сулбактам | 23 |
| Амоксициллин | 18 |
| Кларитромицин | 17 |
| Амоксициллин + клавулановая кислота | 10 |
| Ванкомицин | 10 |
| Цефуроксим аксетил | 8 |
| Пиперациллин + тазобактам | 7 |
| Рифаксимин | 7 |
| Меропенем | 6 |
| Пенициллин G | 4 |
| Линезолид | 4 |
| Клиндамицин | 2 |
| Гентамицин | 1 |
| Эритромицин | 1 |
| Норфлоксацин | 1 |
| Рефобацина | 1 |
| Сульфаметоксазол + триметоприм | 1 |
| Цефтазидим | 1 |
| Моксифлоксацин | 1 |
Рисунок 1. Снижение частоты ААД при применении комплексного пробиотического препарата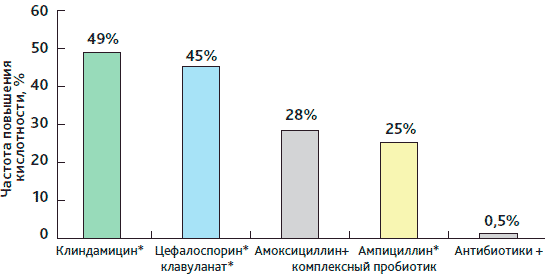
С марта 2007 г. все пациенты отделения общей хирургии Landesklinikum Thermenregion Neunkirchen, получавшие антибиотикотерапию, регулярно принимали комплексный пробиотический препарат вплоть до июня 2009 г. Всего за это время было назначено 15 000 упаковок лекарственного средства, что соответствует 7500 дням терапии. Средняя продолжительность назначения комплексного пробиотика составляла 10,08 дня (2-33 дня). За 6 мес. наблюдения (с ноября 2008 г. по май 2009 г.) были собраны данные о состоянии пациентов, принимавших антибиотики и комплексный пробиотик. Был проведен анализ частоты развития ААД на фоне приема пробиотика. Диареей считались случаи, когда у пациента отмечалось более 3 патологических дефекаций в сутки.
Всего за 6 мес. наблюдения антибиотики получал 201 пациент. Из них 199 получали 5 г комплексного пробиотика 2 раза в день. Два пациента были исключены из исследования, поскольку им забыли назначить пробиотик. Если рассматривать их как группу сравнения, не лишним будет упомянуть, что впоследствии у них развилась диарея, а у одного — псевдомембранозный колит.
В данном исследовании использовался пробиотик, состоящий из 9 видов бактерий (B. bifidum W23, B. lactis W51 ранее известные как Bifidobacterium longum и Bifidobacterium lactis соответственно, E. faecium W54, L. acidophilus W37 и W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 L. salivarius W24). Этот комплексный пробиотик использовался также в двойном слепом плацебо-контролируемом рандомизированном исследовании [25], в ходе которого изучался состав микрофлоры кишечника у здоровых добровольцев во время и после приема амоксициллина. Также изучалось влияние пробиотиков на метаболическую активность микрофлоры кишечника, ритмы дефекации и состояние местного иммунитета. Был показан положительный эффект комплексного пробиотического препарата.
8 из перечисленных видов бактерий входят в состав препарата РиоФлора Баланс (за исключением E. faecium). Благодаря специально отобранным бактериям в составе, препарат РиоФлора Баланс оказывает следующие эффекты:
Благодаря этому, назначение препарата РиоФлора Баланс на фоне антибиотикотерапии способствует снижению риска развития кишечных расстройств на трех уровнях:
Из 199 пациентов, получавших комплексный пробиотик, диарея развилась только у одного (рис. 1) в день выписки из стационара, спустя 10 дней после начала курсового введения пенициллина по поводу рожистого воспаления. Данный пациент отказался от дальнейшего лечения и покинул стационар. Один пациент (из 199 участников исследования), у которого развилась ААД, составляет 0,5% популяции. Эта цифра существенно ниже тех, что приводятся в литературе (напомним, что это 5-49%).
В приведенном исследовании на фоне введения комплексного пробиотика:
При этом за весь период лечения не было зарегистрировано случаев непереносимости комплексного пробиотика. Не отмечалось случаев досрочного прекращения терапии, а также не было обнаружено нежелательных явлений. Немаловажно, что применение комплексного пробиотика приводило к значительному снижению общих затрат на лечение, поскольку назначение этого препарата нивелировало необходимость в лечении ААД или колита, вызванного Clostridium difficile.
Все вышеизложенное позволяет рекомендовать комплексные пробиотические препараты (в частности, препарат РиоФлора Баланс, наиболее близкий по составу к тому лекарственному средству, которое с хорошими результатами использовали австрийские исследователи) для профилактики антибиотик-ассоциированной диареи.
ЛИТЕРАТУРА
1. Zoetendal E.G., Akkermans A.D. , De Vos W.M. (1998). Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria // Appl Environ Microbiol. 64 3854-3 859.
2. Isolauri E., Salminen S., Ouwehand A.C. (2004). Probiotics. Best practice & research // Clin Gastroenterol. 18 299-313.
3. Barza M., Giuliano M.,Jacobus N.V., Gorbach S.L. (1987). Effect of broad-spectrum parenteral antibiotics on «colonization resistance» of intestinal microflora of humans // Antimicrob Agents Chemother. 31 723-727.
4. Edlund C., Nord C.E. (2000). Effect on the human normal microflora of oral antibiotics for treatment of urinary tract infections // J Antimicrob Chemother. 46 (Suppl 1) 41-48.
5. Bartlett J.G. (1992). Antibiotic-associated diarrhea // Clin Infect Dis. 15 573-581.
6. McFarland L.V. (1998). Epidemiology, risk factors and treatments for antibiotic-associated diarrhea // Dig Dis. 16 292-307.
7. Jernberg C., Lufmark S., Edlund C., Jansson J.K. (2007). Long-term ecological impacts of antibiotic administration on the human intestinal microbiota // ISME J. 1 56-66.
8. Madden J.A., Plummer S.F., Tang J., Garaiova et al. (2005). Effect of probiotics on preventing disruption of the intestinal micro-flora following antibiotic therapy: a double-blind, placebo-controlled pilot study // Int Immunopharmacol. 5 1091-1097.
9. Hammer H.F. (2003). Schnellrepetitorium: Antibiotic associated diarrhoea (AAD) // J Gastroenterol Hepatol Erkr. 1 30-3 3.
10. Hammer H.F., Aichbichler B. (2003). Probiotika und Prabiotika; Grundlagen, Einsatz und Wirkung beim gesunden und kranken Menschen // J Ernahrungsmed. 5 1624.
11. Preidis G.A., VersalovicJ. (2009). Targeting the human microbiome with antibiotics, probiotics, and prebiotics: gastroenterology enters the metagenomics era. Special issue: Intestinal microbes in health and disease // Gastroenterol. 136 2015-2031.
12. Hugenauer C., Hammer H.F., Krejs G.J., ReisingerE.C. (1998). Mechanisms and management of antibiotic-associated diarrhea // Clin Infect Dis. 27 702-7 10.
13. Cremonini F., Di Caro S., Nista E.C., Bartolozzi F. et al. (2002). Metaanalysis: the effect of probiotic administration on antibiotic-associated diarrhea // Aliment Pharmacol Ther. 16 1461-1467.
14. D'Souza A.L., Rajkumar C., Cooke J., Bulpitt C.J. (2002). Probiotics in prevention of antibiotic associated diarrhoea: meta-analysis // BMJ. 324 1361.
15. HuangJ.S., Bousvaros A., Lee J.W., Diaz A., Davidson E.J. (2002). Efficacy of probiotic use in acute diarrhea in children: a meta-analysis // Dig Dis Sci. 47 2625-2634.
16. Van Niel C. W., Feudtner C., Garrison M.M., Christakis D.A. (2002). Lactobacillus therapy for acute diarrhea in children: a meta-analysis // Pediatrics. 109 678-684.
17. Johnston B.C., Supina A.L., Vohra S. (2006). Probiotics for pediatric antibiotic-associated diarrhea: a meta-analysis of randomized placebo-controlled trials // CMAJ. 175 377-38318.
18. Sazawal S., Hiremath G., Dhingra U., Malik P., Deb S., Black R.E. (2006). Efficacy of probiotics in prevention of acute diarrhoea: a meta-analysis of masked, randomized, placebo-controlled trials // Lancet Infect. Dis. 6 374-3 82.
19. Szajewska H., Ruszczynski M., Radzikowski A. (2006). Probiotics in the prevention of antibiotic-associated diarrhea in children: a meta-analysis of randomized controlled trials // J Pediatr. 149 367-372.
20. McFarland L.V. (2006). Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease // The J Gastroenterol. 101 8 12-822.
21. Hickson M., D'Souza A.L., Muthu N., Rogers T. R., Want S., Rajkumar C., Bulpitt C.J. (2007). Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial // BMJ. 335 80.
22. Timmerman H.M., Koning C.J., Mulder L., Rombouts F.M., Beynen A. C. (2004). Monostrain, multistrain and multi-species probiotics — a comparison of functionality and efficacy // Int J Food Microbiol. 96 219-233.
23. Steyer G.E. (2009). Multispezies-Probiotika der dritten Generation fur zeitgemabe Therapien. 50. Chirurgenkongress In: Universum Innere Medizin. 5 117.
24. Mulder L. (2008). A multispecies probiotic food supplement (Ecologic® 825) for IBD // NUTRA foods. 7 89-91.
25. Koning C.J., Jonkers D.M., Stobberingh E.E., Mulder L., Rombouts F.M., Stockbrugger R.W. (2008). The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxicillin // The Am J Gastroenterol. 103 178-189.
Комментарии
ПРАКТИКА ПЕДИАТРА
