Механизм действия препарата на основе LGG
СтатьиПредыдущая глава | Оглавление | Следующая глава
5. Механизм действия
Механизм действия L. rhamnosus GG объясняется в многочисленных исследованиях, проведенных как экспериментально, так и in vitro. Данные исследования объясняют, каким образом L. rhamnosus GG способен регулировать иммунный ответ, снижая, таким образом, частоту как желудоч-но-кишечных, так и респираторных инфекций (рисунок 11).
Рисунок 11. Ключевые элементы кишечного барьера и потенциальный механизм действия L. rhamnosus GG.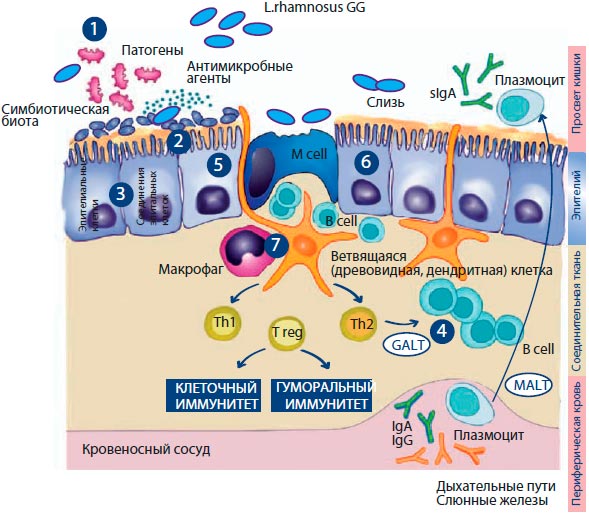
Проведенные экспериментальные исследования с участием животных демонстрируют, что прием L. rhamnosus GG замедляет рост введенного патогена в желудочно-кишечном тракте, транслокацию кишечных бактерий в ткани и внутренние органы, а также улучшает иммунную реакцию животных (Hudault et al., 1997; Lee et al., 2000; Naaber et al., 1998; Sherman et al., 2004; Wagner et al., 2000; Wagner et al., 1997a). Улучшение иммунного ответа частично объясняется нормализацией/укреплением кишечного барьера слизистой оболочки, который, как было показано, препятствует транслокации бактерий в ткани (Kirjavainen et al., 1999; Negretti et al., 1997; Wagner et al., 2000; Wagner et al., 1997). Одним из потенциальных механизмов L. rhamnosus GG, препятствующих перемещению бактерий, является тот факт, что данная культура способствует нормализации поврежденного барьера слизистой оболочки. Как ротавирус, так и коровье молоко увеличили проходимость интактного белка сквозь слизистую оболочку тонкой кишки, однако сопутствующий прием L. rhamnosus GG противодействовал нарушению работы механизма проводимости (Isolauri et al., 1993а; Isolauri et al., 1993b). Кроме того, также увеличилось и число клеток, производящих антитела (Isolauri et al., 1993а; Isolauri et al 1993b).
Наличие структуры пили в L. rhamnosus GG имеет важное значение для прикрепления к кишечной стенке человека, а так же объясняет иммуностимулирующее влияние.
Потенциальный механизм действия L. rhamnosus GG (LGG®)
1. Снижение интенсивности роста патогенов в пищеварительном тракте.
2. Снижение транслокации кишечных бактерий в ткани.
3. Улучшение состояния/нормализации барьера слизистой оболочки, увеличение целостности клеток слизистой оболочки.
4. Увеличение числа производящих антитела клеток.
5. Увеличение производства эпителиальных клеток, измеренное митотическим индексом, числа и глубины клеток слизистой, высоты ворсинок, а также числа эпителиальных клеток в ворсинках.
6. Модуляция иммунной реакции через эпителиальные клетки.
7. Активация системного иммунного ответа посредством макрофагов и дендритных клеток.
Экспериментальные исследования и исследования, проведенные в искусственных условиях, указывают, что L. rhamnosus GG способен вырабатывать специфические белки, оказывающие влияние на целостность клеток слизистой оболочки, а так же уровень их апоптоза-пролиферации. (Mack et al., 2003; Mack et al., 1999; Seth et al, 2008: Tao et al 20% Van et аll 2007). Введение L. rhamnosus GG лабораторным крысам показало увеличение производства клеток эпителия как в тонкой, так и в толстой кишке, которое измерялось показателями митотического индекса, количества клеток кишечной слизи, глубины слизи, а также высоты и количества эпителиальных клеток на ворсинках (Banasaz et al., 2002). Несмотря на то, что L. rhamnosus GG показал способность к прикреплению к эпителиальным клеткам кишечника моноассоциированных мышей, также была продемонстрирована неспособность культуры к ухудшению состояния слизистой оболочки кишечника, что является важным показателем безопасности (Ruseler-van Embden et al., 1995). Среди первичных лейкоцитов человека L. rhamnosus GG способен стимулировать выработку и экспрессию провоспалительных цитокинов типа Th-1 -TNF-альфа, IL-1бета, IL-6 и IL-18 в мононуклеарных клетках периферической крови, но не цитокинов типа Th-2 IL-4, а также относительно мало IL-10 (Kekkonen et al., 2008; Miettinen et al., 1998; Miettinen et al., 1996).
L. rhamnosus GG также способен задействовать фактор транскрипции NF-кВ, являющийся центральным активатором иммунного ответа, а также толл-подобных TLR1 и TLR2, которые являются посредниками в процессе узнавания бактерий и клеточной сигнализации (Miettinen et al., 2000). L. rhamnosus GG узнается рецептором TLR2 (Miettinen et al., 2008) и, таким образом, способен вызвать каскад иммунологических процессов в клетках кишечного эпителия и/или антиген-презентирующих клетках. L. rhamnosus GG способен регулировать системный иммунный ответ через эпителиальные клетки (Lopez et al., 2008; Wallace et al., 2003; Zhang et al., 2005), a также через подлежащие специализированные антиген-пре-зентирующие макрофаги и дендритные клетки (Latvala et al., 2000; Veck-man et al., 2003).
Известно, что хромосомальная ДНК L. rhamnosus GG обладает особенным, высокоиммуногенным строением, что стимулирует лейкоциты лабораторных грызунов и человека in vitro (lliev et al., 2005), а также подавляет продуцирование OVA-специфичных IgE in vitro (lliev et al., 2008). Данные исследования показывают, что не только L. rhamnosus GG, но также и компоненты его структуры имеют иммуномодулятор-ное воздействие. Для исследования процессов функционирования L. rhamnosus GG было проведено секвенирование полной последовательности его генома как одного из первых пробиотиков. Его геномная последовательность, состоящая из 3.0 МЬр, сравнивалась с аналогичным по размеру геномом L. rhamnosus Lc705 (Kankainen et al., 2009). Исследование выявило ранее неизвестное строение волосковых структур (pili structure), белковоподобного, поверхностно-экспонированного полимерного протеина в пробиотических лактобациллах (рисунок 12). Было заключено, что присутствие подобных структур является необходимым для прикрепления к слизистой оболочке кишечника человека, что также может объяснить иммуностимулирующее воздействие L. rhamnosus GG, поскольку известно, что пили-группы грампозитивных патогенов обладают иммуностимулирующим влиянием.
В заключение
Несмотря на то, что экспериментальные исследования и исследования, проведенные в искусственных условиях не могут быть напрямую экстраполированы на человека, они, тем не менее, в состоянии показать, что L. rhamnosus GG (LGG®) подавляет рост патогенной флоры и препятствует ее транслокации в кровоток и внутренние органы, улучшает как системный, так и локальный иммунный ответ, а также стабилизирует барьер слизистой оболочки во время инфекции, снижая, таким образом, длительность и тяжесть ее течения.
Предыдущая глава | Оглавление | Следующая глава
Комментарии
ПРАКТИКА ПЕДИАТРА
