Различные области применения препарата на основе LGG
СтатьиПредыдущая глава | Оглавление | Следующая глава
4. Прочие области применения
4.1. Аллергия
Доля атопических заболеваний в западных странах постоянно увеличивается, в настоящее время это самое распространенное состояние среди детей. Факторами, способствующими развитию подобного рода заболеваний, являются нарушенное функционирование барьера кожного эпителия и слизистой оболочки кишечника, а также регуляторных процессов иммунной реакции на антигены окружающей среды (Isolauri et al., 2008). В последние годы проводились специальные исследования способности пробиотиков противостоять дисфункции иммунологического барьера и барьера слизистой оболочки кишечника, связанного с аллергией. Исследования с использованием контрольной группы плацебо, проводившиеся среди случайным образом выбранных детей, страдающих атопической экземой, связанной с аллергией на молоко, показали, что интенсивность и длительность высыпаний на коже, а также субъективные симптомы значительно быстрей уходят в случае, если в элиминационной диете содержится культура L. rhamnosus GG (Majamaa et Isolauri, 1997). Интенсивность воспалительных процессов в кишечнике измерялась при помощи анализа содержания цитокинов в стуле. Было выявлено, что в группе, принимающей L. rhamnosus GG, фактор TNF-альфа снижался существенно более интенсивно, чем в группе, принимавшей плацебо, что указывает на ускорение восстановительных процессов после воспаления. В другом исследовании L. rhamnosus GG давался грудным детям с симптомами атопической экземы, находившимся на грудном вскармливании и не получавшим детского питания или специальных молочных смесей (Isolauri et al., 2000). Грудное молоко было заменено высокогидролизированной сывороточной белковой молочной смесью с добавлением культур (L. rhamnosus GG или бифидобактерий) или той же смесью, однако без добавления пробиотиков. После двух месяцев такого режима питания симптомы атопической экземы существенно уменьшились в группе детей, получавших смесь с добавлением L. rhamnosus GG в сравнении с группой, принимавшей плацебо. Кроме того, у детей основной группы снизилось содержание воспалительного эозинофильного белка X в моче, тогда как содержание антивоспалитель-ного фактора TGF-бета в сыворотке увеличилось, что указывает на более быстрое восстановление после воспаления.
L. rhamnosus GG значительно снижает риск атопической экземы.
Для дальнейшего исследования влияния пробиотических культур на течение синдрома атопической экземы/дерматита (AEDS) среди грудных детей с аллергией на различные виды продуктов питания, а также выявления оптимальной комбинации пробиотиков, было проведено клиническое исследование с участием 230 грудных детей (Viljanen et al., 2005с). Дети были распределены по группам в случайном порядке, а смесь препаратов (L. rhamnosus GG, L. rhamnosus LC705, Bifidobacterium breve 99 и Propionibacterium shermanii ssp. freudenreichii JS), L. rhamnosus GG или плацебо выдавалась слепым методом в течение 4 недель. Во всей группе средняя Шкала Тяжести Атопического Дерматита (SCORAD) (основание 32.5) снизилась на 65%, однако небыло выявлено существенной разницы между группами больных после 4-х недель лечения. Аналогичная ситуация была выявлена среди детей, страдающих СМА (cow's milk allergy — аллергия на белки коровьего молока). Тем не менее, среди детей с сенсибилизированными IgE группа L. rhamnosus GG показала существенное снижение по вышеозначенной шкале в сравнении с группой, принимавшей плацебо: -26.1 и -19.8 (р=0.036). Таким образом был сделан вывод, что лечение с применением L. rhamnosus GG способно снизить тяжесть течения синдрома атопической экземы/дерматита среди детей с сенсибилизированными IgE. В этом исследовании также было продемонстрировано, что после лечения уровень IgA в фекалиях имел тенденцию к повышению среди детей, принимавших пробиотики по сравнению детьми, принимавшими плацебо (L.rhamnosus GG по сравнению с плацебо, р=0.064; комбинация пробиотиков по сравнению с плацебо, р=0.064). Кроме того, было отмечено снижение уровня антитрипсина в кале среди группы, принимавшей L. rhamnosus GG, чего не наблюдалось среди прочих групп, что говорит о способности L. rhamnosus GG облегчать течение кишечного воспаления у грудных детей с симптомами AEDS или СМА (Viljanen et al., 2005а).
Пробиотики также по-разному регулировали системный иммунный ответ, L. rhamnosus GG повысил выработку IFN-гамма в периферических мононуклеарных клетках крови у детей, страдающих СМА, а также IgE-ассоциированным дерматитом, таким образом осуществляя полезные Th-1 иммуномодуляторные сигналы, тогда как комбинация пробиотиков повысила выделение IL-4 (Pohjavuori et al., 2004). Среди детей с AEDS, ассоциированным с IgE, лечение культурой L. rhamnosus GG вызвало повышение уровня С-реактивного белка (CRP) в сравнении с группой плацебо (р=0.021) (Viljanen et al., 2005). Данному факту также сопутствовало повышение уровня IL-6 после лечения L. rhamnosus GG (р=0.023), чего не наблюдалось при применении комбинации или плацебо. Применение комбинации, однако, вызвало увеличение уровня IL-10 в плазме (р=0.016)(Viljanen et al., 2005). При последующем анализе было выявлено, что грудные дети, получающие пробиотические культуры, имели повышенный уровень С-реактивного белка (CRP) в плазме (р=0.008), общего количества IgA (р=0.016), IgE (р=0.047), а также IL-10(p=0.002) в сравнении с детьми из группы, принимавшей плацебо (Marschan et al.,2008). Увеличенный уровень CRP в плазме крови в возрасте 6 месяцев связывался со сниженным риском развития экземы (соотношение шансов (СШ) 0.41 (95% доверительный интервал (ДИ) 0.17-0.99), р=0.046), так же как и сниженным риском развития аллергических заболеваний (СШ 0.38 (95% ДИ 0.16-0.87), р=0.023) в возрасте двух лет в случае регулирования диеты с применением пробиотика. Связь CRP со сниженным риском экземы среди детей в возрасте двух лет поддерживает утверждение, что незначительное хроническое воспаление способствует успешной защите от экземы, подчеркивая роль хронического контакта с микробами как иммуномодулятора, обеспечивающего защиту от аллергии (Marschan et al., 2008).
Для того, чтобы понять, возможно ли предотвратить развитие аллергических заболеваний в раннем детстве путем нормализации качественного и количественного состава желудочно-кишечной микрофлоры при помощи пробиотических культур, были отобраны семьи с высоким риском аллергии. 159 матерей в случайном порядке разделили на две группы, одна из которых принимала L. rhamnosus GG (1010 КОЕ), а другая — плацебо в виде капсул каждый день в течение 2-4 недель перед ожидаемой датой рождения ребенка (Kalliomaki et al., 2001). После родов препараты давались либо кормящей матери, либо ребенку в течение шести месяцев. Дети прошли клиническое обследование в возрасте двух лет, и уровень распространения атопической экземы среди группы, принимавшей L. rhamnosus GG, составлял 23%, тогда как в группе плацебо аналогичный показатель составлял 46% (Kalliomaki et al., 2001). Полученный результат также был подтвержден путем проведения повторных клинических обследований спустя четыре и семь лет (рисунок 10) (Kalliomaki et al., 2003; Kalliomaki et al., 2007). В соответствии с моделью Кокса во время повторного исследования, проведенного спустя семь лет, риск заболевания экземой был существенно ниже в группе L. rhamnosus GG в сравнении с группой плацебо (СШ, 0.58; 95% ДИ, 0.35-0.94; р=0.027) (Kalliomaki et al., 2007). Однако было показано, что количество клеток, продуцирующих иммуноглобулин, было выше среди детей, чьи матери принимали L. rhamnosus GG, и показатели соотносились с содержанием sCD14 в молозиве, что дает основания предполагать позитивное влияние приема пробиотических культур во время грудного вскармливания на формирование кишечного иммунитета (Rinnie et al., 2005). Кроме того, L. rhamnosus GG способствовал значительному увеличению уровня противовоспалительных факторов TGF-бета2 в грудном молоке в сравнении с группой плацебо (Rautava et al., 2002). В результатах исследований, проводившихся через четыре года, было также отмечено, что перинатальный прием пробиотиков безопасен, т. к. он не повлиял на соотношение массы тела к росту (the height of the height-for-weight) среди детей (Laitinen et al., 2005). В другом исследовании определялась возможность предотвращения развития аллергических заболеваний путем приема пробиотических культур в раннем детстве. 1223 беременные женщины, вынашивающие детей с высоким риском заболевания аллергией, разделили случайным образом на две группы, одна из которых принимала препарат с пробиотической культурой, а другая — плацебо в течение периода от 2 до 4 недель перед родами (Kukkonen et al., 2007). Новорожденные получали тот же самый препарат (L. rhamnosus GG, L. rhamnosus LC705, Bifidobacterium breve 99 и Propionibac-terium shermanii ssp. freudenreichii JS) плюс фруктоолигосахариды (n=461) или плацебо (п=464) в течение шести месяцев. Прием пробиотиков в сравнении с плацебо существенно не повлиял на частоту всех аллергических заболеваний в возрасте двух лет, однако существенно снизил частоту эпизодов атопической экземы (Kukkonnen et al., 2007). Прием пробиотиков также показал тенденцию к увеличению количества IgA в фекалиях (р=0.085), а также способствовал существенному повышению концентрации альфа1 -антитрипсина (р=0.001) в кале (Kukkonen et al., 2009).
Рисунок 10. Соотношение 2-, 4- и 7-летних детей, страдающих атопической экземой (%), в основном и последующих исследованиях влияния L. rhamnosus GG (Kalliomaki et al. 2001, 2003 and 2007).
У детей, которые получали Lactobacillus rhamnosus GG заболеваемость атопической экземой была значительно ниже по прошествии 7-ми лет. 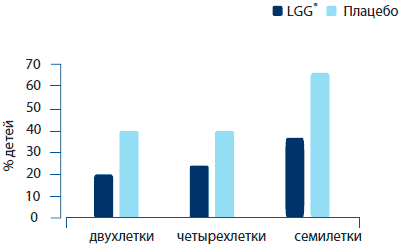
Лечение аллергии на продукты питания пробиотическими культурами среди детей младшего возраста показало достаточно перспективные результаты. Поэтому было проведено исследование с целью выявить аналогичное влияние пробиотических культур у подростков и молодых людей, подверженных аллергии на пыльцу березы и яблоки (Helin et al., 2002). В начале и в конце сезона цветения березы было проведено открытое исследование, где участникам предложили употребить в пищу яблоки. Пациенты были случайным образом распределены по группам, одна из которых получала L. rhamnosus GG, а другая — плацебо в течение 2.5 месяца перед началом сезона цветения, в течение 1 месяца во время цветения и 2 месяца после окончания сезона. L rhamnosus GG не показал способности облегчить течение заболевания или снизить потребность в употреблении медикаментов как во время, так и через 2 месяца после сезона (Hellin et al., 2002). Тем не менее спустя 5 месяцев в группе L. rhamnosus GG уровни rBet vl и rMal d1 - специфичных IgA возросли по отношению к контрольным замерам в начале в сравнении с плацебо (р=0.02). Сравнение уровней rBet v1-специфичных IgE сыворотки среди групп не выявило разницы. Среди группы L. rhamnosus GG в слюне субъектов было выявлено положительное соотношение rBet v1-специфичных IgE со стимулированным общим IgA (p=0.04) и IgG (р=0.003). В группе плацебо было выявлено отрицательное соотношение rBet v1-специфичных IgE со стимулированным уровнем rBet v1 и rMal dl IgA, а также IgG (p=0.02 и p-0.03 соответственно). Таким образом, было заключено, что L. rhamnosus GG оказал иммуностимулирующее воздействие на слизистую оболочку ротовой полости, наблюдаемое в увеличении уровня аллергеноспецифических IgA в слюне (Piiirainen et al.,2008).
Суммируя приведенную выше информацию
Прием L. rhamnosus GG (LGG® облегчает течение атопической экземы и воспалительных явлений в желудочно-кишечном тракте. L. rhamnosus GG также способствует снижению риска развития атопических заболеваний, так как, по результатам исследования, отслеживавшего состояние участников в течение семи лет, у детей, принимавших L. rhamnosus GG, случаи экземы наблюдались значительно реже.
4.2. Здоровье полости рта
Бактерии семейства Lactobacilli достаточно распространены в полости рта, однако, как правило, их причисляют к потенциальным кари-огенам, развивающимся вместе с Streptococcus mutans. Тем не менее исследования, проводившиеся in vitro, показали, что L. rhamnosus GG сбраживают сахарозу и лактозу медленно или вообще не участвуют в этом процессе (Saxelin, 1997), а также подавляют рост группы стрептококков Streptococcus mutans, являющихся бактериальным показателем зубного кариеса (Meurman et al., 1995). В прошедшем десятилетии эти открытия привели к проведению нескольких клинических исследований влияния L. rhamnosus GG на здоровье полости рта, включая исследования факторов риска заболевания зубным кариесом, распространенности грибков Candida в полости рта, а также повышенного слюноотделения. Длительное влияние L. rhamnosus GG на риск заболевания кариесом среди детей изучался в рандомизированном, плацебо-контролируемом исследовании, проводившемся в 18 центрах дневного ухода за детьми младшего возраста в Финляндии (Nase et al., 2001). В течение семи месяцев, пять раз в неделю детям во время ежедневных приемов пищи давали порции пастеризованного молока с добавлением L. rhamnosus GG (5-10х106 КОЕ/мл) или плацебо в виде обычного молока. Состояние полости рта участников было зафиксировано в начале исследования, а также в конце 7-месячного срока проведения испытания. Риск кариеса оценивался на основе количества разрушенных, отсутствующих или запломбированных зубов с учетом первоначальных показателей кариеса и количества Streptococcus mutans в слюно-дентальных пробах зубного налета. Результаты показали снижение показателей развития кариеса в группе L. rhamnosus GG, где он был на 44% (Соотношение шансов (СШ)=0.56, р=0.01) ниже, чем в группе плацебо. Количество микрофлоры, вызывающей кариес в слюне среди взрослых, оценивалось в рандомизированном и плацебо-контролируемом исследовании, продолжавшемся в течение трех недель и с участием 74 субъектов (Ahola et al., 2002). Во время испытания участникам предлагалось употребление сыра, 5x15 г/день, либо с добавлением L. rhamnosus GG и L. rhamnosus LC705 (1-2х107 КОЕ/г каждой культуры), либо без добавления культур (плацебо). Обследование полости рта участников проводилось как в начале исследования, так и по его окончании. Перед исследованием, после него и в последующий трехнедельный период проводились замеры объема стимулированного слюноотделения, буферности и количества Streptococcus mutans в слюне, а также дрожжевых грибков и лактобацилл. Несмотря на то, что никакой статистически значимой разницы между группами выявлено не было, в группе L. rhamnosus GG в конце испытаний и в последующий трехнедельный период наблюдалось значительное снижение количества Streptococcus mutans в сравнении с контрольной группой (р=0.05). Кроме того, была выявлена логарифмическая регрессионная зависимость, которая указывает, что употребление пробиотиков способствует снижению риска, связанного с высокими уровнями S. mutans (СШ=0.37,95% ДИ 0.08-1.75, р=0.21) и грибков в слюне (СШ=0.40,0.09-1.71, р=0.22).
Хронические заболевания, прием медикаментов, недостаточная гигиена полости рта, пониженное слюноотделение, а также сниженная активность иммунной системы делают пожилое население особенно уязвимым к инфекциям, вызываемым грибком Candida. Колонизация данного грибка может протекать асимптоматически, однако чрезмерный рост колоний может привести к развитию кандидоза, сопровождаемого различными типами повреждения слизистой рта и другими симптомами. Было проведено рандомизированное, плацебо-контролируемое исследование, продолжавшееся в течение 16 недель, с целью выявить влияние L. rhamnosus GG в комплексе с различными пробиотическими культурами на распространенность Candida среди людей пожилого возраста (Hattaka et al., 2007). Во время исследования 276 лицам пожилого возраста было предложено употреблять 50 г/день сыра с добавлением комплекса культур (L. rhamnosus GG, L. rhamnosus LC705 и Propionibac-terium shermanii ssp. freudenreichii JS, 107 КОЕ/г каждой культуры) или обычный сыр в том же объеме. В группе, принимавшей пробиотики, количество Candida снизилось с 30% до 21% (снижение составило 33%), тогда как в контрольной группе этот показатель возрос от 28% до 34%. Согласно замерам первичных результатов, распространенность грибка в слюне была высокой (>104 КОЕ/мл), однако в группе, принимавшей пробиотики, было определено снижение риска на 75% в сравнении с кон- группе, принимавшей пробиотики, риск гипосаливации снизился на 56% трольной группой (СШ=0-25. 95% ДИ 0.10-0.65, р=0.004). Кроме того, в (СШ=0.44, 95% ДИ 0.19-1.01, р=0.05).
В заключение
L. rhamnosus GG (LGG®) показал возможность снижения риска возникновения зубного кариеса, а также в комбинации с другими культурами продемонстрировал возможность снижения распространенности Candida в ротовой полости и гипосаливации у людей пожилого возраста.
4.3. Ревматоидный артрит
Лечение пациентов, страдающих ревматоидным артритом, при помощи пробиотиков является достаточно интересной областью исследования, где L. rhamnosus GG показал положительные результаты в предварительных исследованиях. Проведенные более десяти лет назад исследования (Malin et al., 1996, 1997) показали, что кратковременный прием (10 дней) L. rhamnosus GG среди детей, страдающих хроническим артритом, способен нормализовать высокую активность уреазы в стуле, которая является индикатором дисбаланса кишечной микрофлоры. Предварительные результаты указывали на то, что L. rhamnosus GG может иметь положительное влияние на лечение пациентов с хроническим артритом. В более позднем исследовании влияние L. rhamnosus GG на здоровье пациентов, больных ревматоидным артритом, оценивалось в двойном слепом рандомизированном, плацебо-контролируемом исследовании (Hattaka et al., 2003). В конце исследования, длившегося один год, была выявлена тенденция к уменьшению количества опухших и болезненных суставов в группе L. rhamnosus GG в сравнении с контрольной группой. Активность артрита имела тенденцию к большему снижению в группе L. rhamnosus GG, и пациентам из этой группы требовалось принимать меньше медикаментов для лечения ревматоидного артрита. Тем не менее из-за ограниченного числа участников полученные результаты не были статистически значимыми, однако тенденция прослеживалась четко.
В заключение
L. rhamnosus GG (LGG®) показал положительные результаты в лечении ревматоидного артрита в предварительных исследованиях, однако для подтверждения выявленных тенденций требуется проведение дальнейших клинических исследований.
4.4. Муковисцидоз
На тему лечения муковисцидоза с использованием пробиотических культур было проведено относительно небольшое количество исследований. L. rhamnosus GG показал положительные предварительные результаты в трех клинических испытаниях. В пилотном исследовании, (Bruzesse et al., 2004) было обнаружено, что L. rhamnosus GG уменьшал воспаление в желудочно-кишечном тракте среди детей, страдающих муковисцидозом: в особенности, концентрация кальпротектина и окиси азота снизилась после четырех недель приема препарата в сравнении с контрольной группой. Дальнейшие предварительные исследования той же итальянской группы ученых выявили, что ежедневный прием L. rhamnosus GG в течение шести месяцев значительно снизил частоту легочных инфекций и госпитализаций (Bruzezze et al., 2007). Данное рандомизированное плацебо-контролируемое исследование проводилось среди детей, средний возраст которых составлял 13.2 года. Результаты данного исследования указывали на то, что L. rhamnosus GG способен задержать ухудшение респираторных функций, а также то, что существует взаимосвязь между кишечным воспалением и воспалением дыхательных путей. В недавнем пилотном исследовании (Pina et al., 2008) было показано улучшение функции желудочно-кишечного тракта при двухразовом ежедневном приеме L. rhamnosus GG в течение двух недель. Тринадцать из двадцати пациентов, страдающих муковисцидозом (81.3%), почувствовали улучшение состояния пищеварительной системы и стула.
Суммируя приведенную выше информацию
L. rhamnosus GG (LGG®) показал положительные результаты в лечении муковисцидоза в предварительных исследованиях, однако, прежде чем можно будет дать однозначное заключение, требуется проведение более масштабных клинических испытаний.
Предыдущая глава | Оглавление | Следующая глава
